2025年四川省蓬溪县蓬南中学九年级下学期中考二模化学试卷(含答案)
文档属性
| 名称 | 2025年四川省蓬溪县蓬南中学九年级下学期中考二模化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 669.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-20 15:48:04 | ||
图片预览



文档简介
化学试题
一、选择题
1.劳动创造美好生活,下列活动属于化学变化的是
A.用水淘米洗菜 B.点燃天然气炒菜 C.清洗杯盘碗碟 D.整理折叠衣物
2.安全是化学实验成功的保障。下列操作安全的是
A. B. C. D.
3.图一是镁元素的部分信息,图二是另外三种微粒的结构示意图。下列说法不正确的是
A.镁原子在化学反应中容易失去电子
B.A与C对应元素具有相似的化学性质
C.镁的相对原子质量为24.31g
D.A与B对应微粒属于同种元素
4.下表对化学知识的阐述中,完全正确的一组是
A B
①加热煮沸可以降低水的硬度 ②使用乙醇汽油的优点是不污染环境 ③鉴别羊毛和棉线的方法是点燃,闻气味 ①馒头中富含的营养素是糖类 ②合金、塑料都属于有机合成材料 ③钾肥可以增强农作物的抗寒、抗旱能力
C D
①能产生温室效应的气体有二氧化碳、臭氧、甲烷等 ②酸雨可以使森林和草场受到破坏 ③防止铁制品生锈可采用喷漆、涂油等方法 ①一氧化碳和二氧化碳的性质不同,是因为分子的构成不同 ②能闻到花香说明分子是不断运动的 ③霉变的大米,高温蒸煮之后可以放心食用
A.A B.B C.C D.D
5.如图1为KNO3和NH4Cl的溶解度曲线,小亮同学利用其中的一种物质X进行了图2所示实验。下列说法中错误的是
A.小亮选择的X物质是硝酸钾
B.若让③中的溶液达到饱和状态需再加入X的质量为25g
C.t2℃时,两物质的溶解度相等
D.t3℃时,两溶液的溶质质量分数KNO3>NH4Cl
6.下列说法正确的是
A.红磷在空气中燃烧产生大量白色烟雾
B.用紫色石蕊溶液鉴别二氧化碳和一氧化碳两种气体
C.除去CaCl2溶液中混有的HCl,加入过量的氢氧化钙溶液
D.在pH=2的溶液中能大量共存,形成无色溶液
7.向一定质量的Cu(NO3)2和AgNO3的混合溶液中逐渐加入锌粉。反应过程中溶质Cu(NO3)2的质量随加入锌粉质量的变化关系如图所示。下列说法错误的是
A.a点时,溶液的总质量与反应前相比减小
B.b点时,溶液为Zn(NO3)2和Cu(NO3)2的混合溶液
C.c点时,溶液呈无色
D.d点时,过滤所得滤渣为Cu和Ag的混合物
二、填空与简答
8.某管道疏通剂标签上的部分文字如图所示。
请用化学用语填空:
(1)2个铝原子 。
(2)氢氧化钠中阴离子的符号为 。
9.化学使世界变得绚丽多彩。请结合所需知识回答下列问题:
(1)2025年4月24日17时17分,我国神舟二十号载人飞船在酒泉卫星发射中心成功发射,三位航天员顺利进入空间站。NiFe2O4可作为催化剂将航天员呼出的CO2转化为O2,已知NiFe2O4中Fe为+3价,则Ni的化合价为 。
(2)在西晋史学家陈寿所著的《三国志》中,有“乃取蒙冲斗舰数十艘,实以薪草,膏油灌其中……(黄)盖放诸船,同时发火。时风盛猛,悉延烧岸上营落”的描述。从燃烧条件分析,薪草属于 。
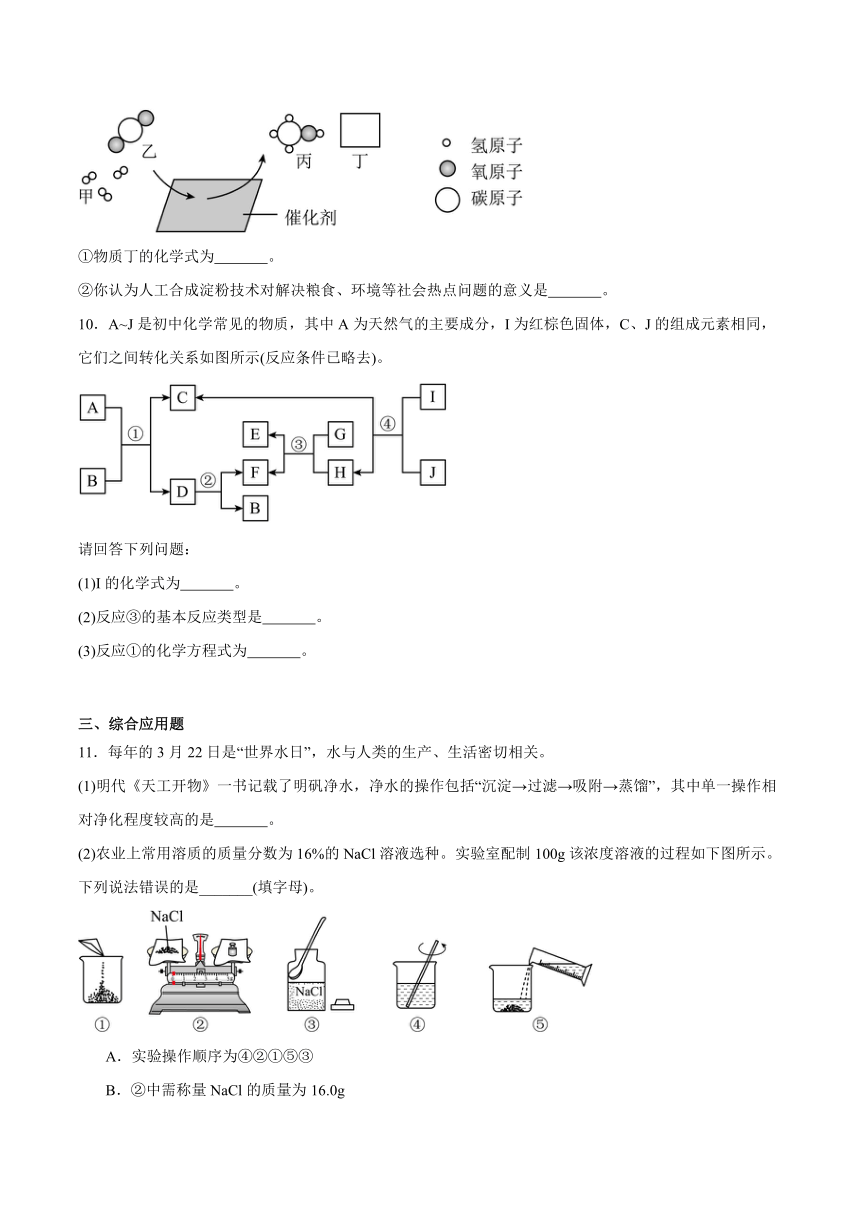
(3)我国科学家在国际上首次实现了二氧化碳到淀粉的人工合成,其中二氧化碳制取甲醇环节的微观示意图如图(图中的微观粒子恰好完全反应)。
①物质丁的化学式为 。
②你认为人工合成淀粉技术对解决粮食、环境等社会热点问题的意义是 。
10.A~J是初中化学常见的物质,其中A为天然气的主要成分,I为红棕色固体,C、J的组成元素相同,它们之间转化关系如图所示(反应条件已略去)。
请回答下列问题:
(1)I的化学式为 。
(2)反应③的基本反应类型是 。
(3)反应①的化学方程式为 。
三、综合应用题
11.每年的3月22日是“世界水日”,水与人类的生产、生活密切相关。
(1)明代《天工开物》一书记载了明矾净水,净水的操作包括“沉淀→过滤→吸附→蒸馏”,其中单一操作相对净化程度较高的是 。
(2)农业上常用溶质的质量分数为16%的NaCl溶液选种。实验室配制100g该浓度溶液的过程如下图所示。下列说法错误的是_______(填字母)。
A.实验操作顺序为④②①⑤③
B.②中需称量NaCl的质量为16.0g
C.选用100mL量筒量取所需水
D.①中烧杯内壁附着有水,对配制的溶液浓度无影响
(3)海水中含有丰富的化学资源,可提取食盐。下图是粗盐提纯的部分流程,粗盐中的杂质有泥沙、氯化钙、氯化镁,回答下列问题。
①粗盐溶解时,玻璃棒的作用是 。
②过滤后,滤渣中除泥沙外,还含有 (填化学式)。
③蒸发时,当蒸发皿中出现 时即停止加热。
四、实验题
12.实验探究是学习化学的重要方法。请根据下列实验装置图回答问题。
(1)装置B中仪器①的名称是 。
(2)实验室某小组同学用过氧化氢溶液和二氧化锰制取氧气,请写出化学方程式 。
(3)实验室制取CO2和O2,均不能选用的收集装置是 。
五、科学探究题
13.小明和他的同学在实验室发现上一次实验后忘记塞上瓶塞的氢氧化钠溶液的试剂瓶瓶口周围有一些白色固体。他们怀疑氢氧化钠溶液已经变质,于是进行了如下实验探究。
【提出问题】
氢氧化钠溶液是否变质?
【提出猜想】
①该氢氧化钠溶液没有变质;②该氢氧化钠溶液部分变质;③该氢氧化钠溶液全部变质。
【实验验证】
(1)填写下列表格。
操作 现象 结论
ⅰ取少量溶液于试管中,滴加无色酚酞溶液 无色酚酞变红 溶液显碱性
ⅱ取少量溶液于试管中,滴加稀盐酸 溶液中含碳酸钠
【讨论】
(2)小明同学认为,根据上述实验ⅰ、ⅱ可推断,猜想②正确。而小张则认为猜想③也可能正确,理由是 。
(3)于是小王又设计了如下补充实验:
(a)取原溶液少量于试管中,逐滴加入BaCl2溶液至不再产生沉淀。静置,分层。
(b)取上层清液,向其中加入CuSO4溶液,若有蓝色沉淀产生,则说明氢氧化钠溶液部分变质,化学方程式: 。反之则说明氢氧化钠溶液已经全部变质。
【反思】
(4)该氢氧化钠溶液变质的原因是(用化学方程式表示): 。
六、计算题
14.为测定黄铜(铜锌合金)样品中铜的质量分数,小明取一定质量的样品放入烧杯中,分2次加入质量分数相同的稀硫酸,实验过程和数据如图所示。
请计算:
(1)生成氢气的总质量是 g。
(2)黄铜样品中铜的质量分数。
参考答案
1.B
2.B
3.C
4.C
5.D
6.B
7.C
8.(1)
(2)
9.(1)+2
(2)可燃物
(3) 缓解温室效应,缓解粮食危机
10.(1)Fe2O3
(2)置换反应
(3)
11.(1)蒸馏
(2)AD
(3) 加快溶解速率 Mg(OH)2、CaCO3 较多固体
12.(1)分液漏斗
(2)
(3)D
13.(1)有气泡产生
(2)若氢氧化钠全部变成碳酸钠,也会产生相同的现象
(3)CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
(4)2NaOH+CO2=Na2CO3+H2O
14.(1)0.4
(2)充分反应后,产生氢气的质量为0.4g。
解:设黄铜样品中锌的质量为x。
黄铜样品中铜的质量为
黄铜样品中铜的质量分数为
答:黄铜样品中铜的质量分数为67.5%。
一、选择题
1.劳动创造美好生活,下列活动属于化学变化的是
A.用水淘米洗菜 B.点燃天然气炒菜 C.清洗杯盘碗碟 D.整理折叠衣物
2.安全是化学实验成功的保障。下列操作安全的是
A. B. C. D.
3.图一是镁元素的部分信息,图二是另外三种微粒的结构示意图。下列说法不正确的是
A.镁原子在化学反应中容易失去电子
B.A与C对应元素具有相似的化学性质
C.镁的相对原子质量为24.31g
D.A与B对应微粒属于同种元素
4.下表对化学知识的阐述中,完全正确的一组是
A B
①加热煮沸可以降低水的硬度 ②使用乙醇汽油的优点是不污染环境 ③鉴别羊毛和棉线的方法是点燃,闻气味 ①馒头中富含的营养素是糖类 ②合金、塑料都属于有机合成材料 ③钾肥可以增强农作物的抗寒、抗旱能力
C D
①能产生温室效应的气体有二氧化碳、臭氧、甲烷等 ②酸雨可以使森林和草场受到破坏 ③防止铁制品生锈可采用喷漆、涂油等方法 ①一氧化碳和二氧化碳的性质不同,是因为分子的构成不同 ②能闻到花香说明分子是不断运动的 ③霉变的大米,高温蒸煮之后可以放心食用
A.A B.B C.C D.D
5.如图1为KNO3和NH4Cl的溶解度曲线,小亮同学利用其中的一种物质X进行了图2所示实验。下列说法中错误的是
A.小亮选择的X物质是硝酸钾
B.若让③中的溶液达到饱和状态需再加入X的质量为25g
C.t2℃时,两物质的溶解度相等
D.t3℃时,两溶液的溶质质量分数KNO3>NH4Cl
6.下列说法正确的是
A.红磷在空气中燃烧产生大量白色烟雾
B.用紫色石蕊溶液鉴别二氧化碳和一氧化碳两种气体
C.除去CaCl2溶液中混有的HCl,加入过量的氢氧化钙溶液
D.在pH=2的溶液中能大量共存,形成无色溶液
7.向一定质量的Cu(NO3)2和AgNO3的混合溶液中逐渐加入锌粉。反应过程中溶质Cu(NO3)2的质量随加入锌粉质量的变化关系如图所示。下列说法错误的是
A.a点时,溶液的总质量与反应前相比减小
B.b点时,溶液为Zn(NO3)2和Cu(NO3)2的混合溶液
C.c点时,溶液呈无色
D.d点时,过滤所得滤渣为Cu和Ag的混合物
二、填空与简答
8.某管道疏通剂标签上的部分文字如图所示。
请用化学用语填空:
(1)2个铝原子 。
(2)氢氧化钠中阴离子的符号为 。
9.化学使世界变得绚丽多彩。请结合所需知识回答下列问题:
(1)2025年4月24日17时17分,我国神舟二十号载人飞船在酒泉卫星发射中心成功发射,三位航天员顺利进入空间站。NiFe2O4可作为催化剂将航天员呼出的CO2转化为O2,已知NiFe2O4中Fe为+3价,则Ni的化合价为 。
(2)在西晋史学家陈寿所著的《三国志》中,有“乃取蒙冲斗舰数十艘,实以薪草,膏油灌其中……(黄)盖放诸船,同时发火。时风盛猛,悉延烧岸上营落”的描述。从燃烧条件分析,薪草属于 。
(3)我国科学家在国际上首次实现了二氧化碳到淀粉的人工合成,其中二氧化碳制取甲醇环节的微观示意图如图(图中的微观粒子恰好完全反应)。
①物质丁的化学式为 。
②你认为人工合成淀粉技术对解决粮食、环境等社会热点问题的意义是 。
10.A~J是初中化学常见的物质,其中A为天然气的主要成分,I为红棕色固体,C、J的组成元素相同,它们之间转化关系如图所示(反应条件已略去)。
请回答下列问题:
(1)I的化学式为 。
(2)反应③的基本反应类型是 。
(3)反应①的化学方程式为 。
三、综合应用题
11.每年的3月22日是“世界水日”,水与人类的生产、生活密切相关。
(1)明代《天工开物》一书记载了明矾净水,净水的操作包括“沉淀→过滤→吸附→蒸馏”,其中单一操作相对净化程度较高的是 。
(2)农业上常用溶质的质量分数为16%的NaCl溶液选种。实验室配制100g该浓度溶液的过程如下图所示。下列说法错误的是_______(填字母)。
A.实验操作顺序为④②①⑤③
B.②中需称量NaCl的质量为16.0g
C.选用100mL量筒量取所需水
D.①中烧杯内壁附着有水,对配制的溶液浓度无影响
(3)海水中含有丰富的化学资源,可提取食盐。下图是粗盐提纯的部分流程,粗盐中的杂质有泥沙、氯化钙、氯化镁,回答下列问题。
①粗盐溶解时,玻璃棒的作用是 。
②过滤后,滤渣中除泥沙外,还含有 (填化学式)。
③蒸发时,当蒸发皿中出现 时即停止加热。
四、实验题
12.实验探究是学习化学的重要方法。请根据下列实验装置图回答问题。
(1)装置B中仪器①的名称是 。
(2)实验室某小组同学用过氧化氢溶液和二氧化锰制取氧气,请写出化学方程式 。
(3)实验室制取CO2和O2,均不能选用的收集装置是 。
五、科学探究题
13.小明和他的同学在实验室发现上一次实验后忘记塞上瓶塞的氢氧化钠溶液的试剂瓶瓶口周围有一些白色固体。他们怀疑氢氧化钠溶液已经变质,于是进行了如下实验探究。
【提出问题】
氢氧化钠溶液是否变质?
【提出猜想】
①该氢氧化钠溶液没有变质;②该氢氧化钠溶液部分变质;③该氢氧化钠溶液全部变质。
【实验验证】
(1)填写下列表格。
操作 现象 结论
ⅰ取少量溶液于试管中,滴加无色酚酞溶液 无色酚酞变红 溶液显碱性
ⅱ取少量溶液于试管中,滴加稀盐酸 溶液中含碳酸钠
【讨论】
(2)小明同学认为,根据上述实验ⅰ、ⅱ可推断,猜想②正确。而小张则认为猜想③也可能正确,理由是 。
(3)于是小王又设计了如下补充实验:
(a)取原溶液少量于试管中,逐滴加入BaCl2溶液至不再产生沉淀。静置,分层。
(b)取上层清液,向其中加入CuSO4溶液,若有蓝色沉淀产生,则说明氢氧化钠溶液部分变质,化学方程式: 。反之则说明氢氧化钠溶液已经全部变质。
【反思】
(4)该氢氧化钠溶液变质的原因是(用化学方程式表示): 。
六、计算题
14.为测定黄铜(铜锌合金)样品中铜的质量分数,小明取一定质量的样品放入烧杯中,分2次加入质量分数相同的稀硫酸,实验过程和数据如图所示。
请计算:
(1)生成氢气的总质量是 g。
(2)黄铜样品中铜的质量分数。
参考答案
1.B
2.B
3.C
4.C
5.D
6.B
7.C
8.(1)
(2)
9.(1)+2
(2)可燃物
(3) 缓解温室效应,缓解粮食危机
10.(1)Fe2O3
(2)置换反应
(3)
11.(1)蒸馏
(2)AD
(3) 加快溶解速率 Mg(OH)2、CaCO3 较多固体
12.(1)分液漏斗
(2)
(3)D
13.(1)有气泡产生
(2)若氢氧化钠全部变成碳酸钠,也会产生相同的现象
(3)CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
(4)2NaOH+CO2=Na2CO3+H2O
14.(1)0.4
(2)充分反应后,产生氢气的质量为0.4g。
解:设黄铜样品中锌的质量为x。
黄铜样品中铜的质量为
黄铜样品中铜的质量分数为
答:黄铜样品中铜的质量分数为67.5%。
同课章节目录
