2.3.1 利用高锰酸钾制取氧气 课件(共27张PPT内嵌视频) 2025-2026学年人教版(2024)初中化学九年级上册
文档属性
| 名称 | 2.3.1 利用高锰酸钾制取氧气 课件(共27张PPT内嵌视频) 2025-2026学年人教版(2024)初中化学九年级上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 157.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-23 15:10:30 | ||
图片预览








文档简介
(共27张PPT)
2.3 制取氧气
课时1 利用高锰酸钾制取氧气
人教版 九年级上册
1.了解实验室中制取氧气的主要方法和原理。
2.初步学会用高锰酸钾制取氧气的原理、装置及操作步骤和注意事项。
3.了解氧气的工业制法。
氧气是一种非常重要的气体
如何获取氧气?
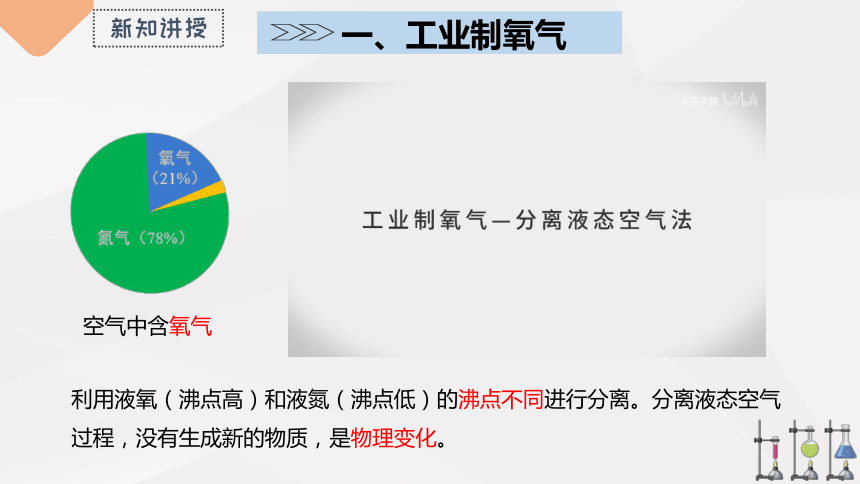
一、工业制氧气
空气中含氧气
利用液氧(沸点高)和液氮(沸点低)的沸点不同进行分离。分离液态空气过程,没有生成新的物质,是物理变化。
液态空气
液态氧气
氮气
低温加压
控制温度在-1960C~
-1830C
空气
一、工业制氧气
储存在蓝色钢瓶中
实验室如何简便地制取纯净的氧气?
核心成分:过氧化氢
特种部队用高锰酸钾野外生火
氧气助燃
二、实验室制氧气
1.用高锰酸钾制氧气
加热
高锰酸钾
KMnO4
锰酸钾 + 二氧化锰 + 氧气
K2MnO4
O2
MnO2
反应原理
实验室制氧气选择药品和反应时需考虑的因素:
制氧气的原料须是含氧的物质。
利用比较简单的实验条件就能较快得到氧气。
生成的气体成分单一,便于收集 。
加热
高锰酸钾
KMnO4
锰酸钾 + 二氧化锰 + 氧气
K2MnO4
O2
MnO2
反应原理
暗紫色固体
暗绿色固体
黑色固体
无色气体
制取装置
加热
高锰酸钾
KMnO4
锰酸钾+二氧化锰+氧气
K2MnO4
O2
MnO2
反应原理
反应仪器
能加热
能加橡胶塞,导出气体
试管
制取装置
加热
高锰酸钾
KMnO4
锰酸钾+二氧化锰+氧气
K2MnO4
O2
MnO2
反应原理
加热仪器
酒精灯
铁架台
夹持仪器
发生装置
固体加热装置
反应物状态 固体
反应条件 加热
试管口略向下倾斜
防止冷凝水流至热的试管底部,避免试管破裂
药品平铺试管底部
外焰加热
制取装置
加热
高锰酸钾
KMnO4
锰酸钾+二氧化锰+氧气
K2MnO4
O2
MnO2
反应原理
收集仪器
集气瓶
收集装置
排空气集气法
向上排空气法
向下排空气法
不与空气中的成分反应
密度比空气大
密度比空气小
可用于
收集氧气
排水集气法
气体不易溶于水
气体不与水反应
可用于
收集氧气
收集装置
排水法
向上排空气法
思考与讨论:实验室常用的两种氧气的收集方法各有什么优点?
纯度更高
气体干燥
加热
高锰酸钾
锰酸钾+二氧化锰+氧气
棉花
防止加热时高锰酸钾粉末进入导管,影响实验
棉花
制取装置
试管
高锰酸钾
铁架台
酒精灯
玻璃管
橡胶塞
集气瓶
连接装置
思考与讨论:利用以下药品和仪器,如何操作制取氧气?
装入药品
加热
收集气体
检查气密性
平铺
先预热
检验、验满
停止反应,整理清洁
观看加热高锰酸钾制氧气,总结操作步骤和注意事项。
①查—连接仪器,检查装置气密性;
②装—试剂装入试管,使之平铺在试管的
底部,管口塞一小团棉花;
③定—用铁夹夹持试管,并固定在铁架台上;
④点—点燃酒精灯加热(须预热);
⑤收—排水法收集氧气(等气泡连续均匀放出时再开始收集);
⑥离—实验完毕,先把导管撤离水面;
⑦熄—熄灭酒精灯,停止加热,冷却后拆除装置。
谐音记忆:茶庄定点收利息
实验步骤:
思考与讨论
(1)为什么要先对试管进行预热,然后再对准试剂部位加热?
(2)为什么要到导管口连续均匀冒出气泡时,再开始收集氧气?
防止试管因受热不均匀而炸裂
放置收集的氧气中混有空气
(3)试验结束,为什么先将导管移出水面,再熄灭酒精灯?
防止水槽中的水倒吸入试管,使试管因骤冷而炸裂
实验内容 现象
加热试管,用排水集气法收集一瓶氧气
把带火星的木条伸入集气瓶中
有大量气泡进入集气瓶
木条复燃
检验氧气
1.用排水法收集:当集气瓶中的水排完,集气瓶口有大量气泡冒出,证明已收集满。
2.用向上排空气法收集:将带火星的木条放在集气瓶口,若木条复燃,证明已收集满。
验满方法
1.工业上制取氧气的原理如图1所示,部分物质的沸点如图2。下列有关说法正确的是( )
A.操作①中控制温度在-183℃之上
B.液态物质为液态氧气
C.蓝色钢瓶中气体能用作燃料
D.工业制氧气过程为物理变化
D
2.如图所示为实验室用高锰酸钾制取氧气,其中有关试管的操作正确的是( )
C
A.加入高锰酸钾
B.连接橡胶塞和试管
C.加热高锰酸钾
D.洗涤试管
3.高锰酸钾制取氧气的实验如图,
下列操作符合安全规范的是( )
A.连接仪器——将试管抵住实验台,用力塞紧胶塞
B.加热试管——先预热,再对准试剂所在部位加热
C.结束实验——熄灭酒精灯后,将导管移出水面
D.整理复位——加热后的试管,立即用冷水清洗
B
4.如图是氧气的实验室制备、收集、验满、检验操作,错误的是( )
D
A.氧气的制备
B.收集氧气
C.氧气验满
D.氧气的检验
制
取
氧
气
工业制氧气
实验室制氧气
分离液态空气
发生装置
收集装置
实验步骤
原理:加热高锰酸钾
2.3 制取氧气
课时1 利用高锰酸钾制取氧气
人教版 九年级上册
1.了解实验室中制取氧气的主要方法和原理。
2.初步学会用高锰酸钾制取氧气的原理、装置及操作步骤和注意事项。
3.了解氧气的工业制法。
氧气是一种非常重要的气体
如何获取氧气?
一、工业制氧气
空气中含氧气
利用液氧(沸点高)和液氮(沸点低)的沸点不同进行分离。分离液态空气过程,没有生成新的物质,是物理变化。
液态空气
液态氧气
氮气
低温加压
控制温度在-1960C~
-1830C
空气
一、工业制氧气
储存在蓝色钢瓶中
实验室如何简便地制取纯净的氧气?
核心成分:过氧化氢
特种部队用高锰酸钾野外生火
氧气助燃
二、实验室制氧气
1.用高锰酸钾制氧气
加热
高锰酸钾
KMnO4
锰酸钾 + 二氧化锰 + 氧气
K2MnO4
O2
MnO2
反应原理
实验室制氧气选择药品和反应时需考虑的因素:
制氧气的原料须是含氧的物质。
利用比较简单的实验条件就能较快得到氧气。
生成的气体成分单一,便于收集 。
加热
高锰酸钾
KMnO4
锰酸钾 + 二氧化锰 + 氧气
K2MnO4
O2
MnO2
反应原理
暗紫色固体
暗绿色固体
黑色固体
无色气体
制取装置
加热
高锰酸钾
KMnO4
锰酸钾+二氧化锰+氧气
K2MnO4
O2
MnO2
反应原理
反应仪器
能加热
能加橡胶塞,导出气体
试管
制取装置
加热
高锰酸钾
KMnO4
锰酸钾+二氧化锰+氧气
K2MnO4
O2
MnO2
反应原理
加热仪器
酒精灯
铁架台
夹持仪器
发生装置
固体加热装置
反应物状态 固体
反应条件 加热
试管口略向下倾斜
防止冷凝水流至热的试管底部,避免试管破裂
药品平铺试管底部
外焰加热
制取装置
加热
高锰酸钾
KMnO4
锰酸钾+二氧化锰+氧气
K2MnO4
O2
MnO2
反应原理
收集仪器
集气瓶
收集装置
排空气集气法
向上排空气法
向下排空气法
不与空气中的成分反应
密度比空气大
密度比空气小
可用于
收集氧气
排水集气法
气体不易溶于水
气体不与水反应
可用于
收集氧气
收集装置
排水法
向上排空气法
思考与讨论:实验室常用的两种氧气的收集方法各有什么优点?
纯度更高
气体干燥
加热
高锰酸钾
锰酸钾+二氧化锰+氧气
棉花
防止加热时高锰酸钾粉末进入导管,影响实验
棉花
制取装置
试管
高锰酸钾
铁架台
酒精灯
玻璃管
橡胶塞
集气瓶
连接装置
思考与讨论:利用以下药品和仪器,如何操作制取氧气?
装入药品
加热
收集气体
检查气密性
平铺
先预热
检验、验满
停止反应,整理清洁
观看加热高锰酸钾制氧气,总结操作步骤和注意事项。
①查—连接仪器,检查装置气密性;
②装—试剂装入试管,使之平铺在试管的
底部,管口塞一小团棉花;
③定—用铁夹夹持试管,并固定在铁架台上;
④点—点燃酒精灯加热(须预热);
⑤收—排水法收集氧气(等气泡连续均匀放出时再开始收集);
⑥离—实验完毕,先把导管撤离水面;
⑦熄—熄灭酒精灯,停止加热,冷却后拆除装置。
谐音记忆:茶庄定点收利息
实验步骤:
思考与讨论
(1)为什么要先对试管进行预热,然后再对准试剂部位加热?
(2)为什么要到导管口连续均匀冒出气泡时,再开始收集氧气?
防止试管因受热不均匀而炸裂
放置收集的氧气中混有空气
(3)试验结束,为什么先将导管移出水面,再熄灭酒精灯?
防止水槽中的水倒吸入试管,使试管因骤冷而炸裂
实验内容 现象
加热试管,用排水集气法收集一瓶氧气
把带火星的木条伸入集气瓶中
有大量气泡进入集气瓶
木条复燃
检验氧气
1.用排水法收集:当集气瓶中的水排完,集气瓶口有大量气泡冒出,证明已收集满。
2.用向上排空气法收集:将带火星的木条放在集气瓶口,若木条复燃,证明已收集满。
验满方法
1.工业上制取氧气的原理如图1所示,部分物质的沸点如图2。下列有关说法正确的是( )
A.操作①中控制温度在-183℃之上
B.液态物质为液态氧气
C.蓝色钢瓶中气体能用作燃料
D.工业制氧气过程为物理变化
D
2.如图所示为实验室用高锰酸钾制取氧气,其中有关试管的操作正确的是( )
C
A.加入高锰酸钾
B.连接橡胶塞和试管
C.加热高锰酸钾
D.洗涤试管
3.高锰酸钾制取氧气的实验如图,
下列操作符合安全规范的是( )
A.连接仪器——将试管抵住实验台,用力塞紧胶塞
B.加热试管——先预热,再对准试剂所在部位加热
C.结束实验——熄灭酒精灯后,将导管移出水面
D.整理复位——加热后的试管,立即用冷水清洗
B
4.如图是氧气的实验室制备、收集、验满、检验操作,错误的是( )
D
A.氧气的制备
B.收集氧气
C.氧气验满
D.氧气的检验
制
取
氧
气
工业制氧气
实验室制氧气
分离液态空气
发生装置
收集装置
实验步骤
原理:加热高锰酸钾
同课章节目录
