第六单元控制燃烧 单元测试 (含答案) 2025-2026学年化学鲁教版(2024)九年级上册
文档属性
| 名称 | 第六单元控制燃烧 单元测试 (含答案) 2025-2026学年化学鲁教版(2024)九年级上册 |  | |
| 格式 | docx | ||
| 文件大小 | 624.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-29 23:30:54 | ||
图片预览

文档简介
第六单元 控制燃烧
班级: 姓名: 学号: 得分:
可能用到的相对原子质量:H—1 C—12 N—14 O—16
一、 选择题:共10题,每小题只有一个选项最符合题意。
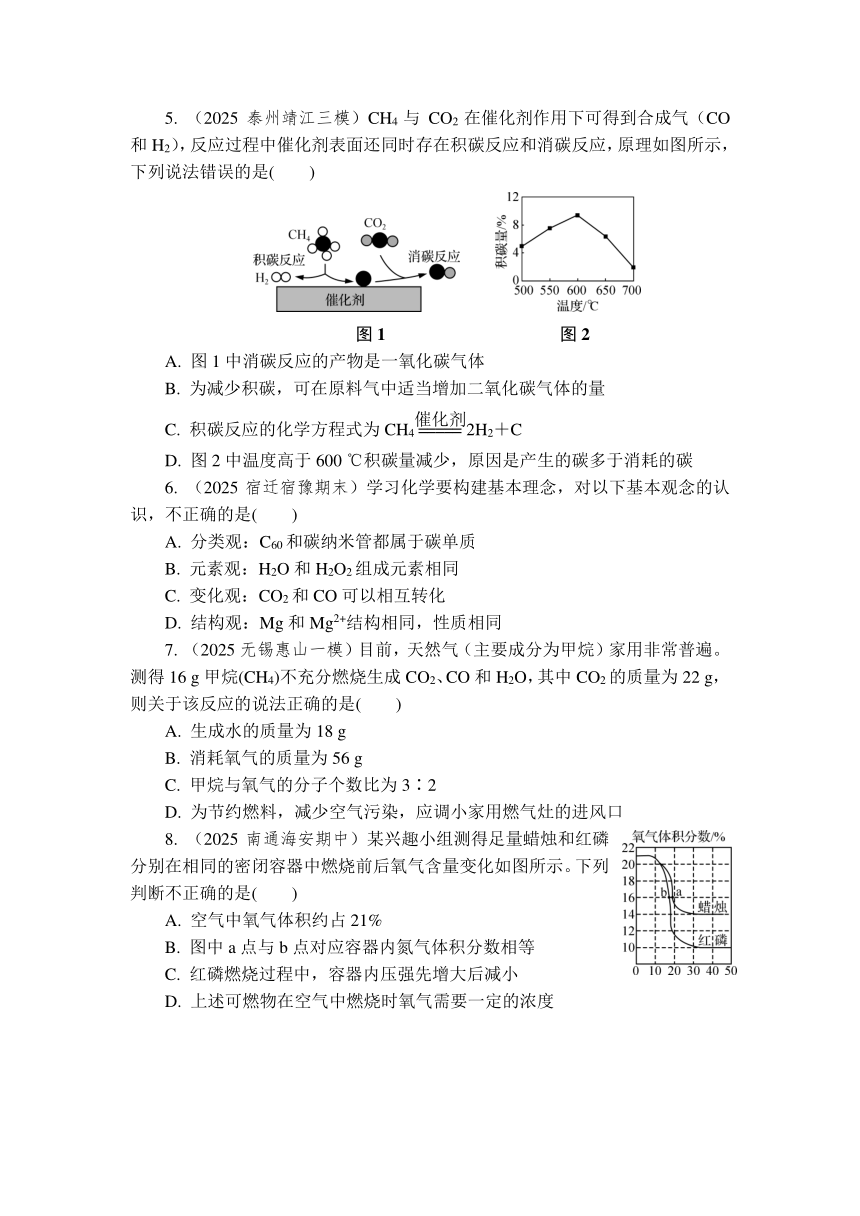
1. (2025扬州江都月考)2024年11月15日,2024年亚洲低碳技术和创新大会暨第四届碳中和与绿色发展大会在辽宁省大连市举办。本次大会以“推动低零碳技术创新,共建清洁美丽亚洲”为主题。下列行为不符合大会主题的是( )
A. 购物拒绝过度包装 B. 及时关闭电器电源
C. 使用一次性餐具 D. 短途出行骑自行车
2. (2025无锡宜兴二模)下列有关二氧化碳的制取、收集、验满和检验的操作,其中错误的是( )
A B C D
3. (2025常州武进二模)新材料“碳海绵”主要成分是石墨烯和碳纳米管(两者都是碳单质),具备高弹性和疏松多孔的结构,其密度约为氢气密度的两倍。关于“碳海绵”的说法不正确的是( )
A. “碳海绵”充分燃烧生成CO2 B. “碳海绵”具有吸附性,属于物理性质
C. “碳海绵”具有一定的吸附性 D. “碳海绵”是单质
4. (2025扬州高邮期末)阅读近几年我国发电量及占比情况表格。下列说法不正确的是( )
年份 总量/亿千瓦时 火电/% 水电/% 核电/% 风能/% 太阳能/%
2022 88 487 69.80 14.30 5.00 8.20 2.70
2023 94 564 69.95 12.80 4.86 9.08 3.30
A. 发电总量的增长说明我国经济发展势头良好
B. 核电不安全,应禁止使用
C. 火力发电仍然占我国发电结构的第一位置,减排工作任重道远
D. 风能、太阳能、水电的发电量会受气候条件的影响
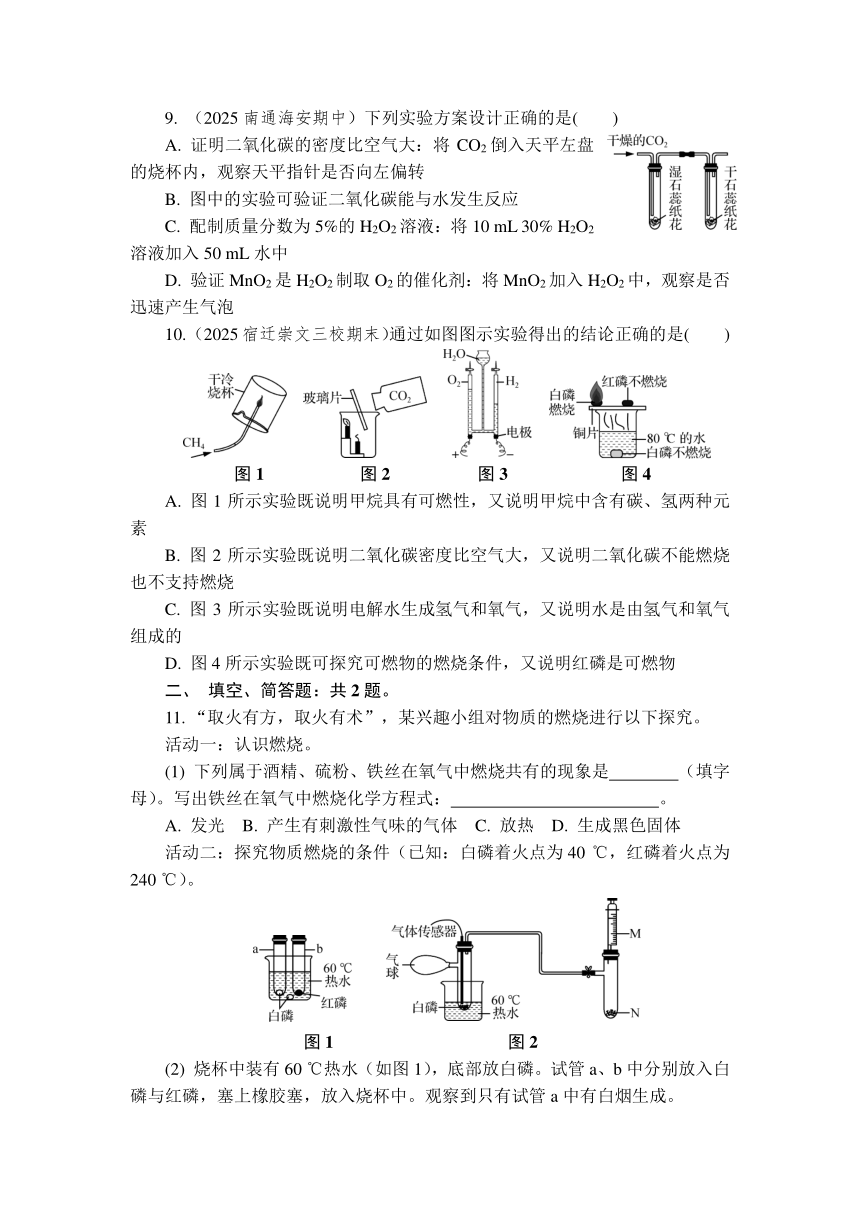
5. (2025泰州靖江三模)CH4与CO2在催化剂作用下可得到合成气(CO和H2),反应过程中催化剂表面还同时存在积碳反应和消碳反应,原理如图所示,下列说法错误的是( )
图1 图2
A. 图1中消碳反应的产物是一氧化碳气体
B. 为减少积碳,可在原料气中适当增加二氧化碳气体的量
C. 积碳反应的化学方程式为CH42H2+C
D. 图2中温度高于600 ℃积碳量减少,原因是产生的碳多于消耗的碳
6. (2025宿迁宿豫期末)学习化学要构建基本理念,对以下基本观念的认识,不正确的是( )
A. 分类观:C60和碳纳米管都属于碳单质
B. 元素观:H2O和H2O2组成元素相同
C. 变化观:CO2和CO可以相互转化
D. 结构观:Mg和Mg2+结构相同,性质相同
7. (2025无锡惠山一模)目前,天然气(主要成分为甲烷)家用非常普遍。测得16 g甲烷(CH4)不充分燃烧生成CO2、CO和H2O,其中CO2的质量为22 g,则关于该反应的说法正确的是( )
A. 生成水的质量为18 g
B. 消耗氧气的质量为56 g
C. 甲烷与氧气的分子个数比为3∶2
D. 为节约燃料,减少空气污染,应调小家用燃气灶的进风口
8. (2025南通海安期中)某兴趣小组测得足量蜡烛和红磷分别在相同的密闭容器中燃烧前后氧气含量变化如图所示。下列判断不正确的是( )
A. 空气中氧气体积约占21%
B. 图中a点与b点对应容器内氮气体积分数相等
C. 红磷燃烧过程中,容器内压强先增大后减小
D. 上述可燃物在空气中燃烧时氧气需要一定的浓度
9. (2025南通海安期中)下列实验方案设计正确的是( )
A. 证明二氧化碳的密度比空气大:将CO2倒入天平左盘的烧杯内,观察天平指针是否向左偏转
B. 图中的实验可验证二氧化碳能与水发生反应
C. 配制质量分数为5%的H2O2溶液:将10 mL 30% H2O2溶液加入50 mL水中
D. 验证MnO2是H2O2制取O2的催化剂:将MnO2加入H2O2中,观察是否迅速产生气泡
10. (2025宿迁崇文三校期末)通过如图图示实验得出的结论正确的是( )
图1 图2 图3 图4
A. 图1所示实验既说明甲烷具有可燃性,又说明甲烷中含有碳、氢两种元素
B. 图2所示实验既说明二氧化碳密度比空气大,又说明二氧化碳不能燃烧也不支持燃烧
C. 图3所示实验既说明电解水生成氢气和氧气,又说明水是由氢气和氧气组成的
D. 图4所示实验既可探究可燃物的燃烧条件,又说明红磷是可燃物
二、 填空、简答题:共2题。
11. “取火有方,取火有术”,某兴趣小组对物质的燃烧进行以下探究。
活动一:认识燃烧。
(1) 下列属于酒精、硫粉、铁丝在氧气中燃烧共有的现象是 (填字母)。写出铁丝在氧气中燃烧化学方程式: 。
A. 发光 B. 产生有刺激性气味的气体 C. 放热 D. 生成黑色固体
活动二:探究物质燃烧的条件(已知:白磷着火点为40 ℃,红磷着火点为240 ℃)。
图1 图2
(2) 烧杯中装有60 ℃热水(如图1),底部放白磷。试管a、b中分别放入白磷与红磷,塞上橡胶塞,放入烧杯中。观察到只有试管a中有白烟生成。
①对比图1中试管a、b的实验现象,说明可燃物燃烧所需条件之一是 。
②在实验过程中发现白磷燃烧不剧烈,可能的原因是氧气不足,于是对实验进行改进(如图2),物质M和N分别是 (填化学式)。
12. (2025宿迁沭阳期末)清华大学团队研发的超长碳纳米管可能会成为未来建造太空电梯的材料。碳纳米管是碳单质的一种。请根据题图回答问题。
(1) 碳纳米管、金刚石、石墨和C60都是碳的单质,但它们的物理性质差异很大的原因是 。
(2) 到目前为止,碳纳米管是人类能造出来最坚固的材料。请推测碳纳米管可能具有的一条物理性质: 。
(3) 中国高铁惊艳世界,“大国重器”扬我国威。高铁动车与电路连接的石墨电刷用到石墨的物理性质主要是 性。
(4) 我国提出争取2030年前达到碳达峰,2060年实现碳中和的目标。“碳中和”“碳达峰”中“碳”指的主要是 ;“碳中和”的途径之一是利用海水吸收该气体,反应的化学方程式为 。
三、 推理、计算题:共1题。
13. (2025苏州高新二模)天然气(主要成分为CH4,含有少量的杂质H2S)是重要的化工原料。
Ⅰ. CH4的综合利用,制备甲醇(CH3OH)流程如图1所示。
图1 图2 图3
(1) 天然气属于 (填“可再生”或“不可再生”)能源。CH4完全燃烧的化学方程式为 。
(2) 已知:元素化合价在反应前后发生改变的反应属于氧化还原反应,则在催化反应室Ⅰ中的化学反应 (填“属于”或“不属于”)氧化还原反应。
(3) 催化反应室Ⅰ中16 g CH4完全转化,理论上得到的H2的质量为 g。
(4) 我国学者开发了一种新型催化剂可用于反应室Ⅱ中,转化的微观示意图如图2,该过程的中间产物为O、H和 (填化学式),进一步作用生成甲醇(CH3OH)和水。
Ⅱ. H2S的处理。
活性Fe2O3·H2O是一种固体脱硫剂,其脱硫原理是将含硫化合物吸附到脱硫剂的孔隙中,进而发生反应。利用Fe2O3·H2O脱除天然气中的H2S可生成Fe2S3·H2O和水,当脱硫剂达到饱和后即不再具有脱硫能力,需要对其进行再生。研究表明:一定的温度下,通入浓度为4%的氧气可使Fe2S3·H2O重新转化为Fe2O3·H2O和S,实现“再生”。
(5) 利用该固体脱硫剂脱去H2S的化学方程式为________________________
______________________________。
(6) 多次“再生”后,脱硫剂的活性不断下降,脱硫效果明显变差的原因可能是 。
(7) “再生”结束的标志是 。
四、 实验、探究题:共2题。
14. (2025宿迁沭阳期末)实现2030年碳达峰、2060年碳中和,是我国政府对国际社会的重要承诺。为此某小组对二氧化碳的制备、性质产生兴趣,开启了探究之旅。如图是实验室制备CO2并验证CO2性质的实验装置图,按要求回答下列问题。
F G
(1) 在检查装置C的气密性操作时,关闭活塞M和N,向仪器②中注水至其中的液面高于①中的液面,观察到 ,说明装置C不漏气。
(2) 关闭活塞N,打开活塞M,向仪器②中加入稀盐酸,写出装置C中发生反应的化学方程式: 。装置B中的现象是 。
(3) 关闭活塞M、打开活塞N,用装置C、D制取并收集CO2,观察到 ,说明D中已收集满CO2。
(4) 也可用装置F代替装置C制取CO2,优点是 。
(5) 装置G有多种用途,实验中若用装置G检验二氧化碳气体,瓶内装澄清石灰水,应将气体从 (填“m”或“n”)端通入。
15. 随着“碳中和”目标的提出,CO2的捕集成为研究热点。氧化钙基吸附剂是目前CO2捕集技术中极具潜力的高温吸附剂。某研究团队对该固体吸附剂吸附性能的最佳改性条件展开探究。
任务一:认识吸附剂的工作原理
【查阅资料1】
①吸附:CaO在高温下与CO2反应生成CaCO3;
②脱附:CaCO3焙烧分解生成CO2和CaO,实现CaO再生。
(1) CaO吸附CO2的化学方程式为 。
在不同温度下,通过不同的溶剂与吸附剂产生相互作用,改变其比表面积等因素,可改良吸附剂的吸附性能。
任务二:探究溶剂种类和温度对吸附剂改性效果的影响
【实验探究】分别用75%的乙醇溶液和纯水在三个不同温度下,浸泡吸附剂进行改性。用等质量改性后的吸附剂进行吸附量的循环实验,得到吸附量与循环次数的关系如图所示。(已知:吸附量=×100%)
【查阅资料2】
①吸附剂每经过一次吸附和脱附为一个循环;
②吸附量越大,多次循环后吸附量越稳定,改性效果越好。
图1 图2
(2) 由图1、图2可知:吸附剂的最佳改性条件为 ,理由是 。
吸附剂吸附过程中,生成的CaCO3会覆盖在表面,阻止CO2的进一步扩散,造成吸附性能显著降低,蜂窝状多孔结构有利于CO2向吸附剂内部扩散和吸附。
任务三:探究吸附剂的孔结构对吸附效果的影响
【查阅资料3】
①Ca(OH)2与CO2反应制备CaCO3时,CO2流速会影响CaCO3的孔结构;
②由上述方法制得的CaCO3再制备CaO时,原有孔结构可以保留。
(3) 设计实验,探究用Ca(OH)2与CO2制备优质CaCO3原料的最佳条件:
。
【模型建构】探究多因素对某一变量的影响时,可采用控制变量法。
1. C 2. C 3. D 4. B 5. D 6. D 7. B 8. B
9. A 10. B
11. (1) AC 3Fe+2O2Fe3O4 (2) ①温度达到可燃物的着火点 ②H2O2、MnO2
12. (1) 碳原子排列方式不同 (2) 硬度大或强度高(合理即可) (3) 导电 (4) 二氧化碳(或CO2) CO2+H2O===H2CO3
13. (1) 不可再生 CH4+2O2CO2+2H2O (2) 属于 (3) 8 (4) CO (5) Fe2O3·H2O+3H2S===Fe2S3·H2O+3H2O (6) 多次再生后,脱硫剂表面的大部分孔隙被硫填充,故脱硫效果变差 (7) 氧气浓度不再变化或不再下降
14. (1) 一段时间后液面差保持不变 (2) CaCO3+2HCl===CaCl2+H2O+CO2↑ 紫色石蕊溶液变红 (3) 装置E中低处蜡烛熄灭 (4) 可以控制反应的发生和停止 (5) m
15. (1) CaO+CO2CaCO3 (2) 75%乙醇(25 ℃) 吸附量大,且多次循环后吸附量较稳定 (3) 取多份等质量、等浓度的Ca(OH)2浆液,在相同温度和反应时间下,通入不同流速的CO2
班级: 姓名: 学号: 得分:
可能用到的相对原子质量:H—1 C—12 N—14 O—16
一、 选择题:共10题,每小题只有一个选项最符合题意。
1. (2025扬州江都月考)2024年11月15日,2024年亚洲低碳技术和创新大会暨第四届碳中和与绿色发展大会在辽宁省大连市举办。本次大会以“推动低零碳技术创新,共建清洁美丽亚洲”为主题。下列行为不符合大会主题的是( )
A. 购物拒绝过度包装 B. 及时关闭电器电源
C. 使用一次性餐具 D. 短途出行骑自行车
2. (2025无锡宜兴二模)下列有关二氧化碳的制取、收集、验满和检验的操作,其中错误的是( )
A B C D
3. (2025常州武进二模)新材料“碳海绵”主要成分是石墨烯和碳纳米管(两者都是碳单质),具备高弹性和疏松多孔的结构,其密度约为氢气密度的两倍。关于“碳海绵”的说法不正确的是( )
A. “碳海绵”充分燃烧生成CO2 B. “碳海绵”具有吸附性,属于物理性质
C. “碳海绵”具有一定的吸附性 D. “碳海绵”是单质
4. (2025扬州高邮期末)阅读近几年我国发电量及占比情况表格。下列说法不正确的是( )
年份 总量/亿千瓦时 火电/% 水电/% 核电/% 风能/% 太阳能/%
2022 88 487 69.80 14.30 5.00 8.20 2.70
2023 94 564 69.95 12.80 4.86 9.08 3.30
A. 发电总量的增长说明我国经济发展势头良好
B. 核电不安全,应禁止使用
C. 火力发电仍然占我国发电结构的第一位置,减排工作任重道远
D. 风能、太阳能、水电的发电量会受气候条件的影响
5. (2025泰州靖江三模)CH4与CO2在催化剂作用下可得到合成气(CO和H2),反应过程中催化剂表面还同时存在积碳反应和消碳反应,原理如图所示,下列说法错误的是( )
图1 图2
A. 图1中消碳反应的产物是一氧化碳气体
B. 为减少积碳,可在原料气中适当增加二氧化碳气体的量
C. 积碳反应的化学方程式为CH42H2+C
D. 图2中温度高于600 ℃积碳量减少,原因是产生的碳多于消耗的碳
6. (2025宿迁宿豫期末)学习化学要构建基本理念,对以下基本观念的认识,不正确的是( )
A. 分类观:C60和碳纳米管都属于碳单质
B. 元素观:H2O和H2O2组成元素相同
C. 变化观:CO2和CO可以相互转化
D. 结构观:Mg和Mg2+结构相同,性质相同
7. (2025无锡惠山一模)目前,天然气(主要成分为甲烷)家用非常普遍。测得16 g甲烷(CH4)不充分燃烧生成CO2、CO和H2O,其中CO2的质量为22 g,则关于该反应的说法正确的是( )
A. 生成水的质量为18 g
B. 消耗氧气的质量为56 g
C. 甲烷与氧气的分子个数比为3∶2
D. 为节约燃料,减少空气污染,应调小家用燃气灶的进风口
8. (2025南通海安期中)某兴趣小组测得足量蜡烛和红磷分别在相同的密闭容器中燃烧前后氧气含量变化如图所示。下列判断不正确的是( )
A. 空气中氧气体积约占21%
B. 图中a点与b点对应容器内氮气体积分数相等
C. 红磷燃烧过程中,容器内压强先增大后减小
D. 上述可燃物在空气中燃烧时氧气需要一定的浓度
9. (2025南通海安期中)下列实验方案设计正确的是( )
A. 证明二氧化碳的密度比空气大:将CO2倒入天平左盘的烧杯内,观察天平指针是否向左偏转
B. 图中的实验可验证二氧化碳能与水发生反应
C. 配制质量分数为5%的H2O2溶液:将10 mL 30% H2O2溶液加入50 mL水中
D. 验证MnO2是H2O2制取O2的催化剂:将MnO2加入H2O2中,观察是否迅速产生气泡
10. (2025宿迁崇文三校期末)通过如图图示实验得出的结论正确的是( )
图1 图2 图3 图4
A. 图1所示实验既说明甲烷具有可燃性,又说明甲烷中含有碳、氢两种元素
B. 图2所示实验既说明二氧化碳密度比空气大,又说明二氧化碳不能燃烧也不支持燃烧
C. 图3所示实验既说明电解水生成氢气和氧气,又说明水是由氢气和氧气组成的
D. 图4所示实验既可探究可燃物的燃烧条件,又说明红磷是可燃物
二、 填空、简答题:共2题。
11. “取火有方,取火有术”,某兴趣小组对物质的燃烧进行以下探究。
活动一:认识燃烧。
(1) 下列属于酒精、硫粉、铁丝在氧气中燃烧共有的现象是 (填字母)。写出铁丝在氧气中燃烧化学方程式: 。
A. 发光 B. 产生有刺激性气味的气体 C. 放热 D. 生成黑色固体
活动二:探究物质燃烧的条件(已知:白磷着火点为40 ℃,红磷着火点为240 ℃)。
图1 图2
(2) 烧杯中装有60 ℃热水(如图1),底部放白磷。试管a、b中分别放入白磷与红磷,塞上橡胶塞,放入烧杯中。观察到只有试管a中有白烟生成。
①对比图1中试管a、b的实验现象,说明可燃物燃烧所需条件之一是 。
②在实验过程中发现白磷燃烧不剧烈,可能的原因是氧气不足,于是对实验进行改进(如图2),物质M和N分别是 (填化学式)。
12. (2025宿迁沭阳期末)清华大学团队研发的超长碳纳米管可能会成为未来建造太空电梯的材料。碳纳米管是碳单质的一种。请根据题图回答问题。
(1) 碳纳米管、金刚石、石墨和C60都是碳的单质,但它们的物理性质差异很大的原因是 。
(2) 到目前为止,碳纳米管是人类能造出来最坚固的材料。请推测碳纳米管可能具有的一条物理性质: 。
(3) 中国高铁惊艳世界,“大国重器”扬我国威。高铁动车与电路连接的石墨电刷用到石墨的物理性质主要是 性。
(4) 我国提出争取2030年前达到碳达峰,2060年实现碳中和的目标。“碳中和”“碳达峰”中“碳”指的主要是 ;“碳中和”的途径之一是利用海水吸收该气体,反应的化学方程式为 。
三、 推理、计算题:共1题。
13. (2025苏州高新二模)天然气(主要成分为CH4,含有少量的杂质H2S)是重要的化工原料。
Ⅰ. CH4的综合利用,制备甲醇(CH3OH)流程如图1所示。
图1 图2 图3
(1) 天然气属于 (填“可再生”或“不可再生”)能源。CH4完全燃烧的化学方程式为 。
(2) 已知:元素化合价在反应前后发生改变的反应属于氧化还原反应,则在催化反应室Ⅰ中的化学反应 (填“属于”或“不属于”)氧化还原反应。
(3) 催化反应室Ⅰ中16 g CH4完全转化,理论上得到的H2的质量为 g。
(4) 我国学者开发了一种新型催化剂可用于反应室Ⅱ中,转化的微观示意图如图2,该过程的中间产物为O、H和 (填化学式),进一步作用生成甲醇(CH3OH)和水。
Ⅱ. H2S的处理。
活性Fe2O3·H2O是一种固体脱硫剂,其脱硫原理是将含硫化合物吸附到脱硫剂的孔隙中,进而发生反应。利用Fe2O3·H2O脱除天然气中的H2S可生成Fe2S3·H2O和水,当脱硫剂达到饱和后即不再具有脱硫能力,需要对其进行再生。研究表明:一定的温度下,通入浓度为4%的氧气可使Fe2S3·H2O重新转化为Fe2O3·H2O和S,实现“再生”。
(5) 利用该固体脱硫剂脱去H2S的化学方程式为________________________
______________________________。
(6) 多次“再生”后,脱硫剂的活性不断下降,脱硫效果明显变差的原因可能是 。
(7) “再生”结束的标志是 。
四、 实验、探究题:共2题。
14. (2025宿迁沭阳期末)实现2030年碳达峰、2060年碳中和,是我国政府对国际社会的重要承诺。为此某小组对二氧化碳的制备、性质产生兴趣,开启了探究之旅。如图是实验室制备CO2并验证CO2性质的实验装置图,按要求回答下列问题。
F G
(1) 在检查装置C的气密性操作时,关闭活塞M和N,向仪器②中注水至其中的液面高于①中的液面,观察到 ,说明装置C不漏气。
(2) 关闭活塞N,打开活塞M,向仪器②中加入稀盐酸,写出装置C中发生反应的化学方程式: 。装置B中的现象是 。
(3) 关闭活塞M、打开活塞N,用装置C、D制取并收集CO2,观察到 ,说明D中已收集满CO2。
(4) 也可用装置F代替装置C制取CO2,优点是 。
(5) 装置G有多种用途,实验中若用装置G检验二氧化碳气体,瓶内装澄清石灰水,应将气体从 (填“m”或“n”)端通入。
15. 随着“碳中和”目标的提出,CO2的捕集成为研究热点。氧化钙基吸附剂是目前CO2捕集技术中极具潜力的高温吸附剂。某研究团队对该固体吸附剂吸附性能的最佳改性条件展开探究。
任务一:认识吸附剂的工作原理
【查阅资料1】
①吸附:CaO在高温下与CO2反应生成CaCO3;
②脱附:CaCO3焙烧分解生成CO2和CaO,实现CaO再生。
(1) CaO吸附CO2的化学方程式为 。
在不同温度下,通过不同的溶剂与吸附剂产生相互作用,改变其比表面积等因素,可改良吸附剂的吸附性能。
任务二:探究溶剂种类和温度对吸附剂改性效果的影响
【实验探究】分别用75%的乙醇溶液和纯水在三个不同温度下,浸泡吸附剂进行改性。用等质量改性后的吸附剂进行吸附量的循环实验,得到吸附量与循环次数的关系如图所示。(已知:吸附量=×100%)
【查阅资料2】
①吸附剂每经过一次吸附和脱附为一个循环;
②吸附量越大,多次循环后吸附量越稳定,改性效果越好。
图1 图2
(2) 由图1、图2可知:吸附剂的最佳改性条件为 ,理由是 。
吸附剂吸附过程中,生成的CaCO3会覆盖在表面,阻止CO2的进一步扩散,造成吸附性能显著降低,蜂窝状多孔结构有利于CO2向吸附剂内部扩散和吸附。
任务三:探究吸附剂的孔结构对吸附效果的影响
【查阅资料3】
①Ca(OH)2与CO2反应制备CaCO3时,CO2流速会影响CaCO3的孔结构;
②由上述方法制得的CaCO3再制备CaO时,原有孔结构可以保留。
(3) 设计实验,探究用Ca(OH)2与CO2制备优质CaCO3原料的最佳条件:
。
【模型建构】探究多因素对某一变量的影响时,可采用控制变量法。
1. C 2. C 3. D 4. B 5. D 6. D 7. B 8. B
9. A 10. B
11. (1) AC 3Fe+2O2Fe3O4 (2) ①温度达到可燃物的着火点 ②H2O2、MnO2
12. (1) 碳原子排列方式不同 (2) 硬度大或强度高(合理即可) (3) 导电 (4) 二氧化碳(或CO2) CO2+H2O===H2CO3
13. (1) 不可再生 CH4+2O2CO2+2H2O (2) 属于 (3) 8 (4) CO (5) Fe2O3·H2O+3H2S===Fe2S3·H2O+3H2O (6) 多次再生后,脱硫剂表面的大部分孔隙被硫填充,故脱硫效果变差 (7) 氧气浓度不再变化或不再下降
14. (1) 一段时间后液面差保持不变 (2) CaCO3+2HCl===CaCl2+H2O+CO2↑ 紫色石蕊溶液变红 (3) 装置E中低处蜡烛熄灭 (4) 可以控制反应的发生和停止 (5) m
15. (1) CaO+CO2CaCO3 (2) 75%乙醇(25 ℃) 吸附量大,且多次循环后吸附量较稳定 (3) 取多份等质量、等浓度的Ca(OH)2浆液,在相同温度和反应时间下,通入不同流速的CO2
同课章节目录
