高二化学气体的制备归纳总结
图片预览

文档简介
高二化学气体的制备归纳总结
气体制备装置一般分四大部分:发生装置,净化装置(干燥装置),收集装置,尾气处理装置。
一、气体的发生装置
一)固+固(加热):适用于制O2、NH3、(CH4课本没有)
二)固+液体(不加热):适用于制CO2、H2 、H2S(SO2、NO2、NO课本没有制法)
(一)常规类
(二)启普发生器类
三)固+液或液+液(加热):适用于制C2H4、Cl2、SO2、乙酸乙酯、蒸馏(HCl课本没有)
a b c d e f
注意点:
1、用KMnO4制取O2时,为了防止生成的细小颗粒堵塞导管,在大试管口放一松软棉花。
2、实验室制取氨气时,由于氨气极易与空气中的水结合,导致外部空气向试管里“冲”,里面氨气向外逸出,在小试管口放一疏松棉花。
3、在制取C2H2时,若用大试管为反应器时,在大试管口放一松软棉花,防止生成的泡沫喷出。
4、Cu和浓硫酸制取SO2做性质试验的小试管口堵一块蘸有少量碱液的棉花防止污染。
二、气体的净化(干燥)装置
一)常见净化原理:气体的净化可分为物理方法和化学方法。遵循以下原理:
①不损失主体气体;②不引入新杂质;③在密闭容器中进行;④先除易除的气体。
1、物理方法:
(1)液化法:利用沸点不同从空气中分离N2和O2。
(2)水洗法:利用溶解度不同从N2和NH3中除去NH3;从NO和NO2中除去NO2。
2、化学方法:
(1)氧化还原法:灼热铜丝网除去混合物中的O2(2Cu+O2=2CuO);CuO除去H2、CO等。
(2)酸碱法:NH3和CO2通过碱石灰除去CO2。(CaO+CO2=CaCO3)
(3)沉淀法:除去CO2中的H2S通过CuSO4溶液。H2S+CuSO4=CuS↓+H2SO4
(4)最常用的为洗气法:
①用饱和NaCl除去Cl2中的HCl;
②用饱和NaHCO3除去CO2中的HCl、SO2等;
③用酸性高锰酸钾除去气体中的SO2;(如CO2中的SO2)
注意:以下考得比较少:
④用饱和NaHSO3除去SO2中的SO3;[浓硫酸也可除SO3(SO3易溶于浓硫酸)];冷却同样可以除SO3。
⑤用饱和Na2CO3溶液除去乙酸乙酯中的乙醇或乙酸;
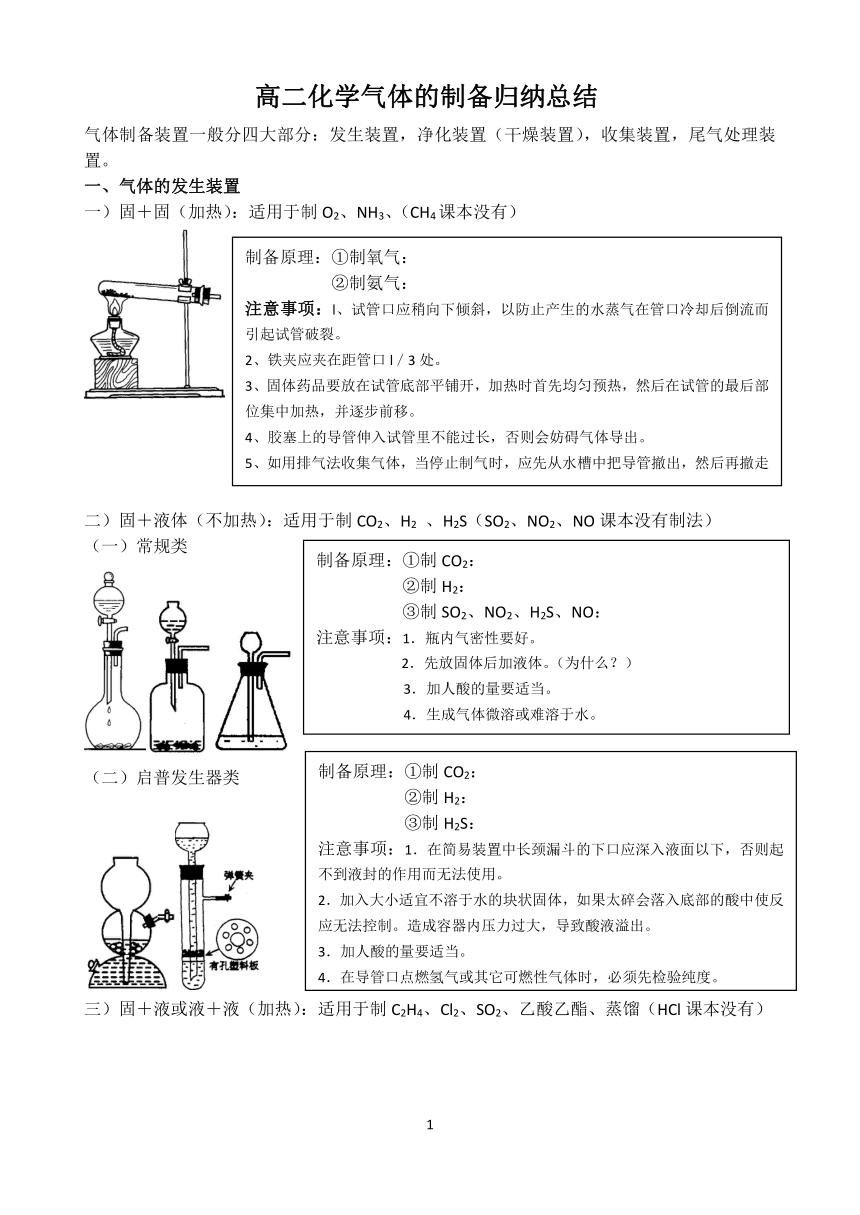
二)常见净化装置
a b c d e
a为加热固态试剂以除去气体中杂质的装置,为防止固体“流动”,两端用石棉或玻璃棉堵住,但要使气流通畅。b、c、d一般盛液体药品,用于洗液。e一般盛固体药品,往往根据增重可测出吸收物质的质量,用于定量计算。
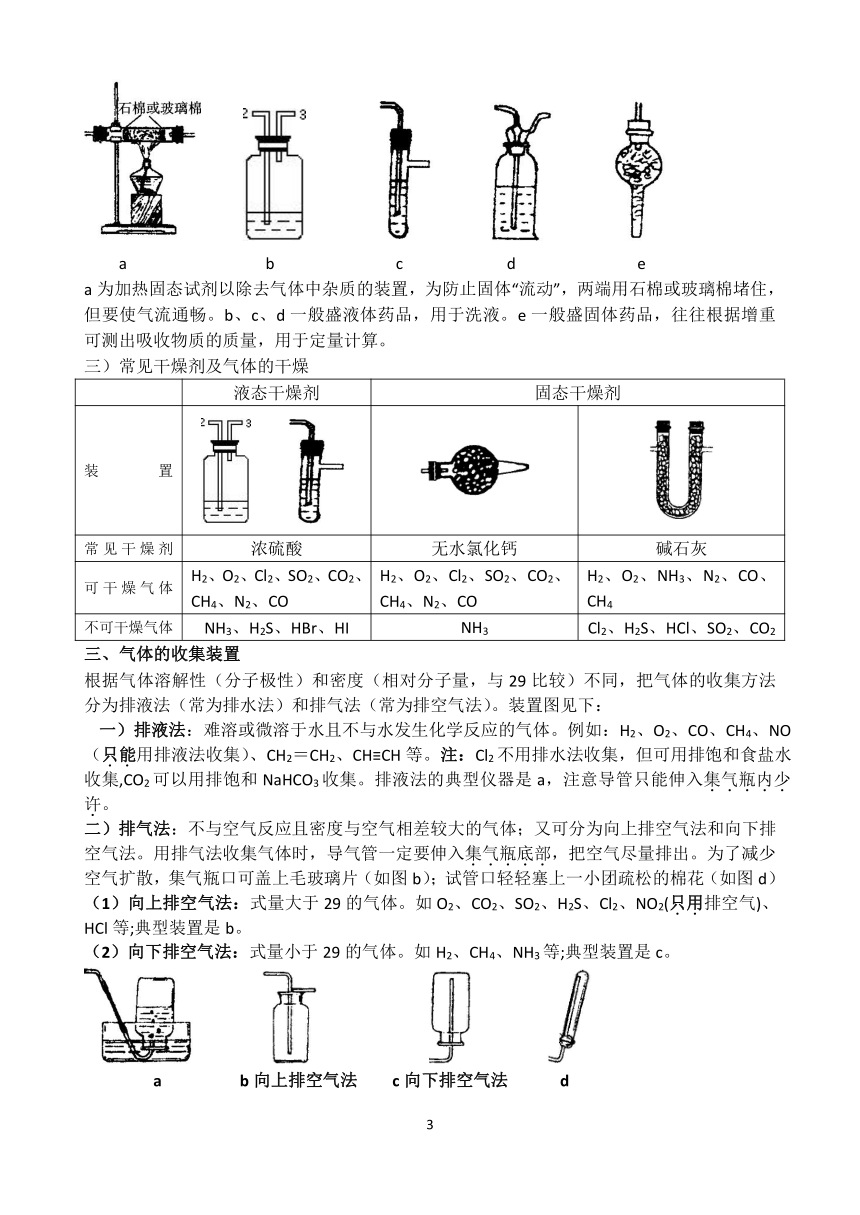
三)常见干燥剂及气体的干燥
液态干燥剂 固态干燥剂
装置
常见干燥剂 浓硫酸 无水氯化钙 碱石灰
可干燥气体 H2、O2、Cl2、SO2、CO2、CH4、N2、CO H2、O2、Cl2、SO2、CO2、CH4、N2、CO H2、O2、NH3、N2、CO、CH4
不可干燥气体 NH3、H2S、HBr、HI NH3 Cl2、H2S、HCl、SO2、CO2
三、气体的收集装置
根据气体溶解性(分子极性)和密度(相对分子量,与29比较)不同,把气体的收集方法分为排液法(常为排水法)和排气法(常为排空气法)。装置图见下:
一)排液法:难溶或微溶于水且不与水发生化学反应的气体。例如:H2、O2、CO、CH4、NO(只能用排液法收集)、CH2=CH2、CH≡CH等。注:Cl2不用排水法收集,但可用排饱和食盐水收集,CO2可以用排饱和NaHCO3收集。排液法的典型仪器是a,注意导管只能伸入集气瓶内少许。
二)排气法:不与空气反应且密度与空气相差较大的气体;又可分为向上排空气法和向下排空气法。用排气法收集气体时,导气管一定要伸入集气瓶底部,把空气尽量排出。为了减少空气扩散,集气瓶口可盖上毛玻璃片(如图b);试管口轻轻塞上一小团疏松的棉花(如图d)
(1)向上排空气法:式量大于29的气体。如O2、CO2、SO2、H2S、Cl2、NO2(只用排空气)、HCl等;典型装置是b。
(2)向下排空气法:式量小于29的气体。如H2、CH4、NH3等;典型装置是c。
a b向上排空气法 c向下排空气法 d
练习:(发散思维)
1、下列装置也能用于收集气体,试根据气体的流向判断收集气体的种类。
2、排水法收集的气体和排气法收集的气体纯度有何不同?
3、某些气体要求非常干燥,则收集前后都要干燥,如何组装仪器?
四、尾气处理装置
通常有毒和有污染的尾气必须适当处理。常用经典仪器有:
a b c d e
a用于NaOH吸收氯气、CO2;硫酸铜吸收H2S(气体溶解或反应速度不很快,不易引起倒吸);
b用于收集少量气体然后处理;c、d收集极易溶且溶解很快的气体。如HCl、HBr、NH3等;其中d 吸收量少。e用于处理难以吸收(有毒)且可燃的气体。如H2、CO等。
实验装置总结思路
1、装置的安装顺序
2、操作顺序
装置连接→气密性检查→装固体药品→加液体药品→气体制取
要点1:气密性的检查
创新设计方案集锦:
1、气体安全装置
1)防倒吸安全装置
2)防堵塞安全装置
3)防污染安全装置 2、液封装置
3、量气体体积装置(读数时,要使量筒与洗气瓶中的液面保持水平,消除水位差造成的误差)
4、启普发生器原理及类似反应器
精选题
一、选择题
1.图5-19装置可用于 [ ]
A.加热NaHCO3制CO2 B.用铜和稀硝酸反应制NO
C.用NH4Cl与浓NaOH溶液反应制NH3
D.用NaCl与浓硫酸反应制HCl
2.按下述方法制备气体,合理而又实用的是 [ ]
A.锌粒与稀硝酸反应制备H2
B.向饱和氯化钠溶液中滴加浓硫酸制备HCl
C.亚硫酸钠与浓硫酸反应制备SO2
D.大理石与浓硫酸反应制备CO2
3.图5-20是一套实验室制气装置,用于发生、干燥和收集气体。下列各组物质中能利用这套装置进行实验的是[ ]
A.铜屑和浓硝酸 B.二氧化锰和浓HCl
C.电石和水 D.碳酸钙和稀盐酸
4.现用二氧化锰氧化浓盐酸来制取氯气,将氯气经过净化装置、干燥装置后,再跟灼热的铜屑反应,以制取氯化铜固体,最后还应连接尾气吸收装置,以保护环境。在尾气吸收装置中,若只有以下试剂,你认为不适宜的试剂是 [ ]
A.溴化钠溶液 B.氢氧化钠溶液 C.氯化钠溶液 D.硫酸亚铁溶液
5.实验桌上只有烧碱、盐酸、铜片、大理石、蒸馏水五种试剂,从欠缺试剂的角度来看(实验仪器齐全),无法进行的实验项目是 [ ]
A.制取氢气 B.制取碳酸钠
C.制取氯化铜 D.测定盐酸的浓度
6.如图5-21装置,红磷、硫磺分别在a、b瓶中燃烧,当燃烧结束后同时打开两个夹子,可看到 [ ]
A.水同时流入a、b两集气瓶 B.水只流入a集气瓶
C.水只流入b集气瓶 D.a、b集气瓶中都无水流入
7.某实验室有锥形瓶、集气瓶、各种玻璃导管、橡皮塞、烧杯、药匙和所需药品,可以制备下列各组气体的是[ ]
A.H2、NO2、CH4 B.HCl、Cl2、O2 C.H2、CO2、H2S D.C2H2、NH3、C2H4
8.当氢气混有氯化氢、硫化氢、二氧化碳和水蒸气时,为得到干燥纯净的氢气,操作步骤和顺序完全正确的是(每一步只除去一种杂质) [ ]
①通过装浓硫酸的洗气瓶 ②通过装水的洗气瓶 ③通过装氢氧化钠溶液的洗气瓶 ④通过灼热的氧化铜 ⑤通过装硫酸铜溶液的洗气瓶 ⑥通过装有五氧化二磷的干燥管
A.②、⑤、③、① B.①、③、④、⑤ C.②、④、③、① D.①、②、⑤、⑥
二、非选择题
9.图5-22所示装置可以收集以下气体:
H2、NO、CH4、HCl、Cl2、NH3、SO2。
(1)若集气瓶是干燥的,气体从a进入,可收集的气体有______。
(2)若将集气瓶盛满水,收集气体并测量气体的体积,可收集并测量体积的气体有______。此时气体应由______管进入,由______管通向量筒。
10.图5-23装置:(铁架台和加持仪器均略去)制得的气体X是干燥和纯净的,在装置A、B、C中盛放的试剂在下列①~(11)中选用。
①MnO2粉末 ②P2O5粉末 ③NaOH粒 ④无水CaCl2 ⑤NaBr粉粒 ⑥浓盐酸 ⑦浓硫酸 ⑧浓氨水 ⑨浓NaOH溶液 ⑩稀盐酸 (11)稀硫酸。试回答:
(1)A中a盛放的是(均用编号)______,B中盛放的是______,B中盛放的是______,C中盛放的是______。
(2)发生器中产生气体X的原理是______。
化学气体的制备归纳总结参考答案
1 2 3 4 5 6 7 8 9
B C AD C D B C A (1)Cl2、H2S、SO2;(2)H2、CH4、NO;b,a。
10
(1)a为⑧、b为③、B中为③、C中为③;(2)因浓氨水滴入固体NaOH时NaOH迅速溶解,同时放热使温度升高,溶液里OH-的浓度大增,使反应NH3+H2O NH3·H2O NH4++OH-的平衡向逆反应方向移动,并因升高温度使氨气的溶解度减小而逸出氨气。
制备原理:①制氧气:
②制氨气:
注意事项:l、试管口应稍向下倾斜,以防止产生的水蒸气在管口冷却后倒流而引起试管破裂。
2、铁夹应夹在距管口l/3处。
3、固体药品要放在试管底部平铺开,加热时首先均匀预热,然后在试管的最后部位集中加热,并逐步前移。
4、胶塞上的导管伸入试管里不能过长,否则会妨碍气体导出。
5、如用排气法收集气体,当停止制气时,应先从水槽中把导管撤出,然后再撤走酒精灯。以防止水倒流。
制备原理:①制CO2:
②制H2:
③制SO2、NO2、H2S、NO:
注意事项:1.瓶内气密性要好。
2.先放固体后加液体。(为什么?)
3.加人酸的量要适当。
4.生成气体微溶或难溶于水。
制备原理:①制CO2:
②制H2:
③制H2S:
注意事项:1.在简易装置中长颈漏斗的下口应深入液面以下,否则起不到液封的作用而无法使用。
2.加入大小适宜不溶于水的块状固体,如果太碎会落入底部的酸中使反应无法控制。造成容器内压力过大,导致酸液溢出。
3.加人酸的量要适当。
4.在导管口点燃氢气或其它可燃性气体时,必须先检验纯度。
制备原理:①制C2H4:②制Cl2:③制NO:④f用于Cu和浓硫酸制取SO2:⑤冰醋酸和乙醇浓硫酸作用下制乙酸乙酯:
注意事项:l、瓶内反应物体积不宜超过烧瓶容积的1/3。
2、a、b、c加热前应放入碎瓷片,防止暴沸。
3、a装置温度计插入反应液面以下,测反应液温度;b装置温度计水银球与支管端口处相平,测气体温度,便于控制馏份。
4、d装置便于随时加入液体,但随反应进行烧瓶内压强增加,液体不易滴入。(改进方法见e)
△
1、将装置的导管口一端浸没于水中,再用双手手掌握住容器(试管可用一只手握住,如左图;复杂仪器还可微热),若在导管口处有气泡冒出,松手后,水在导管里形成了一段水柱,则装置的气密性良好。
概括为:微热看气泡,静置看液面(又称整体法)。
2、如左图,关闭止水夹后,从长颈漏斗向试管中注入一定量的水,使漏斗内液面高于试管内液面,静置后若漏斗内液面不下降,则装置的气密性良好;液面下降,则装置的漏气;
概括为:注液静置看液面(又称局部法)。
PAGE
1
气体制备装置一般分四大部分:发生装置,净化装置(干燥装置),收集装置,尾气处理装置。
一、气体的发生装置
一)固+固(加热):适用于制O2、NH3、(CH4课本没有)
二)固+液体(不加热):适用于制CO2、H2 、H2S(SO2、NO2、NO课本没有制法)
(一)常规类
(二)启普发生器类
三)固+液或液+液(加热):适用于制C2H4、Cl2、SO2、乙酸乙酯、蒸馏(HCl课本没有)
a b c d e f
注意点:
1、用KMnO4制取O2时,为了防止生成的细小颗粒堵塞导管,在大试管口放一松软棉花。
2、实验室制取氨气时,由于氨气极易与空气中的水结合,导致外部空气向试管里“冲”,里面氨气向外逸出,在小试管口放一疏松棉花。
3、在制取C2H2时,若用大试管为反应器时,在大试管口放一松软棉花,防止生成的泡沫喷出。
4、Cu和浓硫酸制取SO2做性质试验的小试管口堵一块蘸有少量碱液的棉花防止污染。
二、气体的净化(干燥)装置
一)常见净化原理:气体的净化可分为物理方法和化学方法。遵循以下原理:
①不损失主体气体;②不引入新杂质;③在密闭容器中进行;④先除易除的气体。
1、物理方法:
(1)液化法:利用沸点不同从空气中分离N2和O2。
(2)水洗法:利用溶解度不同从N2和NH3中除去NH3;从NO和NO2中除去NO2。
2、化学方法:
(1)氧化还原法:灼热铜丝网除去混合物中的O2(2Cu+O2=2CuO);CuO除去H2、CO等。
(2)酸碱法:NH3和CO2通过碱石灰除去CO2。(CaO+CO2=CaCO3)
(3)沉淀法:除去CO2中的H2S通过CuSO4溶液。H2S+CuSO4=CuS↓+H2SO4
(4)最常用的为洗气法:
①用饱和NaCl除去Cl2中的HCl;
②用饱和NaHCO3除去CO2中的HCl、SO2等;
③用酸性高锰酸钾除去气体中的SO2;(如CO2中的SO2)
注意:以下考得比较少:
④用饱和NaHSO3除去SO2中的SO3;[浓硫酸也可除SO3(SO3易溶于浓硫酸)];冷却同样可以除SO3。
⑤用饱和Na2CO3溶液除去乙酸乙酯中的乙醇或乙酸;
二)常见净化装置
a b c d e
a为加热固态试剂以除去气体中杂质的装置,为防止固体“流动”,两端用石棉或玻璃棉堵住,但要使气流通畅。b、c、d一般盛液体药品,用于洗液。e一般盛固体药品,往往根据增重可测出吸收物质的质量,用于定量计算。
三)常见干燥剂及气体的干燥
液态干燥剂 固态干燥剂
装置
常见干燥剂 浓硫酸 无水氯化钙 碱石灰
可干燥气体 H2、O2、Cl2、SO2、CO2、CH4、N2、CO H2、O2、Cl2、SO2、CO2、CH4、N2、CO H2、O2、NH3、N2、CO、CH4
不可干燥气体 NH3、H2S、HBr、HI NH3 Cl2、H2S、HCl、SO2、CO2
三、气体的收集装置
根据气体溶解性(分子极性)和密度(相对分子量,与29比较)不同,把气体的收集方法分为排液法(常为排水法)和排气法(常为排空气法)。装置图见下:
一)排液法:难溶或微溶于水且不与水发生化学反应的气体。例如:H2、O2、CO、CH4、NO(只能用排液法收集)、CH2=CH2、CH≡CH等。注:Cl2不用排水法收集,但可用排饱和食盐水收集,CO2可以用排饱和NaHCO3收集。排液法的典型仪器是a,注意导管只能伸入集气瓶内少许。
二)排气法:不与空气反应且密度与空气相差较大的气体;又可分为向上排空气法和向下排空气法。用排气法收集气体时,导气管一定要伸入集气瓶底部,把空气尽量排出。为了减少空气扩散,集气瓶口可盖上毛玻璃片(如图b);试管口轻轻塞上一小团疏松的棉花(如图d)
(1)向上排空气法:式量大于29的气体。如O2、CO2、SO2、H2S、Cl2、NO2(只用排空气)、HCl等;典型装置是b。
(2)向下排空气法:式量小于29的气体。如H2、CH4、NH3等;典型装置是c。
a b向上排空气法 c向下排空气法 d
练习:(发散思维)
1、下列装置也能用于收集气体,试根据气体的流向判断收集气体的种类。
2、排水法收集的气体和排气法收集的气体纯度有何不同?
3、某些气体要求非常干燥,则收集前后都要干燥,如何组装仪器?
四、尾气处理装置
通常有毒和有污染的尾气必须适当处理。常用经典仪器有:
a b c d e
a用于NaOH吸收氯气、CO2;硫酸铜吸收H2S(气体溶解或反应速度不很快,不易引起倒吸);
b用于收集少量气体然后处理;c、d收集极易溶且溶解很快的气体。如HCl、HBr、NH3等;其中d 吸收量少。e用于处理难以吸收(有毒)且可燃的气体。如H2、CO等。
实验装置总结思路
1、装置的安装顺序
2、操作顺序
装置连接→气密性检查→装固体药品→加液体药品→气体制取
要点1:气密性的检查
创新设计方案集锦:
1、气体安全装置
1)防倒吸安全装置
2)防堵塞安全装置
3)防污染安全装置 2、液封装置
3、量气体体积装置(读数时,要使量筒与洗气瓶中的液面保持水平,消除水位差造成的误差)
4、启普发生器原理及类似反应器
精选题
一、选择题
1.图5-19装置可用于 [ ]
A.加热NaHCO3制CO2 B.用铜和稀硝酸反应制NO
C.用NH4Cl与浓NaOH溶液反应制NH3
D.用NaCl与浓硫酸反应制HCl
2.按下述方法制备气体,合理而又实用的是 [ ]
A.锌粒与稀硝酸反应制备H2
B.向饱和氯化钠溶液中滴加浓硫酸制备HCl
C.亚硫酸钠与浓硫酸反应制备SO2
D.大理石与浓硫酸反应制备CO2
3.图5-20是一套实验室制气装置,用于发生、干燥和收集气体。下列各组物质中能利用这套装置进行实验的是[ ]
A.铜屑和浓硝酸 B.二氧化锰和浓HCl
C.电石和水 D.碳酸钙和稀盐酸
4.现用二氧化锰氧化浓盐酸来制取氯气,将氯气经过净化装置、干燥装置后,再跟灼热的铜屑反应,以制取氯化铜固体,最后还应连接尾气吸收装置,以保护环境。在尾气吸收装置中,若只有以下试剂,你认为不适宜的试剂是 [ ]
A.溴化钠溶液 B.氢氧化钠溶液 C.氯化钠溶液 D.硫酸亚铁溶液
5.实验桌上只有烧碱、盐酸、铜片、大理石、蒸馏水五种试剂,从欠缺试剂的角度来看(实验仪器齐全),无法进行的实验项目是 [ ]
A.制取氢气 B.制取碳酸钠
C.制取氯化铜 D.测定盐酸的浓度
6.如图5-21装置,红磷、硫磺分别在a、b瓶中燃烧,当燃烧结束后同时打开两个夹子,可看到 [ ]
A.水同时流入a、b两集气瓶 B.水只流入a集气瓶
C.水只流入b集气瓶 D.a、b集气瓶中都无水流入
7.某实验室有锥形瓶、集气瓶、各种玻璃导管、橡皮塞、烧杯、药匙和所需药品,可以制备下列各组气体的是[ ]
A.H2、NO2、CH4 B.HCl、Cl2、O2 C.H2、CO2、H2S D.C2H2、NH3、C2H4
8.当氢气混有氯化氢、硫化氢、二氧化碳和水蒸气时,为得到干燥纯净的氢气,操作步骤和顺序完全正确的是(每一步只除去一种杂质) [ ]
①通过装浓硫酸的洗气瓶 ②通过装水的洗气瓶 ③通过装氢氧化钠溶液的洗气瓶 ④通过灼热的氧化铜 ⑤通过装硫酸铜溶液的洗气瓶 ⑥通过装有五氧化二磷的干燥管
A.②、⑤、③、① B.①、③、④、⑤ C.②、④、③、① D.①、②、⑤、⑥
二、非选择题
9.图5-22所示装置可以收集以下气体:
H2、NO、CH4、HCl、Cl2、NH3、SO2。
(1)若集气瓶是干燥的,气体从a进入,可收集的气体有______。
(2)若将集气瓶盛满水,收集气体并测量气体的体积,可收集并测量体积的气体有______。此时气体应由______管进入,由______管通向量筒。
10.图5-23装置:(铁架台和加持仪器均略去)制得的气体X是干燥和纯净的,在装置A、B、C中盛放的试剂在下列①~(11)中选用。
①MnO2粉末 ②P2O5粉末 ③NaOH粒 ④无水CaCl2 ⑤NaBr粉粒 ⑥浓盐酸 ⑦浓硫酸 ⑧浓氨水 ⑨浓NaOH溶液 ⑩稀盐酸 (11)稀硫酸。试回答:
(1)A中a盛放的是(均用编号)______,B中盛放的是______,B中盛放的是______,C中盛放的是______。
(2)发生器中产生气体X的原理是______。
化学气体的制备归纳总结参考答案
1 2 3 4 5 6 7 8 9
B C AD C D B C A (1)Cl2、H2S、SO2;(2)H2、CH4、NO;b,a。
10
(1)a为⑧、b为③、B中为③、C中为③;(2)因浓氨水滴入固体NaOH时NaOH迅速溶解,同时放热使温度升高,溶液里OH-的浓度大增,使反应NH3+H2O NH3·H2O NH4++OH-的平衡向逆反应方向移动,并因升高温度使氨气的溶解度减小而逸出氨气。
制备原理:①制氧气:
②制氨气:
注意事项:l、试管口应稍向下倾斜,以防止产生的水蒸气在管口冷却后倒流而引起试管破裂。
2、铁夹应夹在距管口l/3处。
3、固体药品要放在试管底部平铺开,加热时首先均匀预热,然后在试管的最后部位集中加热,并逐步前移。
4、胶塞上的导管伸入试管里不能过长,否则会妨碍气体导出。
5、如用排气法收集气体,当停止制气时,应先从水槽中把导管撤出,然后再撤走酒精灯。以防止水倒流。
制备原理:①制CO2:
②制H2:
③制SO2、NO2、H2S、NO:
注意事项:1.瓶内气密性要好。
2.先放固体后加液体。(为什么?)
3.加人酸的量要适当。
4.生成气体微溶或难溶于水。
制备原理:①制CO2:
②制H2:
③制H2S:
注意事项:1.在简易装置中长颈漏斗的下口应深入液面以下,否则起不到液封的作用而无法使用。
2.加入大小适宜不溶于水的块状固体,如果太碎会落入底部的酸中使反应无法控制。造成容器内压力过大,导致酸液溢出。
3.加人酸的量要适当。
4.在导管口点燃氢气或其它可燃性气体时,必须先检验纯度。
制备原理:①制C2H4:②制Cl2:③制NO:④f用于Cu和浓硫酸制取SO2:⑤冰醋酸和乙醇浓硫酸作用下制乙酸乙酯:
注意事项:l、瓶内反应物体积不宜超过烧瓶容积的1/3。
2、a、b、c加热前应放入碎瓷片,防止暴沸。
3、a装置温度计插入反应液面以下,测反应液温度;b装置温度计水银球与支管端口处相平,测气体温度,便于控制馏份。
4、d装置便于随时加入液体,但随反应进行烧瓶内压强增加,液体不易滴入。(改进方法见e)
△
1、将装置的导管口一端浸没于水中,再用双手手掌握住容器(试管可用一只手握住,如左图;复杂仪器还可微热),若在导管口处有气泡冒出,松手后,水在导管里形成了一段水柱,则装置的气密性良好。
概括为:微热看气泡,静置看液面(又称整体法)。
2、如左图,关闭止水夹后,从长颈漏斗向试管中注入一定量的水,使漏斗内液面高于试管内液面,静置后若漏斗内液面不下降,则装置的气密性良好;液面下降,则装置的漏气;
概括为:注液静置看液面(又称局部法)。
PAGE
1
同课章节目录
