理科会考复习(四) 氮族元素(基础知识)
文档属性
| 名称 | 理科会考复习(四) 氮族元素(基础知识) |  | |
| 格式 | rar | ||
| 文件大小 | 23.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-03-19 09:43:00 | ||
图片预览

文档简介
理科会考复习(四) 氮族元素(基础知识)
请同学们先把前面的基础知识填好、看完、记住、理解然后完成习题。
一、氮族元素
1、在周期表中的位置:______________,包括_____、______、_______、_____、______五种元素(写元素名称)
2、原子结构:相同点:____________________________________
3、主要性质:
相似性:最高价态为______,最低负价为______,氮的化合价有_______________。
递变性:从上到下
①原子半径_________________,
②氢化物的通式:_______________稳定性_________________,
③最高价氧化物对应水化物的通式:_________酸性_________________,
④元素非金属性_____________,且比同周期的卤族、氧族元素_______。
二、氮及其化合物的相互联系和转变
1、氮气(N2)
(1)物理性质
色 味气体,密度与空气接近,难溶于水(1:0.02),熔点、沸点低,是空气的重要组成部分(体积分数占78%)
(2)分子结构
对共用电子对,电子式为_______,结构式为______(键能大,键牢固,分子稳定)
(3)化学性质
与氢气的反应:______________________________________
与氧气的反应:______________________________________
与活泼金属Mg反应:_________________________________
(4)氮的氧化物:________________________________________.
氮的氧化物是大气主要污染物之一,会引起光化学烟雾。
NO NO2
色
毒 性
水 溶 性
与O2反应 无
与O2、H2O反应
收集
其它反应 NO + NO2+ NaOH 2NO2= N2O4;
(5)氮气的用途
①合成氨、制硝酸的重要原料;②保护气;③冷冻剂。
2、氨气
(1)氨气分子结构
电子式: 结构式: 空间构型: 分子极性:
(2)物理性质
无色、刺激性气味的气体,比空气轻,易液化(常压下降温到—33.5℃或常温下加压到700~800KPa)
(3)化学性质
氨与水的反应:NH3 + H2ONH3·H2ONH4+ + OH-
氨与HCl的反应:___________________________________
氨与氧气的反应: __________________________________
(4)氨气的实验室制法
反应原理:_______________________________
装置类型: 固固加热型(同氧气)
干燥: 用__________干燥,不能用_______、_________、_________干燥。
检验:____________________________________________________________。
(5)氨气的用途
制取氮肥、硝酸、纯碱的原料;有机合成工业原料;致冷剂。
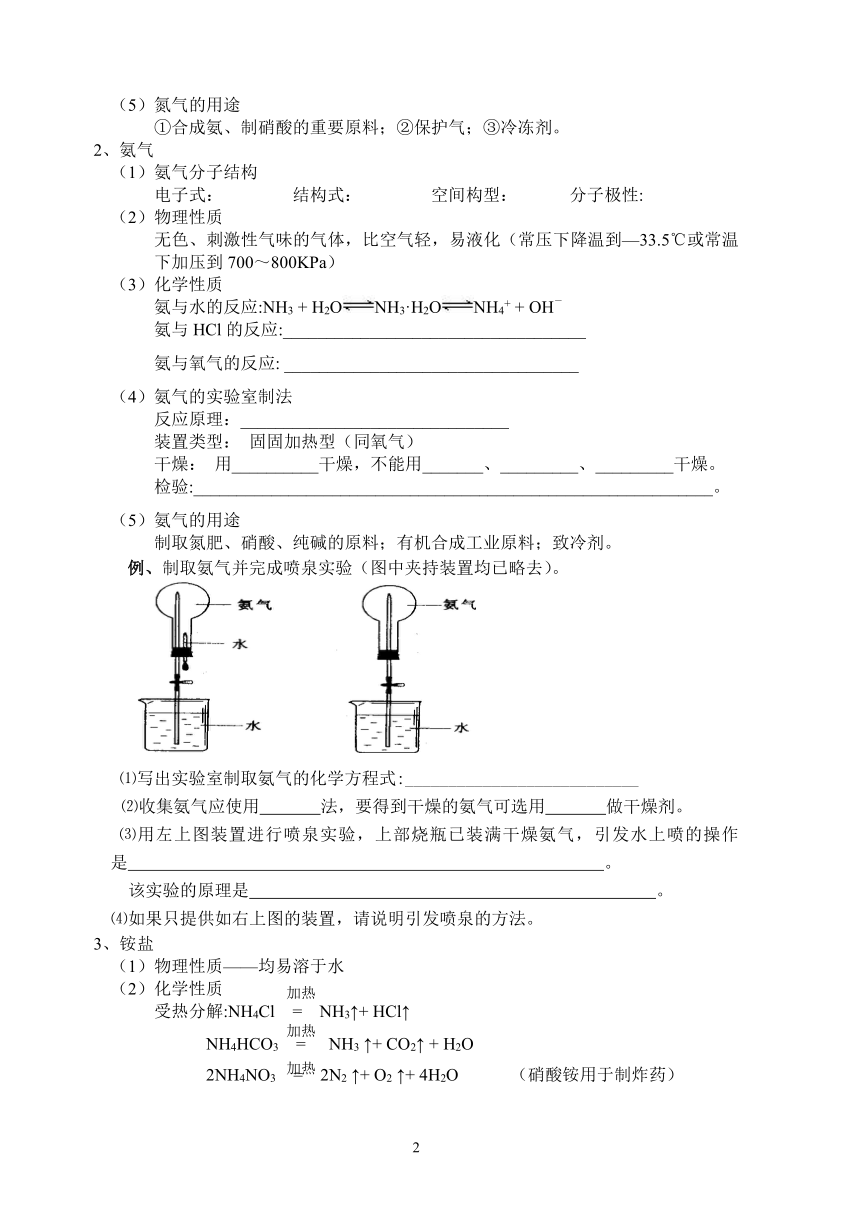
例、制取氨气并完成喷泉实验(图中夹持装置均已略去)。
⑴写出实验室制取氨气的化学方程式:___________________________
⑵收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂。
⑶用左上图装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 。
该实验的原理是 。
⑷如果只提供如右上图的装置,请说明引发喷泉的方法。
3、铵盐
(1)物理性质——均易溶于水
(2)化学性质
受热分解:NH4Cl = NH3↑+ HCl↑
NH4HCO3 = NH3 ↑+ CO2↑ + H2O
2NH4NO3 = 2N2 ↑+ O2 ↑+ 4H2O (硝酸铵用于制炸药)
与碱的反应——用于NH4+离子的检验
NH4+ + OH- = NH3 ↑ + H2O
4、硝酸
(1)物理性质:无色、易挥发、有刺激性气味的液体,比水重,能跟水以任意比互溶。
(2)化学性质
酸的通性①稀HNO3使石蕊 ,浓HNO3使石蕊
②与金属反应 H2生成
不稳定性——见光或受热分解:_______________(硝酸浓度越大,越易分解。)
强氧化性:①与大多数金属的反应 Cu+4HNO3浓=4Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3稀=3Cu(NO3)2+2NO↑+4H2O
②与非金属的反应:C+4HNO3浓=CO2↑+4NO2↑+2H2O
③与其他还原性物质反应:3Fe2++4H++NO3—=3Fe3++NO↑+2H2O
与有机物的反应
(3)用途
重要的化工原料——制炸药、染料、塑料、硝酸盐等;
实验室里重要的化学试剂。
【练习】
1.氮族元素中原子半径最大的非金属元素是( )
A. 氮 B. 磷 C. 砷 D. 铋
2.下列化学药品中,可用铝槽车运输的是( )
A.浓HNO3 B.浓H3PO4 C.稀HNO3 D.浓HCl
3.氮气能大量存在于空气中,且能维持含量基本稳定的主要原因是 ( )
A.氮分子结构稳定 B.氮气难溶于水
C.氮分子是非极性分子 D.氮气比空气轻
4.通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的是 ( )
A、NH3 B、Cl2 C、NO D、HCl
5.下列反应中,既表现硝酸的氧化性,又表现了硝酸的酸性的是( )
A. CuO+HNO3 B.Cu+HNO3(浓)
C.Fe(OH)3+HNO3 D.C+HNO3(浓)
6.一定条件下,将等体积的NO和O2的混合气置于试管中,并将试管倒立于水槽中(水槽中有足量水),充分反应后剩余气体的体积约为原混合气体总体积的 ( )
A. B. C. D.
7.下列操作不能用于检验NH3的是 ( )
A. 气体使湿润的酚酞试纸变红 B. 气体能使湿润的红色石蕊试纸变蓝
C. 气体与浓H2SO4生成铵盐 D. 气体与浓盐酸产生铵盐
8.在标准状况时,把NO2和O2按1:1的体积比混合使其充满一个大试管,把大试管倒立于水中,水面逐渐上升,最后试管中溶液的物质的量浓度(不考虑试管中溶液扩散)为 ( )
A. 0.8 mol/L B. 0.036 mol/L C. 0.1 mol/L D. 0.72 mol/L
9.在反应中,若有10.2g NH3被氧化,则反应用去的氯气在标准状况下体积为 ( )
A. 5.04L B. 6.72L C. 20.16L D. 40.32L
10.黑火药爆炸时,发生的反应是S+KNO3+C—→K2S+CO2+N2,配平的化学计量系数依次是___________,反应中的氧化剂是___________,___________元素被氧化,每生成1molCO2转移___________mol电子。
11.工业上用铜屑和浓硝酸为原料制取硝酸铜,在实际生产中,需把浓硝酸用等体积水稀释。试简答:
(1)用稀硝酸而不用浓硝酸的原因: ____________
(2)写出Cu与浓、稀硝酸两个反应的方程式:
;
(3)从经济效益和环保角度考虑、设计制取硝酸铜最适宜方法,用化学方程式表示为:
_________________________________________________________________________
NO2
O2N
CH3
NO2
+ 3H2O
浓硫酸
△
+ 3HO-NO2
CH3
+H2O
浓硫酸
水浴
+HO-NO2
NO2
加热
加热
加热
加热
⒆
⒅
⒄
⒃
⒂
⒁
⒀
⑿
⑾
⑽
⑼
⑻
⑺
⑹
⑸
⑶
⑵
⑷
⑴
C2H5ONO2
NO2-
[C6H7O2(ONO2)3]n
C6H5-NO2
NO3-
N2O4
HNO3
NO2
Mg3N2
NO
N2
NH3
NH4+
NH3·H2O
Ag(NH3)2OH
PAGE
1
请同学们先把前面的基础知识填好、看完、记住、理解然后完成习题。
一、氮族元素
1、在周期表中的位置:______________,包括_____、______、_______、_____、______五种元素(写元素名称)
2、原子结构:相同点:____________________________________
3、主要性质:
相似性:最高价态为______,最低负价为______,氮的化合价有_______________。
递变性:从上到下
①原子半径_________________,
②氢化物的通式:_______________稳定性_________________,
③最高价氧化物对应水化物的通式:_________酸性_________________,
④元素非金属性_____________,且比同周期的卤族、氧族元素_______。
二、氮及其化合物的相互联系和转变
1、氮气(N2)
(1)物理性质
色 味气体,密度与空气接近,难溶于水(1:0.02),熔点、沸点低,是空气的重要组成部分(体积分数占78%)
(2)分子结构
对共用电子对,电子式为_______,结构式为______(键能大,键牢固,分子稳定)
(3)化学性质
与氢气的反应:______________________________________
与氧气的反应:______________________________________
与活泼金属Mg反应:_________________________________
(4)氮的氧化物:________________________________________.
氮的氧化物是大气主要污染物之一,会引起光化学烟雾。
NO NO2
色
毒 性
水 溶 性
与O2反应 无
与O2、H2O反应
收集
其它反应 NO + NO2+ NaOH 2NO2= N2O4;
(5)氮气的用途
①合成氨、制硝酸的重要原料;②保护气;③冷冻剂。
2、氨气
(1)氨气分子结构
电子式: 结构式: 空间构型: 分子极性:
(2)物理性质
无色、刺激性气味的气体,比空气轻,易液化(常压下降温到—33.5℃或常温下加压到700~800KPa)
(3)化学性质
氨与水的反应:NH3 + H2ONH3·H2ONH4+ + OH-
氨与HCl的反应:___________________________________
氨与氧气的反应: __________________________________
(4)氨气的实验室制法
反应原理:_______________________________
装置类型: 固固加热型(同氧气)
干燥: 用__________干燥,不能用_______、_________、_________干燥。
检验:____________________________________________________________。
(5)氨气的用途
制取氮肥、硝酸、纯碱的原料;有机合成工业原料;致冷剂。
例、制取氨气并完成喷泉实验(图中夹持装置均已略去)。
⑴写出实验室制取氨气的化学方程式:___________________________
⑵收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂。
⑶用左上图装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 。
该实验的原理是 。
⑷如果只提供如右上图的装置,请说明引发喷泉的方法。
3、铵盐
(1)物理性质——均易溶于水
(2)化学性质
受热分解:NH4Cl = NH3↑+ HCl↑
NH4HCO3 = NH3 ↑+ CO2↑ + H2O
2NH4NO3 = 2N2 ↑+ O2 ↑+ 4H2O (硝酸铵用于制炸药)
与碱的反应——用于NH4+离子的检验
NH4+ + OH- = NH3 ↑ + H2O
4、硝酸
(1)物理性质:无色、易挥发、有刺激性气味的液体,比水重,能跟水以任意比互溶。
(2)化学性质
酸的通性①稀HNO3使石蕊 ,浓HNO3使石蕊
②与金属反应 H2生成
不稳定性——见光或受热分解:_______________(硝酸浓度越大,越易分解。)
强氧化性:①与大多数金属的反应 Cu+4HNO3浓=4Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3稀=3Cu(NO3)2+2NO↑+4H2O
②与非金属的反应:C+4HNO3浓=CO2↑+4NO2↑+2H2O
③与其他还原性物质反应:3Fe2++4H++NO3—=3Fe3++NO↑+2H2O
与有机物的反应
(3)用途
重要的化工原料——制炸药、染料、塑料、硝酸盐等;
实验室里重要的化学试剂。
【练习】
1.氮族元素中原子半径最大的非金属元素是( )
A. 氮 B. 磷 C. 砷 D. 铋
2.下列化学药品中,可用铝槽车运输的是( )
A.浓HNO3 B.浓H3PO4 C.稀HNO3 D.浓HCl
3.氮气能大量存在于空气中,且能维持含量基本稳定的主要原因是 ( )
A.氮分子结构稳定 B.氮气难溶于水
C.氮分子是非极性分子 D.氮气比空气轻
4.通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的是 ( )
A、NH3 B、Cl2 C、NO D、HCl
5.下列反应中,既表现硝酸的氧化性,又表现了硝酸的酸性的是( )
A. CuO+HNO3 B.Cu+HNO3(浓)
C.Fe(OH)3+HNO3 D.C+HNO3(浓)
6.一定条件下,将等体积的NO和O2的混合气置于试管中,并将试管倒立于水槽中(水槽中有足量水),充分反应后剩余气体的体积约为原混合气体总体积的 ( )
A. B. C. D.
7.下列操作不能用于检验NH3的是 ( )
A. 气体使湿润的酚酞试纸变红 B. 气体能使湿润的红色石蕊试纸变蓝
C. 气体与浓H2SO4生成铵盐 D. 气体与浓盐酸产生铵盐
8.在标准状况时,把NO2和O2按1:1的体积比混合使其充满一个大试管,把大试管倒立于水中,水面逐渐上升,最后试管中溶液的物质的量浓度(不考虑试管中溶液扩散)为 ( )
A. 0.8 mol/L B. 0.036 mol/L C. 0.1 mol/L D. 0.72 mol/L
9.在反应中,若有10.2g NH3被氧化,则反应用去的氯气在标准状况下体积为 ( )
A. 5.04L B. 6.72L C. 20.16L D. 40.32L
10.黑火药爆炸时,发生的反应是S+KNO3+C—→K2S+CO2+N2,配平的化学计量系数依次是___________,反应中的氧化剂是___________,___________元素被氧化,每生成1molCO2转移___________mol电子。
11.工业上用铜屑和浓硝酸为原料制取硝酸铜,在实际生产中,需把浓硝酸用等体积水稀释。试简答:
(1)用稀硝酸而不用浓硝酸的原因: ____________
(2)写出Cu与浓、稀硝酸两个反应的方程式:
;
(3)从经济效益和环保角度考虑、设计制取硝酸铜最适宜方法,用化学方程式表示为:
_________________________________________________________________________
NO2
O2N
CH3
NO2
+ 3H2O
浓硫酸
△
+ 3HO-NO2
CH3
+H2O
浓硫酸
水浴
+HO-NO2
NO2
加热
加热
加热
加热
⒆
⒅
⒄
⒃
⒂
⒁
⒀
⑿
⑾
⑽
⑼
⑻
⑺
⑹
⑸
⑶
⑵
⑷
⑴
C2H5ONO2
NO2-
[C6H7O2(ONO2)3]n
C6H5-NO2
NO3-
N2O4
HNO3
NO2
Mg3N2
NO
N2
NH3
NH4+
NH3·H2O
Ag(NH3)2OH
PAGE
1
同课章节目录
