理科会考复习(七)几种重要的金属(基础知识)
文档属性
| 名称 | 理科会考复习(七)几种重要的金属(基础知识) | 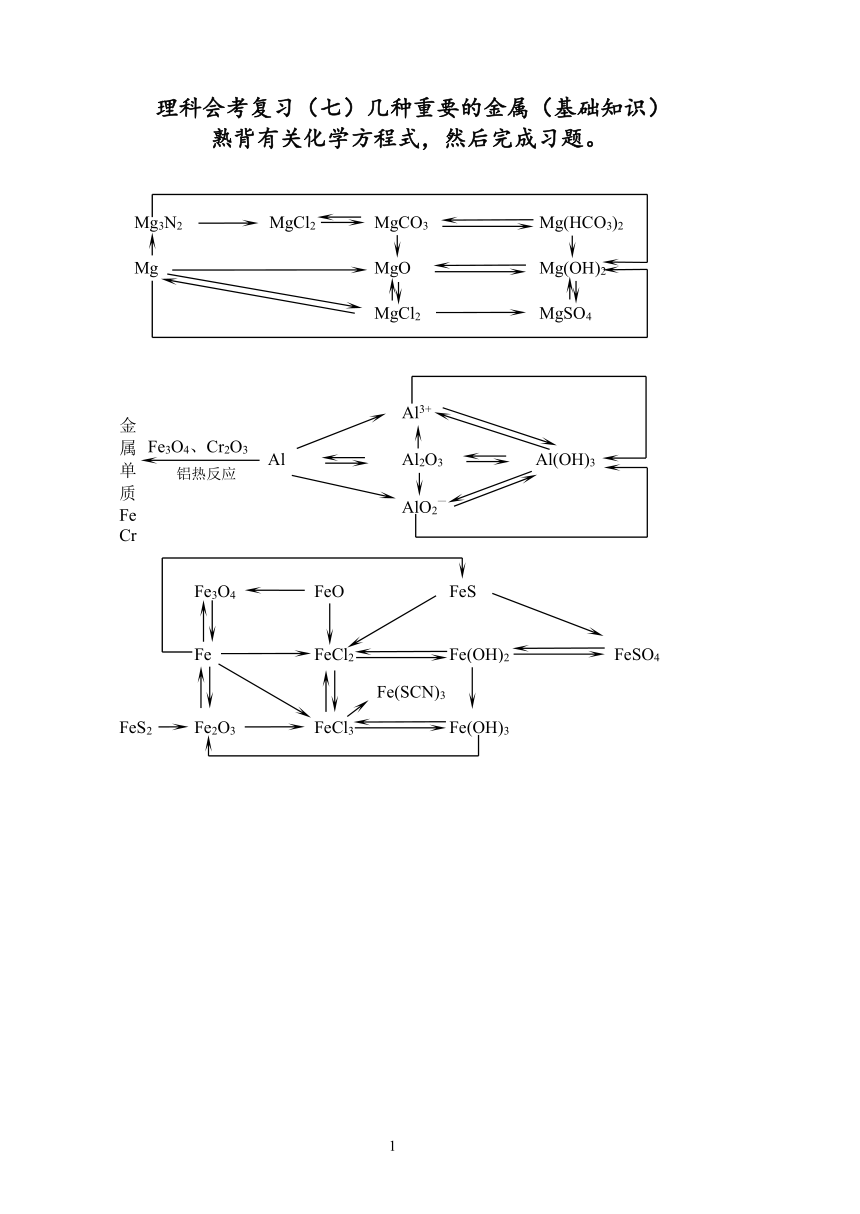 | |
| 格式 | rar | ||
| 文件大小 | 17.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-03-19 09:48:00 | ||
图片预览

文档简介
理科会考复习(七)几种重要的金属(基础知识)
熟背有关化学方程式,然后完成习题。
练习:
1.工业制造镁粉是将镁蒸气在某冷却剂中冷却,下列可作为冷却剂的是( )
①空气;②O2;③Ar;④H2;⑤N2;⑥H2O
A.①② B.③④ C.③⑥ D.③⑤
2.向某溶液中投入铝片后有大量H2放出,则溶液中不可能大量存在的离子是 ( )
A. Cl- B. H+ C. OH- D. HCO3-
3.铁在氧气中灼烧,生成物是( )
A FeO B Fe2O3 C Fe3O4 D Fe(OH)3
4.欲使硫酸铝溶液中的Al3+完全转化成氢氧化铝沉淀,所用适宜的试剂是( )
A.氨水 B.氢氧化钠 C.氢氧化钡 D.碳酸氢钠
5.将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )
A.3 mol·L-1HCl B.4 mol·L-1HNO3 C.8 mol·L-1NaOH D.18 mol·L-1H2SO4
6.为了使氢氧化亚铁氧化为氢氧化铁而不引入杂质,应向悬浊液中加入( )
A.氯水 B.硝酸 C.双氧水 D.过氧化钠
7.铁片投入下列溶液中,金属片的质量减小,但无气体放出的是( )
A.冷浓硝酸 B.硝酸铜溶液 C.稀硝酸 D.硝酸铁溶液
8.下列叙述中,可以说明金属甲比乙活泼性强的是( )
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出;
B.在氧化还原反应中,甲比乙失去的电子多;
C.将甲乙作电极组成原电池时甲是负极;
D.同价态的阳离子,甲比乙的氧化性强;
9.下列各组物质中,滴入KSCN溶液显红色的是( )
A.铁与稀盐酸 B.过量铁与稀硫酸 C.氯水与氯化亚铁溶液 D.铁粉与氯化铜溶液
10.下列离子方程式中,正确的是( )
A Fe + Fe3 + = 2Fe2 + B 2Fe + 6H + = 2Fe3 + + 3H2
C Fe2 + + Cl2 = Fe3 + + 2Cl - D Fe(OH)3 + 3H+ = Fe3 + + 3H2O
11.能使铁溶解,又不生成沉淀和气体的是( )
A 稀硫酸 B 硫酸铜溶液 C 浓硝酸 D 硫酸铁溶液
12.钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
A 2H ++ 2e- =H2 B Fe2 + + 2e- = Fe
C 2H2O+ O2 + 4e- = 4OH- D Fe3 + +e- = Fe2 +
13.将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是( )
A 硫酸 B 氯水 C 硝酸锌 D 氯化铜
14. 把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若A、B 相连时,A为负极;C、D相连,D上有气泡逸出;A、C相连时A极减轻;B、D相连,B为正极。则四种金属的活泼性顺序由大到小排列为( )
A.A>B>C>D B.A>C>B>D C.A>C>D>B D.B>D>C>A
15. 实验室中欲加快制取氢气的速率,应采取的措施是 ( )
A.纯锌与稀硫酸反应 B.纯锌与浓硫酸反应
C.含铜、铅等杂质的粗锌与稀硫酸反应 D.粗锌与稀硝酸反应
16.下列关于原电池的叙述,正确的是 ( )
A.构成原电池的正极和负极必须是两种活泼性不同的金属
B.电子从负极流向正极,电流从正极流向负极
C.在电解质溶液中,阴离子从负极向正极移动,阳离子从正极向负极移动
D.原电池工作时,正极发生还原反应,负极发生氧化反应
17、质量相同的钠、镁、铝分别与足量的稀硫酸反应,在相同状况下放出H2的体积比是( )
A、1/23 : 1/12 : 1/9 B、9 : 12 : 23 C、23 : 12 : 9 D、1 : 2 : 3
18、下列离子方程式书写错误的是( )
A、铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑
B、Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-=AlO2-+2H2O
C、NaAlO2溶液中通入足量的CO2:2AlO2-+ CO2+3H2O= 2Al(OH)3↓+CO32-
D、Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-=2AlO2-+H2O
19、把过量的铁粉加入稀HNO3中,其结果是( )
(A)不反应 (B)铁钝化 (C)生成硝酸铁 (D)生成硝酸亚铁
20.用Zn片、Cu板和稀硫酸溶液可以组成原电池,则其正极发生的电极反应是 ,负极发生的电极反应是 ;该原电池的电池反应是 。
21.除去氯化铁中混有的少量的氯化亚铁,应选用的试剂是 ,反应的离子方程式是 ;除去氯化亚铁中混有的少量的氯化铁,应选用的物质是 ,反应的离子方程式是 。
22.铝盐中加过量氨水,观察到的现象 ,离子方程式:
若向铝盐中逐滴加入过量NaOH溶液,观察到的现象是: ,离子方程式是 , 。
23、金属单质A与盐酸反应生成浅绿色溶液B,同时放出气体C。如果在B溶液中通入氯气,则B转变成棕黄色溶液D,将溶液D分为两份,一份加入几滴硫氰化钾溶液,生成血红色物质E,另一份加入A,则棕黄色溶液D重新变成浅绿色溶液B,在溶液B中滴加NaOH溶液,露置在空气中,会逐渐变成红褐色沉淀F。则各物质的化学式分别是:A __ B C ______ D E F 。
有关反应的离子方程式有:①
② ③
④ ⑤
⑥
24、将一定质量的镁、铝合金投入100mL一定物质的量浓度HCl中,合金全部溶解,向所得的溶液中滴加5mol/L NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液体积关系如图:
求:(1)原合金中Mg、Al质量各多少?
(2)盐酸的物质的量浓度。
Fe(SCN)3
FeO
Fe(OH)3
FeS
FeCl2
FeSO4
Fe(OH)2
Fe3O4
Fe2O3
FeCl3
Fe
FeS2
AlO2—
Al
金属单质FeCr
铝热反应
Fe3O4、Cr2O3
Al2O3
Al(OH)3
Al3+
MgCO3
MgCl2
MgO
Mg(OH)2
Mg(HCO3)2
MgSO4
MgCl2
Mg
Mg3N2
PAGE
3
熟背有关化学方程式,然后完成习题。
练习:
1.工业制造镁粉是将镁蒸气在某冷却剂中冷却,下列可作为冷却剂的是( )
①空气;②O2;③Ar;④H2;⑤N2;⑥H2O
A.①② B.③④ C.③⑥ D.③⑤
2.向某溶液中投入铝片后有大量H2放出,则溶液中不可能大量存在的离子是 ( )
A. Cl- B. H+ C. OH- D. HCO3-
3.铁在氧气中灼烧,生成物是( )
A FeO B Fe2O3 C Fe3O4 D Fe(OH)3
4.欲使硫酸铝溶液中的Al3+完全转化成氢氧化铝沉淀,所用适宜的试剂是( )
A.氨水 B.氢氧化钠 C.氢氧化钡 D.碳酸氢钠
5.将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )
A.3 mol·L-1HCl B.4 mol·L-1HNO3 C.8 mol·L-1NaOH D.18 mol·L-1H2SO4
6.为了使氢氧化亚铁氧化为氢氧化铁而不引入杂质,应向悬浊液中加入( )
A.氯水 B.硝酸 C.双氧水 D.过氧化钠
7.铁片投入下列溶液中,金属片的质量减小,但无气体放出的是( )
A.冷浓硝酸 B.硝酸铜溶液 C.稀硝酸 D.硝酸铁溶液
8.下列叙述中,可以说明金属甲比乙活泼性强的是( )
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出;
B.在氧化还原反应中,甲比乙失去的电子多;
C.将甲乙作电极组成原电池时甲是负极;
D.同价态的阳离子,甲比乙的氧化性强;
9.下列各组物质中,滴入KSCN溶液显红色的是( )
A.铁与稀盐酸 B.过量铁与稀硫酸 C.氯水与氯化亚铁溶液 D.铁粉与氯化铜溶液
10.下列离子方程式中,正确的是( )
A Fe + Fe3 + = 2Fe2 + B 2Fe + 6H + = 2Fe3 + + 3H2
C Fe2 + + Cl2 = Fe3 + + 2Cl - D Fe(OH)3 + 3H+ = Fe3 + + 3H2O
11.能使铁溶解,又不生成沉淀和气体的是( )
A 稀硫酸 B 硫酸铜溶液 C 浓硝酸 D 硫酸铁溶液
12.钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
A 2H ++ 2e- =H2 B Fe2 + + 2e- = Fe
C 2H2O+ O2 + 4e- = 4OH- D Fe3 + +e- = Fe2 +
13.将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是( )
A 硫酸 B 氯水 C 硝酸锌 D 氯化铜
14. 把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若A、B 相连时,A为负极;C、D相连,D上有气泡逸出;A、C相连时A极减轻;B、D相连,B为正极。则四种金属的活泼性顺序由大到小排列为( )
A.A>B>C>D B.A>C>B>D C.A>C>D>B D.B>D>C>A
15. 实验室中欲加快制取氢气的速率,应采取的措施是 ( )
A.纯锌与稀硫酸反应 B.纯锌与浓硫酸反应
C.含铜、铅等杂质的粗锌与稀硫酸反应 D.粗锌与稀硝酸反应
16.下列关于原电池的叙述,正确的是 ( )
A.构成原电池的正极和负极必须是两种活泼性不同的金属
B.电子从负极流向正极,电流从正极流向负极
C.在电解质溶液中,阴离子从负极向正极移动,阳离子从正极向负极移动
D.原电池工作时,正极发生还原反应,负极发生氧化反应
17、质量相同的钠、镁、铝分别与足量的稀硫酸反应,在相同状况下放出H2的体积比是( )
A、1/23 : 1/12 : 1/9 B、9 : 12 : 23 C、23 : 12 : 9 D、1 : 2 : 3
18、下列离子方程式书写错误的是( )
A、铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑
B、Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-=AlO2-+2H2O
C、NaAlO2溶液中通入足量的CO2:2AlO2-+ CO2+3H2O= 2Al(OH)3↓+CO32-
D、Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-=2AlO2-+H2O
19、把过量的铁粉加入稀HNO3中,其结果是( )
(A)不反应 (B)铁钝化 (C)生成硝酸铁 (D)生成硝酸亚铁
20.用Zn片、Cu板和稀硫酸溶液可以组成原电池,则其正极发生的电极反应是 ,负极发生的电极反应是 ;该原电池的电池反应是 。
21.除去氯化铁中混有的少量的氯化亚铁,应选用的试剂是 ,反应的离子方程式是 ;除去氯化亚铁中混有的少量的氯化铁,应选用的物质是 ,反应的离子方程式是 。
22.铝盐中加过量氨水,观察到的现象 ,离子方程式:
若向铝盐中逐滴加入过量NaOH溶液,观察到的现象是: ,离子方程式是 , 。
23、金属单质A与盐酸反应生成浅绿色溶液B,同时放出气体C。如果在B溶液中通入氯气,则B转变成棕黄色溶液D,将溶液D分为两份,一份加入几滴硫氰化钾溶液,生成血红色物质E,另一份加入A,则棕黄色溶液D重新变成浅绿色溶液B,在溶液B中滴加NaOH溶液,露置在空气中,会逐渐变成红褐色沉淀F。则各物质的化学式分别是:A __ B C ______ D E F 。
有关反应的离子方程式有:①
② ③
④ ⑤
⑥
24、将一定质量的镁、铝合金投入100mL一定物质的量浓度HCl中,合金全部溶解,向所得的溶液中滴加5mol/L NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液体积关系如图:
求:(1)原合金中Mg、Al质量各多少?
(2)盐酸的物质的量浓度。
Fe(SCN)3
FeO
Fe(OH)3
FeS
FeCl2
FeSO4
Fe(OH)2
Fe3O4
Fe2O3
FeCl3
Fe
FeS2
AlO2—
Al
金属单质FeCr
铝热反应
Fe3O4、Cr2O3
Al2O3
Al(OH)3
Al3+
MgCO3
MgCl2
MgO
Mg(OH)2
Mg(HCO3)2
MgSO4
MgCl2
Mg
Mg3N2
PAGE
3
同课章节目录
