氯、溴、碘及其化合物复习学案
图片预览

文档简介
氯、溴、碘及其化合物复习学案
班级 姓名
【会考要求】
氯、溴、碘及其化合物①氯气的工业制法②氯气的实验室制法③氯气的物理性质及用途④氯气的化学性质(跟某些金属、H2、H2O、碱的反应)。C1-的检验⑤溴、碘单质的物理性质⑥氯、溴、碘单质间的置换反应⑦氧化还原反应中氧化剂和还原剂、氧化产物和还原产物等概念⑧氧化还原反应中电子转移的方向和数目 abacab bb
一、氯气的生产原理
1.氯气的制法
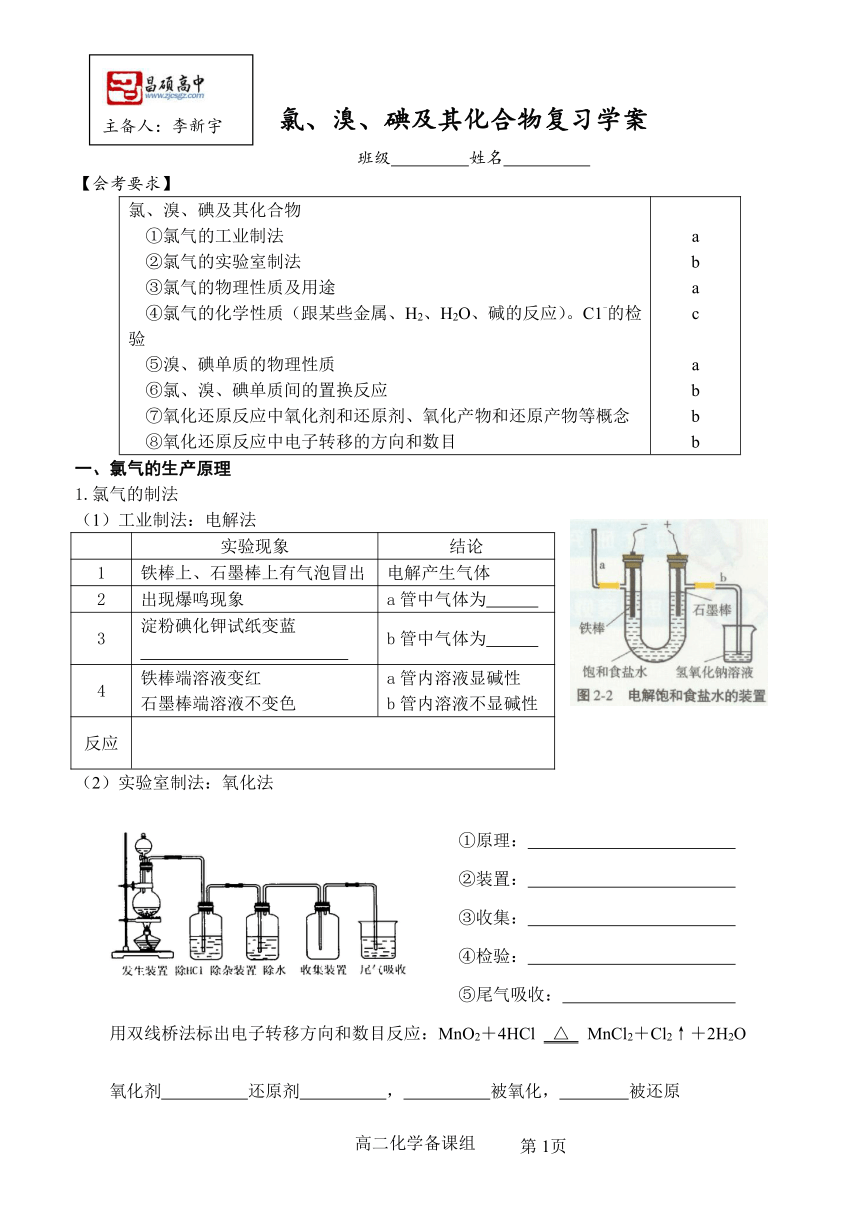
(1)工业制法:电解法
实验现象 结论
1 铁棒上、石墨棒上有气泡冒出 电解产生气体
2 出现爆鸣现象 a管中气体为
3 淀粉碘化钾试纸变蓝 b管中气体为
4 铁棒端溶液变红石墨棒端溶液不变色 a管内溶液显碱性b管内溶液不显碱性
反应
(2)实验室制法:氧化法
①原理:
②装置:
③收集:
④检验:
⑤尾气吸收:
用双线桥法标出电子转移方向和数目反应:MnO2+4HCl △ MnCl2+Cl2↑+2H2O
氧化剂 还原剂 , 被氧化, 被还原
2.氯气的性质
(1)物理性质:通常是______色、密度比空气____、有_____气味气体。能溶于水,有毒。
(2)化学性质:氯是活泼的非金属元素,氯原子易________电子。氯气与金属、非金属等发生_________反应,一般作________剂,有强 性。
① 与金属反应: Cl2+ Fe , Cl2+ Cu
② 与非金属反应: Cl2+ H2 (光照或点燃)
③ 与水反应: Cl2+ H2O
④ 与碱反应: Cl2+ NaOH
Cl2+ Ca(OH)2
漂白粉和漂粉精的有效成分都是 ,主要成分是 。
漂白粉的作用原理 。
漂白粉的失效原理: 。
(3)氯水
① 氯气溶于水后可得到氯水(离子方程式: )
② 氯水的成分:新制的氯水中存在 等多种微粒。
③ HClO的 性质:具有 性, 性, 性和弱酸性。
A.HClO不稳定,见光或受热易分解:
B.次氯酸具有漂白作用:次氯酸具有强氧化性,可使有机色质氧化成无色物质。
C.次氯酸具有强氧化性,所以可用氯气对自来水进行消毒。
D.次氯酸具有弱酸性,酸性比 酸性弱。
4.溴和碘的提取:
实验内容 操作方法 实验现象 化学方程式
1.氯置换溴 将少量氯水滴入试管内的KBr溶液中,用力振荡试管 试管内的溶液由无色变为 色。
2.氯置换碘 将少量氯水滴入试管内的KI溶液中,用力振荡试管 试管内的溶液由无色变为 色。
3.溴置换碘 将少量溴水滴入试管内的KI溶液中,用力振荡试管 试管内的溶液由无色变为 色。
结论 氯能从可溶的溴化物和碘化物水溶液中置换出 和 ,溴能置换出 ,即氧化性: 。
5.氧化还原反应
(1)本质:电子转移(包括电子得失和共用电子对的偏移)(2)特征(判断):
(3)定量关系: 化合价升高总数=化合价降低总数(失电子总数=得电子总数)
(4)氧化还原反应规律
强弱规律
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
钠、镁及其化合物学案
班级 姓名
【会考要求】
钠、镁及其化合物①钠的物理性质②钠、镁的化学性质(跟非金属、酸、某些氧化物的反应)③钠、镁的生产原理④碳酸钠的性质(跟酸、碱、盐的复分解反应)⑤碳酸钠的用途⑥强弱电解质,离子反应的本质及发生的条件⑦离子方程式 abababb
一、金属钠的性质与应用
结构 钠原子最外层只有 电子,化学反应中易 电子而表现出强 性。
物理性质 质软、银白色,有金属光泽的金属,具有良好的导电导热性,密度比水 ,比煤油 ,熔点较 。
化学性质 与非金属单质 钠在常温下切开后表面变暗: 产物颜色: 钠在O2中点燃: 产物颜色:
钠在氯气中燃烧,现象: 色火焰,有 烟产生。
与化合物 与水反应,现象:“浮·游·熔·响·红”,方程
与盐溶液反应:钠先与水反应,生成 和H2,再考虑 与溶液中的盐反应。如:钠投入CuSO4溶液中,有 放出和 。2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑
*与某些熔融盐:4Na+TiCl4 700~800℃ 4NaCl+Ti
存在 自然界中只能以化合态存在
保存 保存在 中,使之隔绝空气和水
制取
用途 A.制取钠的化合物 B.钠钾合金常温为液体,用于快中子反应堆热交换剂C.作强还原剂 D.作电光源
二、碳酸钠的性质与应用
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
俗 名
溶解性 易溶(同温下,溶解度比碳酸氢钠_______) 易溶
热稳定性
碱性 碱性 碱性
与酸 盐酸
转化 Na2CO3_____________________=2NaHCO32NaHCO3 __________________________________
碱 NaOH
CaCl2
三、侯式制碱法:
四、镁的提取及应用
1.存在:主要以 态的形式存在于 和 中。
2.结构:(原子结构示意图):
3.物性: 色金属,密度较 (1.74 g·cm-3)质地较 。
4.化性:
(1)与非金属: Mg+ O2 Mg+ N2
(2)与酸: Mg+ HCl
(3)与氧化物: Mg+ CO2
5.制取:
五、离子反应
1.电离方程式的书写
HCl NaOH
Na2SO4 NaHSO4
Na2CO3 NaHCO3
CH3COOH NH3·H2O
2.离子方程式的书写
写——写出反应的化学方程式;
拆——把易溶于水的强电解质拆成离子形式,
难溶、沉淀、气体、弱酸、弱碱、水、氧化物、单质仍以分子式表示。
删——将不参加反应的离子从方程式两端删去。
查——检查“质量守恒”、“电荷守恒”。
【巩固提高】写出下列反应的离子方程式:
(1)石灰石与盐酸反应
(2)氯气与氢氧化钠溶液反应
(3)硫酸与氢氧化钡溶液反应
主备人:李新宇
主备人:李新宇
PAGE
第3页
高二化学备课组
班级 姓名
【会考要求】
氯、溴、碘及其化合物①氯气的工业制法②氯气的实验室制法③氯气的物理性质及用途④氯气的化学性质(跟某些金属、H2、H2O、碱的反应)。C1-的检验⑤溴、碘单质的物理性质⑥氯、溴、碘单质间的置换反应⑦氧化还原反应中氧化剂和还原剂、氧化产物和还原产物等概念⑧氧化还原反应中电子转移的方向和数目 abacab bb
一、氯气的生产原理
1.氯气的制法
(1)工业制法:电解法
实验现象 结论
1 铁棒上、石墨棒上有气泡冒出 电解产生气体
2 出现爆鸣现象 a管中气体为
3 淀粉碘化钾试纸变蓝 b管中气体为
4 铁棒端溶液变红石墨棒端溶液不变色 a管内溶液显碱性b管内溶液不显碱性
反应
(2)实验室制法:氧化法
①原理:
②装置:
③收集:
④检验:
⑤尾气吸收:
用双线桥法标出电子转移方向和数目反应:MnO2+4HCl △ MnCl2+Cl2↑+2H2O
氧化剂 还原剂 , 被氧化, 被还原
2.氯气的性质
(1)物理性质:通常是______色、密度比空气____、有_____气味气体。能溶于水,有毒。
(2)化学性质:氯是活泼的非金属元素,氯原子易________电子。氯气与金属、非金属等发生_________反应,一般作________剂,有强 性。
① 与金属反应: Cl2+ Fe , Cl2+ Cu
② 与非金属反应: Cl2+ H2 (光照或点燃)
③ 与水反应: Cl2+ H2O
④ 与碱反应: Cl2+ NaOH
Cl2+ Ca(OH)2
漂白粉和漂粉精的有效成分都是 ,主要成分是 。
漂白粉的作用原理 。
漂白粉的失效原理: 。
(3)氯水
① 氯气溶于水后可得到氯水(离子方程式: )
② 氯水的成分:新制的氯水中存在 等多种微粒。
③ HClO的 性质:具有 性, 性, 性和弱酸性。
A.HClO不稳定,见光或受热易分解:
B.次氯酸具有漂白作用:次氯酸具有强氧化性,可使有机色质氧化成无色物质。
C.次氯酸具有强氧化性,所以可用氯气对自来水进行消毒。
D.次氯酸具有弱酸性,酸性比 酸性弱。
4.溴和碘的提取:
实验内容 操作方法 实验现象 化学方程式
1.氯置换溴 将少量氯水滴入试管内的KBr溶液中,用力振荡试管 试管内的溶液由无色变为 色。
2.氯置换碘 将少量氯水滴入试管内的KI溶液中,用力振荡试管 试管内的溶液由无色变为 色。
3.溴置换碘 将少量溴水滴入试管内的KI溶液中,用力振荡试管 试管内的溶液由无色变为 色。
结论 氯能从可溶的溴化物和碘化物水溶液中置换出 和 ,溴能置换出 ,即氧化性: 。
5.氧化还原反应
(1)本质:电子转移(包括电子得失和共用电子对的偏移)(2)特征(判断):
(3)定量关系: 化合价升高总数=化合价降低总数(失电子总数=得电子总数)
(4)氧化还原反应规律
强弱规律
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
钠、镁及其化合物学案
班级 姓名
【会考要求】
钠、镁及其化合物①钠的物理性质②钠、镁的化学性质(跟非金属、酸、某些氧化物的反应)③钠、镁的生产原理④碳酸钠的性质(跟酸、碱、盐的复分解反应)⑤碳酸钠的用途⑥强弱电解质,离子反应的本质及发生的条件⑦离子方程式 abababb
一、金属钠的性质与应用
结构 钠原子最外层只有 电子,化学反应中易 电子而表现出强 性。
物理性质 质软、银白色,有金属光泽的金属,具有良好的导电导热性,密度比水 ,比煤油 ,熔点较 。
化学性质 与非金属单质 钠在常温下切开后表面变暗: 产物颜色: 钠在O2中点燃: 产物颜色:
钠在氯气中燃烧,现象: 色火焰,有 烟产生。
与化合物 与水反应,现象:“浮·游·熔·响·红”,方程
与盐溶液反应:钠先与水反应,生成 和H2,再考虑 与溶液中的盐反应。如:钠投入CuSO4溶液中,有 放出和 。2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑
*与某些熔融盐:4Na+TiCl4 700~800℃ 4NaCl+Ti
存在 自然界中只能以化合态存在
保存 保存在 中,使之隔绝空气和水
制取
用途 A.制取钠的化合物 B.钠钾合金常温为液体,用于快中子反应堆热交换剂C.作强还原剂 D.作电光源
二、碳酸钠的性质与应用
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
俗 名
溶解性 易溶(同温下,溶解度比碳酸氢钠_______) 易溶
热稳定性
碱性 碱性 碱性
与酸 盐酸
转化 Na2CO3_____________________=2NaHCO32NaHCO3 __________________________________
碱 NaOH
CaCl2
三、侯式制碱法:
四、镁的提取及应用
1.存在:主要以 态的形式存在于 和 中。
2.结构:(原子结构示意图):
3.物性: 色金属,密度较 (1.74 g·cm-3)质地较 。
4.化性:
(1)与非金属: Mg+ O2 Mg+ N2
(2)与酸: Mg+ HCl
(3)与氧化物: Mg+ CO2
5.制取:
五、离子反应
1.电离方程式的书写
HCl NaOH
Na2SO4 NaHSO4
Na2CO3 NaHCO3
CH3COOH NH3·H2O
2.离子方程式的书写
写——写出反应的化学方程式;
拆——把易溶于水的强电解质拆成离子形式,
难溶、沉淀、气体、弱酸、弱碱、水、氧化物、单质仍以分子式表示。
删——将不参加反应的离子从方程式两端删去。
查——检查“质量守恒”、“电荷守恒”。
【巩固提高】写出下列反应的离子方程式:
(1)石灰石与盐酸反应
(2)氯气与氢氧化钠溶液反应
(3)硫酸与氢氧化钡溶液反应
主备人:李新宇
主备人:李新宇
PAGE
第3页
高二化学备课组
同课章节目录
