2018-2019学年湖北省黄冈市九年级(下)开学化学试卷(解析版)
文档属性
| 名称 | 2018-2019学年湖北省黄冈市九年级(下)开学化学试卷(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 401.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-04-06 08:18:15 | ||
图片预览

文档简介
2018-2019学年湖北省黄冈市九年级(下)开学化学试卷
一、选择题(本题包括8小题,每小题只有一个选项符合题意,共16分)
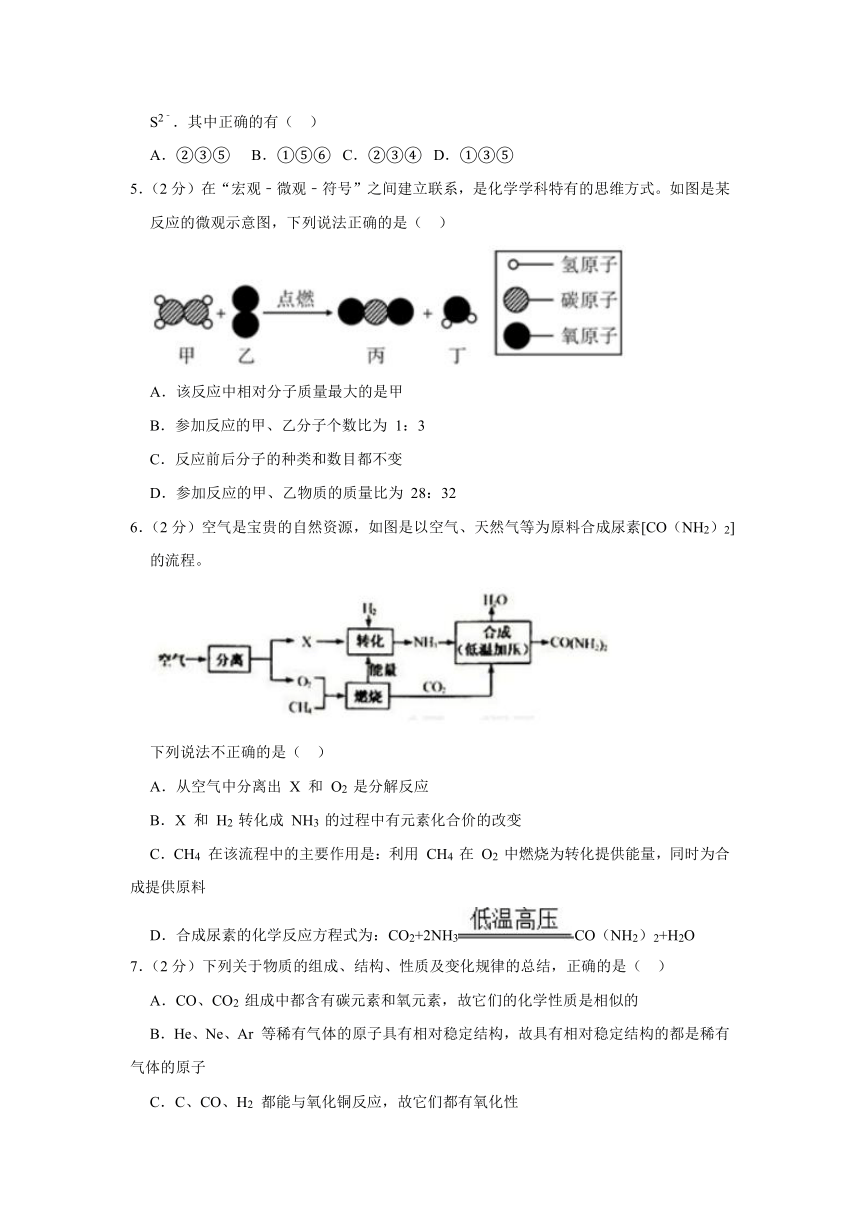
1.(2分)下列四个事例中一定发生了化学变化的是( )
A.①② B.②③ C.①④ D.③④
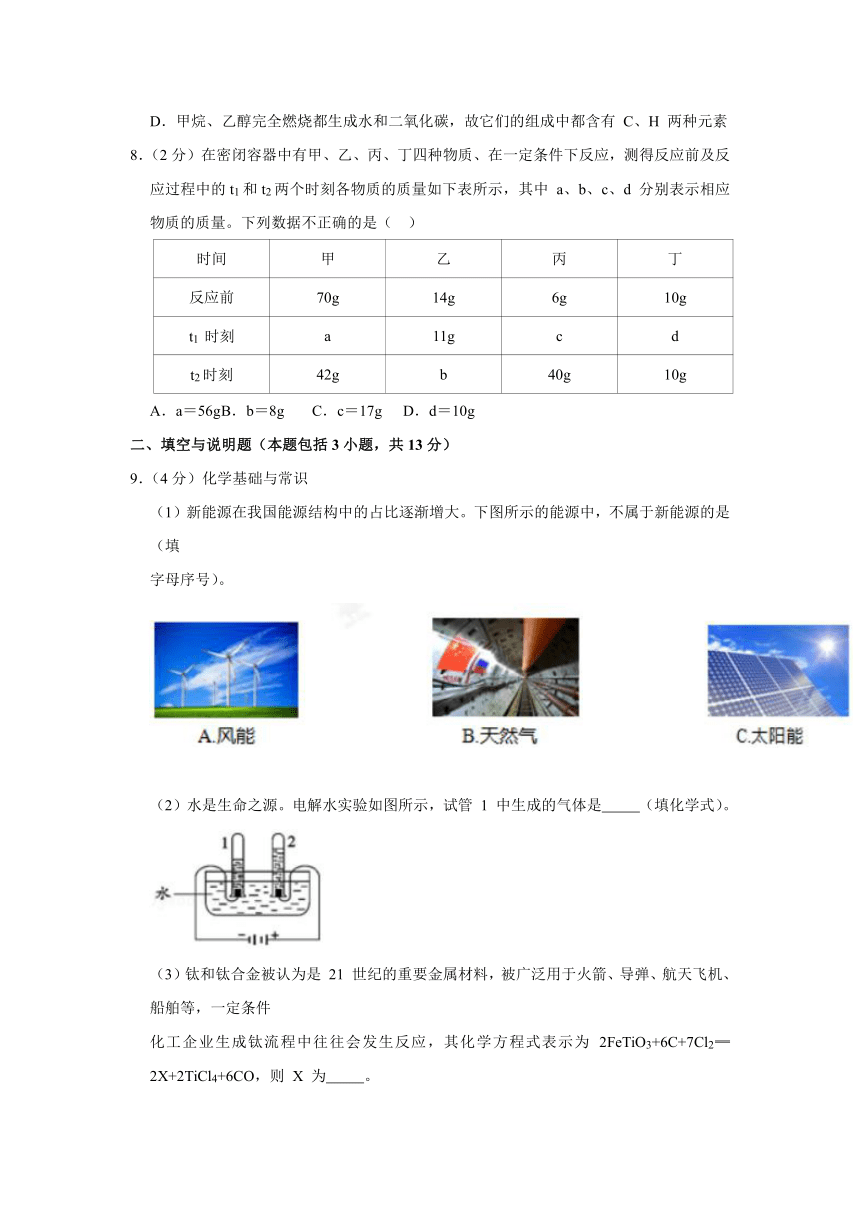
2.(2分)下列实验操作中,不正确的是( )
A.熄灭酒精灯 B.取固体粉末
C.过滤 D.检查气密性
3.(2分)下列说法:①一氧化碳和二氧化碳都是空气污染物;②冰和干冰都是氧化物;③明矾净水 的作用是杀菌消毒;④分子、原子、离子都可以直接构成物质;⑤金刚石、石墨、C60 都是由原 子构成的碳单质;⑥降低可燃物的着火点是灭火的途径之一;⑦煤、石油、天然气、可燃冰、乙醇、氢气都是不可再生能源。其中不正确的是( )
A.②③⑤⑥⑦ B.①③④⑤⑥ C.①③④⑥⑦ D.①③⑤⑥⑦
4.(2分)小雨同学依据描述书写的化学符号:①3 个钾原子:K3;②2 个氮分子:2N2;③三个碳酸根离子:3CO32﹣
;④结构示意图对应的粒子O2﹣;⑤氯化铁的化学式:FeCl2;⑥﹣2 价的硫元素:S2﹣.其中正确的有( )
A.②③⑤ B.①⑤⑥ C.②③④ D.①③⑤
5.(2分)在“宏观﹣微观﹣符号”之间建立联系,是化学学科特有的思维方式。如图是某反应的微观示意图,下列说法正确的是( )
A.该反应中相对分子质量最大的是甲
B.参加反应的甲、乙分子个数比为 1:3
C.反应前后分子的种类和数目都不变
D.参加反应的甲、乙物质的质量比为 28:32
6.(2分)空气是宝贵的自然资源,如图是以空气、天然气等为原料合成尿素[CO(NH2)2]的流程。
下列说法不正确的是( )
A.从空气中分离出 X 和 O2 是分解反应
B.X 和 H2 转化成 NH3 的过程中有元素化合价的改变
C.CH4 在该流程中的主要作用是:利用 CH4 在 O2 中燃烧为转化提供能量,同时为合成提供原料
D.合成尿素的化学反应方程式为:CO2+2NH3CO(NH2)2+H2O
7.(2分)下列关于物质的组成、结构、性质及变化规律的总结,正确的是( )
A.CO、CO2 组成中都含有碳元素和氧元素,故它们的化学性质是相似的
B.He、Ne、Ar 等稀有气体的原子具有相对稳定结构,故具有相对稳定结构的都是稀有气体的原子
C.C、CO、H2 都能与氧化铜反应,故它们都有氧化性
D.甲烷、乙醇完全燃烧都生成水和二氧化碳,故它们的组成中都含有 C、H 两种元素
8.(2分)在密闭容器中有甲、乙、丙、丁四种物质、在一定条件下反应,测得反应前及反应过程中的t1和t2两个时刻各物质的质量如下表所示,其中 a、b、c、d 分别表示相应物质的质量。下列数据不正确的是( )
时间 甲 乙 丙 丁
反应前 70g 14g 6g 10g
t1 时刻 a 11g c d
t2时刻 42g b 40g 10g
A.a=56g B.b=8g C.c=17g D.d=10g
二、填空与说明题(本题包括3小题,共13分)
9.(4分)化学基础与常识
(1)新能源在我国能源结构中的占比逐渐增大。下图所示的能源中,不属于新能源的是 (填
字母序号)。
(2)水是生命之源。电解水实验如图所示,试管 1 中生成的气体是 (填化学式)。
(3)钛和钛合金被认为是 21 世纪的重要金属材料,被广泛用于火箭、导弹、航天飞机、船舶等,一定条件
化工企业生成钛流程中往往会发生反应,其化学方程式表示为 2FeTiO3+6C+7Cl2═2X+2TiCl4+6CO,则 X 为 。
(4)我国的煤炭资源丰富,但液体燃料短缺。通过“煤液化”技术,用煤炭和水制取甲醇(CH3OH) 对我国具有重要意义。主要流程如下:
写出在高温高压和催化剂的条件下,合成塔中制取甲醇的化学方程式 。
10.(5分)化学就在我们身边,请用所学化学知识回答下列问题。
(1)硬水危害人们健康,在生活中降低水的硬度常采用的方法是 。
(2)长期盛放澄清的石灰水的试剂瓶内壁往往附着一层白色固体,这层白色固体形成的原因是 (用化学方程式表示)。
(3)酒精常用作内燃机的燃料,燃烧时反应的化学方程式是 。
(4)二氧化碳气体通入紫色石蕊试液中,溶液变红的原因是 (用化学方 程式表示)。
(5)碱式碳酸铜【化学式为 Cu2(OH)2CO3】在空气中加热能完全分解,生成三种氧化物,其中 一种是黑色固体,一种是无色气体,一种是无色液体。该反应的化学方程式是 。
11.(4分)A~E 为初中化学常见的物质,其中 A 和 B 是单质,C、D 是组成元素相同的气体,B 和 E 都是黑色固体。他们之间有如图所示的转化和反应关系(“→”表示某一种物质经一步反应可转化为另一种物质,“﹣”表示相连两种物质能发生化学反应,部分反应物、生成物及反应条件已略去。)。请回答下列问题:
(1)写出 A 的化学式为 ;
(2)写出下列反应的化学方程式:B 和 C 的反应: ;D 和 E 的反应: 。
(3)列举物质 C 在生产、生活中的用途 (答一点即可)。
三、计算题(本题包括1小题,共3分)
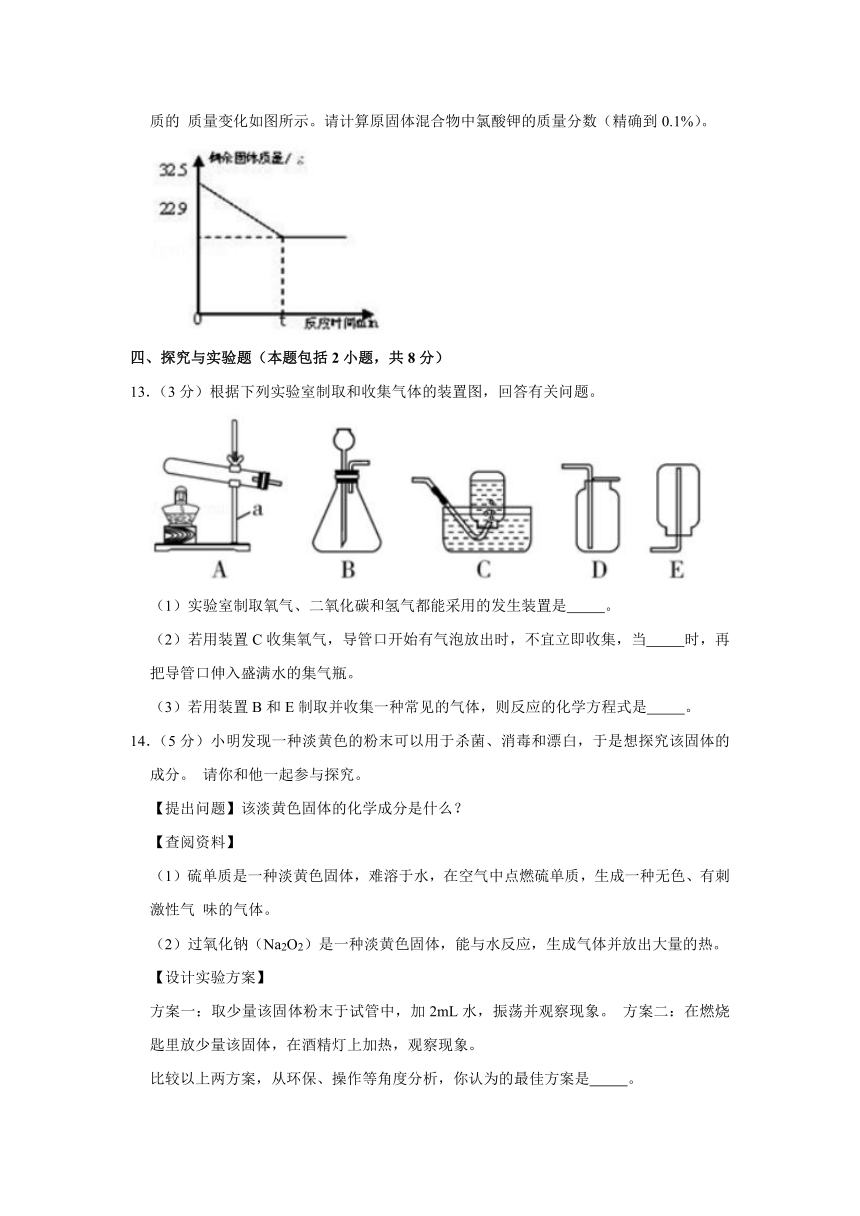
12.(3分)在实验室加热 32.5g 二氧化锰和氯酸钾的固体混合物制取氧气时,剩余固体物质的 质量变化如图所示。请计算原固体混合物中氯酸钾的质量分数(精确到0.1%)。
四、探究与实验题(本题包括2小题,共8分)
13.(3分)根据下列实验室制取和收集气体的装置图,回答有关问题。
(1)实验室制取氧气、二氧化碳和氢气都能采用的发生装置是 。
(2)若用装置C收集氧气,导管口开始有气泡放出时,不宜立即收集,当 时,再把导管口伸入盛满水的集气瓶。
(3)若用装置B和E制取并收集一种常见的气体,则反应的化学方程式是 。
14.(5分)小明发现一种淡黄色的粉末可以用于杀菌、消毒和漂白,于是想探究该固体的成分。 请你和他一起参与探究。
【提出问题】该淡黄色固体的化学成分是什么?
【查阅资料】
(1)硫单质是一种淡黄色固体,难溶于水,在空气中点燃硫单质,生成一种无色、有刺激性气 味的气体。
(2)过氧化钠(Na2O2)是一种淡黄色固体,能与水反应,生成气体并放出大量的热。
【设计实验方案】
方案一:取少量该固体粉末于试管中,加2mL水,振荡并观察现象。 方案二:在燃烧匙里放少量该固体,在酒精灯上加热,观察现象。
比较以上两方案,从环保、操作等角度分析,你认为的最佳方案是 。
【实验验证并得出结论】
(1)小明向盛有少量该固体的试管中加入 2mL 水,立刻观察到有无色气泡产生,并且验证出该 反应同时生成了氢氧化钠(NaOH)。通过实验验证,确定该淡黄色粉末为过氧化钠。
(2)小明想对生成的气体成分判断,他提出了以下两种假设:
①该气体是 CO
②该气体是 O2
你认为假设 合理,理由是 。
(3)请设计一个实验,验证你的合理假设(写出简要操作步骤、实验现象和结论)。
操作步骤 实验现象 结论
取少量固体粉末于试管中,向试管 中加入 2mL 水,将带火星的木条 伸入试管中 你的假设正确
【反思与提高】
过氧化钠不仅能和水反应,在常温下过氧化钠还能和二氧化碳反应生成碳酸钠和氧气,因此 过氧化钠常用作潜水艇里的供氧剂,请写出该反应的化学方程式 。
2018-2019学年湖北省黄冈市九年级(下)开学化学试卷
参考答案与试题解析
一、选择题(本题包括8小题,每小题只有一个选项符合题意,共16分)
1.【解答】解:①胆矾研碎过程中没有新物质生成,属于物理变化。
②喷洒石蕊溶液的纸花放入二氧化碳中的过程中有新物质生成,属于化学变化。
③验证鸡蛋壳的主要成分实验的过程中有新物质生成,属于化学变化。
③干冰升华的过程中没有新物质生成,属于物理变化。
故选:B。
2.【解答】解:A、熄灭酒精灯禁止用嘴吹灭,防止灯内酒精引起燃烧,应该用灯帽该灭,故A实验操作正确;
B、取固体粉末时应该将试管排放,用药匙或纸槽将固体送入试管底部,然后缓缓竖立试管,故B实验操作正确;
C、过滤要做到一贴二低三靠,要有玻璃棒引流液体,故C实验操作错误。
D、检查气密性,先将导管插入水中,再用手握着试管外壁,故D实验操作正确。
故选:C。
3.【解答】解:①二氧化碳不属于空气污染物,故错误;
②冰是水的固体,是由氢元素和氧元素组成的化合物,是氧化物,干冰是二氧化碳固体,是由碳元素和氧元素组成的化合物,是氧化物,因此冰和干冰都是氧化物,故正确;
③使用明矾只能加快水中不溶性固体小颗粒的沉降,不能消毒杀菌,故错误;
④构成物质的微粒有3种,即分子、原子、离子,故正确;
⑤C60都是由碳60分子构成的碳单质,故错误;
⑥着火点是物质的一种属性,一般不变,故错误;
⑦煤、石油、天然气、可燃冰这些化石燃料是不可再生能源,而乙醇、氢气则是可再生能源,故错误;
故选:D。
4.【解答】解:①3 个钾原子表示为3K,错误;
②2 个氮分子就是在氮气化学式的前面加上数字2,表示为2N2,正确;
③三个碳酸根离子就是在碳酸根离子的前面加上数字3,表示为3CO32﹣,正确;
④结构示意图对应的粒子O2﹣,正确;
⑤氯化铁的化学式:FeCl3,错误;
⑥﹣2 价的硫元素表示为,错误;
故选:C。
5.【解答】解:由反应的微观示意图可知,该反应是乙烯燃烧生成了二氧化碳和水,反应的化学方程式是:C2H4+3O22CO2+2H2O。
A.甲的相对分子质量为:12×2+1×4=28;丙的相对分子质量为:12+16×2=44,故说法错误;
B.由化学方程式可知,参加反应的甲、乙分子个数比为 1:3,故说法正确;
C.由化学方程式可知,化学反应前后分子的种类发生了变化,故说法错误;
D.由化学方程式可知,参加反应的甲、乙物质的质量比为:28:(32×3)=7:24,故说法错误。
故选:B。
6.【解答】解:A、由题意可知,X为N2,从空气中分离出N2 和 O2,没有新物质生成,属于物理变化,不是分解反应,故A错误;
B、N2 和H2转化成 NH3的过程中,有单质参加反应,一定有元素化合价的改变,故B正确;
C、由题意可知,CH4 在该流程中的主要作用是:利用 CH4在 O2中燃烧为转化提供能量,同时为合成提供原料,故C正确;
D、由题意可知,合成尿素的化学反应方程式为:CO2+2NH3CO(NH2)2+H2O,故D正确。
故选:A。
7.【解答】解:A、CO、CO2 组成中虽然都含有碳元素和氧元素,但分子的构成不同,决定了它们的化学性质是不相似,故A错误;
B、He、Ne、Ar 等稀有气体的原子具有相对稳定结构,但具有相对稳定结构的不一定是稀有气体的原子,例如钠离子具有稳定结构,故B错误;
C、C、CO、H2 都能与氧化铜反应,在反应夺去了氧化铜中的氧,故它们都有还原性,故C错误;
D、甲烷、乙醇完全燃烧都生成水和二氧化碳,由质量守恒定律可知,它们的组成中都含有 C、H 两种元素,可能含有氧元素,故D正确。
故选:D。
8.【解答】解:A、由题意可知,=
a=56g,故A正确;
B、依据质量守恒定律可知,b=70g+14g+6g+10g﹣42g+40g﹣10g=8g,故B正确;
C、=
c=23g,故C错误;
D、丁物质在反应前和t2时刻都是10g,所以d=10g,故D正确。
故选:C。
二、填空与说明题(本题包括3小题,共13分)
9.【解答】解:(1)人们正在利用和开发的新能源有太阳能、核能、风能、地热能、潮汐能、生物质能等。
A、风能是清洁、无污染的新能源,故选项错误。
B、天然气属于化石燃料,不属于新能源,故选项正确。
C、太阳能是清洁、无污染的新能源,故选项错误。
故填:B;
(2)试管1中的气体体积较大,是氢气;故填:H2;
(3)由2FeTiO3+6C+7Cl2=2X+2TiCl4+6CO可知,反应前后钛原子都是2个,氧原子都是6个,碳原子都是6个,反应前铁原子是2个,反应后应该是2个,包含在2X中,反应前氯原子是14个,反应后应该是14个,其中6个包含在2X中,则X为FeCl3.故填:FeCl3;
(4)在高温高压和催化剂的条件下,一氧化碳与氢气反应生成甲醇;故填:CO+2H2CH3OH。
10.【解答】解:(1)硬水危害人们健康,在生活中降低水的硬度常采用的方法是加热煮沸,加热煮沸时,水中的钙离子、镁离子能够以碳酸钙沉淀、氢氧化镁沉淀的形式从水中析出,从而降低水的硬度。
(2)长期盛放澄清的石灰水的试剂瓶内壁往往附着一层白色固体,这层白色固体形成的原因是二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O。
(3)酒精常用作内燃机的燃料,燃烧时生成水和二氧化碳,反应的化学方程式为:C2H5OH+3O2 2CO2+3H2O。
(4)二氧化碳气体通入紫色石蕊试液中,溶液变红的原因是二氧化碳和水反应生成碳酸,碳酸能使石蕊试液变红色,反应的化学方程式为:CO2 +H2O═H2CO3。
(5)碱式碳酸铜【化学式为 Cu2(OH)2CO3】在空气中加热能完全分解,生成三种氧化物,其中一种是黑色固体(氧化铜),一种是无色气体(二氧化碳),一种是无色液体(水),该反应的化学方程式是:Cu2(OH)2CO3 2CuO+H2O+CO2↑。
故填:加热煮沸;Ca(OH)2+CO2═CaCO3↓+H2O;C2H5OH+3O2 2CO2+3H2O;CO2 +H2O═H2CO3;Cu2(OH)2CO3 2CuO+H2O+CO2↑。
11.【解答】解:A 和 B 是单质B 和 E 都是黑色固体,则B是碳,C、D 是组成元素相同的气体,故两者是一氧化碳和二氧化碳中的一种,A加X可以生成黑色固体E,故E可能是氧化铜,则D是一氧化碳,C是二氧化碳,A是氧气,带入框图涂端合理;
(1)A是氧气,化学式为O2;
(2)B 和 C 的反应是碳和二氧化碳的反应,方程式为C+CO2 2CO;D 和 E 的反应是一氧化碳和氧化铜的反应,方程式为CO+CuO Cu+CO2;
(3)物质 C是二氧化碳,在生产、生活中常用来灭火(或温室气体肥料或制取汽水等);
故答案为:(1)O2;
(2)C+CO2 2CO;CO+CuO Cu+CO2
(3)灭火(或温室气体肥料或制取汽水等);
三、计算题(本题包括1小题,共3分)
12.【解答】解:由质量守恒定律可得,产生O2的质量为:32.5g﹣22.9 g=9.6 g
设原固体混合物中氯酸钾的质量为x
2KClO3 ═2KCl+3O2↑
245 96
x 9.6 g
x=24.5g
原混合物中氯酸钾的溶质质量分数=×100%=75.4%
答:原混合物中氯酸钾的溶质质量分数为75.4%。
四、探究与实验题(本题包括2小题,共8分)
13.【解答】解:(1)实验室制取氧气、二氧化碳和氢气都能采用的发生装置是固液常温型反应装置,故填:B。
(2)用装置C收集氧气,导管口开始有气泡放出时,不宜立即收集,需要当气泡连续且均匀放出时,再把导管口伸入盛满水的集气瓶,故填:气泡连续且均匀放出。
(3)用装置B和E制取并收集一种常见的气体,则可以是锌和稀硫酸反应生成硫酸锌和氢气,反应的化学方程式是Zn+H2SO4═ZnSO4+H2↑,故填:Zn+H2SO4═ZnSO4+H2↑。
14.【解答】解:【设计实验方案】
最佳方案是方案一,这是因为方案一操作简单,更环保。
故填:方案一。
【实验验证并得出结论】
(2)假设②合理,理由是反应物中含有氧元素,不含有碳元素。
故填:②;反应物中含有氧元素,不含有碳元素。
(3)取少量固体粉末于试管中,向试管 中加入 2mL 水,将带火星的木条 伸入试管中,带火星的木条复燃,说明气体是氧气,实验过程如下所示:
操作步骤 实验现象 结论
取少量固体粉末于试管中,向试管 中加入 2mL 水,将带火星的木条 伸入试管中 带火星的木条复燃 气体是氧气
【反思与提高】
在常温下过氧化钠还能和二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2。
故填:2Na2O2+2CO2═2Na2CO3+O2。
一、选择题(本题包括8小题,每小题只有一个选项符合题意,共16分)
1.(2分)下列四个事例中一定发生了化学变化的是( )
A.①② B.②③ C.①④ D.③④
2.(2分)下列实验操作中,不正确的是( )
A.熄灭酒精灯 B.取固体粉末
C.过滤 D.检查气密性
3.(2分)下列说法:①一氧化碳和二氧化碳都是空气污染物;②冰和干冰都是氧化物;③明矾净水 的作用是杀菌消毒;④分子、原子、离子都可以直接构成物质;⑤金刚石、石墨、C60 都是由原 子构成的碳单质;⑥降低可燃物的着火点是灭火的途径之一;⑦煤、石油、天然气、可燃冰、乙醇、氢气都是不可再生能源。其中不正确的是( )
A.②③⑤⑥⑦ B.①③④⑤⑥ C.①③④⑥⑦ D.①③⑤⑥⑦
4.(2分)小雨同学依据描述书写的化学符号:①3 个钾原子:K3;②2 个氮分子:2N2;③三个碳酸根离子:3CO32﹣
;④结构示意图对应的粒子O2﹣;⑤氯化铁的化学式:FeCl2;⑥﹣2 价的硫元素:S2﹣.其中正确的有( )
A.②③⑤ B.①⑤⑥ C.②③④ D.①③⑤
5.(2分)在“宏观﹣微观﹣符号”之间建立联系,是化学学科特有的思维方式。如图是某反应的微观示意图,下列说法正确的是( )
A.该反应中相对分子质量最大的是甲
B.参加反应的甲、乙分子个数比为 1:3
C.反应前后分子的种类和数目都不变
D.参加反应的甲、乙物质的质量比为 28:32
6.(2分)空气是宝贵的自然资源,如图是以空气、天然气等为原料合成尿素[CO(NH2)2]的流程。
下列说法不正确的是( )
A.从空气中分离出 X 和 O2 是分解反应
B.X 和 H2 转化成 NH3 的过程中有元素化合价的改变
C.CH4 在该流程中的主要作用是:利用 CH4 在 O2 中燃烧为转化提供能量,同时为合成提供原料
D.合成尿素的化学反应方程式为:CO2+2NH3CO(NH2)2+H2O
7.(2分)下列关于物质的组成、结构、性质及变化规律的总结,正确的是( )
A.CO、CO2 组成中都含有碳元素和氧元素,故它们的化学性质是相似的
B.He、Ne、Ar 等稀有气体的原子具有相对稳定结构,故具有相对稳定结构的都是稀有气体的原子
C.C、CO、H2 都能与氧化铜反应,故它们都有氧化性
D.甲烷、乙醇完全燃烧都生成水和二氧化碳,故它们的组成中都含有 C、H 两种元素
8.(2分)在密闭容器中有甲、乙、丙、丁四种物质、在一定条件下反应,测得反应前及反应过程中的t1和t2两个时刻各物质的质量如下表所示,其中 a、b、c、d 分别表示相应物质的质量。下列数据不正确的是( )
时间 甲 乙 丙 丁
反应前 70g 14g 6g 10g
t1 时刻 a 11g c d
t2时刻 42g b 40g 10g
A.a=56g B.b=8g C.c=17g D.d=10g
二、填空与说明题(本题包括3小题,共13分)
9.(4分)化学基础与常识
(1)新能源在我国能源结构中的占比逐渐增大。下图所示的能源中,不属于新能源的是 (填
字母序号)。
(2)水是生命之源。电解水实验如图所示,试管 1 中生成的气体是 (填化学式)。
(3)钛和钛合金被认为是 21 世纪的重要金属材料,被广泛用于火箭、导弹、航天飞机、船舶等,一定条件
化工企业生成钛流程中往往会发生反应,其化学方程式表示为 2FeTiO3+6C+7Cl2═2X+2TiCl4+6CO,则 X 为 。
(4)我国的煤炭资源丰富,但液体燃料短缺。通过“煤液化”技术,用煤炭和水制取甲醇(CH3OH) 对我国具有重要意义。主要流程如下:
写出在高温高压和催化剂的条件下,合成塔中制取甲醇的化学方程式 。
10.(5分)化学就在我们身边,请用所学化学知识回答下列问题。
(1)硬水危害人们健康,在生活中降低水的硬度常采用的方法是 。
(2)长期盛放澄清的石灰水的试剂瓶内壁往往附着一层白色固体,这层白色固体形成的原因是 (用化学方程式表示)。
(3)酒精常用作内燃机的燃料,燃烧时反应的化学方程式是 。
(4)二氧化碳气体通入紫色石蕊试液中,溶液变红的原因是 (用化学方 程式表示)。
(5)碱式碳酸铜【化学式为 Cu2(OH)2CO3】在空气中加热能完全分解,生成三种氧化物,其中 一种是黑色固体,一种是无色气体,一种是无色液体。该反应的化学方程式是 。
11.(4分)A~E 为初中化学常见的物质,其中 A 和 B 是单质,C、D 是组成元素相同的气体,B 和 E 都是黑色固体。他们之间有如图所示的转化和反应关系(“→”表示某一种物质经一步反应可转化为另一种物质,“﹣”表示相连两种物质能发生化学反应,部分反应物、生成物及反应条件已略去。)。请回答下列问题:
(1)写出 A 的化学式为 ;
(2)写出下列反应的化学方程式:B 和 C 的反应: ;D 和 E 的反应: 。
(3)列举物质 C 在生产、生活中的用途 (答一点即可)。
三、计算题(本题包括1小题,共3分)
12.(3分)在实验室加热 32.5g 二氧化锰和氯酸钾的固体混合物制取氧气时,剩余固体物质的 质量变化如图所示。请计算原固体混合物中氯酸钾的质量分数(精确到0.1%)。
四、探究与实验题(本题包括2小题,共8分)
13.(3分)根据下列实验室制取和收集气体的装置图,回答有关问题。
(1)实验室制取氧气、二氧化碳和氢气都能采用的发生装置是 。
(2)若用装置C收集氧气,导管口开始有气泡放出时,不宜立即收集,当 时,再把导管口伸入盛满水的集气瓶。
(3)若用装置B和E制取并收集一种常见的气体,则反应的化学方程式是 。
14.(5分)小明发现一种淡黄色的粉末可以用于杀菌、消毒和漂白,于是想探究该固体的成分。 请你和他一起参与探究。
【提出问题】该淡黄色固体的化学成分是什么?
【查阅资料】
(1)硫单质是一种淡黄色固体,难溶于水,在空气中点燃硫单质,生成一种无色、有刺激性气 味的气体。
(2)过氧化钠(Na2O2)是一种淡黄色固体,能与水反应,生成气体并放出大量的热。
【设计实验方案】
方案一:取少量该固体粉末于试管中,加2mL水,振荡并观察现象。 方案二:在燃烧匙里放少量该固体,在酒精灯上加热,观察现象。
比较以上两方案,从环保、操作等角度分析,你认为的最佳方案是 。
【实验验证并得出结论】
(1)小明向盛有少量该固体的试管中加入 2mL 水,立刻观察到有无色气泡产生,并且验证出该 反应同时生成了氢氧化钠(NaOH)。通过实验验证,确定该淡黄色粉末为过氧化钠。
(2)小明想对生成的气体成分判断,他提出了以下两种假设:
①该气体是 CO
②该气体是 O2
你认为假设 合理,理由是 。
(3)请设计一个实验,验证你的合理假设(写出简要操作步骤、实验现象和结论)。
操作步骤 实验现象 结论
取少量固体粉末于试管中,向试管 中加入 2mL 水,将带火星的木条 伸入试管中 你的假设正确
【反思与提高】
过氧化钠不仅能和水反应,在常温下过氧化钠还能和二氧化碳反应生成碳酸钠和氧气,因此 过氧化钠常用作潜水艇里的供氧剂,请写出该反应的化学方程式 。
2018-2019学年湖北省黄冈市九年级(下)开学化学试卷
参考答案与试题解析
一、选择题(本题包括8小题,每小题只有一个选项符合题意,共16分)
1.【解答】解:①胆矾研碎过程中没有新物质生成,属于物理变化。
②喷洒石蕊溶液的纸花放入二氧化碳中的过程中有新物质生成,属于化学变化。
③验证鸡蛋壳的主要成分实验的过程中有新物质生成,属于化学变化。
③干冰升华的过程中没有新物质生成,属于物理变化。
故选:B。
2.【解答】解:A、熄灭酒精灯禁止用嘴吹灭,防止灯内酒精引起燃烧,应该用灯帽该灭,故A实验操作正确;
B、取固体粉末时应该将试管排放,用药匙或纸槽将固体送入试管底部,然后缓缓竖立试管,故B实验操作正确;
C、过滤要做到一贴二低三靠,要有玻璃棒引流液体,故C实验操作错误。
D、检查气密性,先将导管插入水中,再用手握着试管外壁,故D实验操作正确。
故选:C。
3.【解答】解:①二氧化碳不属于空气污染物,故错误;
②冰是水的固体,是由氢元素和氧元素组成的化合物,是氧化物,干冰是二氧化碳固体,是由碳元素和氧元素组成的化合物,是氧化物,因此冰和干冰都是氧化物,故正确;
③使用明矾只能加快水中不溶性固体小颗粒的沉降,不能消毒杀菌,故错误;
④构成物质的微粒有3种,即分子、原子、离子,故正确;
⑤C60都是由碳60分子构成的碳单质,故错误;
⑥着火点是物质的一种属性,一般不变,故错误;
⑦煤、石油、天然气、可燃冰这些化石燃料是不可再生能源,而乙醇、氢气则是可再生能源,故错误;
故选:D。
4.【解答】解:①3 个钾原子表示为3K,错误;
②2 个氮分子就是在氮气化学式的前面加上数字2,表示为2N2,正确;
③三个碳酸根离子就是在碳酸根离子的前面加上数字3,表示为3CO32﹣,正确;
④结构示意图对应的粒子O2﹣,正确;
⑤氯化铁的化学式:FeCl3,错误;
⑥﹣2 价的硫元素表示为,错误;
故选:C。
5.【解答】解:由反应的微观示意图可知,该反应是乙烯燃烧生成了二氧化碳和水,反应的化学方程式是:C2H4+3O22CO2+2H2O。
A.甲的相对分子质量为:12×2+1×4=28;丙的相对分子质量为:12+16×2=44,故说法错误;
B.由化学方程式可知,参加反应的甲、乙分子个数比为 1:3,故说法正确;
C.由化学方程式可知,化学反应前后分子的种类发生了变化,故说法错误;
D.由化学方程式可知,参加反应的甲、乙物质的质量比为:28:(32×3)=7:24,故说法错误。
故选:B。
6.【解答】解:A、由题意可知,X为N2,从空气中分离出N2 和 O2,没有新物质生成,属于物理变化,不是分解反应,故A错误;
B、N2 和H2转化成 NH3的过程中,有单质参加反应,一定有元素化合价的改变,故B正确;
C、由题意可知,CH4 在该流程中的主要作用是:利用 CH4在 O2中燃烧为转化提供能量,同时为合成提供原料,故C正确;
D、由题意可知,合成尿素的化学反应方程式为:CO2+2NH3CO(NH2)2+H2O,故D正确。
故选:A。
7.【解答】解:A、CO、CO2 组成中虽然都含有碳元素和氧元素,但分子的构成不同,决定了它们的化学性质是不相似,故A错误;
B、He、Ne、Ar 等稀有气体的原子具有相对稳定结构,但具有相对稳定结构的不一定是稀有气体的原子,例如钠离子具有稳定结构,故B错误;
C、C、CO、H2 都能与氧化铜反应,在反应夺去了氧化铜中的氧,故它们都有还原性,故C错误;
D、甲烷、乙醇完全燃烧都生成水和二氧化碳,由质量守恒定律可知,它们的组成中都含有 C、H 两种元素,可能含有氧元素,故D正确。
故选:D。
8.【解答】解:A、由题意可知,=
a=56g,故A正确;
B、依据质量守恒定律可知,b=70g+14g+6g+10g﹣42g+40g﹣10g=8g,故B正确;
C、=
c=23g,故C错误;
D、丁物质在反应前和t2时刻都是10g,所以d=10g,故D正确。
故选:C。
二、填空与说明题(本题包括3小题,共13分)
9.【解答】解:(1)人们正在利用和开发的新能源有太阳能、核能、风能、地热能、潮汐能、生物质能等。
A、风能是清洁、无污染的新能源,故选项错误。
B、天然气属于化石燃料,不属于新能源,故选项正确。
C、太阳能是清洁、无污染的新能源,故选项错误。
故填:B;
(2)试管1中的气体体积较大,是氢气;故填:H2;
(3)由2FeTiO3+6C+7Cl2=2X+2TiCl4+6CO可知,反应前后钛原子都是2个,氧原子都是6个,碳原子都是6个,反应前铁原子是2个,反应后应该是2个,包含在2X中,反应前氯原子是14个,反应后应该是14个,其中6个包含在2X中,则X为FeCl3.故填:FeCl3;
(4)在高温高压和催化剂的条件下,一氧化碳与氢气反应生成甲醇;故填:CO+2H2CH3OH。
10.【解答】解:(1)硬水危害人们健康,在生活中降低水的硬度常采用的方法是加热煮沸,加热煮沸时,水中的钙离子、镁离子能够以碳酸钙沉淀、氢氧化镁沉淀的形式从水中析出,从而降低水的硬度。
(2)长期盛放澄清的石灰水的试剂瓶内壁往往附着一层白色固体,这层白色固体形成的原因是二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O。
(3)酒精常用作内燃机的燃料,燃烧时生成水和二氧化碳,反应的化学方程式为:C2H5OH+3O2 2CO2+3H2O。
(4)二氧化碳气体通入紫色石蕊试液中,溶液变红的原因是二氧化碳和水反应生成碳酸,碳酸能使石蕊试液变红色,反应的化学方程式为:CO2 +H2O═H2CO3。
(5)碱式碳酸铜【化学式为 Cu2(OH)2CO3】在空气中加热能完全分解,生成三种氧化物,其中一种是黑色固体(氧化铜),一种是无色气体(二氧化碳),一种是无色液体(水),该反应的化学方程式是:Cu2(OH)2CO3 2CuO+H2O+CO2↑。
故填:加热煮沸;Ca(OH)2+CO2═CaCO3↓+H2O;C2H5OH+3O2 2CO2+3H2O;CO2 +H2O═H2CO3;Cu2(OH)2CO3 2CuO+H2O+CO2↑。
11.【解答】解:A 和 B 是单质B 和 E 都是黑色固体,则B是碳,C、D 是组成元素相同的气体,故两者是一氧化碳和二氧化碳中的一种,A加X可以生成黑色固体E,故E可能是氧化铜,则D是一氧化碳,C是二氧化碳,A是氧气,带入框图涂端合理;
(1)A是氧气,化学式为O2;
(2)B 和 C 的反应是碳和二氧化碳的反应,方程式为C+CO2 2CO;D 和 E 的反应是一氧化碳和氧化铜的反应,方程式为CO+CuO Cu+CO2;
(3)物质 C是二氧化碳,在生产、生活中常用来灭火(或温室气体肥料或制取汽水等);
故答案为:(1)O2;
(2)C+CO2 2CO;CO+CuO Cu+CO2
(3)灭火(或温室气体肥料或制取汽水等);
三、计算题(本题包括1小题,共3分)
12.【解答】解:由质量守恒定律可得,产生O2的质量为:32.5g﹣22.9 g=9.6 g
设原固体混合物中氯酸钾的质量为x
2KClO3 ═2KCl+3O2↑
245 96
x 9.6 g
x=24.5g
原混合物中氯酸钾的溶质质量分数=×100%=75.4%
答:原混合物中氯酸钾的溶质质量分数为75.4%。
四、探究与实验题(本题包括2小题,共8分)
13.【解答】解:(1)实验室制取氧气、二氧化碳和氢气都能采用的发生装置是固液常温型反应装置,故填:B。
(2)用装置C收集氧气,导管口开始有气泡放出时,不宜立即收集,需要当气泡连续且均匀放出时,再把导管口伸入盛满水的集气瓶,故填:气泡连续且均匀放出。
(3)用装置B和E制取并收集一种常见的气体,则可以是锌和稀硫酸反应生成硫酸锌和氢气,反应的化学方程式是Zn+H2SO4═ZnSO4+H2↑,故填:Zn+H2SO4═ZnSO4+H2↑。
14.【解答】解:【设计实验方案】
最佳方案是方案一,这是因为方案一操作简单,更环保。
故填:方案一。
【实验验证并得出结论】
(2)假设②合理,理由是反应物中含有氧元素,不含有碳元素。
故填:②;反应物中含有氧元素,不含有碳元素。
(3)取少量固体粉末于试管中,向试管 中加入 2mL 水,将带火星的木条 伸入试管中,带火星的木条复燃,说明气体是氧气,实验过程如下所示:
操作步骤 实验现象 结论
取少量固体粉末于试管中,向试管 中加入 2mL 水,将带火星的木条 伸入试管中 带火星的木条复燃 气体是氧气
【反思与提高】
在常温下过氧化钠还能和二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2。
故填:2Na2O2+2CO2═2Na2CO3+O2。
同课章节目录
