2019-2020年福建省泉州市永春一中初三化学寒假质检试卷三(含答案)
文档属性
| 名称 | 2019-2020年福建省泉州市永春一中初三化学寒假质检试卷三(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 149.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-10 21:59:11 | ||
图片预览




文档简介
2019-2020年寒假永春一中初三年化学质检试卷三
(考试时间60分钟,满分100分)
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Si-28 S-32 Cl-35.5 Ca-40 Fe-56 Ba-137
班级 座号 姓名 成绩
第I卷选择题
第I卷10小题,每小题3分,计30分,每小题只有一个正确答案。
.下列做法正确的是( )
A.高温煮沸,杀菌消毒 B.霉变大米,清洗食用
C.深埋电池,消除污染 D.食品防腐,硫磺熏蒸
.下列说法中正确的是( )
A.油脂和葡萄糖都易溶于水 B.油脂是有机高分子化合物
C.鸡蛋清中加入饱和硫酸铵溶液,有黄色沉淀 D.维生素是人体不可缺少的营养物质
.下列归类正确的是( )
选项 归类 内容
A 常见的碱 纯碱、氨水、火碱
B 挥发性酸 浓盐酸、浓硫酸、浓硝酸
C 大气污染物 PM2.5、二氧化硫、二氧化碳
D 合成材料 聚乙烯、聚氯乙烯、有机玻璃
A.A B.B C.C D.D
AUTONUM .如图是实验室制取并收集氢气的主要操作,其中不正确的是( )
A.检查气密性 B.加入锌粒 C.产生氢气 D.收集氢气
.食物的酸碱性与化学上所指的溶液的酸碱性是不同的概念。富含蛋白质、油脂和糖类之一的食物多为酸性食物。下列不属于酸性食物的是( )
A.鱼肉 B.黄瓜 C.大米 D.猪油
.25℃时,pH=1的盐酸与pH=13的氢氧化钠溶液混合,立即测定混合液的温度T,然后测定混合液的pH(25℃时)。有关判断合理的是( )
A.T=25℃pH=7 B.T=25℃1≤pH≤13 C.T>25℃pH=14 D.T>25℃1<pH<13
.下列各组溶液,不用其他试剂就能鉴别出来的是( )
A.FeCl3、NaOH、KCl、Ba(NO3)2 B.K2CO3、Ba(OH)2、KOH、稀HNO3
C.K2SO4、Na2CO3、稀HCl、稀HNO3 D.CaCl2、AgNO3、Mg(NO3)2、NaCl
.下列指定反应的化学方程式正确的是( )
A.酸雨形成的原因CO2+H2O═H2CO3
B.证明铜的活动性大于银:Cu+2AgCl═2Ag+CuCl2
C.用含氢氧化铝的药物治疗胃酸过多:Al(OH)3+3HCl═AlCl3+3H2O
D.超氧化钾(KO2)与二氧化碳反应生成碳酸钾和氧气:2KO2+CO2═K2CO3+O2
.下列实验操作能达到实验目的是( )
选项 物质 目的 主要实验操作
A CO2和N2 鉴别 分别用燃着的木条试验,观察现象
B CaCl2溶液中混有少量盐酸 检验 取样,滴加AgNO3溶液,观察是否产生沉淀
C Na2SO4溶液中混有少量MgSO4 除杂 加入Ba(OH)2溶液至不再产生沉淀,过滤
D KCl和BaCl2的混合溶液 分离 加入过量的K2CO3溶液,过滤、洗涤,再分别向滤渣和滤液中加入适量稀盐酸
A.A B.B C.C D.D
.有Fe2(SO4)3和H2SO4的混合溶液200.0g,先向其中滴加BaCl2溶液,再滴加8.0%的NaOH溶液,产生沉淀质量与滴加溶液质量关系如图所示。下列说法正确的是( )
A.a点溶液呈中性
B.b~c段只发生了1个反应
C.c点对应的沉淀有2种,m=400
D.原混合溶液中硫酸铁的溶质质量分数为10%
第II卷非选择题
第II卷8小题,计70分。
.(10分)根据下列要求填空。
(1)用化学符号表示:
①水银 。②2个钠离子 。③人体缺少 元素会导致甲状腺疾病。④最常用的溶剂 。
(2)选择下列适当的物质填空(选填序号):
A.明矾 B.硝酸 C.洗洁精 D.熟石灰 E.硫酸 F.食盐 G.维生素 H.硝酸铵
①溶于水温度降低的是 。②生活中作乳化剂的是 。③铅蓄电池含有的酸是 。
④厨房中作调味品的是 。⑤可配制波尔多液的是 。⑥蔬菜,水果中富含有 。
.(7分)新中国成立70年来,我国化学工业得到长足发展。
(1)积极开发燃料酒精等石油替代品。酒精(C2H6O)由 种元素组成,属于 (选填“有机物”或“无机物”)。乙醇汽油是在汽油在加入一定比例的酒精,乙醇汽油作为汽车燃料能减少空气污染的原因是 。
(2)人造金刚石世界闻名。金刚石硬度大,可用于 。金刚石、 (填物质名称)和碳60都属于碳的单质。
(3)光伏产品遍及全球。生产中涉及反应:SiO2+2C Si+2X↑。X的化学式是 。 SiO2中硅元素的质量分数为 (写出计算式)。
AUTONUM .(6分)纯金属与合金都属于金属材料。
(1)Mg,Al按其一定比例熔合后冷却可得到储氢合金材料。该过程属于 变化(选填“物理”或“化学”)
(2)图中能表示锡铅合金的是 (选填“a”“b”或“c”)
(3)用废铜屑生产硫酸铜晶体(CuSO4?5H2O)的流程如下:
①“溶解”时需要加热,但温度不宜过高,原因是 。
②“系列操作”包括:除杂、蒸发浓缩、 、过滤等。过滤时用到的玻璃仪器有烧杯,漏斗、 。
③“洗涤”时为减少晶体损失,最好选用 (选填序号)。
a.热水 b.冰水 c.95%的酒精溶液
.(7分)研究物质的溶解对于生产、生活有着重要意义。
温度(℃) 20 40 60 80
溶解度(g/100g水) 31.6 63.9 110 169
(1)右表是硝酸钾的部分溶解度数据。
由表中数据可知,硝酸钾的溶解度随温度升高而
(选填“变大”或“变小”)。60℃时100g硝酸钾饱和溶液中,溶质的质量为 g,能将该饱和溶液转化为不饱和溶液的一种方法是 。
(2)探究20℃时配制硝酸钾溶液过程中,溶质质量分数与加入水的质量关系。
向硝酸钾中分批加水,充分搅拌,现象如图所示。
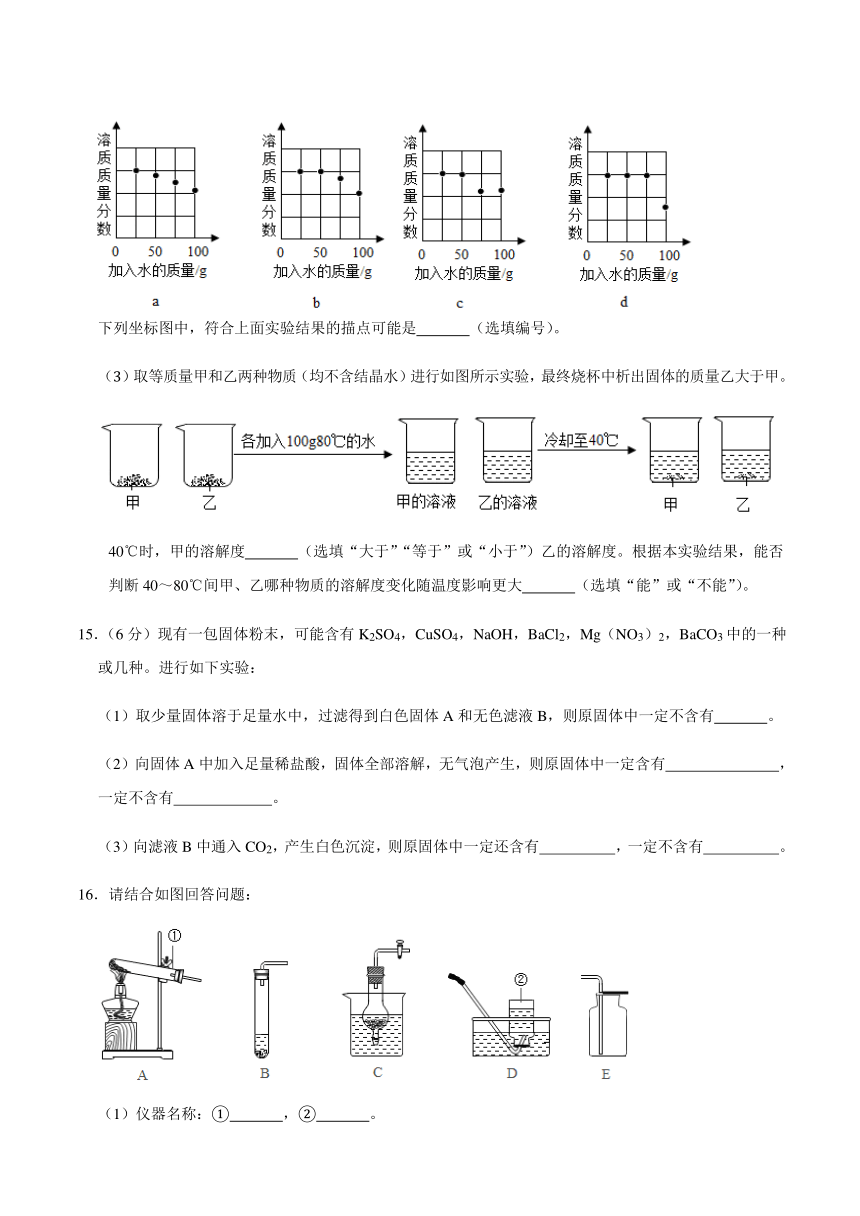
下列坐标图中,符合上面实验结果的描点可能是 (选填编号)。
(3)取等质量甲和乙两种物质(均不含结晶水)进行如图所示实验,最终烧杯中析出固体的质量乙大于甲。
40℃时,甲的溶解度 (选填“大于”“等于”或“小于”)乙的溶解度。根据本实验结果,能否判断40~80℃间甲、乙哪种物质的溶解度变化随温度影响更大 (选填“能”或“不能”)。
.(6分)现有一包固体粉末,可能含有K2SO4,CuSO4,NaOH,BaCl2,Mg(NO3)2,BaCO3中的一种或几种。进行如下实验:
(1)取少量固体溶于足量水中,过滤得到白色固体A和无色滤液B,则原固体中一定不含有 。
(2)向固体A中加入足量稀盐酸,固体全部溶解,无气泡产生,则原固体中一定含有 ,一定不含有 。
(3)向滤液B中通入CO2,产生白色沉淀,则原固体中一定还含有 ,一定不含有 。
.请结合如图回答问题:
(1)仪器名称:① ,② 。
(2)实验室用氯酸钾和二氧化锰制取并收集O2,可选用发生装置 (选填序号)和收集装置D组合,反应的化学方程式为 。
(3)实验室制取CO2的化学方程式为 ,用装置C相对于B的优点是 ,CO2可用装置E收集,理由是 。
(4)实验室用FeS和稀H2SO4反应制取H2S.H2S是有毒气体,能溶于水,其水溶液为氢硫酸。
①制取H2S的化学方程式为 。
②图中“防倒吸装置”应选择 (选填“甲”或“乙”)
③NaOH溶液的作用是 。
.(13分)某混合溶液含一定量的硝酸银、硝酸铜和硝酸钡,为逐一沉淀分离其中的金属元素,从稀盐酸、稀硫酸、氢氧化钠稀溶液、氯化钠溶液、硫酸钠溶液中选择试剂进行实验。
①甲的实验如下表所示:
步骤 操作 现象与解释
Ⅰ 向混合溶液中加入过量稀盐酸,充分反应后过滤 得到白色沉淀,相应的化学方程式是
Ⅱ 向Ⅰ中滤液加入过量稀硫酸,充分反应后过滤 得到 色沉淀
Ⅲ 向Ⅱ中滤液加入过量氢氧化钠稀溶液,充分反应后过滤 得到蓝色沉淀,该沉淀的化学式是
在Ⅱ中,需确认钡元素是否完全沉淀。甲在此环节的部分实验记录如图所示:
请根据这部分记录,指出该环节中甲存在的哪些具体问题并说明理由
。
②乙同学与甲实验中所加试剂的顺序一样,最后得到无色的滤液中所含的阴离子为 。
③丙设计了一种新的方案,不仅达到了实验目的,而且理论上氢氧化钠的消耗量减到最少。丙所加试剂依次为 。
.(5分)将一定质量的碳酸钠加入到100 g水中得澄清透明溶液,向其中加10%CaCl2的溶液至恰好不再产生沉淀,所得沉淀质量与加入CaCl2溶液质量的关系如右图所示,则反应后溶液中溶质的质量分数分别是多少?
2019-2020年寒假永春一中初三年化学质检试卷三答题卡
(考试时间60分钟,满分100分)
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Si-28 S-32 Cl-35.5 Ca-40 Fe-56 Ba-137
班级 座号 姓名 成绩
1 2 3 4 5 6 7 8 9 10
第I卷10小题,每小题3分,计30分,每小题只有一个正确答案。
第II卷8小题,计70分。
11.(10分)(1)① 。② 。③ 。④ 。
(2)① 。② 。③ 。④ 。⑤ 。⑥ 。
12.(7分)(1) , 。 。
(2) 。 。(3) 。 (写出计算式)。
13.(6分)(1) (2) (选填“a”“b”或“c”)
(3)① 。② 、 。
③ (选填序号)。
14.(7分)(1) 。 g, 。(2) (选填编号)。
(3) (选填“大于”“等于”或“小于”) (选填“能”或“不能”)。
15.(6分)(1) 。(2) , 。
(3) , 。
16(16分)(1)① ,② 。(2) , 。
(3) , ,理由是 。
(4)① 。② (选填“甲”或“乙”)
③ 。
第17、18题直接做在原题位置
2019-2020年寒假永春一中初三年化学质检试卷三参考答案
第I卷10小题,每小题3分,计30分,每小题只有一个正确答案。
1 2 3 4 5 6 7 8 9 10
A D D D B D B C C D
第II卷8小题,计70分。
11.(10分)(1)①Hg ② 2Na+ ③ I ④ H2O (2)①H ②C ③E ④F ⑤D ⑥G (每空1分)
12.(7分)(1)3 , 有机物。乙醇完全燃烧生成水和二氧化碳不会污染空气。 (2) 做钻头(切割玻璃)。石墨(活性炭或木炭)。 (3)CO。 ×100%(写出计算式)。(每空1分)
13.(6分)(1)物理(2)a(3)①温度过高容易使H2O2 分解。 ②降温结晶。玻璃棒。③ c(每空1分)
14.(7分)(1)变大。52.4 ,加热升温(或加入适量的水)。(每空1分)
(2) b d(2分) (3)大于。 不能。(每空1分)
15.(6分)(1)CuSO4 (2)NaOH 、Mg(NO3)2 (本空2分其余每空1分) BaCO3 (3)BaCl2 K2SO4
16.(16分)(1)①试管 ②集气瓶。(2)A 2KClO3 2KCl +3O2 ↑
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑, 随开随用随关随停,节约药品,
二氧化碳密度空气大且不与空气中的成分反应。
(4)①FeS+H2SO4 =FeSO4+H2S↑。 ②乙 ③吸收过量的硫化氢气体,防止污染空气。
(16题方程式3分,余每空1分)
17.(13分)
步骤 操作 现象与解释
Ⅰ AgNO3+HCl=AgCl↓+HNO3 (3分)
Ⅱ 白(1分)
Ⅲ Cu(OH)2(1分)
(1)测量pH小于7不能说明稀硫酸过量(1分),因为稀硫酸与硝酸钡反应生成硫酸钡沉淀的另一种产生是稀硝酸,稀硝酸是酸,稀硫酸不管是否过量溶液pH都小于7。(另I中所得的滤液中有生成的硝酸和过量的盐酸也会使溶液pH小于7)(1分)(2)将上层清液沾到湿润的pH试纸上是错误的操作(1分),因为先把试纸湿润后会使所测溶液稀释,测得的pH值偏大。(1分)
②Cl- 、OH-、 NO3- 、SO42- 。(2分,每个0.5分,多写1个其它离子2分全扣)
③NaCl 、NaOH 、H2SO4 (2分顺序完全正确给2分其他情况不给分)
18.(5分)解:设碳酸钠质量为x ,刚好反应后生成氯化钠质量为y. (0.5分)
Na2CO3 + CaCl2 = 2NaCl +CaCO3↓ (1分)
106 117 100
X y 10g
= = (1分)
解得:x=10.6g y=11.7g (1分)
ω(NaCl)=×100%=5.5% (1分)
答:刚好完全反应后溶液中溶质的质量分数为5.5% 。 (0.5分)
高温
MnO2
△
同课章节目录
