2012年高中化学学业水平测试课件:第六讲 氧化还原反应
文档属性
| 名称 | 2012年高中化学学业水平测试课件:第六讲 氧化还原反应 |  | |
| 格式 | rar | ||
| 文件大小 | 186.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | |||
| 科目 | 化学 | ||
| 更新时间 | 2011-10-03 13:00:15 | ||
图片预览








文档简介
(共25张PPT)
第六讲 氧化还原反应
1.了解常见的氧化还原反应。
2.了解氧化还原反应的本质是电子的转移。
一、氧化还原反应概念
1.氧化-还原反应的定义:一种物质__________,一种物质__________的反应。
或者说:有__________(得失或偏移)的反应就叫做氧化还原反应。
氧化:原子或离子失电子(化合价升高)的过程。
还原:原子或离子得电子(化合价降低)的过程。
氧化剂:(指反应物)____________的物质,在反应时所含元素的____________。
一、1.被氧化 被还原 电子转移 得到电子 化合价降低
氧化剂:得、降、还,表现氧化性,生成还原产物。
还原剂:(指反应物)____________的物质,在反应时所含元素的______________。
还原剂:失、升、氧,表现还原性,生成氧化产物。
氧化产物: (指生成物)还原剂失去电子被氧化后的产物。
还原产物:(指生成物)氧化剂得到电子被还原后的产物。
2.特征(判断的依据):反应前后元素化合价____________。
失去电子 化合价升高
2.有升降
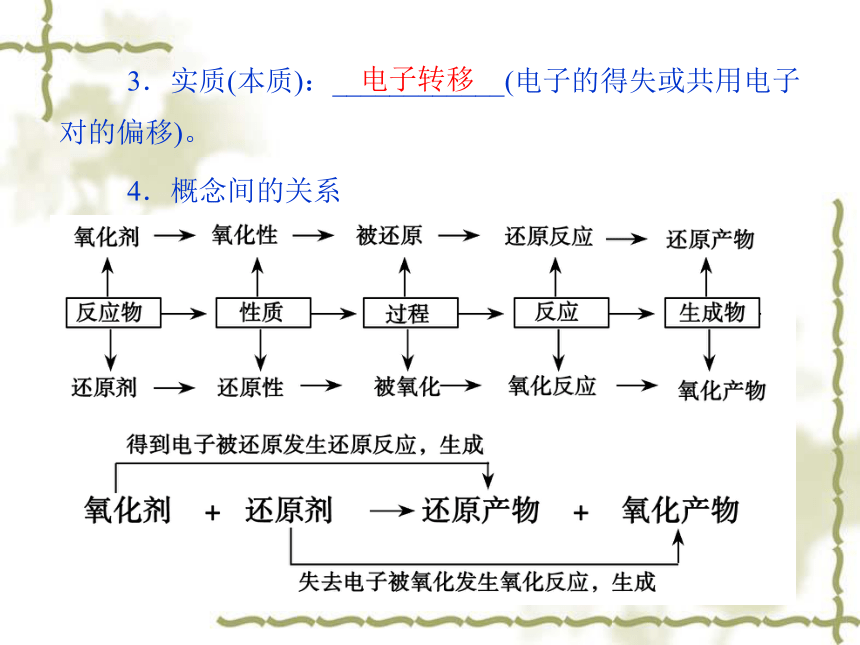
3.实质(本质):____________(电子的得失或共用电子对的偏移)。
4.概念间的关系
电子转移
二、常见的氧化剂、还原剂
(1)重要的氧化剂
① 活泼非金属单质,如F2、Cl2、Br2、O2等。
② 元素处于高价时的氧化物、含氧酸、盐等,如MnO2,NO2;浓H2SO4,HNO3;KMnO4,KClO3,FeCl3等。
③ 过氧化物,如Na2O2,H2O2等。
④某些阳离子:Cu2+, Fe3+,H+等。
(2)重要的还原剂
①活泼的金属单质,如Na,K,Zn,Fe等。
② 某些非金属单质,如H2,C,Si等。
③ 元素处于低化合价时的氧化物,如CO,SO2等。
④ 元素处于低化合价时的酸,如HCl(浓),HBr,HI,H2S等。
⑤ 元素处于低化合价时的盐,如Na2SO3,FeSO4等。
⑥某些阴离子: I-, S2-等。
注意:具有中间价态的化合物,在氧化还原反应中既能得到电子又能失去电子,既能做氧化剂又能做还原剂,所以既有氧化性又有还原性。
三、氧化还原反应规律
1.反应规律
强氧化剂+强还原剂→弱还原剂+弱氧化剂
(还原产物) (氧化产物)
氧化性强弱顺序为:氧化剂________氧化产物,还原性强弱顺序为:还原剂________还原产物。
2.氧化还原反应遵循电子守恒规律。
三、1.大于 大于
特别提示:
1.金属单质只有还原性,大多数非金属单质既有氧化性又有还原性,F2只有氧化性,O2和F2反应生成OF2时表现还原性,在其他反应中表现氧化性。
2.非金属元素从化合态转化为游离态可由低价氧化为单质(如S2-→S),也可由高价还原为单质(如SO2→S)。金属元素从化合态转变为游离态,由高价还原为单质。
3.具有最高化合价的元素不一定有强氧化性,如稀H2SO4溶液中的 ,硫元素化合价为+6价,不具有强氧化性。
4.在某些氧化还原反应中,反应物自身既作氧化剂,又作还原剂,不需要外加氧化剂或还原剂即能发生。(如硝酸分解反应4HNO3 4NO2↑+O2↑+2H2O )
氧化还原反应
(2011年江苏省新海高级中学学业水平测试)下列反应属于氧化还原反应的是( )
A.铝与盐酸反应
B.NaOH和HCl反应
C.Ba(OH)2·8H2O与NH4Cl的反应
D.CaCO3受热分解生成CaO和CO2
解析:B、C为复分解反应,不属于氧化还原反应;D为没有化合价发生变化的分解反应,也不属于氧化还原反应,如NH4NO3 N2O↑+2H2O;故本题正确选项为A。
答案:A
下列关于氧化还原反应的叙述,正确的是( )
A.失去电子的反应是还原反应
B.失去电子的物质是还原剂
C.发生氧化反应的物质是氧化剂
D.电子是从还原剂出发向氧化剂转移
解析:失去电子的反应是氧化反应 ,A错;发生氧化反应的物质是还原剂,C错。只有B、D正确。
答案:BD
氧化还原能力的比较
(2011年潮州市模拟)I-和Cl2能够发生反应,说明I-比Cl-的( )
A.非金属性强 B.得电子能力强
C.氧化性强 D.还原性强
解析:反应2I-+Cl2=I2+2Cl-能进行的原因,是因为 I-还原性强于Cl-。
答案:D
现有下列三个氧化还原反应存在:
①2FeCl3+2KI=2FeCl2+2KCl+I2;
②2FeCl2+Cl2=2FeCl3;
③KMnO4+16HCl=2KCl+2MnCl2+8H2O+5Cl2↑。
若某溶液中有Fe2+和I-共存,要氧化除去I-而又不影响Fe2+和Cl-。下列试剂中,可加入的试剂是( )
A.Cl2 B.KMnO4
C.FeCl3 D.HCl
解析:可由三个反应方程式得出如下结论:氧化性:
>Cl2>Fe3+>I2;还原性:Mn2+可氧化Cl-、Fe2+、I-,Cl2能氧化Fe2+、I-,只有Fe3+只能氧化I-,因而符合题意的氧化剂只能为C。
答案:C
一、单项选择
1.下列说法不正确的是( )
A.分解反应一定是氧化还原反应
B.复分解反应一定不是氧化还原反应
C.置换反应一定是氧化还原反应
D.化合反应不一定是氧化还原反应
解析:四种基本反应类型的划分是根据原子组合方式确定,氧化还原反应是根据元素的化合价变化确定,化合反应和分解反应有元素化合价变化的反应,也有化合价不变化的反应。
答案:A
2.(2010年河南省学业水平测试)从海水中提取溴单质时涉及如下反应:Cl2+2NaBr=Br2+2NaCl,下列有关该反应的说法不正确的是( )
A.Cl2是氧化剂
B.NaBr是还原剂
C.该反应属于置换反应
D.Cl2本身发生氧化反应
解析:Cl2中Cl从0价下降至-1价,作氧化剂被还原;NaBr中Br从-1价上升至0价,作还原剂;该反应属于置换反应。
答案:D
3.下列反应属于非氧化还原反应的是( )
A.Fe2O3+3CO 2Fe+3CO2
B.NH4NO3 N2O↑+2H2O
C.CO2+C 2CO
D.Cu2(OH)2CO3 2CuO+CO2↑+H2O
解析:氧化还原反应的本质是有电子的转移(得失或偏移),其特征是反应前后元素的化合价发生改变,本题中反应前后元素的化合价没有改变的是D,故应选D。
答案:D
4.(2010年江苏如皋学业水平模拟)下列四个反应中,水起的作用与其他反应不同的是( )
A.NO2+H2O B.Cl2+H2O
C.Na+H2O D.SO2+H2O
解析:Na与H2O反应时,H2O中H化合价下降,H2O作氧化剂,另三项中H2O的化合价未发生变化。
答案:C
5.(2010年广东省学业水平考试备考题)下列气体溶于水,发生氧化还原反应的是( )
A.SO2溶解于水 B.CO2溶解于水
C.NO2溶解于水 D.NH3溶解于水
解析:NO2溶解于水:3NO2+H2O=2HNO3+NO,为氧化还原反应,故选C。
答案:C
6.下列反应中属于氧化还原反应的是( )
A.SO3+H2O=H2SO4
B.CaCO3 CaO+ CO2↑
C.Zn+H2SO4=ZnSO4+H2 ↑
D.AgNO3+HCl=AgCl↓+HNO3
解析:选项C属于置换反应,Zn→Zn2+、 H+→H2,锌和氢两种元素价态均发生变化。
答案:C
7.(2011年三亚一中高中基础会考模拟)炼铁的反应:CO+FeO CO2+Fe中,CO充当( )
A.氧化剂 B.还原剂
C.熔融剂 D.无法判断
解析:CO明显为还原剂,选B。
答案:B
8.(2011年常州市高二化学模拟)我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸反应为2KNO3+S+3C =K2S+N2↑+3CO2↑。该反应中被还原的元素是( )
A.N B.C C.N和S D.N和C
解析:元素的化合价降低的在反应中被还原,故选C。
答案:C
二、多项选择(在每小题列出的四个选项中,至少有2个选项是正确的)
16.2008年我国的“神舟七号”宇宙飞船搭载3名宇航员顺利升空,并成功实现宇航员太空行走。火箭和飞船升空所需的巨大能量可由下列化学反应提供:
C2H8N2 + 2N2O4=2CO2↑+3N2↑+4H2O
有关该反应的说法不正确的是( )
A.该反应是复分解反应
B.反应中碳元素的化合价降低
C.氧化剂是N2O4
D.该反应不是氧化还原反应
解析:N2O4中的氮元素由+4价降低到0价,氮元素被还原,发生还原反应,作氧化剂。C2H8N2 氮元素由-3价升高到0价、碳元素由-1价升高到+4价、氢元素价态不变,C2H8N2 作还原剂,该反应属于氧化还原反应,不属于复分解反应。
答案:ABD
17.(2011年江苏省学业水平测试改编)制太阳能电池需要高纯硅,工业上用粗硅制高纯硅可通过以下反应实现:
①Si+3HCl(气) SiHCl3(气)+H2
②SiHCl3(气)+H2 Si+3HCl(气)
对上述两个反应的叙述正确的是( )
A.都是置换反应 B.都是氧化还原反应
C.反应中硅元素都被还原 D.都不是离子反应
解析:①中Si被氧化,②Si被还原,故C错。
答案:ABD
第六讲 氧化还原反应
1.了解常见的氧化还原反应。
2.了解氧化还原反应的本质是电子的转移。
一、氧化还原反应概念
1.氧化-还原反应的定义:一种物质__________,一种物质__________的反应。
或者说:有__________(得失或偏移)的反应就叫做氧化还原反应。
氧化:原子或离子失电子(化合价升高)的过程。
还原:原子或离子得电子(化合价降低)的过程。
氧化剂:(指反应物)____________的物质,在反应时所含元素的____________。
一、1.被氧化 被还原 电子转移 得到电子 化合价降低
氧化剂:得、降、还,表现氧化性,生成还原产物。
还原剂:(指反应物)____________的物质,在反应时所含元素的______________。
还原剂:失、升、氧,表现还原性,生成氧化产物。
氧化产物: (指生成物)还原剂失去电子被氧化后的产物。
还原产物:(指生成物)氧化剂得到电子被还原后的产物。
2.特征(判断的依据):反应前后元素化合价____________。
失去电子 化合价升高
2.有升降
3.实质(本质):____________(电子的得失或共用电子对的偏移)。
4.概念间的关系
电子转移
二、常见的氧化剂、还原剂
(1)重要的氧化剂
① 活泼非金属单质,如F2、Cl2、Br2、O2等。
② 元素处于高价时的氧化物、含氧酸、盐等,如MnO2,NO2;浓H2SO4,HNO3;KMnO4,KClO3,FeCl3等。
③ 过氧化物,如Na2O2,H2O2等。
④某些阳离子:Cu2+, Fe3+,H+等。
(2)重要的还原剂
①活泼的金属单质,如Na,K,Zn,Fe等。
② 某些非金属单质,如H2,C,Si等。
③ 元素处于低化合价时的氧化物,如CO,SO2等。
④ 元素处于低化合价时的酸,如HCl(浓),HBr,HI,H2S等。
⑤ 元素处于低化合价时的盐,如Na2SO3,FeSO4等。
⑥某些阴离子: I-, S2-等。
注意:具有中间价态的化合物,在氧化还原反应中既能得到电子又能失去电子,既能做氧化剂又能做还原剂,所以既有氧化性又有还原性。
三、氧化还原反应规律
1.反应规律
强氧化剂+强还原剂→弱还原剂+弱氧化剂
(还原产物) (氧化产物)
氧化性强弱顺序为:氧化剂________氧化产物,还原性强弱顺序为:还原剂________还原产物。
2.氧化还原反应遵循电子守恒规律。
三、1.大于 大于
特别提示:
1.金属单质只有还原性,大多数非金属单质既有氧化性又有还原性,F2只有氧化性,O2和F2反应生成OF2时表现还原性,在其他反应中表现氧化性。
2.非金属元素从化合态转化为游离态可由低价氧化为单质(如S2-→S),也可由高价还原为单质(如SO2→S)。金属元素从化合态转变为游离态,由高价还原为单质。
3.具有最高化合价的元素不一定有强氧化性,如稀H2SO4溶液中的 ,硫元素化合价为+6价,不具有强氧化性。
4.在某些氧化还原反应中,反应物自身既作氧化剂,又作还原剂,不需要外加氧化剂或还原剂即能发生。(如硝酸分解反应4HNO3 4NO2↑+O2↑+2H2O )
氧化还原反应
(2011年江苏省新海高级中学学业水平测试)下列反应属于氧化还原反应的是( )
A.铝与盐酸反应
B.NaOH和HCl反应
C.Ba(OH)2·8H2O与NH4Cl的反应
D.CaCO3受热分解生成CaO和CO2
解析:B、C为复分解反应,不属于氧化还原反应;D为没有化合价发生变化的分解反应,也不属于氧化还原反应,如NH4NO3 N2O↑+2H2O;故本题正确选项为A。
答案:A
下列关于氧化还原反应的叙述,正确的是( )
A.失去电子的反应是还原反应
B.失去电子的物质是还原剂
C.发生氧化反应的物质是氧化剂
D.电子是从还原剂出发向氧化剂转移
解析:失去电子的反应是氧化反应 ,A错;发生氧化反应的物质是还原剂,C错。只有B、D正确。
答案:BD
氧化还原能力的比较
(2011年潮州市模拟)I-和Cl2能够发生反应,说明I-比Cl-的( )
A.非金属性强 B.得电子能力强
C.氧化性强 D.还原性强
解析:反应2I-+Cl2=I2+2Cl-能进行的原因,是因为 I-还原性强于Cl-。
答案:D
现有下列三个氧化还原反应存在:
①2FeCl3+2KI=2FeCl2+2KCl+I2;
②2FeCl2+Cl2=2FeCl3;
③KMnO4+16HCl=2KCl+2MnCl2+8H2O+5Cl2↑。
若某溶液中有Fe2+和I-共存,要氧化除去I-而又不影响Fe2+和Cl-。下列试剂中,可加入的试剂是( )
A.Cl2 B.KMnO4
C.FeCl3 D.HCl
解析:可由三个反应方程式得出如下结论:氧化性:
>Cl2>Fe3+>I2;还原性:Mn2+
答案:C
一、单项选择
1.下列说法不正确的是( )
A.分解反应一定是氧化还原反应
B.复分解反应一定不是氧化还原反应
C.置换反应一定是氧化还原反应
D.化合反应不一定是氧化还原反应
解析:四种基本反应类型的划分是根据原子组合方式确定,氧化还原反应是根据元素的化合价变化确定,化合反应和分解反应有元素化合价变化的反应,也有化合价不变化的反应。
答案:A
2.(2010年河南省学业水平测试)从海水中提取溴单质时涉及如下反应:Cl2+2NaBr=Br2+2NaCl,下列有关该反应的说法不正确的是( )
A.Cl2是氧化剂
B.NaBr是还原剂
C.该反应属于置换反应
D.Cl2本身发生氧化反应
解析:Cl2中Cl从0价下降至-1价,作氧化剂被还原;NaBr中Br从-1价上升至0价,作还原剂;该反应属于置换反应。
答案:D
3.下列反应属于非氧化还原反应的是( )
A.Fe2O3+3CO 2Fe+3CO2
B.NH4NO3 N2O↑+2H2O
C.CO2+C 2CO
D.Cu2(OH)2CO3 2CuO+CO2↑+H2O
解析:氧化还原反应的本质是有电子的转移(得失或偏移),其特征是反应前后元素的化合价发生改变,本题中反应前后元素的化合价没有改变的是D,故应选D。
答案:D
4.(2010年江苏如皋学业水平模拟)下列四个反应中,水起的作用与其他反应不同的是( )
A.NO2+H2O B.Cl2+H2O
C.Na+H2O D.SO2+H2O
解析:Na与H2O反应时,H2O中H化合价下降,H2O作氧化剂,另三项中H2O的化合价未发生变化。
答案:C
5.(2010年广东省学业水平考试备考题)下列气体溶于水,发生氧化还原反应的是( )
A.SO2溶解于水 B.CO2溶解于水
C.NO2溶解于水 D.NH3溶解于水
解析:NO2溶解于水:3NO2+H2O=2HNO3+NO,为氧化还原反应,故选C。
答案:C
6.下列反应中属于氧化还原反应的是( )
A.SO3+H2O=H2SO4
B.CaCO3 CaO+ CO2↑
C.Zn+H2SO4=ZnSO4+H2 ↑
D.AgNO3+HCl=AgCl↓+HNO3
解析:选项C属于置换反应,Zn→Zn2+、 H+→H2,锌和氢两种元素价态均发生变化。
答案:C
7.(2011年三亚一中高中基础会考模拟)炼铁的反应:CO+FeO CO2+Fe中,CO充当( )
A.氧化剂 B.还原剂
C.熔融剂 D.无法判断
解析:CO明显为还原剂,选B。
答案:B
8.(2011年常州市高二化学模拟)我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸反应为2KNO3+S+3C =K2S+N2↑+3CO2↑。该反应中被还原的元素是( )
A.N B.C C.N和S D.N和C
解析:元素的化合价降低的在反应中被还原,故选C。
答案:C
二、多项选择(在每小题列出的四个选项中,至少有2个选项是正确的)
16.2008年我国的“神舟七号”宇宙飞船搭载3名宇航员顺利升空,并成功实现宇航员太空行走。火箭和飞船升空所需的巨大能量可由下列化学反应提供:
C2H8N2 + 2N2O4=2CO2↑+3N2↑+4H2O
有关该反应的说法不正确的是( )
A.该反应是复分解反应
B.反应中碳元素的化合价降低
C.氧化剂是N2O4
D.该反应不是氧化还原反应
解析:N2O4中的氮元素由+4价降低到0价,氮元素被还原,发生还原反应,作氧化剂。C2H8N2 氮元素由-3价升高到0价、碳元素由-1价升高到+4价、氢元素价态不变,C2H8N2 作还原剂,该反应属于氧化还原反应,不属于复分解反应。
答案:ABD
17.(2011年江苏省学业水平测试改编)制太阳能电池需要高纯硅,工业上用粗硅制高纯硅可通过以下反应实现:
①Si+3HCl(气) SiHCl3(气)+H2
②SiHCl3(气)+H2 Si+3HCl(气)
对上述两个反应的叙述正确的是( )
A.都是置换反应 B.都是氧化还原反应
C.反应中硅元素都被还原 D.都不是离子反应
解析:①中Si被氧化,②Si被还原,故C错。
答案:ABD
同课章节目录
