2020-2021学年西藏昌都一中高三(上)期末化学试卷(含解析)
文档属性
| 名称 | 2020-2021学年西藏昌都一中高三(上)期末化学试卷(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 410.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-19 16:06:34 | ||
图片预览




文档简介
2020-2021学年西藏昌都一中高三(上)期末化学试卷
一、选择题(本小题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.化学与生产、生活和社会发展密切相关,下列叙述正确的是( )
A.“蜡炬成灰泪始干”中的“蜡”为高级脂肪酸酯,属于天然高分子化合物
B.“九秋风露越窑开,夺得千峰翠色来”描写的是越窑青瓷,青瓷的显色成分为氧化铁
C.现代科技已经能够拍到氢键的“照片”,从而可直观地证实乙醇分子间存在氢键
D.二氧化氯泡腾片和酒精均可杀灭新型冠状病毒,二者消毒时均表现为强氧化性
2.下列实验操作和现象所得结论正确的是( )
选项
实验操作
现象
结论
A
向某无色溶液中滴加稀盐酸
溶液变浑浊
原溶液中一定存在Ag+
B
向某无色溶液中滴加稀NaOH溶液
未观察到明显现象
原溶液中一定不存在NH4+
C
向酸性KMnO4溶液中通入SO2
溶液紫红色褪去
SO2具有还原性
D
向某溶液中通入Cl2,再滴入KSCN溶液
溶液变红
原溶液中一定含有Fe2+
A.A
B.B
C.C
D.D
3.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
A.14g乙烯和丙烯混合气体中的氢原子数为2NA
B.1mol
N2与4mol
H2反应生成的NH3分子数为2NA
C.常温下,27g
Al投入到足量的浓硫酸中转移电子数为3NA
D.标准状况下,2.24L
CCl4含有的共价键数为0.4NA
4.新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )
A.电极b为电池的负极
B.电路中每流过4
mol电子,正极消耗44.8
L
H2S
C.电极b上的电极反应为:O2+4e﹣+4H+═2H2O
D.电极a上的电极反应为:2H2S+2O2﹣﹣4e﹣═S2+2H2O
5.某有机物的结构简式如图所示,下列有关该物质的说法正确的是( )
A.该物质的分子式为C16H18O3
B.该物质分子中的所有氢原子可能共平面
C.滴人KMnO4(H+)溶液,可观察到紫色褪去,能证明结构中存在碳碳双键
D.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol、7mol
6.短周期元素W、X、Y和Z的原子序数依次增大,元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
A.元素X与氢形成原子个数比为1:1的化合物有多种
B.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
C.Z的原子半径比Y的原子半径大
D.元素Z可与元素X形成共价化合物XZ2,且各微粒均满足8电子的稳定结构
7.下列表示对应化学反应的离子方程式正确的是( )
A.铁溶于稀硝酸,溶液变为浅绿色:Fe+4H++NO3﹣═Fe3++NO↑十2H2O
B.用KIO3氧化酸性溶液中的KI:5I﹣+IO3﹣+3H2O═3I2+6OH﹣
C.向水杨酸()中滴加NaHCO3溶液,放出无色气体:
D.0.01mol?L﹣1
NH4Al(SO4)2溶液与0.02mol?L﹣1
Ba(OH)2溶液等体积混合:NH4++Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+Al(OH)3↓+NH3?H2O
二、解答题(共3小题,满分43分)
8.硫化氢大量存在于天然气及液化石油气中,近年来发现H2S可用于制取氢气、合成硫醇等。回答下列问题:
(1)D.Berk等学者设计的用FeS催化分解H2S包括下列反应:
Ⅰ.FeS(s)+H2S(g)═FeS2(s)+H2(g)△H1
Ⅱ.FeS2(s)═FeS(s)+S2(g)△H2
Ⅲ.2H2S(g)═2H2(g)+S2(g)△H3
①△H3=
(用△H1、△H2表示)。
②已知单质硫气态时以S2形式存在(结构为S=S)。键能E(H﹣S)=339
kJ?mol﹣1、E(H﹣H)=436kJ?mol﹣1、E(S=S)=225kJ?mol﹣1,则△H3=
kJ?mol﹣1。
③Fes2是离子化合物,Fe显+2价,FeS2的电子式为
。
(2)银器长期露置在含H2S的空气中表面会生成Ag2S而变黑,该反应的氧化剂为
;将表面变黑的银器放在盛有食盐水的铝制容器中煮沸,表面重新变为光亮,正极发生的电极反应为
。
(3)实验室用粗锌制取氢气时常含有少量的H2S,可用酸性KMnO4溶液(MnO4﹣被还原为Mn2+)将H2S氧化为S而除去,该反应的离子方程式为
。
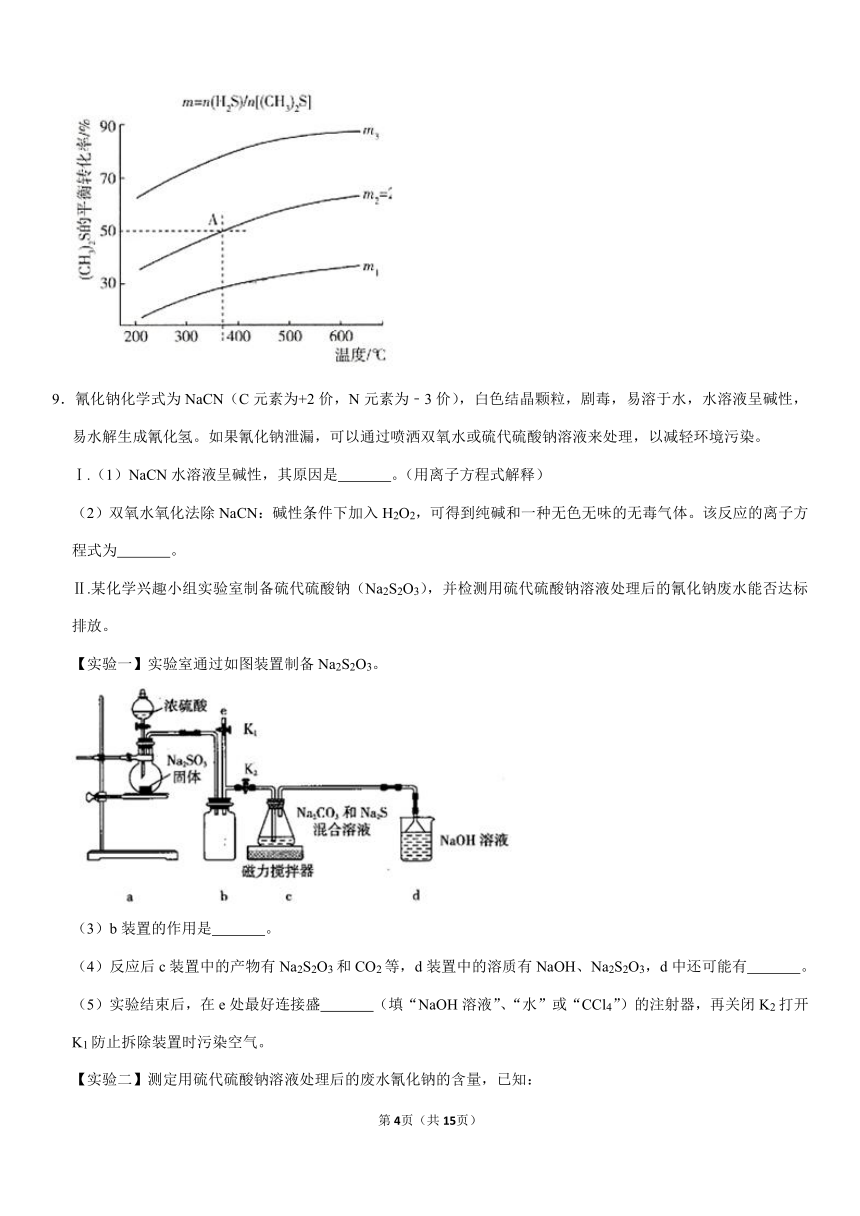
(4)H2S与(CH3)2S合成硫醇CH3SH的反应H2S(g)+(CH3)2S(g)?2CH3SH(g)在不同温度及不同物质的量之比时(CH3)2S的平衡转化率如图所示:
①该反应的△H
0(填“>”或“<“);m1
m3(填“>”或“<”)。
②在2L密闭容器中充入0.2mol
H2S和0.1mol
(CH3)2S,在A点达到平衡时,A点对应温度下反应的平衡常数为K=
。
③为提高
(CH3)2S的平衡转化率,除改变温度及投料比(m)外,还可采取的措施是
。
9.氰化钠化学式为NaCN(C元素为+2价,N元素为﹣3价),白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。如果氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。
Ⅰ.(1)NaCN水溶液呈碱性,其原因是
。(用离子方程式解释)
(2)双氧水氧化法除NaCN:碱性条件下加入H2O2,可得到纯碱和一种无色无味的无毒气体。该反应的离子方程式为
。
Ⅱ.某化学兴趣小组实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过如图装置制备Na2S2O3。
(3)b装置的作用是
。
(4)反应后c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2S2O3,d中还可能有
。
(5)实验结束后,在e处最好连接盛
(填“NaOH溶液”、“水”或“CCl4”)的注射器,再关闭K2打开K1防止拆除装置时污染空气。
【实验二】测定用硫代硫酸钠溶液处理后的废水氰化钠的含量,已知:
①废水中氰化钠的最高排放标准为0.50mg/L
②Ag++2Cn﹣═[Ag(CN)2]﹣,Ag++2I﹣═AgI↓,AgI呈黄色,且CN﹣优先与Ag+反应。实验如下:取25.00mL处理后的氰化钠废水于锥形瓶中,消耗AgNO2溶液的体积为2.50mL。(已知AgNO2溶液的浓度为0.1mmol/L)
(6)滴定终点的判断方法是
。
(7)处理后的废水中氰化钠的含量为
mg/L。
10.铬鞣剂[Cr(OH)SO4]可用于提高皮革的耐曲折强度。一种以铬渣(含Cr2O3及少量Fe2O3、CaO、Al2O3、SiO2等杂质)为原料制备Cr(OH)SO4的工艺流程如图。
(1)铬渣焙烧时需要粉碎,其目的是
。“焙烧”时Cr2O3转化为Na2CrO4的化学方程式是
。
(2)“滤渣1”中的一种成分为铁铝酸四钙(Ca4Fe2Al2O10),是制造水泥的原料之一,用氧化物的形式表示其化学式:
。
(3)“滤渣2”的主要成分是
和H2SiO3,调节pH=b(b小于7)时发生的主要反应离子方程式为
。
(4)“过滤2”所得溶液中铬元素含量为23.4g/L,调节pH后CrO42﹣有转化为Cr2O72﹣,转化后所得溶液中c(Cr2O72﹣)=
。
(5)最终产品中可能含有微量Cr2O42﹣,测定其含量时,可用TBP溶剂萃取溶液中的Cr2O42﹣。由萃取剂选择标准,猜想选择TBP作为萃取剂的理由是
。
[化学--选修3:物质结构与性质]
11.历史上金、银、铜主要是作为货币金属或装饰品被应用。试回答下列问题:
(1)Ag在元素周期表中的位置
,Ag+的价电子排布式为
。
(2)冶金工业上,提取金的原理是2[Au(CN)2]﹣+Zn═2Au+[Zn(CN)4]2﹣.与CN﹣互为等电子体的分子有
(任写一种),HCN分子中σ键和π键数目之比为
。
(3)已知基态铜的部分电离能如表所示:
电离能/kJ?mol﹣1
I1
I2
I3
Cu
746
1958
2058
由表格数据知,I2(Cu)远远大于I1(Cu),其原因是
。
(4)已知:硫酸铜溶液中滴入氨基乙酸钠(H2N﹣CH2﹣COONa)即可得到结构如图1所示配合物。
①配合物中碳原子的轨道杂化类型为
。
②1
mol氨基乙酸钠(H2N﹣CH2﹣COONa)含有σ键的数目为
mol。
(5)某Q原子的外围电子排布式为3s23p5,铜与Q形成化合物的晶胞如图2所示(白球代表Q原子)。每个铜原子周围距离最近的铜原子数目为
个;该晶体的化学式为
。已知该晶体的密度为ρg?cm﹣3,晶体的摩尔质量为M
g/mol,阿伏伽德罗常数的值为NA,则该晶体中铜原子和Q原子之问的最短距离为
pm.(1pm=10﹣12m,只写计算式)
[化学--选修5:有机化学基础]
12.H是胃炎药溴丙胺太林的合成中间体,其合成路线如图。
已知:。
回答下列问题:
(1)A的名称为
;D的分子式为
。
(2)B→D的反应类型为
。
(3)F在核磁共振氢谱中有
个峰。
(4)F→G反应的化学方程式为
。
(5)B的同分异构中满足下列条件的有
种(不考虑立体异构);任意写出其中的一种同分异构体的结构简式:
。
①遇FeCl3溶液显紫色;
②能发生银镜反应。
(6)设计由邻二甲苯()为原料合成的路线
。(其他无机试剂任选)
2020-2021学年西藏昌都一中高三(上)期末化学试卷
试题解析
一、选择题(本小题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.解:A.高级脂肪酸酯属于油脂,相对分子质量小于10000,为小分子,不是高分子化合物,故A错误;
B.诗句中的“翠色”与氧化铁的颜色不相符,因为氧化铁是红色固体,所以诗句中的“翠色”不可能来自氧化铁,故B错误;
C.乙醇分子含有羟基,O元素电负性大,能与另一个羟基中的H原子形成氢键,故C正确;
D.二氧化氯具有强氧化性,使蛋白质变性,酒精没有强氧化性,杀菌原理是利用乙醇的渗透、凝固作用,把构成病毒的蛋白质凝固为变性蛋白,二者杀菌原理不同,故D错误;
故选:C。
2.解:A.溶液变浑浊,可能生成硅酸或AgCl,原溶液中可能含硅酸根离子,故A错误;
B.可能生成一水合氨,则原溶液中可能存在NH4+,故B错误;
C.酸性KMnO4溶液中通入SO2,发生氧化还原反应,体现二氧化硫的还原性,故C正确;
D.先通入Cl2,可氧化亚铁离子,不能排除铁离子的干扰,试剂顺序不合理,故D错误;
故选:C。
3.解:A.乙烯和丙烯的最简式均为CH2,故14g混合物中含有的CH2的物质的量为n==1mol,故H原子数为2NA个,故A正确;
B.合成氨的反应是可逆反应,不能反应彻底,1mol
N2与4mol
H2反应生成的NH3分子数小于2NA,故B错误;
C.常温下,铝在浓硫酸中钝化,故铝不能反应完全,则转移电子数小于3NA,故C错误;
D.标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量,故D错误。
故选:A。
4.解:A.正极O2即电极b得电子发生还原反应,则电极b为电池的正极,故A错误;
B.气体存在的条件未知,不能确定体积大小,故B错误;
C.电极b为O2得电子发生还原反应,电极反应为:O2+4e﹣=2O2﹣,故C错误;
D.电极a失电子发生氧化反应,则电极反应为:2H2S+2O2﹣﹣4e﹣═S2+2H2O,故D正确。
故选:D。
5.解:A.由有机物结构简式可知有机物的分子式为C16H16O3,故A错误;
B.分子中含有甲基,具有甲烷的结构特征,则不可能所有的氢原子都在同一个平面上,故B错误;
C.分子中能使酸性高锰酸钾褪色的有羟基、甲基和碳碳双键,则滴人KMnO4(H+)溶液,可观察到紫色褪去,不能证明结构中存在碳碳双键,故C错误;
D.分子中含有3个酚羟基,能与溴发生取代的氢原子共有3个,含有1个碳碳双键,可与溴发生加成反应,分子中含有2个苯环、1个碳碳双键,都可与氢气发生加成反应,则1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol、7mol,故D正确。
故选:D。
6.解:短周期元素W、X、Y和Z的原子序数依次增大,W是制备一种高效电池的重要材料,W为Li元素,X原子的最外层电子数是内层电子数的2倍,X有2个电子层,最外层电子数为4,故X为C元素,元素Y是地壳中含量最丰富的金属元素,Y为Al元素,Z原子的最外层电子数是其电子层数的2倍,Z的原子序数大于Al元素,故Z有3个电子层,最外层电子数为6,故Z为S元素,
A.元素X与氢形成的原子个数比为1:1的化合物有C2H2、C6H6、苯乙烯等有机物,故A正确;
B.元素Y为铝,铝与氢氧化钠溶液或盐酸反应均有氢气生成,故B正确;
C.Z为S,Y为Al,Al原子半径大于S,故C错误;
D.元素Z可与元素X形成共价化合物为CS2,由结构式S=C=S可知各微粒均满足8电子的稳定结构,故D正确。
故选:C。
7.解:A、方程式书写违背客观事实,正确的离子反应为:3Fe+8H++2NO3﹣═3Fe2++2NO↑+4H2O,故A错误;
B、与客观事实不符,正确的离子反应为:5I﹣+IO3﹣+6H+═3I2+3H2O,故B错误;
C、向水杨酸()中滴加NaHCO3溶液,放出无色气体,正确的离子反应为+HCO3﹣→+CO2↑+H2O,故C错误;
D、0.01mol?L﹣1
NH4Al(SO4)2溶液与0.02mol?L﹣1
Ba(OH)2溶液等体积混合,两者的量比为1:2,如果设NH4Al(SO4)2为1mol,则Ba(OH)2为2mol,1mol的NH4Al(SO4)2电离出1molNH4+、1molAl3+和2molSO42﹣,而2mol的Ba(OH)2电离出2molBa2+和4molOH﹣,4molOH﹣先跟1molNH4+反应消耗1mol,还有3molOH﹣,恰好与1molAl3+生成1molAl(OH)3,正确的离子反应为NH4++Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+Al(OH)3↓+NH3?H2O,故D正确;
故选:D。
二、解答题(共3小题,满分43分)
8.解:(1)①Ⅰ.FeS(s)+H2S(g)═FeS2(s)+H2(g)△H1
Ⅱ.FeS2(s)═FeS(s)+S2(g)△H2
Ⅲ.2H2S(g)═2H2(g)+S2(g)△H3
盖斯定律计算得到由(I)与(Ⅱ)式相加再乘以2即得(Ⅲ)式,△H3=2(△H1+△H2),
故答案为:2(△H1+△H2);
②键能E(H﹣S)=339
kJ?mol﹣1、E(H﹣H)=436kJ?mol﹣1、E(S=S)=225kJ?mol﹣1,2H2S(g)═2H2(g)+S2(g)△H3=4×E(H﹣S)﹣2×E(H﹣H)﹣E(S=S)=(4×339﹣2×436﹣225)kJ/mol=+259kJ/mol,
故答案为:+259;
③FeS2由Fe2+和S22﹣构成,S22﹣与O22﹣结构相似,FeS2的电子式为,
故答案为:;
(2)由金属活动性,H2S与Ag不能发生置换反应,但在空气中能发生4Ag+2H2S+O2=Ag2S+2H2O,氧化剂为O2.除去表面Ag2S时,放在铝制容器中以食盐水为电解质溶液构成微电池,负极反应:Al﹣3e﹣=Al3+,正极反应:Ag2S+2e﹣=2Ag+S2﹣,溶液中发生反应:2Al3++3S2﹣+6H2O=2Al(OH)3↓+3H2S↑,
故答案为:O2;Ag2S+2e﹣=2Ag+S2﹣;
(3)MnO4﹣→Mn2+得5e﹣,H2S→S失2e﹣,依据电子守恒,配平化学方程式:2MnO4﹣+5H2S+6H+=2Mn2++5S↓+8H2O,
故答案为:2MnO4﹣+5H2S+6H+=2Mn2++5S↓+8H2O;
(4)①由于温度越高,(CH3)2S(甲硫醚)的平衡转化率越大,故正反应为吸热反应。△H>0,反应物中投料比越大,(CH3)2S的平衡转化率越大,故m3>m1,
故答案为:>;<;
②由反应:H2S(g)+(CH3)2S(g)?2CH3SH(g)
起始/mol/L
0.1
0.05
0
转化/mol/L
0.025
0.025
0.05
平衡/mol/L
0.075
0.025
0.05
K===,
故答案为:;
③由于压强不是影响该反应平衡移动的因素,故增大(CH3)2S的平衡转化率可采取减小生成物的浓度,及时将生成的CH3SH从体系中分离出来,
故答案为:及时将生成的CH3SH从体系中分离出来。
9.解:(1)NaCN为强碱弱酸盐,水解呈碱性,反应的离子方程式为:CN﹣+H2O?HCN+OH﹣,
故答案为:CN﹣+H2O?HCN+OH﹣;
(2)用双氧水处理氰化钠,产生一种能使湿润的红色石蕊试纸变蓝的气体为氨气,根据原子守恒一种酸式盐为碳酸氢钠,所以反应为:2CN﹣+5H2O2+2OH﹣=CO32﹣+N2↑+6H2O,
故答案为:2CN﹣+5H2O2+2OH﹣=CO32﹣+N2↑+6H2O;
实验一:a装置制备二氧化硫,c装置中制备Na2S2O3,反应导致装置内气压减小,b为安全瓶作用,防止溶液倒吸,d装置吸收多余的二氧化硫,防止污染空气。
(3)b装置连接外界空气,平衡内外压强,为安全瓶,防止倒吸,
故答案为:安全瓶,防止倒吸;
(4)d装置吸收二氧化硫,d中溶质有NaOH、Na2CO3,碱过量,还有亚硫酸钠生成,
故答案为:Na2SO3;
(5)验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收,
故答案为:NaOH溶液;
(6)Ag+与CN﹣反应生成[Ag(CN)2]﹣,当CN﹣反应结束时,滴入最后一滴硝酸银溶液,Ag+与I﹣生成AgI黄色沉淀,且振荡后不消失,说明反应到达滴定终点,
故答案为:滴入最后一滴硝酸银溶液,出现淡黄色沉淀,且振荡后不消失;
(7)消耗AgNO3的物质的量为:2.5×10﹣3L×0.0001mol/L=2.50×10﹣7mol,根据方程式Ag++2CN﹣=[Ag(CN)2]﹣,处理的废水中氰化钠的质量为2.50×10﹣7mol×2×49g/mol=2.45×10﹣5g,废水中氰化钠的含量为:=0.98mg/L,
故答案为:0.98。
10.解:(1)铬渣焙烧时需要粉碎,铬渣粉碎可以增大反应接触面积,提高原料的利用率,“焙烧”时
Cr2O3转化为
Na2CrO4的化学方程式是:2Cr2O3+4Na2CO3+3O24Na2CrO4+4CO2,
故答案为:增大反应物的接触面积,提高原料的利用率;2Cr2O3+4Na2CO3+3O24Na2CrO4+4CO2;
(2)“滤渣1”中一种成分为铁铝酸四钙(Ca4Fe2Al2O10),由盐的书写改写为氧化物的形式即改写的一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物、水,所以铁铝酸四钙(Ca4Fe2Al2O10),用氧化物的形式表示其化学式为:4CaO?Al2O3?Fe2O3,
故答案为:4CaO?Al2O3?Fe2O3;
(3)“滤渣2”主要成分为Al(OH)3和H2SiO3,“过滤2”后,将溶液调节pH=b(b小于7),目的是:控制酸性可使2CrO42﹣+2H+?Cr2O72﹣+H2O正向进行,
故答案为:Al(OH)3
;2CrO42﹣+2H+?Cr2O72﹣+H2O;
(4)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g即铬的物质的量为=0.45mol,CrO42﹣有转化为Cr2O72﹣,所以溶液中n(Cr2O72﹣)=0.45mol××=0.2
mol,则溶液中c(Cr2O72﹣)=0.2mol?L﹣1,
故答案为:0.2mol?L﹣1;
(5)检测产品中含有微量CrO42﹣,测定其含量时,可用TBP溶剂萃取溶液中的CrO42﹣.选择TBP作为萃取剂的理由是CrO42﹣在TBP中的溶解度大于其在水中的溶解度,且TBP不溶于水,
故答案为:CrO42﹣在TBP中的溶解度大于其在水中的溶解度,且TBP不溶于水。
[化学--选修3:物质结构与性质]
11.解:(1)Ag的原子序数是47,位于铜的下一周期,在元素周期表中的位置是第五周期IB族,Ag+的价电子排布式为4d10,
故答案为:第五周期IB族;4d10;
(2)原子数和价电子数分别都相等的互为等电子体,则与CN﹣互为等电子体的分子有CO或N2等,HCN的结构式为H﹣C≡N,因此分子中σ键和π键数目之比为2:2=1:1,
故答案为:CO或N2;1:1;
(3)由于I1是失去4s电子,I2是失去3d电子,Cu+的3d电子处于全充满状态,稳定性强,因此I2(Cu)远远大于I1(Cu),
故答案为:I1是失去4s电子,I2是失去3d电子,4s电子能量远远高于3d电子;
(4)①配合物中饱和碳原子全部形成单键,为sp3杂化,酯基中的碳原子含有碳氧双键,其轨道杂化类型为sp2,
故答案为:sp2和sp3;
②单键都是σ键,双键中含有1个σ键,则1mol氨基乙酸钠(H2N﹣CH2﹣COONa)含有σ键的数目为8mol,
故答案为:8;
(5)某Q原子的外围电子排布式为3s23p5,Q是Cl,铜与Cl形成化合物的晶胞如图所示
(白球代表Q原子),根据晶胞结构可知每个铜原子周围距离最近的铜原子位于面心处,其数目为12个;晶胞中含有4个Cl,Cu个数是,该晶体的化学式为CuCl;已知该晶体的密度为ρg?cm﹣3,晶体的摩尔质量为Mg/mol,阿伏伽德罗常数的值为NA,则该晶体的边长是cm=×1010pm,晶胞中铜原子和Q原子之问的最短距离为体对角线的,即为
pm,
故答案为:12,;CuCl;。
[化学--选修5:有机化学基础]
12.解:(1)由B的结构简式以及反应条件可知,A为苯甲酸);由图示可知D的分子式为:C13H10O3,
故答案为:苯甲酸;C13H10O3;
(2)由D的结构简式以及B的结构简式可知C的为苯酚,所以由B与C反应生成D的反应为取代反应,
故答案为:取代反应;
(3)由图示可知F有10个氢原子,但有6种环境的氢,所以F的核磁共振氢谱中有6个峰,
故答案为:6;
(4)由已知以及F可得G的结构简式为:,所以F→G反应的化学方程式为:,
故答案为:;
(5)由题意可知①遇FeCl3溶液显紫色,则B的同分异构体含苯环和酚羟基;②能发生银镜反应,则B的同分异构体中含有醛基;又由于B中含有Cl,所以B的同分异构体中的苯环上含有酚羟基,醛基以及氯原子3种官能团,且各含2个。当苯环上羟基与醛基相邻时,则﹣Cl在苯环上有4中同分异构体;羟基与醛基处于间位时,则﹣Cl在苯环上有4中同分异构体;当羟基与醛基处于对位时,则﹣Cl在苯环上有2中同分异构体,所以满足以上条件的B的同分异构体由10种,即,
故答案为:10;(10种中的任意2种皆可);
(6)与氯气在光照的条件下发生取代反应生成;在碱性环境中并加热水解生成;在酸性环境中与NaCH反应生成,再水解生成目标物,故该合成路线为:,
故答案为:。
第1页(共1页)
一、选择题(本小题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.化学与生产、生活和社会发展密切相关,下列叙述正确的是( )
A.“蜡炬成灰泪始干”中的“蜡”为高级脂肪酸酯,属于天然高分子化合物
B.“九秋风露越窑开,夺得千峰翠色来”描写的是越窑青瓷,青瓷的显色成分为氧化铁
C.现代科技已经能够拍到氢键的“照片”,从而可直观地证实乙醇分子间存在氢键
D.二氧化氯泡腾片和酒精均可杀灭新型冠状病毒,二者消毒时均表现为强氧化性
2.下列实验操作和现象所得结论正确的是( )
选项
实验操作
现象
结论
A
向某无色溶液中滴加稀盐酸
溶液变浑浊
原溶液中一定存在Ag+
B
向某无色溶液中滴加稀NaOH溶液
未观察到明显现象
原溶液中一定不存在NH4+
C
向酸性KMnO4溶液中通入SO2
溶液紫红色褪去
SO2具有还原性
D
向某溶液中通入Cl2,再滴入KSCN溶液
溶液变红
原溶液中一定含有Fe2+
A.A
B.B
C.C
D.D
3.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
A.14g乙烯和丙烯混合气体中的氢原子数为2NA
B.1mol
N2与4mol
H2反应生成的NH3分子数为2NA
C.常温下,27g
Al投入到足量的浓硫酸中转移电子数为3NA
D.标准状况下,2.24L
CCl4含有的共价键数为0.4NA
4.新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )
A.电极b为电池的负极
B.电路中每流过4
mol电子,正极消耗44.8
L
H2S
C.电极b上的电极反应为:O2+4e﹣+4H+═2H2O
D.电极a上的电极反应为:2H2S+2O2﹣﹣4e﹣═S2+2H2O
5.某有机物的结构简式如图所示,下列有关该物质的说法正确的是( )
A.该物质的分子式为C16H18O3
B.该物质分子中的所有氢原子可能共平面
C.滴人KMnO4(H+)溶液,可观察到紫色褪去,能证明结构中存在碳碳双键
D.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol、7mol
6.短周期元素W、X、Y和Z的原子序数依次增大,元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
A.元素X与氢形成原子个数比为1:1的化合物有多种
B.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
C.Z的原子半径比Y的原子半径大
D.元素Z可与元素X形成共价化合物XZ2,且各微粒均满足8电子的稳定结构
7.下列表示对应化学反应的离子方程式正确的是( )
A.铁溶于稀硝酸,溶液变为浅绿色:Fe+4H++NO3﹣═Fe3++NO↑十2H2O
B.用KIO3氧化酸性溶液中的KI:5I﹣+IO3﹣+3H2O═3I2+6OH﹣
C.向水杨酸()中滴加NaHCO3溶液,放出无色气体:
D.0.01mol?L﹣1
NH4Al(SO4)2溶液与0.02mol?L﹣1
Ba(OH)2溶液等体积混合:NH4++Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+Al(OH)3↓+NH3?H2O
二、解答题(共3小题,满分43分)
8.硫化氢大量存在于天然气及液化石油气中,近年来发现H2S可用于制取氢气、合成硫醇等。回答下列问题:
(1)D.Berk等学者设计的用FeS催化分解H2S包括下列反应:
Ⅰ.FeS(s)+H2S(g)═FeS2(s)+H2(g)△H1
Ⅱ.FeS2(s)═FeS(s)+S2(g)△H2
Ⅲ.2H2S(g)═2H2(g)+S2(g)△H3
①△H3=
(用△H1、△H2表示)。
②已知单质硫气态时以S2形式存在(结构为S=S)。键能E(H﹣S)=339
kJ?mol﹣1、E(H﹣H)=436kJ?mol﹣1、E(S=S)=225kJ?mol﹣1,则△H3=
kJ?mol﹣1。
③Fes2是离子化合物,Fe显+2价,FeS2的电子式为
。
(2)银器长期露置在含H2S的空气中表面会生成Ag2S而变黑,该反应的氧化剂为
;将表面变黑的银器放在盛有食盐水的铝制容器中煮沸,表面重新变为光亮,正极发生的电极反应为
。
(3)实验室用粗锌制取氢气时常含有少量的H2S,可用酸性KMnO4溶液(MnO4﹣被还原为Mn2+)将H2S氧化为S而除去,该反应的离子方程式为
。
(4)H2S与(CH3)2S合成硫醇CH3SH的反应H2S(g)+(CH3)2S(g)?2CH3SH(g)在不同温度及不同物质的量之比时(CH3)2S的平衡转化率如图所示:
①该反应的△H
0(填“>”或“<“);m1
m3(填“>”或“<”)。
②在2L密闭容器中充入0.2mol
H2S和0.1mol
(CH3)2S,在A点达到平衡时,A点对应温度下反应的平衡常数为K=
。
③为提高
(CH3)2S的平衡转化率,除改变温度及投料比(m)外,还可采取的措施是
。
9.氰化钠化学式为NaCN(C元素为+2价,N元素为﹣3价),白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。如果氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。
Ⅰ.(1)NaCN水溶液呈碱性,其原因是
。(用离子方程式解释)
(2)双氧水氧化法除NaCN:碱性条件下加入H2O2,可得到纯碱和一种无色无味的无毒气体。该反应的离子方程式为
。
Ⅱ.某化学兴趣小组实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过如图装置制备Na2S2O3。
(3)b装置的作用是
。
(4)反应后c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2S2O3,d中还可能有
。
(5)实验结束后,在e处最好连接盛
(填“NaOH溶液”、“水”或“CCl4”)的注射器,再关闭K2打开K1防止拆除装置时污染空气。
【实验二】测定用硫代硫酸钠溶液处理后的废水氰化钠的含量,已知:
①废水中氰化钠的最高排放标准为0.50mg/L
②Ag++2Cn﹣═[Ag(CN)2]﹣,Ag++2I﹣═AgI↓,AgI呈黄色,且CN﹣优先与Ag+反应。实验如下:取25.00mL处理后的氰化钠废水于锥形瓶中,消耗AgNO2溶液的体积为2.50mL。(已知AgNO2溶液的浓度为0.1mmol/L)
(6)滴定终点的判断方法是
。
(7)处理后的废水中氰化钠的含量为
mg/L。
10.铬鞣剂[Cr(OH)SO4]可用于提高皮革的耐曲折强度。一种以铬渣(含Cr2O3及少量Fe2O3、CaO、Al2O3、SiO2等杂质)为原料制备Cr(OH)SO4的工艺流程如图。
(1)铬渣焙烧时需要粉碎,其目的是
。“焙烧”时Cr2O3转化为Na2CrO4的化学方程式是
。
(2)“滤渣1”中的一种成分为铁铝酸四钙(Ca4Fe2Al2O10),是制造水泥的原料之一,用氧化物的形式表示其化学式:
。
(3)“滤渣2”的主要成分是
和H2SiO3,调节pH=b(b小于7)时发生的主要反应离子方程式为
。
(4)“过滤2”所得溶液中铬元素含量为23.4g/L,调节pH后CrO42﹣有转化为Cr2O72﹣,转化后所得溶液中c(Cr2O72﹣)=
。
(5)最终产品中可能含有微量Cr2O42﹣,测定其含量时,可用TBP溶剂萃取溶液中的Cr2O42﹣。由萃取剂选择标准,猜想选择TBP作为萃取剂的理由是
。
[化学--选修3:物质结构与性质]
11.历史上金、银、铜主要是作为货币金属或装饰品被应用。试回答下列问题:
(1)Ag在元素周期表中的位置
,Ag+的价电子排布式为
。
(2)冶金工业上,提取金的原理是2[Au(CN)2]﹣+Zn═2Au+[Zn(CN)4]2﹣.与CN﹣互为等电子体的分子有
(任写一种),HCN分子中σ键和π键数目之比为
。
(3)已知基态铜的部分电离能如表所示:
电离能/kJ?mol﹣1
I1
I2
I3
Cu
746
1958
2058
由表格数据知,I2(Cu)远远大于I1(Cu),其原因是
。
(4)已知:硫酸铜溶液中滴入氨基乙酸钠(H2N﹣CH2﹣COONa)即可得到结构如图1所示配合物。
①配合物中碳原子的轨道杂化类型为
。
②1
mol氨基乙酸钠(H2N﹣CH2﹣COONa)含有σ键的数目为
mol。
(5)某Q原子的外围电子排布式为3s23p5,铜与Q形成化合物的晶胞如图2所示(白球代表Q原子)。每个铜原子周围距离最近的铜原子数目为
个;该晶体的化学式为
。已知该晶体的密度为ρg?cm﹣3,晶体的摩尔质量为M
g/mol,阿伏伽德罗常数的值为NA,则该晶体中铜原子和Q原子之问的最短距离为
pm.(1pm=10﹣12m,只写计算式)
[化学--选修5:有机化学基础]
12.H是胃炎药溴丙胺太林的合成中间体,其合成路线如图。
已知:。
回答下列问题:
(1)A的名称为
;D的分子式为
。
(2)B→D的反应类型为
。
(3)F在核磁共振氢谱中有
个峰。
(4)F→G反应的化学方程式为
。
(5)B的同分异构中满足下列条件的有
种(不考虑立体异构);任意写出其中的一种同分异构体的结构简式:
。
①遇FeCl3溶液显紫色;
②能发生银镜反应。
(6)设计由邻二甲苯()为原料合成的路线
。(其他无机试剂任选)
2020-2021学年西藏昌都一中高三(上)期末化学试卷
试题解析
一、选择题(本小题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.解:A.高级脂肪酸酯属于油脂,相对分子质量小于10000,为小分子,不是高分子化合物,故A错误;
B.诗句中的“翠色”与氧化铁的颜色不相符,因为氧化铁是红色固体,所以诗句中的“翠色”不可能来自氧化铁,故B错误;
C.乙醇分子含有羟基,O元素电负性大,能与另一个羟基中的H原子形成氢键,故C正确;
D.二氧化氯具有强氧化性,使蛋白质变性,酒精没有强氧化性,杀菌原理是利用乙醇的渗透、凝固作用,把构成病毒的蛋白质凝固为变性蛋白,二者杀菌原理不同,故D错误;
故选:C。
2.解:A.溶液变浑浊,可能生成硅酸或AgCl,原溶液中可能含硅酸根离子,故A错误;
B.可能生成一水合氨,则原溶液中可能存在NH4+,故B错误;
C.酸性KMnO4溶液中通入SO2,发生氧化还原反应,体现二氧化硫的还原性,故C正确;
D.先通入Cl2,可氧化亚铁离子,不能排除铁离子的干扰,试剂顺序不合理,故D错误;
故选:C。
3.解:A.乙烯和丙烯的最简式均为CH2,故14g混合物中含有的CH2的物质的量为n==1mol,故H原子数为2NA个,故A正确;
B.合成氨的反应是可逆反应,不能反应彻底,1mol
N2与4mol
H2反应生成的NH3分子数小于2NA,故B错误;
C.常温下,铝在浓硫酸中钝化,故铝不能反应完全,则转移电子数小于3NA,故C错误;
D.标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量,故D错误。
故选:A。
4.解:A.正极O2即电极b得电子发生还原反应,则电极b为电池的正极,故A错误;
B.气体存在的条件未知,不能确定体积大小,故B错误;
C.电极b为O2得电子发生还原反应,电极反应为:O2+4e﹣=2O2﹣,故C错误;
D.电极a失电子发生氧化反应,则电极反应为:2H2S+2O2﹣﹣4e﹣═S2+2H2O,故D正确。
故选:D。
5.解:A.由有机物结构简式可知有机物的分子式为C16H16O3,故A错误;
B.分子中含有甲基,具有甲烷的结构特征,则不可能所有的氢原子都在同一个平面上,故B错误;
C.分子中能使酸性高锰酸钾褪色的有羟基、甲基和碳碳双键,则滴人KMnO4(H+)溶液,可观察到紫色褪去,不能证明结构中存在碳碳双键,故C错误;
D.分子中含有3个酚羟基,能与溴发生取代的氢原子共有3个,含有1个碳碳双键,可与溴发生加成反应,分子中含有2个苯环、1个碳碳双键,都可与氢气发生加成反应,则1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol、7mol,故D正确。
故选:D。
6.解:短周期元素W、X、Y和Z的原子序数依次增大,W是制备一种高效电池的重要材料,W为Li元素,X原子的最外层电子数是内层电子数的2倍,X有2个电子层,最外层电子数为4,故X为C元素,元素Y是地壳中含量最丰富的金属元素,Y为Al元素,Z原子的最外层电子数是其电子层数的2倍,Z的原子序数大于Al元素,故Z有3个电子层,最外层电子数为6,故Z为S元素,
A.元素X与氢形成的原子个数比为1:1的化合物有C2H2、C6H6、苯乙烯等有机物,故A正确;
B.元素Y为铝,铝与氢氧化钠溶液或盐酸反应均有氢气生成,故B正确;
C.Z为S,Y为Al,Al原子半径大于S,故C错误;
D.元素Z可与元素X形成共价化合物为CS2,由结构式S=C=S可知各微粒均满足8电子的稳定结构,故D正确。
故选:C。
7.解:A、方程式书写违背客观事实,正确的离子反应为:3Fe+8H++2NO3﹣═3Fe2++2NO↑+4H2O,故A错误;
B、与客观事实不符,正确的离子反应为:5I﹣+IO3﹣+6H+═3I2+3H2O,故B错误;
C、向水杨酸()中滴加NaHCO3溶液,放出无色气体,正确的离子反应为+HCO3﹣→+CO2↑+H2O,故C错误;
D、0.01mol?L﹣1
NH4Al(SO4)2溶液与0.02mol?L﹣1
Ba(OH)2溶液等体积混合,两者的量比为1:2,如果设NH4Al(SO4)2为1mol,则Ba(OH)2为2mol,1mol的NH4Al(SO4)2电离出1molNH4+、1molAl3+和2molSO42﹣,而2mol的Ba(OH)2电离出2molBa2+和4molOH﹣,4molOH﹣先跟1molNH4+反应消耗1mol,还有3molOH﹣,恰好与1molAl3+生成1molAl(OH)3,正确的离子反应为NH4++Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+Al(OH)3↓+NH3?H2O,故D正确;
故选:D。
二、解答题(共3小题,满分43分)
8.解:(1)①Ⅰ.FeS(s)+H2S(g)═FeS2(s)+H2(g)△H1
Ⅱ.FeS2(s)═FeS(s)+S2(g)△H2
Ⅲ.2H2S(g)═2H2(g)+S2(g)△H3
盖斯定律计算得到由(I)与(Ⅱ)式相加再乘以2即得(Ⅲ)式,△H3=2(△H1+△H2),
故答案为:2(△H1+△H2);
②键能E(H﹣S)=339
kJ?mol﹣1、E(H﹣H)=436kJ?mol﹣1、E(S=S)=225kJ?mol﹣1,2H2S(g)═2H2(g)+S2(g)△H3=4×E(H﹣S)﹣2×E(H﹣H)﹣E(S=S)=(4×339﹣2×436﹣225)kJ/mol=+259kJ/mol,
故答案为:+259;
③FeS2由Fe2+和S22﹣构成,S22﹣与O22﹣结构相似,FeS2的电子式为,
故答案为:;
(2)由金属活动性,H2S与Ag不能发生置换反应,但在空气中能发生4Ag+2H2S+O2=Ag2S+2H2O,氧化剂为O2.除去表面Ag2S时,放在铝制容器中以食盐水为电解质溶液构成微电池,负极反应:Al﹣3e﹣=Al3+,正极反应:Ag2S+2e﹣=2Ag+S2﹣,溶液中发生反应:2Al3++3S2﹣+6H2O=2Al(OH)3↓+3H2S↑,
故答案为:O2;Ag2S+2e﹣=2Ag+S2﹣;
(3)MnO4﹣→Mn2+得5e﹣,H2S→S失2e﹣,依据电子守恒,配平化学方程式:2MnO4﹣+5H2S+6H+=2Mn2++5S↓+8H2O,
故答案为:2MnO4﹣+5H2S+6H+=2Mn2++5S↓+8H2O;
(4)①由于温度越高,(CH3)2S(甲硫醚)的平衡转化率越大,故正反应为吸热反应。△H>0,反应物中投料比越大,(CH3)2S的平衡转化率越大,故m3>m1,
故答案为:>;<;
②由反应:H2S(g)+(CH3)2S(g)?2CH3SH(g)
起始/mol/L
0.1
0.05
0
转化/mol/L
0.025
0.025
0.05
平衡/mol/L
0.075
0.025
0.05
K===,
故答案为:;
③由于压强不是影响该反应平衡移动的因素,故增大(CH3)2S的平衡转化率可采取减小生成物的浓度,及时将生成的CH3SH从体系中分离出来,
故答案为:及时将生成的CH3SH从体系中分离出来。
9.解:(1)NaCN为强碱弱酸盐,水解呈碱性,反应的离子方程式为:CN﹣+H2O?HCN+OH﹣,
故答案为:CN﹣+H2O?HCN+OH﹣;
(2)用双氧水处理氰化钠,产生一种能使湿润的红色石蕊试纸变蓝的气体为氨气,根据原子守恒一种酸式盐为碳酸氢钠,所以反应为:2CN﹣+5H2O2+2OH﹣=CO32﹣+N2↑+6H2O,
故答案为:2CN﹣+5H2O2+2OH﹣=CO32﹣+N2↑+6H2O;
实验一:a装置制备二氧化硫,c装置中制备Na2S2O3,反应导致装置内气压减小,b为安全瓶作用,防止溶液倒吸,d装置吸收多余的二氧化硫,防止污染空气。
(3)b装置连接外界空气,平衡内外压强,为安全瓶,防止倒吸,
故答案为:安全瓶,防止倒吸;
(4)d装置吸收二氧化硫,d中溶质有NaOH、Na2CO3,碱过量,还有亚硫酸钠生成,
故答案为:Na2SO3;
(5)验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收,
故答案为:NaOH溶液;
(6)Ag+与CN﹣反应生成[Ag(CN)2]﹣,当CN﹣反应结束时,滴入最后一滴硝酸银溶液,Ag+与I﹣生成AgI黄色沉淀,且振荡后不消失,说明反应到达滴定终点,
故答案为:滴入最后一滴硝酸银溶液,出现淡黄色沉淀,且振荡后不消失;
(7)消耗AgNO3的物质的量为:2.5×10﹣3L×0.0001mol/L=2.50×10﹣7mol,根据方程式Ag++2CN﹣=[Ag(CN)2]﹣,处理的废水中氰化钠的质量为2.50×10﹣7mol×2×49g/mol=2.45×10﹣5g,废水中氰化钠的含量为:=0.98mg/L,
故答案为:0.98。
10.解:(1)铬渣焙烧时需要粉碎,铬渣粉碎可以增大反应接触面积,提高原料的利用率,“焙烧”时
Cr2O3转化为
Na2CrO4的化学方程式是:2Cr2O3+4Na2CO3+3O24Na2CrO4+4CO2,
故答案为:增大反应物的接触面积,提高原料的利用率;2Cr2O3+4Na2CO3+3O24Na2CrO4+4CO2;
(2)“滤渣1”中一种成分为铁铝酸四钙(Ca4Fe2Al2O10),由盐的书写改写为氧化物的形式即改写的一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物、水,所以铁铝酸四钙(Ca4Fe2Al2O10),用氧化物的形式表示其化学式为:4CaO?Al2O3?Fe2O3,
故答案为:4CaO?Al2O3?Fe2O3;
(3)“滤渣2”主要成分为Al(OH)3和H2SiO3,“过滤2”后,将溶液调节pH=b(b小于7),目的是:控制酸性可使2CrO42﹣+2H+?Cr2O72﹣+H2O正向进行,
故答案为:Al(OH)3
;2CrO42﹣+2H+?Cr2O72﹣+H2O;
(4)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g即铬的物质的量为=0.45mol,CrO42﹣有转化为Cr2O72﹣,所以溶液中n(Cr2O72﹣)=0.45mol××=0.2
mol,则溶液中c(Cr2O72﹣)=0.2mol?L﹣1,
故答案为:0.2mol?L﹣1;
(5)检测产品中含有微量CrO42﹣,测定其含量时,可用TBP溶剂萃取溶液中的CrO42﹣.选择TBP作为萃取剂的理由是CrO42﹣在TBP中的溶解度大于其在水中的溶解度,且TBP不溶于水,
故答案为:CrO42﹣在TBP中的溶解度大于其在水中的溶解度,且TBP不溶于水。
[化学--选修3:物质结构与性质]
11.解:(1)Ag的原子序数是47,位于铜的下一周期,在元素周期表中的位置是第五周期IB族,Ag+的价电子排布式为4d10,
故答案为:第五周期IB族;4d10;
(2)原子数和价电子数分别都相等的互为等电子体,则与CN﹣互为等电子体的分子有CO或N2等,HCN的结构式为H﹣C≡N,因此分子中σ键和π键数目之比为2:2=1:1,
故答案为:CO或N2;1:1;
(3)由于I1是失去4s电子,I2是失去3d电子,Cu+的3d电子处于全充满状态,稳定性强,因此I2(Cu)远远大于I1(Cu),
故答案为:I1是失去4s电子,I2是失去3d电子,4s电子能量远远高于3d电子;
(4)①配合物中饱和碳原子全部形成单键,为sp3杂化,酯基中的碳原子含有碳氧双键,其轨道杂化类型为sp2,
故答案为:sp2和sp3;
②单键都是σ键,双键中含有1个σ键,则1mol氨基乙酸钠(H2N﹣CH2﹣COONa)含有σ键的数目为8mol,
故答案为:8;
(5)某Q原子的外围电子排布式为3s23p5,Q是Cl,铜与Cl形成化合物的晶胞如图所示
(白球代表Q原子),根据晶胞结构可知每个铜原子周围距离最近的铜原子位于面心处,其数目为12个;晶胞中含有4个Cl,Cu个数是,该晶体的化学式为CuCl;已知该晶体的密度为ρg?cm﹣3,晶体的摩尔质量为Mg/mol,阿伏伽德罗常数的值为NA,则该晶体的边长是cm=×1010pm,晶胞中铜原子和Q原子之问的最短距离为体对角线的,即为
pm,
故答案为:12,;CuCl;。
[化学--选修5:有机化学基础]
12.解:(1)由B的结构简式以及反应条件可知,A为苯甲酸);由图示可知D的分子式为:C13H10O3,
故答案为:苯甲酸;C13H10O3;
(2)由D的结构简式以及B的结构简式可知C的为苯酚,所以由B与C反应生成D的反应为取代反应,
故答案为:取代反应;
(3)由图示可知F有10个氢原子,但有6种环境的氢,所以F的核磁共振氢谱中有6个峰,
故答案为:6;
(4)由已知以及F可得G的结构简式为:,所以F→G反应的化学方程式为:,
故答案为:;
(5)由题意可知①遇FeCl3溶液显紫色,则B的同分异构体含苯环和酚羟基;②能发生银镜反应,则B的同分异构体中含有醛基;又由于B中含有Cl,所以B的同分异构体中的苯环上含有酚羟基,醛基以及氯原子3种官能团,且各含2个。当苯环上羟基与醛基相邻时,则﹣Cl在苯环上有4中同分异构体;羟基与醛基处于间位时,则﹣Cl在苯环上有4中同分异构体;当羟基与醛基处于对位时,则﹣Cl在苯环上有2中同分异构体,所以满足以上条件的B的同分异构体由10种,即,
故答案为:10;(10种中的任意2种皆可);
(6)与氯气在光照的条件下发生取代反应生成;在碱性环境中并加热水解生成;在酸性环境中与NaCH反应生成,再水解生成目标物,故该合成路线为:,
故答案为:。
第1页(共1页)
同课章节目录
