2020-2021学年天津市河西区高三(上)期末化学试卷(Word含解析)
文档属性
| 名称 | 2020-2021学年天津市河西区高三(上)期末化学试卷(Word含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 313.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-08 08:33:00 | ||
图片预览



文档简介
2020-2021学年天津市河西区高三(上)期末化学试卷
一、选择题(共12小题,每小题3分,满分36分)
1.下列有关物质的性质与用途的因果关系正确的是( )
A.Al2O3具有两性,可用于电解冶炼铝
B.NH4HCO3受热易分解,可用作化肥
C.SiO2具有酸性氧化物的通性,可溶于水制取硅胶
D.Na2O2能和H2O或CO2反应,可用作呼吸面具的供氧剂
2.下列离子方程式书写正确的是( )
A.硫酸铜溶液中滴加氨水:Cu2++2OH﹣═Cu(OH)2↓
B.氯气与水反应:Cl2+H2O═Cl﹣+ClO﹣+2H+
C.钠放入水中:2Na+2H2O═2Na++2OH﹣+H2↑
D.铝和NaOH溶液反应:Al+2OH﹣═AlO2﹣+H2↑
3.被誉为“生命的奇效元素”硒(Se)与氧同主族,与钙同周期。下列说法正确的是( )
A.Se的原子序数是34
B.H2Se键角为180°
C.H2Se与CaH2都含共价键
D.H2Se的稳定性大于H2S的
4.长征运载火箭常规推进剂xg四氧化二氮(N2O4)与yg偏二甲肼()完全反应放热为qkJ。下列有关说法一定正确的是( )
A.偏二甲肼的燃烧热△H=﹣qkJ?mol﹣1
B.每个偏二甲肼分子含11个σ键
C.四氧化二氮在反应中作还原剂
D.该推进剂泄露在常温常压环境中为无色气体
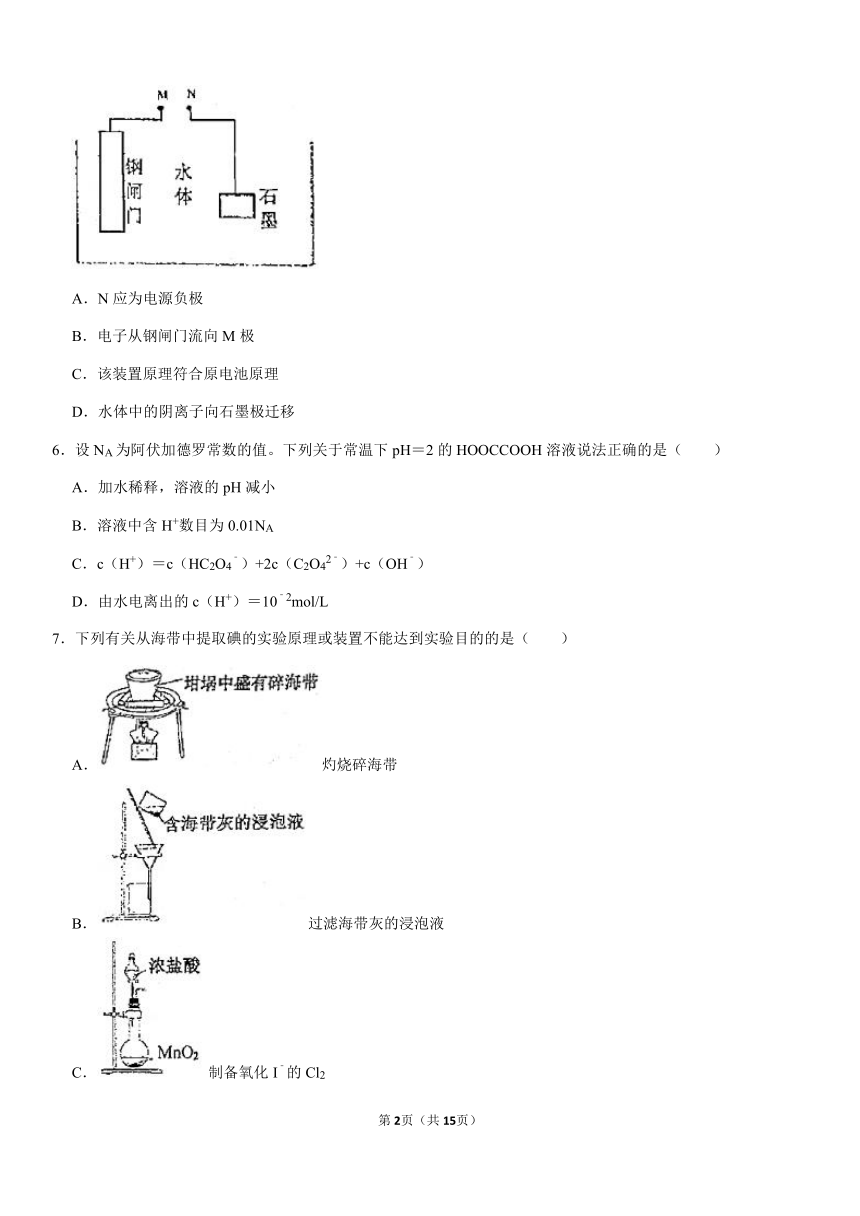
5.应用电化学原理对钢闸门进行防护的示意图如图,其中M、N为电源两极,下列有关说法正确的是( )
A.N应为电源负极
B.电子从钢闸门流向M极
C.该装置原理符合原电池原理
D.水体中的阴离子向石墨极迁移
6.设NA为阿伏加德罗常数的值。下列关于常温下pH=2的HOOCCOOH溶液说法正确的是( )
A.加水稀释,溶液的pH减小
B.溶液中含H+数目为0.01NA
C.c(H+)=c(HC2O4﹣)+2c(C2O42﹣)+c(OH﹣)
D.由水电离出的c(H+)=10﹣2mol/L
7.下列有关从海带中提取碘的实验原理或装置不能达到实验目的的是( )
A.灼烧碎海带
B.过滤海带灰的浸泡液
C.制备氧化I﹣的Cl2
D.吸收Cl2尾气
8.已知CuCl2溶液中[Cu(H2O)42+](蓝色)(aq)+4Cl﹣(aq)?[CuCl4]2﹣(黄色)(aq)+4H2O(l)△H>0。下列叙述不正确的是( )
A.加热CuCl2溶液,溶液颜色由蓝变黄
B.稀释CuCl2溶液,溶液颜色由蓝变黄
C.[Cu(H2O)4]2+中提供孤电子对的成键原子为O原子
D.[CuCl4]2﹣中Cu2+与Cl﹣之间形成的化学键为配位键
9.N2O和CO可在催化剂M的表面发生反应:N2O(g)+CO(g)═CO2(g)+N2(g)△H,转化为无害气体,其能量变化过程如图所示,下列说法正确的是( )
A.该反应的△H=﹣226kJ?mol﹣1
B.正反应的活化能大于逆反应的活化能
C.为了实现该反应的持续转化,需不断向反应器中补充催化剂M
D.催化剂M在反应过程中,改变了反应焓变,但不能改变反应限度
10.对比观察表数据,从中获得的有关结论不正确的是( )
25℃几种酸的Ka
不同温度下CH3COOH的Ka
HF
6.3×10﹣4
0℃
1.66×10﹣5
HClO
4.0×10﹣8
10℃
1.73×10﹣5
HCN
6.2×10﹣10
25℃
1.75×10﹣5
A.表中的酸都是弱酸
B.相同温度下不同弱酸的Ka不同
C.电离常数Ka与温度有关,但Ka随温度的变化不大
D.推测常温下可发生反应:NaClO+HCN═NaCN+HClO
11.已知25℃下,Ksp[Mg(OH)2]=1.8×10﹣11、Ksp[Fe(OH)3]=4.0×10﹣38,按如图所示进行实验,甲、乙两试管中溶液分别充分反应后,下列有关叙述不正确的是( )
A.甲试管溶液中有沉淀生成
B.乙试管溶液中无沉淀生成
C.乙中发生反应为Mg2++2OH﹣═Mg(OH)2↓
D.再向甲中滴入4滴0.1mol/L
FeCl3溶液会观察到白色沉淀转化为红褐色沉淀
12.将1mL
0.1mol/L
FeCl3溶液与5mL
0.1mol/L
KI溶液的混合液X,充分振荡,再向其中滴加3mL
CCl4进行萃取、分液,然后向水溶液中滴加KSCN溶液,溶液变为红色。下列说法不正确的是( )
A.该反应为可逆反应
B.该反应的平衡常数K=
C.加入少量铁粉,振荡,反应平衡常数减小
D.向混合液X中滴加CCl4,振荡,反应平衡正向移动
二、解答题(共4小题,满分64分)
13.硫及其化合物之间的转化具有重要意义。请按要求回答下列问题。
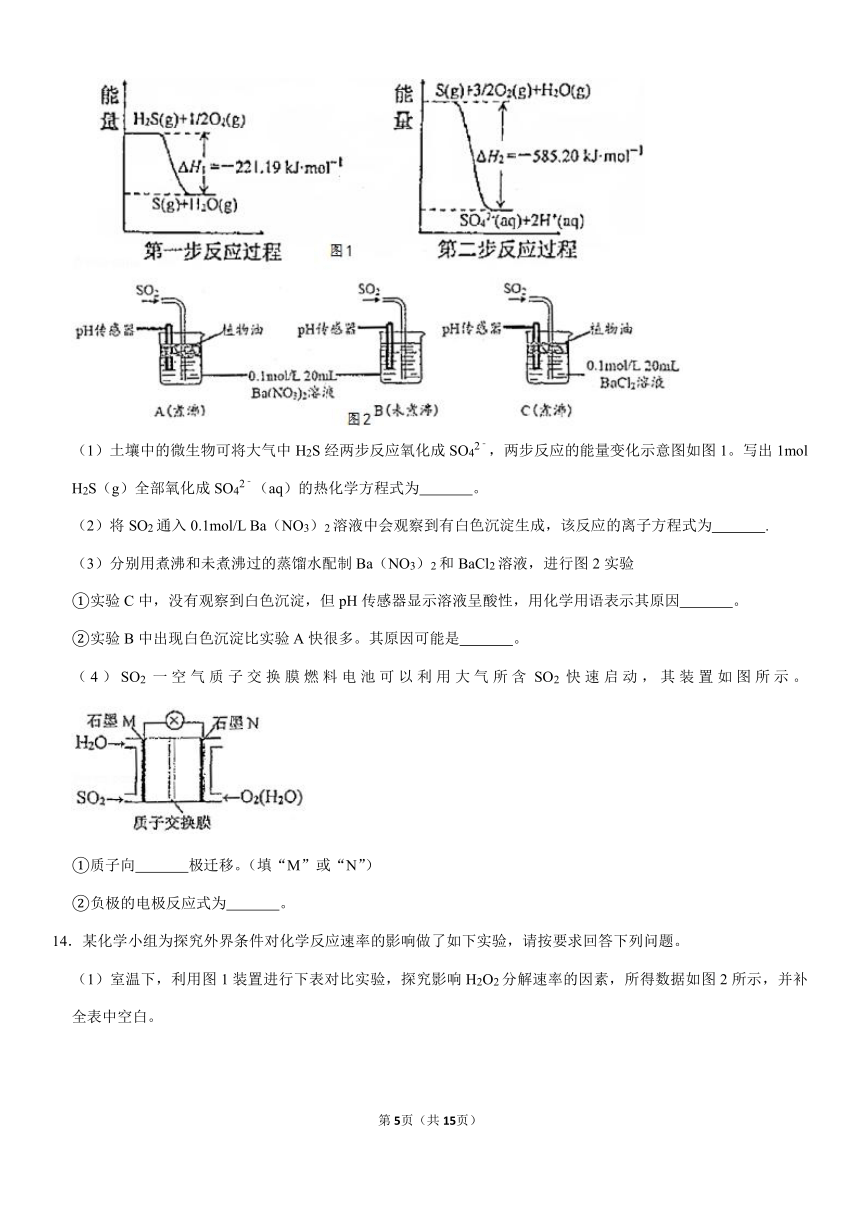
(1)土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣,两步反应的能量变化示意图如图1。写出1mol
H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为
。
(2)将SO2通入0.1mol/L
Ba(NO3)2溶液中会观察到有白色沉淀生成,该反应的离子方程式为
.
(3)分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行图2实验
①实验C中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,用化学用语表示其原因
。
②实验B中出现白色沉淀比实验A快很多。其原因可能是
。
(4)SO2一空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置如图所示。
①质子向
极迁移。(填“M”或“N”)
②负极的电极反应式为
。
14.某化学小组为探究外界条件对化学反应速率的影响做了如下实验,请按要求回答下列问题。
(1)室温下,利用图1装置进行下表对比实验,探究影响H2O2分解速率的因素,所得数据如图2所示,并补全表中空白。
实验
所用试剂
Ⅰ
1mL
H2O
①
Ⅱ
Fe2O3
10mL
5%
H2O2溶液
Ⅲ
MnO2
10mL
5%
H2O2溶液
Ⅳ
1mL
20%
NaOH溶液
9mL
5%
H2O2溶液
②实验Ⅱ、Ⅲ对比得出的结论是
。
③实验Ⅰ、Ⅳ对比得出的结论是
。
(2)探究影响Na2S2O3溶液与稀硫酸反应速率的因素
实验
温度
Na2S2O3(aq)
H2SO4(aq)
加入水的体积
出现沉淀所需时间
体积
浓度
体积
浓度
Ⅰ
0℃
5mL
0.1mol/L
10mL
0.1mol/L
5mL
8s
Ⅱ
0℃
5mL
0.1mol/L
5mL
0.1mol/L
XmL
12s
Ⅲ
30℃
5mL
0.1mol/L
5mL
0.1mol/L
10mL
4s
①本组实验原理的离子方程式:
。
②实验Ⅰ、Ⅱ对比控制的变量是
。
③实验Ⅲ的目的是
。
(3)在25℃时,实验测得溶液中的反应:2HI+H2O2═2H2O+I2在反应物浓度不同时的反应速率数据如表。由表中数据得到的结论是
。
实验编号
1
2
3
4
5
c(HI)/(mol?L﹣1)
0.100
0.200
0.300
0.100
0.100
c(H2O2)/(mol?L﹣1)
0.100
0.100
0.100
0.200
0.300
v/(mol?L﹣1?s﹣1)
0.0076
0.0153
0.0227
0.0152
0.0228
15.(22分)氮元素及其化合物在工农业生产中有重要应用。请按要求回答下列问题。
(1)基态N原子的电子排布式为:
。N2中有
个是π键。NH3是含有
(填“极性”或“非极性”)键的
(与上同)分子,其中心原子的杂化类型:
;其分子的VSEPR模型为
形,分子的空间结构为
形,其晶体类型为
。
(2)以N2为起点,分别以NH4+、NO3﹣为终点,在如下价、类二维图中用“→”和途经中间产物的化学式,画出两种人工合成氮肥的物质转化方案,实现“向空气要氮肥”的目标:
(3)请结合如表数据从反应方向和限度两个视角分析在298K(即25℃)下工业生产氮肥选择合成氨反应的原因(已知:△G=△H﹣T△S<0时反应自发)。
工业生产氮肥设想
K(平衡常数的值)
△H/kJ?mol﹣1
△S/kJ?mol﹣1?K﹣1
N2(g)+3H2(g)?2NH3(g)
4.1×106
﹣92.4
﹣0.20
原因:
。
(4)依据合成氨反应速率v=kc(N2)×c1.5(H2)×c﹣1(NH3)(k为常数),可得知提高该化学反应速率的措施有
、
。
(5)工业合成氨厂的含氮废水进行合理处理,可减弱其造成的环境污染。
①采用提高溶液pH的方法处理含高浓度NH4+废水,其依据的反应原理是
。(用离子方程式表示)
②采用次氯酸钠溶液氧化法处理含低浓度NH4+废水(已知pH≈8时去除率最高)其反应原理为
。(用离子方程式表示)
③采用增大c(Mg2+)、c(PO43﹣)的方法回收低浓度NH4+。已知常温下,MgNH4PO4的Ksp=2.5×10﹣13,写出沉淀反应的离子方程式:
。
16.水杨酸()有刺激性,存在于自然界的柳树皮,可用于阿司匹林()等药物的制备。请按要求回答下列问题。
(1)水杨酸所含官能团的名称:
。水杨酸的羧基中碳原子的杂化类型为
。
(2)已知为改造水杨酸的刺激性,可将其转化为阿司匹林,写出该转化反应的化学方程式:
。
(3)水杨酸的同分异构体有多种。
①请写出符合下列条件的同分异构体M的结构简式:
。
a.与水杨酸含有相同官能团
b.苯环上有两种环境的H原子
②已知:ⅰ.M和水杨酸的沸点相差很大
ⅱ.常温下:的Ka=10﹣10;的Ka=10﹣5
由上述已知信息,你可获得的结论或解释:
其一,M的沸点比水杨酸的
,其原因是
。
其二,
。(不写原因)
2020-2021学年天津市河西区高三(上)期末化学试卷
试题解析
一、选择题(共12小题,每小题3分,满分36分)
1.解:A.氧化铝属于离子化合物,熔融状态可以导电,可用于电解冶炼铝,与氧化铝具有两性无关,故A错误;
B.NH4HCO3中含有氮元素,可用作化肥,与其受热分解无关,故B错误;
C.SiO2既不溶于水,也不能与水反应,故C错误;
D.Na2O2能和H2O或CO2反应生成氧气,所以可用作呼吸面具的供氧剂,故D正确;
故选:D。
2.解:A.硫酸铜溶液中滴加足量浓氨水,二者反应先生成氢氧化铜沉淀,然后氢氧化铜和氨水反应生成铜氨络合物,离子方程式为:Cu2++4NH3?H2O═[Cu(NH3)4]2++4H2O,故A错误;
B.氯气与水反应,离子方程式为:Cl2+H2O?H++Cl﹣+HClO,故B错误;
C.钠放入水中,离子方程式为:2Na+2H2O=2Na++2OH﹣+H2↑,故C正确;
D.铝与碱反应生成偏铝酸钠和氢气,化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,故D错误;
故选:C。
3.解:A.硒(Se)与氧同主族,与钙同周期,即Se处于第四周期第VIA族,在过渡元素之后,同主族相邻元素原子序数相差周期数大的周期容纳元素种数,故Se的原子数为8+8+18=34,故A正确;
B.H2Se与H2O的结构相似,空间构型为V形,则H2Se键角小于180°,故B错误;
C.H2Se属于共价化合物,只含有共价键,而CaH2属于离子化合物,由钙离子与氢负离子构成,只含有离子键,故C错误;
D.同主族自上而下非金属性减弱,非金属性Se<S,元素的非金属性越强,其氢化物越稳定,H2Se的稳定性小于H2S的,故D错误;
故选:A。
4.解:A.四氧化二氮(N2O4)与偏二甲肼()反应的方程式为C2H8N2+2N2O4═3N2+2CO2+4H2O,xg四氧化二氮不一定是1mol,所以△H不一定等于﹣qkJ?mol﹣1,故A错误;
B.中含有6个C﹣H键、2个C﹣N键、1个N﹣N键,2个N﹣H键,一共11个共价单键,则每个偏二甲肼分子含11个σ键,故B正确;
C.N元素的化合价降低,得电子,所以四氧化二氮是氧化剂,故C错误;
D.在常温常压环境中,四氧化二氮会转化为二氧化氮,二氧化氮是红棕色气体,故D错误。
故选:B。
5.解:A.该装置为电解池,Fe作阴极被保护,M为负极,则N为正极,故A错误;
B.电解池中电子由阳极经外电路到阴极,即从石墨电极到N极,故B错误;
C.该装置为电解池装置,故C错误;
D.电解池中阴离子向阳极移动,所以水体中的阴离子向石墨极迁移,故D正确;
故选:D。
6.解:A.加水稀释,乙二酸的电离被促进,电离出的氢离子的物质的量增多,但浓度减小,故溶液的pH增大,故A错误;
B.溶液体积不明确,故溶液中氢离子的个数无法计算,故B错误;
C.溶液显电中性,故根据电荷守恒可知c(H+)=c(HC2O4﹣)+2c(C2O42﹣)+c(OH﹣),故C正确;
D.在酸溶液中,氢离子绝大部分来自酸的电离,故此溶液中c(H+)=10﹣2mol/L几乎全部来自酸的电离,水电离出的氢离子浓度c(H+)水等于溶液中c(OH﹣),即为10﹣12mol/L,故D错误。
故选:C。
7.解:A.灼烧在坩埚中进行,图中操作合理,故A正确;
B.过滤需要烧杯、漏斗、玻璃棒,图中过滤装置合理,故B正确;
C.浓盐酸与二氧化锰反应需要加热,图中缺少酒精灯,故C错误;
D.氯气与NaOH溶液反应,图中装置可吸收尾气,故D正确;
故选:C。
8.解:A.[Cu(H2O)42+](蓝色)(aq)+4Cl﹣(aq)?[CuCl4]2﹣(黄色)(aq)+4H2O(l)△H>0,正反应为吸热反应,加热CuCl2溶液,平衡正向移动,溶液颜色由蓝变黄,故A正确;
B.加水稀释CuCl2溶液,[Cu(H2O)42+](蓝色)(aq)+4Cl﹣(aq)?[CuCl4]2﹣(黄色)(aq)+4H2O(l)△H>0,平衡逆向移动,溶液颜色由黄变蓝,故B错误;
C.[Cu(H2O)4]2+离子中,Cu2+给出空轨道,H2O提供孤对电子,提供孤电子对的成键原子为O原子,故C正确;
D.[CuCl4]2﹣中Cu2+给出空轨道,Cl﹣提供孤对电子,二者形成的化学键为配位键,故D正确;
故选:B。
9.解:A.N2O(g)+CO(g)═CO2(g)+N2(g)的△H=Ea﹣Eb=134kJ/mol﹣360kJ/mol=﹣226kJ/mol,故A正确;
B.Ea、Eb分别是正反应的活化能和逆反应的活化能,Ea=134kJ/mol、Eb=360kJ/mol,故B错误;
C.催化剂M参与反应的历程,但不参与总反应,所以不需要不断向反应器中补充,故C错误;
D.催化剂只能加快反应速率,不能改变反应的始态和终态,也不能改变反应的平衡状态,即不能改变反应的反应热和反应限度,故D错误;
故选:A。
10.解:A.部分电离的酸为弱酸,根据表中数据知,这几种酸电离平衡常数都较小,说明都部分电离,为弱酸,故A正确;
B.根据表中数据知,25℃时HF、HClO和HCN电离平衡常数不同,所以相同温度下不同弱酸的Ka不同,故B正确;
C.根据表中数据知,温度不同时醋酸电离平衡常数不同,但其电离平衡常数相差较小,所以Ka随温度的变化不大,故C正确;
D.弱酸电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸,根据表中数据知,相同温度下酸性:HF>HClO>HCN,所以常温下可发生反应:NaClO、HCN不反应,故D错误;
故选:D。
11.解:A.甲中两溶液混合瞬间:c(OH﹣)=c(Mg2+)=mol/L=0.1mol/L,浓度积Qc[Mg(OH)2]=c2(OH﹣)?c(Mg2+)=0.1×(0.1)2=0.001>1.8×10﹣11=Ksp[Mg(OH)2],所以甲中有沉淀生成,故A正确;
B.pH=9的NaOH溶液中c(OH﹣)=10﹣5mol/L,乙中两溶液混合瞬间:c(OH﹣)=mol/L=5×10﹣6mol/L,c(Mg2+)=mol/L=0.1mol/L,浓度积Qc[Mg(OH)2]=c2(OH﹣)?c(Mg2+)=0.1×(5×10﹣6)2=2.5×10﹣12<1.8×10﹣11=Ksp[Mg(OH)2],则乙中无沉淀生成,故B正确;
C.由选项B分析可知,乙中无沉淀生成,即乙不能发生反应:Mg2++2OH﹣═Mg(OH)2↓,故C错误;
D.甲中有沉淀,混合瞬间c(OH﹣)=c(Mg2+)=0.1mol/L,Mg2++2OH﹣═Mg(OH)2,则Mg2+过量、溶液中c(Mg2+)=0.1mol/L×=0.05mol/L,溶液中c(OH﹣)==mol/L≈1.9×10﹣5mol/L,4滴0.1mol/L
FeCl3溶液的体积大约为0.2mL,加入4滴FeCl3溶液的瞬间c(OH﹣)≈1.9×10﹣5mol/L,c(Fe3+)=mol/L≈0.009mol/L,Qc[Fe(OH)3]=c3(OH﹣)?c(Fe3+)=(1.9×10﹣5)3×0.009mol/L≈6.2×10﹣17>4.0×10﹣38=Ksp[Fe(OH)3],所以有沉淀生成,故D正确;
故选:C。
12.解:A.FeCl3溶液不足,向反应后的溶液中加入KSCN溶液,溶液呈血红色,说明反应后的溶液中含有Fe3+,则说明该反应为可逆反应,离子反应方程式为2Fe3++2I﹣?I2+2Fe2+,故A正确;
B.化学平衡常数K=,故B正确;
C.反应平衡常数只与温度有关,加入少量铁粉,Fe和Fe3+反应生成Fe2+而导致平衡逆向移动,但温度不变,化学平衡常数不变,故C错误;
D.I2易溶于CCl4而难溶于水导致水溶液中c(I2)减小,平衡正向移动,故D正确;
故选:C。
二、解答题(共4小题,满分64分)
13.解:(2)由图可知,第一步热化学反应为:H2S(g)+0.5O2(g)=S(s)+H2O(g)△H=﹣221.19
kJ?mol﹣1;
第二步反应为:S(s)+1.5O2(g)+H2O(g)=2H+(aq)+SO42﹣(aq))△H=﹣585.20
kJ?mol﹣1;
依据盖斯定律,第一步与第二步方程式相加得:H2S(g)+2O2(g)=SO42﹣(aq)+2H+(aq)△H=﹣806.39
kJ?mol﹣1;
故答案为:H2S(g)+2O2(g)=SO42﹣(aq)+2H+(aq)△H=﹣806.39
kJ?mol﹣1;
(2)二氧化硫溶液呈酸性,酸性条件下,硝酸根离子可氧化二氧化硫生成硫酸根离子,则生成沉淀为硫酸钡沉淀,反应的离子方程式:3Ba2++3SO2+2NO3﹣+2H2O=3BaSO4↓+2NO↑+4H+,
故答案为:3Ba2++3SO2+2NO3﹣+2H2O=3BaSO4↓+2NO↑+4H+;
(3)①二氧化硫与水反应生成亚硫酸,亚硫酸溶液呈酸性,涉及反应为SO2+H2O?H2SO3,H2SO3?H++HSO3﹣,
故答案为:SO2+H2O?H2SO3,H2SO3?H++HSO3﹣;
②实验B中出现白色沉淀比实验A快很多,B中有氧气参与反应,在水溶液中O2
氧化SO2
的速率比NO3﹣快,则速率较快,生成更多的硫酸,
故答案为:在水溶液中O2
氧化SO2
的速率比NO3﹣快;
(4)①二氧化硫发生氧化反应,氧气发生还原反应,所以二氧化硫所在电极为负极,氧气所在电极为正极,原电池中阳离子移向正极,所以质子移动方向为:从M到N;
故答案为:N;
②二氧化硫在负极失去电子发生氧化反应,电极反应式为:SO2﹣2e﹣+2H2O═SO42﹣+4H+;
故答案为:SO2﹣2e﹣+2H2O═SO42﹣+4H+。
14.解:(1)①根据实验I与Ⅱ或Ⅲ的数据对比可知,反应的总溶液体积为10mL,所以实验I中5%H2O2溶液的体积为10mL﹣1mL=9mL,
故答案为:9mL
5%H2O2溶液;
②根据表中实验Ⅱ与Ⅲ的数据和图2可知,相同时间内,实验Ⅲ的反应速率较快,MnO2的催化效果好,催化效率高,
故答案为:MnO2比Fe2O3催化H2O2分解效率高;
③实验Ⅰ、Ⅳ的目的是研究溶液的酸碱性对反应速率的影响,由图2可知,实验IV的反应速率远大于I,二者反应条件不同:实验IV在碱性条件下进行,即碱性条件下H2O2分解速率更快,
故答案为:碱性环境有利于H2O2分解速率更快;
(2)①Na2S2O3与稀硫酸反应生成Na2SO4、SO2、S和H2O,离子方程式为S2O32﹣+2H+═S↓+SO2↑+H2O,
故答案为:S2O32﹣+2H+═S↓+SO2↑+H2O;
②对比实验Ⅰ、Ⅱ可知:反应温度相同、Na2S2O3的浓度相同,溶液总体积均为20mL,仅仅是加入H2SO4体积不同,即硫酸浓度不同,
故答案为:硫酸的浓度;
③实验Ⅱ、Ⅲ的变量是温度,所以实验Ⅲ的目的是探究温度对该反应速率的影响,
故答案为:探究温度对该反应速率的影响;
(3)实验1、2、3是探究c(HI)对反应速率的影响,实验1、4、5是探究c(H2O2)对反应速率的影响,由表中数据可知,c(HI)增大一倍,总反应速率约增大一倍,c(H2O2)增大一倍,总反应速率约增大一倍,即总反应速率与c(H2O2)、c(HI)是线性正比例关系,
故答案为:25℃下,反应速率v分别与c(HI)、c(H2O2)成正比。
15.解:(1)N在周期表中位于第2周期第ⅤA族,原子核外电子数7,电子排布式为:1s22s22p3,N2中含氮氮三键,其中有2个是π键,一个是σ,NH3有1对孤对电子和3个σ键,VSEPR模型为四面体,空间构型为三角锥型,形成的晶体类型为分子晶体,N原子采取sp3杂化,是含极性共价键的极性分子,
故答案为:1s22s22p3;2;极性;极性;sp3;四面体;三角锥;分子晶体;
(2)实现“向空气要氮肥”的目标,可以是氮气在空气中放电生成NO,NO被氧化生成NO2,NO2溶于水生成硝酸和一氧化氮,硝酸和碱反应生成硝酸盐,氮气也可以和氢气高温高压催化剂条件下合成氨,氨气和酸反应生成铵盐,画出两种人工合成氮肥的物质转化方案为:,
故答案为:;
(3)如表数据从反应方向和限度两个视角分析在298K(即25℃)下工业生产氮肥选择合成氨反应的原因:合成氨反应的△G=﹣92.2kJ/mol+298K×0.20kJ/(mol?K)<0,故298K下反应能自发进行;K=4.1×106>105,故298K时反应达到平衡时进行很完全,
故答案为:合成氨反应的△G=﹣92.2kJ/mol+298K×0.20kJ/(mol?K)<0,故298K下反应能自发进行;K=4.1×106>105,故298K时反应达到平衡时进行很完全;
(4)公式知,反应物浓度与反应速率成正比,则增大反应物浓度能提高合成氨的反应速率,产物浓度与反应速率成反比,所以减小产物浓度能加快化学反应速率,
故答案为:增大原料气的浓度;分离出氨气;
(5)①采用提高溶液pH的方法处理含高浓度NH4+废水,其依据的反应原理是:NH4++OH﹣=NH3?H2O,
故答案为:NH4++OH﹣=NH3?H2O;
②采用次氯酸钠溶液氧化法处理含低浓度NH4+废水(已知pH≈8时去除率最高),反应生成氮气,其反应原理为:2NH4++3ClO﹣+2OH﹣=N2↑+5H2O+3Cl﹣,
故答案为:2NH4++3ClO﹣+2OH﹣=N2↑+5H2O+3Cl﹣;
③已知常温下,MgNH4PO4的Ksp=2.5×10﹣13,是发生沉淀反应生成MgNH4PO4,采用增大c(Mg2+)、c(PO43﹣)的方法回收低浓度NH4+,反应的离子方程式:NH4++Mg2++PO43﹣=MgNH4PO4↓,
故答案为:NH4++Mg2++PO43﹣=MgNH4PO4↓。
16.解:(1)水杨酸含﹣COOH、﹣OH,名称为羧基、羟基,水杨酸的羧基中碳原子不含孤对电子,形成1个C﹣C键、1个C﹣O、1个C=O键,则C原子为sp2杂化,
故答案为:羧基、羟基;sp2杂化;
(2)由信息可知,水杨酸与乙酸酐发生转化反应,则转化方程式为,
故答案为:;
(3)①符合a.与水杨酸含有相同官能团,含﹣OH、﹣COOH;
b.苯环上有两种环境的H原子,则苯环上﹣OH、﹣COOH位于对位,则同分异构体M的结构简式为,
故答案为:;
②由信息中沸点可知其一,M的沸点比水杨酸的高,其原因是M分子间能形成氢键,而水杨酸分子可形成分子内氢键;
由信息中电离平衡常数及酸性可知其二,杨酸羧基中羟基上的H原子比酚羟基上的H原子更容易电离出H+,
故答案为:高;M分子间能形成氢键,而水杨酸分子可形成分子内氢键;。
第1页(共1页)
一、选择题(共12小题,每小题3分,满分36分)
1.下列有关物质的性质与用途的因果关系正确的是( )
A.Al2O3具有两性,可用于电解冶炼铝
B.NH4HCO3受热易分解,可用作化肥
C.SiO2具有酸性氧化物的通性,可溶于水制取硅胶
D.Na2O2能和H2O或CO2反应,可用作呼吸面具的供氧剂
2.下列离子方程式书写正确的是( )
A.硫酸铜溶液中滴加氨水:Cu2++2OH﹣═Cu(OH)2↓
B.氯气与水反应:Cl2+H2O═Cl﹣+ClO﹣+2H+
C.钠放入水中:2Na+2H2O═2Na++2OH﹣+H2↑
D.铝和NaOH溶液反应:Al+2OH﹣═AlO2﹣+H2↑
3.被誉为“生命的奇效元素”硒(Se)与氧同主族,与钙同周期。下列说法正确的是( )
A.Se的原子序数是34
B.H2Se键角为180°
C.H2Se与CaH2都含共价键
D.H2Se的稳定性大于H2S的
4.长征运载火箭常规推进剂xg四氧化二氮(N2O4)与yg偏二甲肼()完全反应放热为qkJ。下列有关说法一定正确的是( )
A.偏二甲肼的燃烧热△H=﹣qkJ?mol﹣1
B.每个偏二甲肼分子含11个σ键
C.四氧化二氮在反应中作还原剂
D.该推进剂泄露在常温常压环境中为无色气体
5.应用电化学原理对钢闸门进行防护的示意图如图,其中M、N为电源两极,下列有关说法正确的是( )
A.N应为电源负极
B.电子从钢闸门流向M极
C.该装置原理符合原电池原理
D.水体中的阴离子向石墨极迁移
6.设NA为阿伏加德罗常数的值。下列关于常温下pH=2的HOOCCOOH溶液说法正确的是( )
A.加水稀释,溶液的pH减小
B.溶液中含H+数目为0.01NA
C.c(H+)=c(HC2O4﹣)+2c(C2O42﹣)+c(OH﹣)
D.由水电离出的c(H+)=10﹣2mol/L
7.下列有关从海带中提取碘的实验原理或装置不能达到实验目的的是( )
A.灼烧碎海带
B.过滤海带灰的浸泡液
C.制备氧化I﹣的Cl2
D.吸收Cl2尾气
8.已知CuCl2溶液中[Cu(H2O)42+](蓝色)(aq)+4Cl﹣(aq)?[CuCl4]2﹣(黄色)(aq)+4H2O(l)△H>0。下列叙述不正确的是( )
A.加热CuCl2溶液,溶液颜色由蓝变黄
B.稀释CuCl2溶液,溶液颜色由蓝变黄
C.[Cu(H2O)4]2+中提供孤电子对的成键原子为O原子
D.[CuCl4]2﹣中Cu2+与Cl﹣之间形成的化学键为配位键
9.N2O和CO可在催化剂M的表面发生反应:N2O(g)+CO(g)═CO2(g)+N2(g)△H,转化为无害气体,其能量变化过程如图所示,下列说法正确的是( )
A.该反应的△H=﹣226kJ?mol﹣1
B.正反应的活化能大于逆反应的活化能
C.为了实现该反应的持续转化,需不断向反应器中补充催化剂M
D.催化剂M在反应过程中,改变了反应焓变,但不能改变反应限度
10.对比观察表数据,从中获得的有关结论不正确的是( )
25℃几种酸的Ka
不同温度下CH3COOH的Ka
HF
6.3×10﹣4
0℃
1.66×10﹣5
HClO
4.0×10﹣8
10℃
1.73×10﹣5
HCN
6.2×10﹣10
25℃
1.75×10﹣5
A.表中的酸都是弱酸
B.相同温度下不同弱酸的Ka不同
C.电离常数Ka与温度有关,但Ka随温度的变化不大
D.推测常温下可发生反应:NaClO+HCN═NaCN+HClO
11.已知25℃下,Ksp[Mg(OH)2]=1.8×10﹣11、Ksp[Fe(OH)3]=4.0×10﹣38,按如图所示进行实验,甲、乙两试管中溶液分别充分反应后,下列有关叙述不正确的是( )
A.甲试管溶液中有沉淀生成
B.乙试管溶液中无沉淀生成
C.乙中发生反应为Mg2++2OH﹣═Mg(OH)2↓
D.再向甲中滴入4滴0.1mol/L
FeCl3溶液会观察到白色沉淀转化为红褐色沉淀
12.将1mL
0.1mol/L
FeCl3溶液与5mL
0.1mol/L
KI溶液的混合液X,充分振荡,再向其中滴加3mL
CCl4进行萃取、分液,然后向水溶液中滴加KSCN溶液,溶液变为红色。下列说法不正确的是( )
A.该反应为可逆反应
B.该反应的平衡常数K=
C.加入少量铁粉,振荡,反应平衡常数减小
D.向混合液X中滴加CCl4,振荡,反应平衡正向移动
二、解答题(共4小题,满分64分)
13.硫及其化合物之间的转化具有重要意义。请按要求回答下列问题。
(1)土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣,两步反应的能量变化示意图如图1。写出1mol
H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为
。
(2)将SO2通入0.1mol/L
Ba(NO3)2溶液中会观察到有白色沉淀生成,该反应的离子方程式为
.
(3)分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行图2实验
①实验C中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,用化学用语表示其原因
。
②实验B中出现白色沉淀比实验A快很多。其原因可能是
。
(4)SO2一空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置如图所示。
①质子向
极迁移。(填“M”或“N”)
②负极的电极反应式为
。
14.某化学小组为探究外界条件对化学反应速率的影响做了如下实验,请按要求回答下列问题。
(1)室温下,利用图1装置进行下表对比实验,探究影响H2O2分解速率的因素,所得数据如图2所示,并补全表中空白。
实验
所用试剂
Ⅰ
1mL
H2O
①
Ⅱ
Fe2O3
10mL
5%
H2O2溶液
Ⅲ
MnO2
10mL
5%
H2O2溶液
Ⅳ
1mL
20%
NaOH溶液
9mL
5%
H2O2溶液
②实验Ⅱ、Ⅲ对比得出的结论是
。
③实验Ⅰ、Ⅳ对比得出的结论是
。
(2)探究影响Na2S2O3溶液与稀硫酸反应速率的因素
实验
温度
Na2S2O3(aq)
H2SO4(aq)
加入水的体积
出现沉淀所需时间
体积
浓度
体积
浓度
Ⅰ
0℃
5mL
0.1mol/L
10mL
0.1mol/L
5mL
8s
Ⅱ
0℃
5mL
0.1mol/L
5mL
0.1mol/L
XmL
12s
Ⅲ
30℃
5mL
0.1mol/L
5mL
0.1mol/L
10mL
4s
①本组实验原理的离子方程式:
。
②实验Ⅰ、Ⅱ对比控制的变量是
。
③实验Ⅲ的目的是
。
(3)在25℃时,实验测得溶液中的反应:2HI+H2O2═2H2O+I2在反应物浓度不同时的反应速率数据如表。由表中数据得到的结论是
。
实验编号
1
2
3
4
5
c(HI)/(mol?L﹣1)
0.100
0.200
0.300
0.100
0.100
c(H2O2)/(mol?L﹣1)
0.100
0.100
0.100
0.200
0.300
v/(mol?L﹣1?s﹣1)
0.0076
0.0153
0.0227
0.0152
0.0228
15.(22分)氮元素及其化合物在工农业生产中有重要应用。请按要求回答下列问题。
(1)基态N原子的电子排布式为:
。N2中有
个是π键。NH3是含有
(填“极性”或“非极性”)键的
(与上同)分子,其中心原子的杂化类型:
;其分子的VSEPR模型为
形,分子的空间结构为
形,其晶体类型为
。
(2)以N2为起点,分别以NH4+、NO3﹣为终点,在如下价、类二维图中用“→”和途经中间产物的化学式,画出两种人工合成氮肥的物质转化方案,实现“向空气要氮肥”的目标:
(3)请结合如表数据从反应方向和限度两个视角分析在298K(即25℃)下工业生产氮肥选择合成氨反应的原因(已知:△G=△H﹣T△S<0时反应自发)。
工业生产氮肥设想
K(平衡常数的值)
△H/kJ?mol﹣1
△S/kJ?mol﹣1?K﹣1
N2(g)+3H2(g)?2NH3(g)
4.1×106
﹣92.4
﹣0.20
原因:
。
(4)依据合成氨反应速率v=kc(N2)×c1.5(H2)×c﹣1(NH3)(k为常数),可得知提高该化学反应速率的措施有
、
。
(5)工业合成氨厂的含氮废水进行合理处理,可减弱其造成的环境污染。
①采用提高溶液pH的方法处理含高浓度NH4+废水,其依据的反应原理是
。(用离子方程式表示)
②采用次氯酸钠溶液氧化法处理含低浓度NH4+废水(已知pH≈8时去除率最高)其反应原理为
。(用离子方程式表示)
③采用增大c(Mg2+)、c(PO43﹣)的方法回收低浓度NH4+。已知常温下,MgNH4PO4的Ksp=2.5×10﹣13,写出沉淀反应的离子方程式:
。
16.水杨酸()有刺激性,存在于自然界的柳树皮,可用于阿司匹林()等药物的制备。请按要求回答下列问题。
(1)水杨酸所含官能团的名称:
。水杨酸的羧基中碳原子的杂化类型为
。
(2)已知为改造水杨酸的刺激性,可将其转化为阿司匹林,写出该转化反应的化学方程式:
。
(3)水杨酸的同分异构体有多种。
①请写出符合下列条件的同分异构体M的结构简式:
。
a.与水杨酸含有相同官能团
b.苯环上有两种环境的H原子
②已知:ⅰ.M和水杨酸的沸点相差很大
ⅱ.常温下:的Ka=10﹣10;的Ka=10﹣5
由上述已知信息,你可获得的结论或解释:
其一,M的沸点比水杨酸的
,其原因是
。
其二,
。(不写原因)
2020-2021学年天津市河西区高三(上)期末化学试卷
试题解析
一、选择题(共12小题,每小题3分,满分36分)
1.解:A.氧化铝属于离子化合物,熔融状态可以导电,可用于电解冶炼铝,与氧化铝具有两性无关,故A错误;
B.NH4HCO3中含有氮元素,可用作化肥,与其受热分解无关,故B错误;
C.SiO2既不溶于水,也不能与水反应,故C错误;
D.Na2O2能和H2O或CO2反应生成氧气,所以可用作呼吸面具的供氧剂,故D正确;
故选:D。
2.解:A.硫酸铜溶液中滴加足量浓氨水,二者反应先生成氢氧化铜沉淀,然后氢氧化铜和氨水反应生成铜氨络合物,离子方程式为:Cu2++4NH3?H2O═[Cu(NH3)4]2++4H2O,故A错误;
B.氯气与水反应,离子方程式为:Cl2+H2O?H++Cl﹣+HClO,故B错误;
C.钠放入水中,离子方程式为:2Na+2H2O=2Na++2OH﹣+H2↑,故C正确;
D.铝与碱反应生成偏铝酸钠和氢气,化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,故D错误;
故选:C。
3.解:A.硒(Se)与氧同主族,与钙同周期,即Se处于第四周期第VIA族,在过渡元素之后,同主族相邻元素原子序数相差周期数大的周期容纳元素种数,故Se的原子数为8+8+18=34,故A正确;
B.H2Se与H2O的结构相似,空间构型为V形,则H2Se键角小于180°,故B错误;
C.H2Se属于共价化合物,只含有共价键,而CaH2属于离子化合物,由钙离子与氢负离子构成,只含有离子键,故C错误;
D.同主族自上而下非金属性减弱,非金属性Se<S,元素的非金属性越强,其氢化物越稳定,H2Se的稳定性小于H2S的,故D错误;
故选:A。
4.解:A.四氧化二氮(N2O4)与偏二甲肼()反应的方程式为C2H8N2+2N2O4═3N2+2CO2+4H2O,xg四氧化二氮不一定是1mol,所以△H不一定等于﹣qkJ?mol﹣1,故A错误;
B.中含有6个C﹣H键、2个C﹣N键、1个N﹣N键,2个N﹣H键,一共11个共价单键,则每个偏二甲肼分子含11个σ键,故B正确;
C.N元素的化合价降低,得电子,所以四氧化二氮是氧化剂,故C错误;
D.在常温常压环境中,四氧化二氮会转化为二氧化氮,二氧化氮是红棕色气体,故D错误。
故选:B。
5.解:A.该装置为电解池,Fe作阴极被保护,M为负极,则N为正极,故A错误;
B.电解池中电子由阳极经外电路到阴极,即从石墨电极到N极,故B错误;
C.该装置为电解池装置,故C错误;
D.电解池中阴离子向阳极移动,所以水体中的阴离子向石墨极迁移,故D正确;
故选:D。
6.解:A.加水稀释,乙二酸的电离被促进,电离出的氢离子的物质的量增多,但浓度减小,故溶液的pH增大,故A错误;
B.溶液体积不明确,故溶液中氢离子的个数无法计算,故B错误;
C.溶液显电中性,故根据电荷守恒可知c(H+)=c(HC2O4﹣)+2c(C2O42﹣)+c(OH﹣),故C正确;
D.在酸溶液中,氢离子绝大部分来自酸的电离,故此溶液中c(H+)=10﹣2mol/L几乎全部来自酸的电离,水电离出的氢离子浓度c(H+)水等于溶液中c(OH﹣),即为10﹣12mol/L,故D错误。
故选:C。
7.解:A.灼烧在坩埚中进行,图中操作合理,故A正确;
B.过滤需要烧杯、漏斗、玻璃棒,图中过滤装置合理,故B正确;
C.浓盐酸与二氧化锰反应需要加热,图中缺少酒精灯,故C错误;
D.氯气与NaOH溶液反应,图中装置可吸收尾气,故D正确;
故选:C。
8.解:A.[Cu(H2O)42+](蓝色)(aq)+4Cl﹣(aq)?[CuCl4]2﹣(黄色)(aq)+4H2O(l)△H>0,正反应为吸热反应,加热CuCl2溶液,平衡正向移动,溶液颜色由蓝变黄,故A正确;
B.加水稀释CuCl2溶液,[Cu(H2O)42+](蓝色)(aq)+4Cl﹣(aq)?[CuCl4]2﹣(黄色)(aq)+4H2O(l)△H>0,平衡逆向移动,溶液颜色由黄变蓝,故B错误;
C.[Cu(H2O)4]2+离子中,Cu2+给出空轨道,H2O提供孤对电子,提供孤电子对的成键原子为O原子,故C正确;
D.[CuCl4]2﹣中Cu2+给出空轨道,Cl﹣提供孤对电子,二者形成的化学键为配位键,故D正确;
故选:B。
9.解:A.N2O(g)+CO(g)═CO2(g)+N2(g)的△H=Ea﹣Eb=134kJ/mol﹣360kJ/mol=﹣226kJ/mol,故A正确;
B.Ea、Eb分别是正反应的活化能和逆反应的活化能,Ea=134kJ/mol、Eb=360kJ/mol,故B错误;
C.催化剂M参与反应的历程,但不参与总反应,所以不需要不断向反应器中补充,故C错误;
D.催化剂只能加快反应速率,不能改变反应的始态和终态,也不能改变反应的平衡状态,即不能改变反应的反应热和反应限度,故D错误;
故选:A。
10.解:A.部分电离的酸为弱酸,根据表中数据知,这几种酸电离平衡常数都较小,说明都部分电离,为弱酸,故A正确;
B.根据表中数据知,25℃时HF、HClO和HCN电离平衡常数不同,所以相同温度下不同弱酸的Ka不同,故B正确;
C.根据表中数据知,温度不同时醋酸电离平衡常数不同,但其电离平衡常数相差较小,所以Ka随温度的变化不大,故C正确;
D.弱酸电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸,根据表中数据知,相同温度下酸性:HF>HClO>HCN,所以常温下可发生反应:NaClO、HCN不反应,故D错误;
故选:D。
11.解:A.甲中两溶液混合瞬间:c(OH﹣)=c(Mg2+)=mol/L=0.1mol/L,浓度积Qc[Mg(OH)2]=c2(OH﹣)?c(Mg2+)=0.1×(0.1)2=0.001>1.8×10﹣11=Ksp[Mg(OH)2],所以甲中有沉淀生成,故A正确;
B.pH=9的NaOH溶液中c(OH﹣)=10﹣5mol/L,乙中两溶液混合瞬间:c(OH﹣)=mol/L=5×10﹣6mol/L,c(Mg2+)=mol/L=0.1mol/L,浓度积Qc[Mg(OH)2]=c2(OH﹣)?c(Mg2+)=0.1×(5×10﹣6)2=2.5×10﹣12<1.8×10﹣11=Ksp[Mg(OH)2],则乙中无沉淀生成,故B正确;
C.由选项B分析可知,乙中无沉淀生成,即乙不能发生反应:Mg2++2OH﹣═Mg(OH)2↓,故C错误;
D.甲中有沉淀,混合瞬间c(OH﹣)=c(Mg2+)=0.1mol/L,Mg2++2OH﹣═Mg(OH)2,则Mg2+过量、溶液中c(Mg2+)=0.1mol/L×=0.05mol/L,溶液中c(OH﹣)==mol/L≈1.9×10﹣5mol/L,4滴0.1mol/L
FeCl3溶液的体积大约为0.2mL,加入4滴FeCl3溶液的瞬间c(OH﹣)≈1.9×10﹣5mol/L,c(Fe3+)=mol/L≈0.009mol/L,Qc[Fe(OH)3]=c3(OH﹣)?c(Fe3+)=(1.9×10﹣5)3×0.009mol/L≈6.2×10﹣17>4.0×10﹣38=Ksp[Fe(OH)3],所以有沉淀生成,故D正确;
故选:C。
12.解:A.FeCl3溶液不足,向反应后的溶液中加入KSCN溶液,溶液呈血红色,说明反应后的溶液中含有Fe3+,则说明该反应为可逆反应,离子反应方程式为2Fe3++2I﹣?I2+2Fe2+,故A正确;
B.化学平衡常数K=,故B正确;
C.反应平衡常数只与温度有关,加入少量铁粉,Fe和Fe3+反应生成Fe2+而导致平衡逆向移动,但温度不变,化学平衡常数不变,故C错误;
D.I2易溶于CCl4而难溶于水导致水溶液中c(I2)减小,平衡正向移动,故D正确;
故选:C。
二、解答题(共4小题,满分64分)
13.解:(2)由图可知,第一步热化学反应为:H2S(g)+0.5O2(g)=S(s)+H2O(g)△H=﹣221.19
kJ?mol﹣1;
第二步反应为:S(s)+1.5O2(g)+H2O(g)=2H+(aq)+SO42﹣(aq))△H=﹣585.20
kJ?mol﹣1;
依据盖斯定律,第一步与第二步方程式相加得:H2S(g)+2O2(g)=SO42﹣(aq)+2H+(aq)△H=﹣806.39
kJ?mol﹣1;
故答案为:H2S(g)+2O2(g)=SO42﹣(aq)+2H+(aq)△H=﹣806.39
kJ?mol﹣1;
(2)二氧化硫溶液呈酸性,酸性条件下,硝酸根离子可氧化二氧化硫生成硫酸根离子,则生成沉淀为硫酸钡沉淀,反应的离子方程式:3Ba2++3SO2+2NO3﹣+2H2O=3BaSO4↓+2NO↑+4H+,
故答案为:3Ba2++3SO2+2NO3﹣+2H2O=3BaSO4↓+2NO↑+4H+;
(3)①二氧化硫与水反应生成亚硫酸,亚硫酸溶液呈酸性,涉及反应为SO2+H2O?H2SO3,H2SO3?H++HSO3﹣,
故答案为:SO2+H2O?H2SO3,H2SO3?H++HSO3﹣;
②实验B中出现白色沉淀比实验A快很多,B中有氧气参与反应,在水溶液中O2
氧化SO2
的速率比NO3﹣快,则速率较快,生成更多的硫酸,
故答案为:在水溶液中O2
氧化SO2
的速率比NO3﹣快;
(4)①二氧化硫发生氧化反应,氧气发生还原反应,所以二氧化硫所在电极为负极,氧气所在电极为正极,原电池中阳离子移向正极,所以质子移动方向为:从M到N;
故答案为:N;
②二氧化硫在负极失去电子发生氧化反应,电极反应式为:SO2﹣2e﹣+2H2O═SO42﹣+4H+;
故答案为:SO2﹣2e﹣+2H2O═SO42﹣+4H+。
14.解:(1)①根据实验I与Ⅱ或Ⅲ的数据对比可知,反应的总溶液体积为10mL,所以实验I中5%H2O2溶液的体积为10mL﹣1mL=9mL,
故答案为:9mL
5%H2O2溶液;
②根据表中实验Ⅱ与Ⅲ的数据和图2可知,相同时间内,实验Ⅲ的反应速率较快,MnO2的催化效果好,催化效率高,
故答案为:MnO2比Fe2O3催化H2O2分解效率高;
③实验Ⅰ、Ⅳ的目的是研究溶液的酸碱性对反应速率的影响,由图2可知,实验IV的反应速率远大于I,二者反应条件不同:实验IV在碱性条件下进行,即碱性条件下H2O2分解速率更快,
故答案为:碱性环境有利于H2O2分解速率更快;
(2)①Na2S2O3与稀硫酸反应生成Na2SO4、SO2、S和H2O,离子方程式为S2O32﹣+2H+═S↓+SO2↑+H2O,
故答案为:S2O32﹣+2H+═S↓+SO2↑+H2O;
②对比实验Ⅰ、Ⅱ可知:反应温度相同、Na2S2O3的浓度相同,溶液总体积均为20mL,仅仅是加入H2SO4体积不同,即硫酸浓度不同,
故答案为:硫酸的浓度;
③实验Ⅱ、Ⅲ的变量是温度,所以实验Ⅲ的目的是探究温度对该反应速率的影响,
故答案为:探究温度对该反应速率的影响;
(3)实验1、2、3是探究c(HI)对反应速率的影响,实验1、4、5是探究c(H2O2)对反应速率的影响,由表中数据可知,c(HI)增大一倍,总反应速率约增大一倍,c(H2O2)增大一倍,总反应速率约增大一倍,即总反应速率与c(H2O2)、c(HI)是线性正比例关系,
故答案为:25℃下,反应速率v分别与c(HI)、c(H2O2)成正比。
15.解:(1)N在周期表中位于第2周期第ⅤA族,原子核外电子数7,电子排布式为:1s22s22p3,N2中含氮氮三键,其中有2个是π键,一个是σ,NH3有1对孤对电子和3个σ键,VSEPR模型为四面体,空间构型为三角锥型,形成的晶体类型为分子晶体,N原子采取sp3杂化,是含极性共价键的极性分子,
故答案为:1s22s22p3;2;极性;极性;sp3;四面体;三角锥;分子晶体;
(2)实现“向空气要氮肥”的目标,可以是氮气在空气中放电生成NO,NO被氧化生成NO2,NO2溶于水生成硝酸和一氧化氮,硝酸和碱反应生成硝酸盐,氮气也可以和氢气高温高压催化剂条件下合成氨,氨气和酸反应生成铵盐,画出两种人工合成氮肥的物质转化方案为:,
故答案为:;
(3)如表数据从反应方向和限度两个视角分析在298K(即25℃)下工业生产氮肥选择合成氨反应的原因:合成氨反应的△G=﹣92.2kJ/mol+298K×0.20kJ/(mol?K)<0,故298K下反应能自发进行;K=4.1×106>105,故298K时反应达到平衡时进行很完全,
故答案为:合成氨反应的△G=﹣92.2kJ/mol+298K×0.20kJ/(mol?K)<0,故298K下反应能自发进行;K=4.1×106>105,故298K时反应达到平衡时进行很完全;
(4)公式知,反应物浓度与反应速率成正比,则增大反应物浓度能提高合成氨的反应速率,产物浓度与反应速率成反比,所以减小产物浓度能加快化学反应速率,
故答案为:增大原料气的浓度;分离出氨气;
(5)①采用提高溶液pH的方法处理含高浓度NH4+废水,其依据的反应原理是:NH4++OH﹣=NH3?H2O,
故答案为:NH4++OH﹣=NH3?H2O;
②采用次氯酸钠溶液氧化法处理含低浓度NH4+废水(已知pH≈8时去除率最高),反应生成氮气,其反应原理为:2NH4++3ClO﹣+2OH﹣=N2↑+5H2O+3Cl﹣,
故答案为:2NH4++3ClO﹣+2OH﹣=N2↑+5H2O+3Cl﹣;
③已知常温下,MgNH4PO4的Ksp=2.5×10﹣13,是发生沉淀反应生成MgNH4PO4,采用增大c(Mg2+)、c(PO43﹣)的方法回收低浓度NH4+,反应的离子方程式:NH4++Mg2++PO43﹣=MgNH4PO4↓,
故答案为:NH4++Mg2++PO43﹣=MgNH4PO4↓。
16.解:(1)水杨酸含﹣COOH、﹣OH,名称为羧基、羟基,水杨酸的羧基中碳原子不含孤对电子,形成1个C﹣C键、1个C﹣O、1个C=O键,则C原子为sp2杂化,
故答案为:羧基、羟基;sp2杂化;
(2)由信息可知,水杨酸与乙酸酐发生转化反应,则转化方程式为,
故答案为:;
(3)①符合a.与水杨酸含有相同官能团,含﹣OH、﹣COOH;
b.苯环上有两种环境的H原子,则苯环上﹣OH、﹣COOH位于对位,则同分异构体M的结构简式为,
故答案为:;
②由信息中沸点可知其一,M的沸点比水杨酸的高,其原因是M分子间能形成氢键,而水杨酸分子可形成分子内氢键;
由信息中电离平衡常数及酸性可知其二,杨酸羧基中羟基上的H原子比酚羟基上的H原子更容易电离出H+,
故答案为:高;M分子间能形成氢键,而水杨酸分子可形成分子内氢键;。
第1页(共1页)
同课章节目录
