2020-2021学年天津市南开区高三(上)期末化学试卷(含解析)
文档属性
| 名称 | 2020-2021学年天津市南开区高三(上)期末化学试卷(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 160.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-08 08:34:35 | ||
图片预览


文档简介
2020-2021学年天津市南开区高三(上)期末化学试卷
一、选择题(共12小题,每小题3分,满分36分)
1.(3分)化学与社会、生产、生活和科技都密切相关。下列有关说法正确的是( )
A.推广使用煤液化技术,可减少二氧化碳等温室气体的排放
B.还原铁粉和生石灰均可用作食品包装袋内的脱氧剂
C.港珠澳大桥路面使用的沥青可以通过石油分馏得到
D.2020年新冠肺炎疫情的阻击战中,用到的“84”消毒液的有效成分是Ca(ClO)2
2.(3分)古籍《天工开物》收录了井盐的生产过程。其中“汲水而上,入于釜中煎炼,顷刻结盐,色成至白”的描述,涉及的物质分离操作为( )
A.趁热过滤
B.浓缩结晶
C.常压蒸馏
D.萃取分液
3.(3分)下列有关化学用语表示正确的是( )
A.ClO2的结构式:Cl﹣O﹣Cl
B.CH4的球棍模型:
C.羟基(﹣OH)的电子式:
D.中子数为8的C原子:14C8
4.(3分)某基态原子的电子排布图为,从中得到的信息错误的是( )
A.有2个电子层
B.有3种能量不同的电子
C.有7种运动状态不同的电子
D.最外层有3个电子
5.(3分)向CuSO4溶液中滴加氨水至过量,下列叙述正确的是( )
A.先出现沉淀,后沉淀溶解,得到深蓝色的透明溶液
B.离子方程式为Cu2++SO42﹣+4NH3?H2O═[Cu(NH3)4]SO4+4H2O
C.Cu2+与NH3中的氮原子以π键结合
D.NH3分子中两个H﹣N键的键角为109°28ˊ
6.(3分)化学无处不在,与化学有关的说法不正确的是( )
A.可溶性铁盐可用作净水剂
B.管道工人曾用浓氨水检验氯气管道是否漏气
C.纯铝常用于制造飞机外壳
D.废旧电池属于有害垃圾
7.(3分)下列指定反应的化学方程式正确的是( )
A.铁与水蒸气反应:2Fe+3H2O(g)Fe2O3+3H2
B.加热金属锂:4Li+O22Li2O
C.焦炭与石英砂反应制粗硅:C+SiO2Si+CO2↑
D.硫与铜在加热条件下反应:Cu+SCuS
8.(3分)下列叙述正确的是( )
A.还原性:Cl﹣>S2﹣
B.第一电离能:N>O>C
C.碱性:Sr(OH)2>CsOH
D.熔点:晶体硅>碳化硅
9.(3分)有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加足量稀硝酸,充分振荡后,仍有白色沉淀,对此实验下述结论正确的是( )
A.Na2SO3已部分被氧化
B.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4
C.加硝酸后的不溶沉淀一定是BaSO4和BaSO3
D.此实验不能确定Na2SO3是否部分被氧化
10.(3分)向H2O2溶液中加入Br2可以加快H2O2分解速率。其反应机理可能有两步,第1步:H2O2+Br2═2H++O2↑+2Br﹣。下列说法正确的是( )
A.H2O2分子中含有离子键和非极性键
B.第2步反应为:2H2O2+2Br﹣═2H2O+Br2+O2↑
C.第1步反应每生成0.1mol
O2,转移0.2mol电子
D.该反应机理中,Br﹣催化H2O2分解产生O2
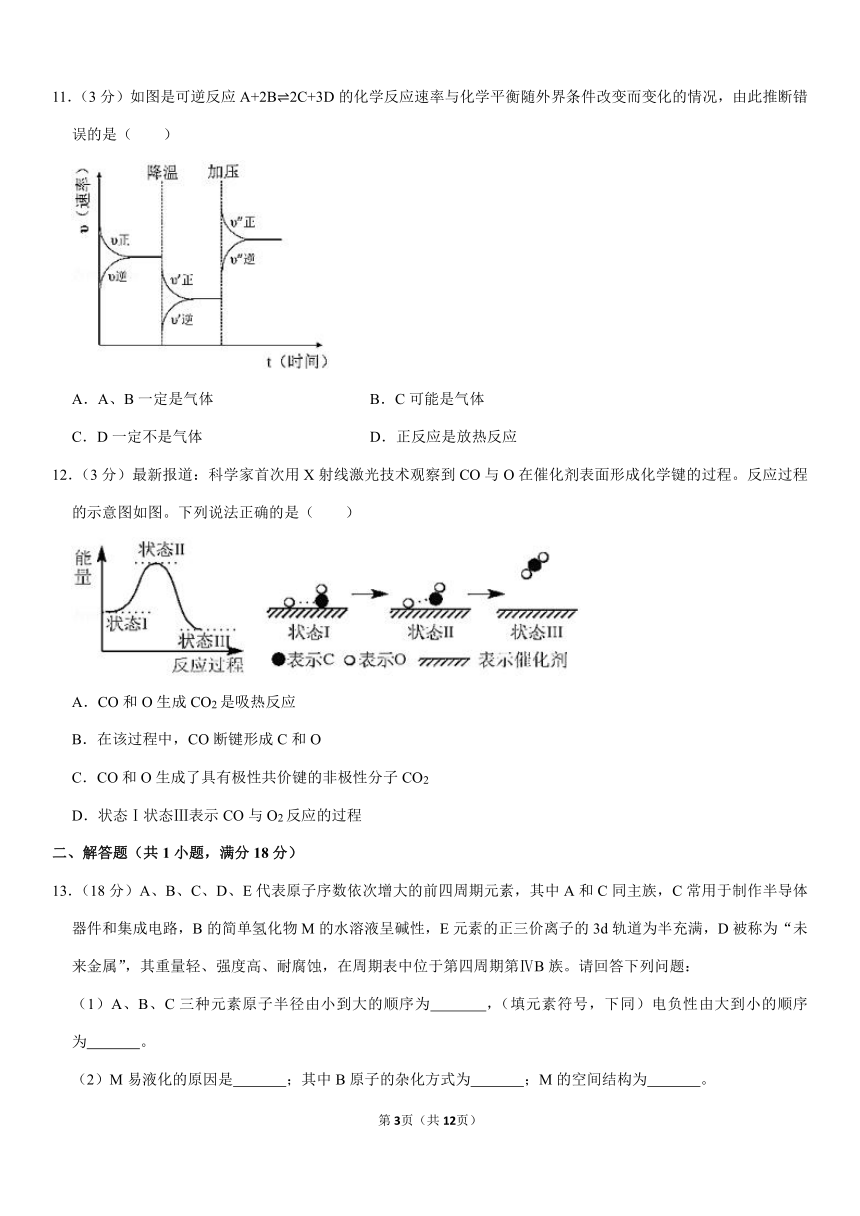
11.(3分)如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变而变化的情况,由此推断错误的是( )
A.A、B一定是气体
B.C可能是气体
C.D一定不是气体
D.正反应是放热反应
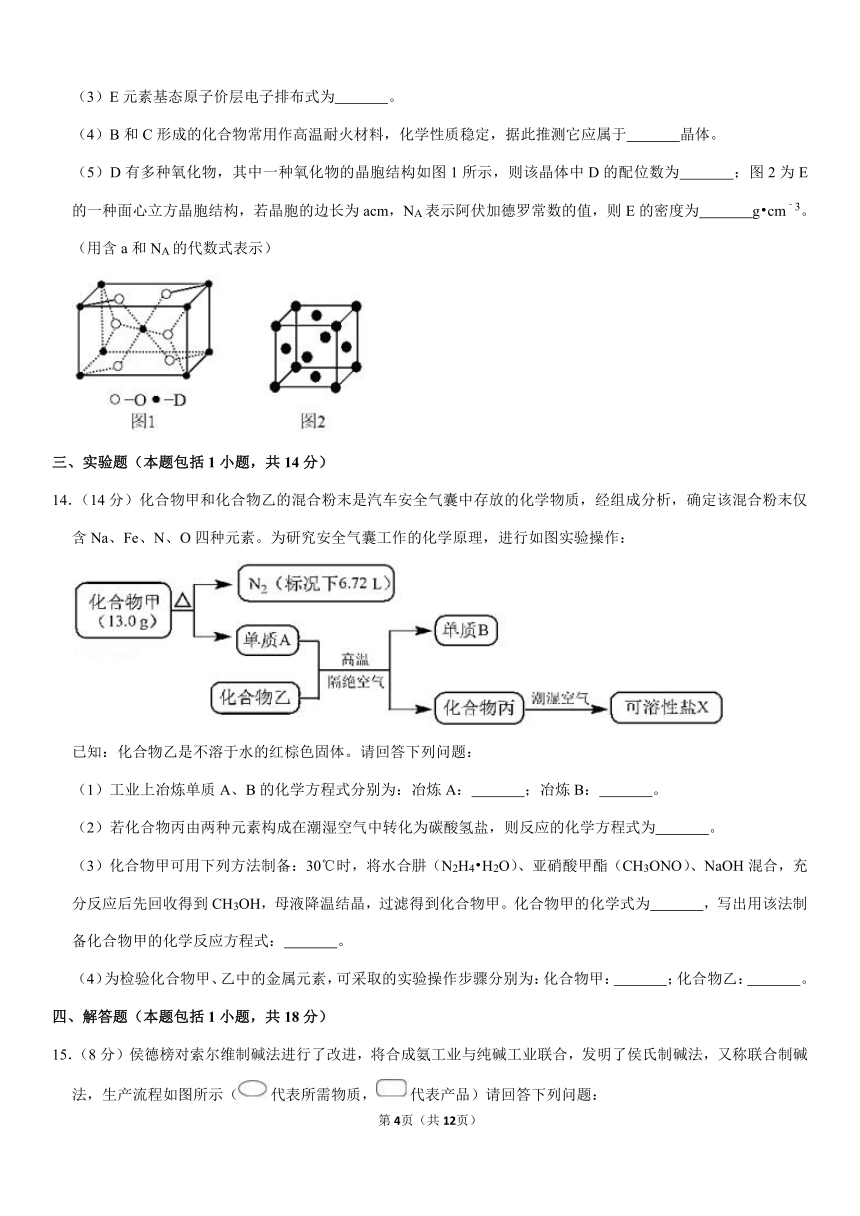
12.(3分)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如图。下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的非极性分子CO2
D.状态Ⅰ状态Ⅲ表示CO与O2反应的过程
二、解答题(共1小题,满分18分)
13.(18分)A、B、C、D、E代表原子序数依次增大的前四周期元素,其中A和C同主族,C常用于制作半导体器件和集成电路,B的简单氢化物M的水溶液呈碱性,E元素的正三价离子的3d轨道为半充满,D被称为“未来金属”,其重量轻、强度高、耐腐蚀,在周期表中位于第四周期第ⅣB族。请回答下列问题:
(1)A、B、C三种元素原子半径由小到大的顺序为
,(填元素符号,下同)电负性由大到小的顺序为
。
(2)M易液化的原因是
;其中B原子的杂化方式为
;M的空间结构为
。
(3)E元素基态原子价层电子排布式为
。
(4)B和C形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于
晶体。
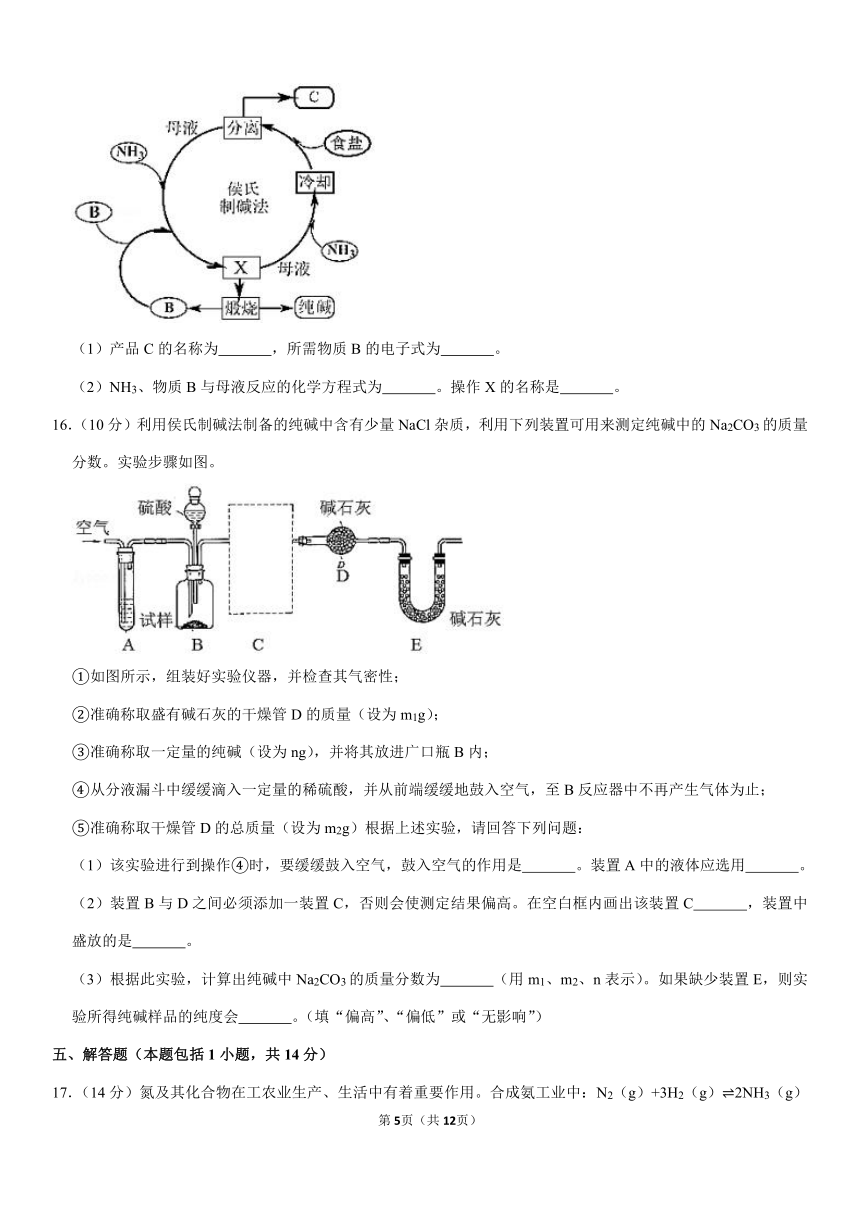
(5)D有多种氧化物,其中一种氧化物的晶胞结构如图1所示,则该晶体中D的配位数为
;图2为E的一种面心立方晶胞结构,若晶胞的边长为acm,NA表示阿伏加德罗常数的值,则E的密度为
g?cm﹣3。(用含a和NA的代数式表示)
三、实验题(本题包括1小题,共14分)
14.(14分)化合物甲和化合物乙的混合粉末是汽车安全气囊中存放的化学物质,经组成分析,确定该混合粉末仅含Na、Fe、N、O四种元素。为研究安全气囊工作的化学原理,进行如图实验操作:
已知:化合物乙是不溶于水的红棕色固体。请回答下列问题:
(1)工业上冶炼单质A、B的化学方程式分别为:冶炼A:
;冶炼B:
。
(2)若化合物丙由两种元素构成在潮湿空气中转化为碳酸氢盐,则反应的化学方程式为
。
(3)化合物甲可用下列方法制备:30℃时,将水合肼(N2H4?H2O)、亚硝酸甲酯(CH3ONO)、NaOH混合,充分反应后先回收得到CH3OH,母液降温结晶,过滤得到化合物甲。化合物甲的化学式为
,写出用该法制备化合物甲的化学反应方程式:
。
(4)为检验化合物甲、乙中的金属元素,可采取的实验操作步骤分别为:化合物甲:
;化合物乙:
。
四、解答题(本题包括1小题,共18分)
15.(8分)侯德榜对索尔维制碱法进行了改进,将合成氨工业与纯碱工业联合,发明了侯氏制碱法,又称联合制碱法,生产流程如图所示(代表所需物质,代表产品)请回答下列问题:
(1)产品C的名称为
,所需物质B的电子式为
。
(2)NH3、物质B与母液反应的化学方程式为
。操作X的名称是
。
16.(10分)利用侯氏制碱法制备的纯碱中含有少量NaCl杂质,利用下列装置可用来测定纯碱中的Na2CO3的质量分数。实验步骤如图。
①如图所示,组装好实验仪器,并检查其气密性;
②准确称取盛有碱石灰的干燥管D的质量(设为m1g);
③准确称取一定量的纯碱(设为ng),并将其放进广口瓶B内;
④从分液漏斗中缓缓滴入一定量的稀硫酸,并从前端缓缓地鼓入空气,至B反应器中不再产生气体为止;
⑤准确称取干燥管D的总质量(设为m2g)根据上述实验,请回答下列问题:
(1)该实验进行到操作④时,要缓缓鼓入空气,鼓入空气的作用是
。装置A中的液体应选用
。
(2)装置B与D之间必须添加一装置C,否则会使测定结果偏高。在空白框内画出该装置C
,装置中盛放的是
。
(3)根据此实验,计算出纯碱中Na2CO3的质量分数为
(用m1、m2、n表示)。如果缺少装置E,则实验所得纯碱样品的纯度会
。(填“偏高”、“偏低”或“无影响”)
五、解答题(本题包括1小题,共14分)
17.(14分)氮及其化合物在工农业生产、生活中有着重要作用。合成氨工业中:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表:
T/℃
200
300
400
K
K1
K2
0.5
请回答下列问题:
(1)试比较K1、K2的大小,K1
K2。(填“>”、“=”或“<”)
(2)400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为
。当测得NH3和N2、H2的物质的量浓度分别为3mol/L和2mol/L、1mol/L时,则此时该反应υ(N2)(正)
υ(N2)(逆)。(填“>”、“=”或“<”)
(3)在恒温、恒容的密闭容器中,下列能作为合成氨反应达到平衡的依据的是
。
a.υ(N2)(正)=3υ(H2)(逆)
b.混合气体的密度保持不变
c.容器内压强保持不变
d.N2、H2、NH3的浓度之比为1:3:2
(4)工业生产中为了提高合成氨反应中H2的转化率,一般会加入稍过量的N2,这样做N2的转化率会
。(填“增大”、“减小”或“无影响”)
(5)已知反应2N2O(g)?2N2(g)+O2(g)△H=﹣163kJ?mol﹣1,1mol
N2(g)、1mol
O2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1mol
N2O(g)分子中化学键断裂时需要吸收的能量为
kJ。
(6)如图是1mol
NO2和1mol
CO反应生成CO2和NO过程中能量变化示意图,其中E1=134kJ?mol﹣1,E2=368kJ?mol﹣1,请写出NO2和CO反应的热化学方程式:
。
2020-2021学年天津市南开区高三(上)期末化学试卷
试题解析
一、选择题(共12小题,每小题3分,满分36分)
1.解:A.把煤转化为液体燃料,可以减少二氧化硫、烟尘等有害物质的排放,但不能减少二氧化碳的排放,故A错误;
B.还原铁粉能与氧气反应,可用作食品包装袋内的脱氧剂,但生石灰能与水反应,作食品包装袋内的干燥剂,故B错误;
C.石油常压分馏产物:液化石油气、汽油、煤油、柴油、重油,减压分馏过程的产物为:重柴油、润滑油、凡士林、石蜡、沥青,故C正确;
D.漂白粉的有效成分是Ca(ClO)2,“84”消毒液的有效成分是NaClO,故D错误;
故选:C。
2.解:由信息可知,煎炼,顷刻结盐,为蒸发析出盐的过程,则涉及的物质分离操作为蒸发结晶,
故选:B。
3.解:A.ClO2为共价化合物,其结构式为O﹣Cl﹣O,故A错误;
B.为甲烷的比例模型,甲烷的球棍模型为,故B错误;
C.羟基(﹣OH)为中性原子团,其电子式为,故C正确;
D.中子数为8的C原子的质量数为6+8=14,该原子可以表示为148C,故D错误;
故选:C。
4.解:A.每层的电子数分别为2、5,所以有2个电子层,故A正确;
B.有三种能量不同的轨道,分别为:1s、2s、2p,故B正确;
C.每个电子为一种运动状态,共7个电子,有7种不同运动状态的电子,故C正确;
D.每层的电子数分别为2、5,所以最外层有5个电子,故D错误;
故选:D。
5.解:A.向CuSO4溶液中滴加氨水至过量,先生成氢氧化铜蓝色沉淀,后溶解形成铜氨溶液,为深蓝色溶液,故A正确;
B.离子方程式为:Cu2++4NH3?H2O=[Cu(NH3)4]2++4H2O,故B错误;
C.Cu2+提供空轨道,NH3中的氮原子提供孤电子对,形成配位键,故C错误;
D.NH3分子中N原子含有3个共用电子对和一个孤电子对,所以其价层电子对是4,采用sp3杂化,NH3分子为三角锥形,两个H﹣N键的键角为107°18ˊ,故D错误;
故选:A。
6.解:A.可溶性铁盐能水解生成氢氧化铁胶体,吸附水中的悬浮杂质形成沉淀起到净水作用,故A正确;
B.氨气和氯气发生氧化还原反应生成氮气和氯化铵,有白烟生成,可用于检验,故B正确;
C.纯铝质软,不适合用于制造飞机外壳,常用硬铝,硬铝具有密度小、硬度大、耐腐蚀等优良性能,故C错误;
D.废旧电池中含有镍、镉等重金属,能够引起土壤、水体污染,属于有害垃圾,应该集中专门处理,故D正确;
故选:C。
7.解:A.铁和水蒸气反应生成四氧化三铁,故化学方程式为3Fe+4H2O(g)Fe3O4+4H2,故A错误;
B.锂和氧气反应生成Li2O,故化学方程式为4Li+O22Li2O,故B正确;
C.焦炭与石英砂反应制粗硅时碳过量,故生成CO,故化学方程式为2C+SiO2Si+2CO↑,故C错误;
D.S和Cu反应后铜变为+1价,生成Cu2S,故化学方程式为2Cu+SCu2S,故D错误。
故选:B。
8.解:A.非金属性Cl>S,单质氧化性Cl2>S,对应阴离子还原性Cl﹣<S2﹣,故A错误;
B.第一电离能依次增大趋势,第ⅡA族,第ⅤA族在同周期中第一电离能反常高,N>O>C,故B正确;
C.同主族金属性增强,同周期金属性减弱,得到金属性Sr<Ba<Cs,碱性:Sr(OH)2<CsOH,故C错误;
D.晶体硅和碳化硅都是原子晶体,原子半径C﹣Si<Si﹣Si,所以熔沸点:晶体硅<SiC,故D错误;
故选:B。
9.解:A.取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀,硝酸根离子在酸溶液中具有氧化性,原溶液中可含硫酸根离子或亚硫酸根离子,不能说明Na2SO3已部分被氧化,故A错误;
B.滴入Ba(NO3)2溶液,产生白色沉淀,白色沉淀为亚硫酸钡或含硫酸钡,生成的沉淀中不一定含有BaSO4,故B错误;
C.亚硫酸钡可与硝酸发生氧化还原反应,则加硝酸后的不溶沉淀一定是BaSO4,故C错误;
D.取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀,因硝酸根离子在酸溶液中具有氧化性,原溶液中可以是硫酸根离子或亚硫酸根离子,则原溶液可能被氧化,也可能没有被氧化,即此实验不能确定Na2SO3是否部分被氧化,故D正确;
故选:D。
10.解:A.H2O2分子中仅含有共价键,故A错误;
B.总反应为过氧化氢分解生成氧气和水,溴为反应的催化剂,由第一步反应可知第2步反应为:2H++H2O2
+2Br﹣═2H2O
+Br2,总反应为过氧化氢分解生成氧气和水,故B错误;
C.在第1步反应中,O元素化合价由﹣1价升高到0价,则每生成0.1
mol
O2,转移0.2
mol电子,故C正确;
D.总反应为过氧化氢分解生成氧气和水,溴为反应的催化剂,不是Br﹣,故D错误;
故选:C。
11.解:A、该反应为气体体积较小的反应且反应物生成物中都有气体,根据化学计量数的关系,A、B一定是都气体,故A正确;
B、反应物生成物中都有气体,且气体体积较小,则C一定是气体,故B错误;
C、该反应为气体体积较小的反应,且D的计量数为3,比反应物的计量数大,所以D一定不是气体,故C正确;
D、降温平衡正向移动,说明该反应为放热反应,故D正确;
故选:B。
12.解:A.由题中图示可知状态Ⅲ的能量低于状态Ⅰ的能量,则该过程是放热过程,故A错误;
B.由图示可知,该过程中CO的化学键没有断裂,只有C=O键的形成,故B错误;
C.CO2是直线形分子,含极性共价键C=O键,结构简式为O=C=O,属于非极性分子,故C正确;
D.状态Ⅰ到状态Ⅲ表示CO与O生成CO2的过程,故D错误;
故选:C。
二、解答题(共1小题,满分18分)
13.解:(1)A、B、C分别为C、N、Si,同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径由小到大的顺序为:N<C<Si,同周期自左而右电负性增大,同主族自上而下电负性减小,故电负性由大到小的顺序为:N>C>Si,
故答案为:N<C<Si;N>C>Si;
(2)B为N元素,B的简单氢化物为NH3,NH3分子之间形成氢键,沸点较高,所以易液化;氨气分子中N原子形成3个N﹣H键,含有1对孤电子对,杂化轨道数目为4,N原子采取sp3杂化;分子的VSEPR模型为四面体形,忽略孤电子对可得微粒空间构型为三角锥形,
故答案为:NH3分子之间形成氢键,沸点较高,所以易液化;sp3;三角锥形;
(3)E元素的正三价离子的3d轨道为半充满,说明E元素原子3d能级有6个电子,4s能级有2个电子,故E元素基态原子价层电子排布式为3d64s2,
故答案为:3d64s2;
(4)B和C形成的化合物常用作高温耐火材料,化学性质稳定,可推断为原子晶体(或共价晶体),
故答案为:原子(或共价);
(5)根据晶胞结构可知,D周围与D等距且最近的O有6个,则该晶体中D的配位数为6;E为Fe,则一个晶胞中,含有Fe的数目为8×+6×=4,不妨取1mol这样的晶胞,则1mol晶胞的质量为m=4×56g=224g,一个晶胞的体积为V=a3cm3,1mol晶胞即有NA个晶胞,1mol晶胞的体积为(NA?a3)cm3,所以晶体密度ρ=g?cm﹣3,
故答案为:6;。
三、实验题(本题包括1小题,共14分)
14.解:(1)A为钠,B为铁,工业上冶炼单质A、B的化学方程式分别为:2NaCl(熔融)2Na+Cl2↑;Fe2O3+3CO2Fe+3CO2,
故答案为:2NaCl(熔融)2Na+Cl2↑;Fe2O3+3CO2Fe+3CO2;
(2)丙为Na2O,和水、CO2反应生成碳酸氢钠方程式为:Na2O+H2O+2CO2=2NaHCO3,
故答案为:Na2O+H2O+2CO2=2NaHCO3;
(3)根据分析甲为NaN3,水合肼(N2H4?H2O)、亚硝酸甲酯(CH3ONO)、NaOH混合得到化合物NaN3的方程式为:N2H4?H2O+CH3ONO+NaOH=NaN3+CH3OH+3H2O,
故答案为:N2H4?H2O+CH3ONO+NaOH=NaN3+CH3OH+3H2O;
(4)化合物甲为NaN3,含有金属钠元素,可以通过焰色反应检测;乙为Fe2O3,含有金属铁元素,可以用KSCN溶液检测,具体操作为:用洁净的铂丝蘸取化合物甲,在酒精灯外焰上灼烧,若火焰呈黄色,则含有钠元素;取少量化合物乙于试管中,加入适量稀盐酸,滴加几滴KSCN溶液,若溶液变红,则含有铁元素,
故答案为:用洁净的铂丝蘸取化合物甲,在酒精灯外焰上灼烧,若火焰呈黄色,则含有钠元素;取少量化合物乙于试管中,加入适量稀盐酸,滴加几滴KSCN溶液,若溶液变红,则含有铁元素。
四、解答题(本题包括1小题,共18分)
15.解:(1)NaCl、NH3、CO2、H2O反应生成NaHCO3、NH4Cl,NaHCO3煅烧得到碳酸钠和CO2,根据图知,A为NH3、B为CO2、C为NH4Cl,C的名称为氯化铵,B为二氧化碳,二氧化碳分子中存在两个碳碳双键,氧原子和碳原子最外层都为8个电子,二氧化碳正确的电子式为,
故答案为:氯化铵;;
(2)NaCl、NH3、CO2、H2O反应生成NaHCO3、NH4Cl,所以其反应原理为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,从溶液中得到难溶性固体采用过滤方法,所以操作X为过滤,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;过滤。
16.解:(1)为使B装置中二氧化碳气体完全被D装置吸收,应该用不和二氧化碳反应且不含二氧化碳的气体将B装置中的二氧化碳排出干净,所以鼓入空气的作用是确保CO2充分被吸收;
空气中含有二氧化碳而影响碳酸钠生成的二氧化碳测定,所以A装置要吸收空气中的二氧化碳,二氧化碳是酸性氧化物,能被碱液吸收,所以可以用NaOH溶液吸收空气中的二氧化碳,则装置A中的液体应选用NaOH溶液,
故答案为:确保CO2充分被吸收;NaOH溶液;
(2)碱石灰能吸收水蒸气,为减少误差,C装置应该为干燥气体的装置且不能和二氧化碳反应,选取浓硫酸作干燥剂,该装置为,
故答案为:;浓硫酸;
(3)D装置增加的质量为二氧化碳质量,m(CO2)=(m2﹣m1)g,根据C原子守恒得n(Na2CO3)=n(CO2)=mol,m(Na2CO3)=mol×106g/mol=×106)g,碳酸钠质量分数=×100%=×100%=×100%;如果缺少装置E,空气中水蒸气和二氧化碳进入D装置,导致二氧化碳测定值偏大,则实验所得纯碱样品的纯度会偏高,
故答案为:×100%;偏高。
五、解答题(本题包括1小题,共14分)
17.解:(1)该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,所以K1>K2,
故答案为:>;
(2)400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数K的值和反应N2(g)+3H2(g)?2NH3(g)的平衡常数呈倒数,所以K==2,当测得NH3和N2、H2的物质的量浓度分别为3mol/L和2mol/L、1mol/L时,400℃时,浓度商Qc==<K=2,说明反应正向进行,因此有v(N2)正>v(N2)逆,
故答案为:2;>;
(3)N2(g)+3H2(g)?2NH3(g)△H<0,反应是气体体积减小的放热反应,
a.不同物质的正逆反应速率之比等于其计量数之比是平衡状态,3υ(N2)(正)=υ(H2)(逆)是平衡状态,υ(N2)(正)=3υ(H2)(逆)不是平衡状态,故a错误;
b.如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故b错误;
c.容器内压强不变,气体的物质的量不变,该反应达平衡状态,故c正确;
d.容器内各物质的浓度之比等于计量数之比,不能证明正逆反应速率相等,故d错误;
故答案为:c;
(4)工业生产中为了提高合成氨反应中H2的转化率,一般会加入稍过量的N2,这样做N2的转化率会减小,
故答案为:减小;
(5)已知反应2N2O(g)?2N2(g)+O2(g)△H=﹣163kJ?mol﹣1,设1mol
N2O(g)分子中化学键断裂时需要吸收的能量为x,则﹣163kJ/mol=(2x﹣2×945kJ/mol﹣498kJ/mol),解得x=1112.5kJ,
故答案为:1112.5;
(6)如图是1mol
NO2和1mol
CO反应生成CO2和NO过程中能量变化示意图,反应焓变△H=134kJ/mol﹣368kJ/mol=﹣234kJ/mol,反应的热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=﹣234kJ/mol,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=﹣234kJ/mol。
第1页(共1页)
一、选择题(共12小题,每小题3分,满分36分)
1.(3分)化学与社会、生产、生活和科技都密切相关。下列有关说法正确的是( )
A.推广使用煤液化技术,可减少二氧化碳等温室气体的排放
B.还原铁粉和生石灰均可用作食品包装袋内的脱氧剂
C.港珠澳大桥路面使用的沥青可以通过石油分馏得到
D.2020年新冠肺炎疫情的阻击战中,用到的“84”消毒液的有效成分是Ca(ClO)2
2.(3分)古籍《天工开物》收录了井盐的生产过程。其中“汲水而上,入于釜中煎炼,顷刻结盐,色成至白”的描述,涉及的物质分离操作为( )
A.趁热过滤
B.浓缩结晶
C.常压蒸馏
D.萃取分液
3.(3分)下列有关化学用语表示正确的是( )
A.ClO2的结构式:Cl﹣O﹣Cl
B.CH4的球棍模型:
C.羟基(﹣OH)的电子式:
D.中子数为8的C原子:14C8
4.(3分)某基态原子的电子排布图为,从中得到的信息错误的是( )
A.有2个电子层
B.有3种能量不同的电子
C.有7种运动状态不同的电子
D.最外层有3个电子
5.(3分)向CuSO4溶液中滴加氨水至过量,下列叙述正确的是( )
A.先出现沉淀,后沉淀溶解,得到深蓝色的透明溶液
B.离子方程式为Cu2++SO42﹣+4NH3?H2O═[Cu(NH3)4]SO4+4H2O
C.Cu2+与NH3中的氮原子以π键结合
D.NH3分子中两个H﹣N键的键角为109°28ˊ
6.(3分)化学无处不在,与化学有关的说法不正确的是( )
A.可溶性铁盐可用作净水剂
B.管道工人曾用浓氨水检验氯气管道是否漏气
C.纯铝常用于制造飞机外壳
D.废旧电池属于有害垃圾
7.(3分)下列指定反应的化学方程式正确的是( )
A.铁与水蒸气反应:2Fe+3H2O(g)Fe2O3+3H2
B.加热金属锂:4Li+O22Li2O
C.焦炭与石英砂反应制粗硅:C+SiO2Si+CO2↑
D.硫与铜在加热条件下反应:Cu+SCuS
8.(3分)下列叙述正确的是( )
A.还原性:Cl﹣>S2﹣
B.第一电离能:N>O>C
C.碱性:Sr(OH)2>CsOH
D.熔点:晶体硅>碳化硅
9.(3分)有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加足量稀硝酸,充分振荡后,仍有白色沉淀,对此实验下述结论正确的是( )
A.Na2SO3已部分被氧化
B.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4
C.加硝酸后的不溶沉淀一定是BaSO4和BaSO3
D.此实验不能确定Na2SO3是否部分被氧化
10.(3分)向H2O2溶液中加入Br2可以加快H2O2分解速率。其反应机理可能有两步,第1步:H2O2+Br2═2H++O2↑+2Br﹣。下列说法正确的是( )
A.H2O2分子中含有离子键和非极性键
B.第2步反应为:2H2O2+2Br﹣═2H2O+Br2+O2↑
C.第1步反应每生成0.1mol
O2,转移0.2mol电子
D.该反应机理中,Br﹣催化H2O2分解产生O2
11.(3分)如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变而变化的情况,由此推断错误的是( )
A.A、B一定是气体
B.C可能是气体
C.D一定不是气体
D.正反应是放热反应
12.(3分)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如图。下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的非极性分子CO2
D.状态Ⅰ状态Ⅲ表示CO与O2反应的过程
二、解答题(共1小题,满分18分)
13.(18分)A、B、C、D、E代表原子序数依次增大的前四周期元素,其中A和C同主族,C常用于制作半导体器件和集成电路,B的简单氢化物M的水溶液呈碱性,E元素的正三价离子的3d轨道为半充满,D被称为“未来金属”,其重量轻、强度高、耐腐蚀,在周期表中位于第四周期第ⅣB族。请回答下列问题:
(1)A、B、C三种元素原子半径由小到大的顺序为
,(填元素符号,下同)电负性由大到小的顺序为
。
(2)M易液化的原因是
;其中B原子的杂化方式为
;M的空间结构为
。
(3)E元素基态原子价层电子排布式为
。
(4)B和C形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于
晶体。
(5)D有多种氧化物,其中一种氧化物的晶胞结构如图1所示,则该晶体中D的配位数为
;图2为E的一种面心立方晶胞结构,若晶胞的边长为acm,NA表示阿伏加德罗常数的值,则E的密度为
g?cm﹣3。(用含a和NA的代数式表示)
三、实验题(本题包括1小题,共14分)
14.(14分)化合物甲和化合物乙的混合粉末是汽车安全气囊中存放的化学物质,经组成分析,确定该混合粉末仅含Na、Fe、N、O四种元素。为研究安全气囊工作的化学原理,进行如图实验操作:
已知:化合物乙是不溶于水的红棕色固体。请回答下列问题:
(1)工业上冶炼单质A、B的化学方程式分别为:冶炼A:
;冶炼B:
。
(2)若化合物丙由两种元素构成在潮湿空气中转化为碳酸氢盐,则反应的化学方程式为
。
(3)化合物甲可用下列方法制备:30℃时,将水合肼(N2H4?H2O)、亚硝酸甲酯(CH3ONO)、NaOH混合,充分反应后先回收得到CH3OH,母液降温结晶,过滤得到化合物甲。化合物甲的化学式为
,写出用该法制备化合物甲的化学反应方程式:
。
(4)为检验化合物甲、乙中的金属元素,可采取的实验操作步骤分别为:化合物甲:
;化合物乙:
。
四、解答题(本题包括1小题,共18分)
15.(8分)侯德榜对索尔维制碱法进行了改进,将合成氨工业与纯碱工业联合,发明了侯氏制碱法,又称联合制碱法,生产流程如图所示(代表所需物质,代表产品)请回答下列问题:
(1)产品C的名称为
,所需物质B的电子式为
。
(2)NH3、物质B与母液反应的化学方程式为
。操作X的名称是
。
16.(10分)利用侯氏制碱法制备的纯碱中含有少量NaCl杂质,利用下列装置可用来测定纯碱中的Na2CO3的质量分数。实验步骤如图。
①如图所示,组装好实验仪器,并检查其气密性;
②准确称取盛有碱石灰的干燥管D的质量(设为m1g);
③准确称取一定量的纯碱(设为ng),并将其放进广口瓶B内;
④从分液漏斗中缓缓滴入一定量的稀硫酸,并从前端缓缓地鼓入空气,至B反应器中不再产生气体为止;
⑤准确称取干燥管D的总质量(设为m2g)根据上述实验,请回答下列问题:
(1)该实验进行到操作④时,要缓缓鼓入空气,鼓入空气的作用是
。装置A中的液体应选用
。
(2)装置B与D之间必须添加一装置C,否则会使测定结果偏高。在空白框内画出该装置C
,装置中盛放的是
。
(3)根据此实验,计算出纯碱中Na2CO3的质量分数为
(用m1、m2、n表示)。如果缺少装置E,则实验所得纯碱样品的纯度会
。(填“偏高”、“偏低”或“无影响”)
五、解答题(本题包括1小题,共14分)
17.(14分)氮及其化合物在工农业生产、生活中有着重要作用。合成氨工业中:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表:
T/℃
200
300
400
K
K1
K2
0.5
请回答下列问题:
(1)试比较K1、K2的大小,K1
K2。(填“>”、“=”或“<”)
(2)400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为
。当测得NH3和N2、H2的物质的量浓度分别为3mol/L和2mol/L、1mol/L时,则此时该反应υ(N2)(正)
υ(N2)(逆)。(填“>”、“=”或“<”)
(3)在恒温、恒容的密闭容器中,下列能作为合成氨反应达到平衡的依据的是
。
a.υ(N2)(正)=3υ(H2)(逆)
b.混合气体的密度保持不变
c.容器内压强保持不变
d.N2、H2、NH3的浓度之比为1:3:2
(4)工业生产中为了提高合成氨反应中H2的转化率,一般会加入稍过量的N2,这样做N2的转化率会
。(填“增大”、“减小”或“无影响”)
(5)已知反应2N2O(g)?2N2(g)+O2(g)△H=﹣163kJ?mol﹣1,1mol
N2(g)、1mol
O2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1mol
N2O(g)分子中化学键断裂时需要吸收的能量为
kJ。
(6)如图是1mol
NO2和1mol
CO反应生成CO2和NO过程中能量变化示意图,其中E1=134kJ?mol﹣1,E2=368kJ?mol﹣1,请写出NO2和CO反应的热化学方程式:
。
2020-2021学年天津市南开区高三(上)期末化学试卷
试题解析
一、选择题(共12小题,每小题3分,满分36分)
1.解:A.把煤转化为液体燃料,可以减少二氧化硫、烟尘等有害物质的排放,但不能减少二氧化碳的排放,故A错误;
B.还原铁粉能与氧气反应,可用作食品包装袋内的脱氧剂,但生石灰能与水反应,作食品包装袋内的干燥剂,故B错误;
C.石油常压分馏产物:液化石油气、汽油、煤油、柴油、重油,减压分馏过程的产物为:重柴油、润滑油、凡士林、石蜡、沥青,故C正确;
D.漂白粉的有效成分是Ca(ClO)2,“84”消毒液的有效成分是NaClO,故D错误;
故选:C。
2.解:由信息可知,煎炼,顷刻结盐,为蒸发析出盐的过程,则涉及的物质分离操作为蒸发结晶,
故选:B。
3.解:A.ClO2为共价化合物,其结构式为O﹣Cl﹣O,故A错误;
B.为甲烷的比例模型,甲烷的球棍模型为,故B错误;
C.羟基(﹣OH)为中性原子团,其电子式为,故C正确;
D.中子数为8的C原子的质量数为6+8=14,该原子可以表示为148C,故D错误;
故选:C。
4.解:A.每层的电子数分别为2、5,所以有2个电子层,故A正确;
B.有三种能量不同的轨道,分别为:1s、2s、2p,故B正确;
C.每个电子为一种运动状态,共7个电子,有7种不同运动状态的电子,故C正确;
D.每层的电子数分别为2、5,所以最外层有5个电子,故D错误;
故选:D。
5.解:A.向CuSO4溶液中滴加氨水至过量,先生成氢氧化铜蓝色沉淀,后溶解形成铜氨溶液,为深蓝色溶液,故A正确;
B.离子方程式为:Cu2++4NH3?H2O=[Cu(NH3)4]2++4H2O,故B错误;
C.Cu2+提供空轨道,NH3中的氮原子提供孤电子对,形成配位键,故C错误;
D.NH3分子中N原子含有3个共用电子对和一个孤电子对,所以其价层电子对是4,采用sp3杂化,NH3分子为三角锥形,两个H﹣N键的键角为107°18ˊ,故D错误;
故选:A。
6.解:A.可溶性铁盐能水解生成氢氧化铁胶体,吸附水中的悬浮杂质形成沉淀起到净水作用,故A正确;
B.氨气和氯气发生氧化还原反应生成氮气和氯化铵,有白烟生成,可用于检验,故B正确;
C.纯铝质软,不适合用于制造飞机外壳,常用硬铝,硬铝具有密度小、硬度大、耐腐蚀等优良性能,故C错误;
D.废旧电池中含有镍、镉等重金属,能够引起土壤、水体污染,属于有害垃圾,应该集中专门处理,故D正确;
故选:C。
7.解:A.铁和水蒸气反应生成四氧化三铁,故化学方程式为3Fe+4H2O(g)Fe3O4+4H2,故A错误;
B.锂和氧气反应生成Li2O,故化学方程式为4Li+O22Li2O,故B正确;
C.焦炭与石英砂反应制粗硅时碳过量,故生成CO,故化学方程式为2C+SiO2Si+2CO↑,故C错误;
D.S和Cu反应后铜变为+1价,生成Cu2S,故化学方程式为2Cu+SCu2S,故D错误。
故选:B。
8.解:A.非金属性Cl>S,单质氧化性Cl2>S,对应阴离子还原性Cl﹣<S2﹣,故A错误;
B.第一电离能依次增大趋势,第ⅡA族,第ⅤA族在同周期中第一电离能反常高,N>O>C,故B正确;
C.同主族金属性增强,同周期金属性减弱,得到金属性Sr<Ba<Cs,碱性:Sr(OH)2<CsOH,故C错误;
D.晶体硅和碳化硅都是原子晶体,原子半径C﹣Si<Si﹣Si,所以熔沸点:晶体硅<SiC,故D错误;
故选:B。
9.解:A.取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀,硝酸根离子在酸溶液中具有氧化性,原溶液中可含硫酸根离子或亚硫酸根离子,不能说明Na2SO3已部分被氧化,故A错误;
B.滴入Ba(NO3)2溶液,产生白色沉淀,白色沉淀为亚硫酸钡或含硫酸钡,生成的沉淀中不一定含有BaSO4,故B错误;
C.亚硫酸钡可与硝酸发生氧化还原反应,则加硝酸后的不溶沉淀一定是BaSO4,故C错误;
D.取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀,因硝酸根离子在酸溶液中具有氧化性,原溶液中可以是硫酸根离子或亚硫酸根离子,则原溶液可能被氧化,也可能没有被氧化,即此实验不能确定Na2SO3是否部分被氧化,故D正确;
故选:D。
10.解:A.H2O2分子中仅含有共价键,故A错误;
B.总反应为过氧化氢分解生成氧气和水,溴为反应的催化剂,由第一步反应可知第2步反应为:2H++H2O2
+2Br﹣═2H2O
+Br2,总反应为过氧化氢分解生成氧气和水,故B错误;
C.在第1步反应中,O元素化合价由﹣1价升高到0价,则每生成0.1
mol
O2,转移0.2
mol电子,故C正确;
D.总反应为过氧化氢分解生成氧气和水,溴为反应的催化剂,不是Br﹣,故D错误;
故选:C。
11.解:A、该反应为气体体积较小的反应且反应物生成物中都有气体,根据化学计量数的关系,A、B一定是都气体,故A正确;
B、反应物生成物中都有气体,且气体体积较小,则C一定是气体,故B错误;
C、该反应为气体体积较小的反应,且D的计量数为3,比反应物的计量数大,所以D一定不是气体,故C正确;
D、降温平衡正向移动,说明该反应为放热反应,故D正确;
故选:B。
12.解:A.由题中图示可知状态Ⅲ的能量低于状态Ⅰ的能量,则该过程是放热过程,故A错误;
B.由图示可知,该过程中CO的化学键没有断裂,只有C=O键的形成,故B错误;
C.CO2是直线形分子,含极性共价键C=O键,结构简式为O=C=O,属于非极性分子,故C正确;
D.状态Ⅰ到状态Ⅲ表示CO与O生成CO2的过程,故D错误;
故选:C。
二、解答题(共1小题,满分18分)
13.解:(1)A、B、C分别为C、N、Si,同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径由小到大的顺序为:N<C<Si,同周期自左而右电负性增大,同主族自上而下电负性减小,故电负性由大到小的顺序为:N>C>Si,
故答案为:N<C<Si;N>C>Si;
(2)B为N元素,B的简单氢化物为NH3,NH3分子之间形成氢键,沸点较高,所以易液化;氨气分子中N原子形成3个N﹣H键,含有1对孤电子对,杂化轨道数目为4,N原子采取sp3杂化;分子的VSEPR模型为四面体形,忽略孤电子对可得微粒空间构型为三角锥形,
故答案为:NH3分子之间形成氢键,沸点较高,所以易液化;sp3;三角锥形;
(3)E元素的正三价离子的3d轨道为半充满,说明E元素原子3d能级有6个电子,4s能级有2个电子,故E元素基态原子价层电子排布式为3d64s2,
故答案为:3d64s2;
(4)B和C形成的化合物常用作高温耐火材料,化学性质稳定,可推断为原子晶体(或共价晶体),
故答案为:原子(或共价);
(5)根据晶胞结构可知,D周围与D等距且最近的O有6个,则该晶体中D的配位数为6;E为Fe,则一个晶胞中,含有Fe的数目为8×+6×=4,不妨取1mol这样的晶胞,则1mol晶胞的质量为m=4×56g=224g,一个晶胞的体积为V=a3cm3,1mol晶胞即有NA个晶胞,1mol晶胞的体积为(NA?a3)cm3,所以晶体密度ρ=g?cm﹣3,
故答案为:6;。
三、实验题(本题包括1小题,共14分)
14.解:(1)A为钠,B为铁,工业上冶炼单质A、B的化学方程式分别为:2NaCl(熔融)2Na+Cl2↑;Fe2O3+3CO2Fe+3CO2,
故答案为:2NaCl(熔融)2Na+Cl2↑;Fe2O3+3CO2Fe+3CO2;
(2)丙为Na2O,和水、CO2反应生成碳酸氢钠方程式为:Na2O+H2O+2CO2=2NaHCO3,
故答案为:Na2O+H2O+2CO2=2NaHCO3;
(3)根据分析甲为NaN3,水合肼(N2H4?H2O)、亚硝酸甲酯(CH3ONO)、NaOH混合得到化合物NaN3的方程式为:N2H4?H2O+CH3ONO+NaOH=NaN3+CH3OH+3H2O,
故答案为:N2H4?H2O+CH3ONO+NaOH=NaN3+CH3OH+3H2O;
(4)化合物甲为NaN3,含有金属钠元素,可以通过焰色反应检测;乙为Fe2O3,含有金属铁元素,可以用KSCN溶液检测,具体操作为:用洁净的铂丝蘸取化合物甲,在酒精灯外焰上灼烧,若火焰呈黄色,则含有钠元素;取少量化合物乙于试管中,加入适量稀盐酸,滴加几滴KSCN溶液,若溶液变红,则含有铁元素,
故答案为:用洁净的铂丝蘸取化合物甲,在酒精灯外焰上灼烧,若火焰呈黄色,则含有钠元素;取少量化合物乙于试管中,加入适量稀盐酸,滴加几滴KSCN溶液,若溶液变红,则含有铁元素。
四、解答题(本题包括1小题,共18分)
15.解:(1)NaCl、NH3、CO2、H2O反应生成NaHCO3、NH4Cl,NaHCO3煅烧得到碳酸钠和CO2,根据图知,A为NH3、B为CO2、C为NH4Cl,C的名称为氯化铵,B为二氧化碳,二氧化碳分子中存在两个碳碳双键,氧原子和碳原子最外层都为8个电子,二氧化碳正确的电子式为,
故答案为:氯化铵;;
(2)NaCl、NH3、CO2、H2O反应生成NaHCO3、NH4Cl,所以其反应原理为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,从溶液中得到难溶性固体采用过滤方法,所以操作X为过滤,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;过滤。
16.解:(1)为使B装置中二氧化碳气体完全被D装置吸收,应该用不和二氧化碳反应且不含二氧化碳的气体将B装置中的二氧化碳排出干净,所以鼓入空气的作用是确保CO2充分被吸收;
空气中含有二氧化碳而影响碳酸钠生成的二氧化碳测定,所以A装置要吸收空气中的二氧化碳,二氧化碳是酸性氧化物,能被碱液吸收,所以可以用NaOH溶液吸收空气中的二氧化碳,则装置A中的液体应选用NaOH溶液,
故答案为:确保CO2充分被吸收;NaOH溶液;
(2)碱石灰能吸收水蒸气,为减少误差,C装置应该为干燥气体的装置且不能和二氧化碳反应,选取浓硫酸作干燥剂,该装置为,
故答案为:;浓硫酸;
(3)D装置增加的质量为二氧化碳质量,m(CO2)=(m2﹣m1)g,根据C原子守恒得n(Na2CO3)=n(CO2)=mol,m(Na2CO3)=mol×106g/mol=×106)g,碳酸钠质量分数=×100%=×100%=×100%;如果缺少装置E,空气中水蒸气和二氧化碳进入D装置,导致二氧化碳测定值偏大,则实验所得纯碱样品的纯度会偏高,
故答案为:×100%;偏高。
五、解答题(本题包括1小题,共14分)
17.解:(1)该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,所以K1>K2,
故答案为:>;
(2)400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数K的值和反应N2(g)+3H2(g)?2NH3(g)的平衡常数呈倒数,所以K==2,当测得NH3和N2、H2的物质的量浓度分别为3mol/L和2mol/L、1mol/L时,400℃时,浓度商Qc==<K=2,说明反应正向进行,因此有v(N2)正>v(N2)逆,
故答案为:2;>;
(3)N2(g)+3H2(g)?2NH3(g)△H<0,反应是气体体积减小的放热反应,
a.不同物质的正逆反应速率之比等于其计量数之比是平衡状态,3υ(N2)(正)=υ(H2)(逆)是平衡状态,υ(N2)(正)=3υ(H2)(逆)不是平衡状态,故a错误;
b.如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故b错误;
c.容器内压强不变,气体的物质的量不变,该反应达平衡状态,故c正确;
d.容器内各物质的浓度之比等于计量数之比,不能证明正逆反应速率相等,故d错误;
故答案为:c;
(4)工业生产中为了提高合成氨反应中H2的转化率,一般会加入稍过量的N2,这样做N2的转化率会减小,
故答案为:减小;
(5)已知反应2N2O(g)?2N2(g)+O2(g)△H=﹣163kJ?mol﹣1,设1mol
N2O(g)分子中化学键断裂时需要吸收的能量为x,则﹣163kJ/mol=(2x﹣2×945kJ/mol﹣498kJ/mol),解得x=1112.5kJ,
故答案为:1112.5;
(6)如图是1mol
NO2和1mol
CO反应生成CO2和NO过程中能量变化示意图,反应焓变△H=134kJ/mol﹣368kJ/mol=﹣234kJ/mol,反应的热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=﹣234kJ/mol,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=﹣234kJ/mol。
第1页(共1页)
同课章节目录
