2020-2021学年上海市崇明区高三(上)期末化学试卷(一模)(答案+解析)
文档属性
| 名称 | 2020-2021学年上海市崇明区高三(上)期末化学试卷(一模)(答案+解析) |  | |
| 格式 | zip | ||
| 文件大小 | 185.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-24 11:14:12 | ||
图片预览




文档简介
2020-2021学年上海市崇明区高三(上)期末化学试卷(一模)
一、选择题(共20小题,每小题2分,满分40分)
1.中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,立即被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些“理解”,你认为其中错误的是( )
A.金刚石属于金属单质
B.这个反应是氧化还原反应
C.另一种化合物为NaCl
D.制造过程中元素种类没有改变
2.下列变化需要加入氧化剂才能实现的转化是( )
A.浓H2SO4→SO2
B.KClO3→O2
C.H2S→SO2
D.HCO3﹣→CO2
3.已知某卤族元素位于周期表中第三周期,该元素原子结构示意图正确的是( )
A.
B.
C.
D.
4.控制变量法是化学实验的常用方法之一,如图所示实验探究影响反应速率的因素是( )
A.催化剂
B.温度
C.压强
D.浓度
5.常温下,下列溶液能用铝制容器盛装的是( )
A.稀硫酸
B.浓硫酸
C.盐酸
D.氢氧化钠的溶液
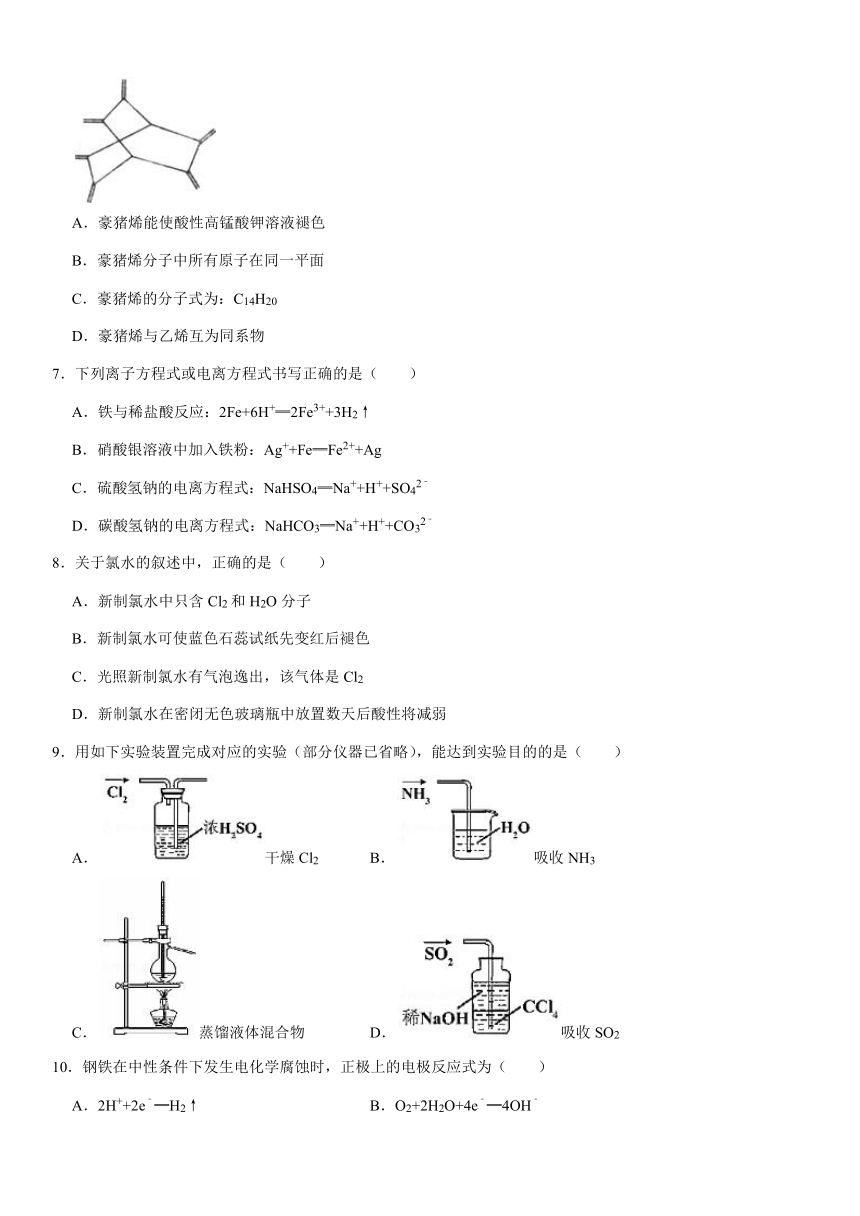
6.豪猪烯(hericenes),形状宛如伏地伸刺的动物,其键线式如图。有关豪猪烯的说法正确的是( )
A.豪猪烯能使酸性高锰酸钾溶液褪色
B.豪猪烯分子中所有原子在同一平面
C.豪猪烯的分子式为:C14H20
D.豪猪烯与乙烯互为同系物
7.下列离子方程式或电离方程式书写正确的是( )
A.铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑
B.硝酸银溶液中加入铁粉:Ag++Fe═Fe2++Ag
C.硫酸氢钠的电离方程式:NaHSO4═Na++H++SO42﹣
D.碳酸氢钠的电离方程式:NaHCO3═Na++H++CO32﹣
8.关于氯水的叙述中,正确的是( )
A.新制氯水中只含Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照新制氯水有气泡逸出,该气体是Cl2
D.新制氯水在密闭无色玻璃瓶中放置数天后酸性将减弱
9.用如下实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
A.干燥Cl2
B.吸收NH3
C.蒸馏液体混合物
D.吸收SO2
10.钢铁在中性条件下发生电化学腐蚀时,正极上的电极反应式为( )
A.2H++2e﹣═H2↑
B.O2+2H2O+4e﹣═4OH﹣
C.Fe﹣2e﹣═Fe2+
D.Fe﹣3e﹣═Fe3+
11.下列说法正确的一组是( )
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②盐都是强电解质
③弱酸、弱碱和水都是弱电解质
④强酸溶液的导电性一定强于弱酸溶液的导电性
⑤电解质溶液能导电的原因是溶液中有自由移动的阴、阳离子
⑥熔融的电解质都能导电.
A.①③⑤⑥
B.②④⑤⑥
C.③⑤
D.③⑥
12.二氧化硫体现还原性的反应是( )
A.SO2+Na2CO3=Na2SO3+CO2
B.SO2+2H2S=2H2O+3S↓
C.SO2+2NaOH=Na2SO3+H2O
D.SO2+2H2O+Cl2=H2SO4+2HCl
13.关于合成氨和联合制纯碱工业生产的叙述中,正确的是( )
A.合成氨生产过程中将NH3液化分离,可加大正反应速率
B.联合制碱法生产工艺相对于氨碱法生产工艺,其优点之一是提高了食盐的利用率
C.合成氨反应产物混合气体中NH3只占15%左右,所以合成氨生产中氢气的利用率都很低
D.联合制碱法中关键的一步是向分离出NaHCO3晶体后的母液中不断地通入CO2
14.NA为阿伏加德罗常数,以下说法正确的是( )
A.18g
D2O和18g
T2O中含有的质子数均为10NA
B.0.5mol?L﹣1Ba(OH)2溶液中含有的OH﹣的数目为NA
C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
D.某密闭容器盛有0.1mol
N2和0.3mol
H2,在一定条件下充分反应,转移电子的数目为0.6NA
15.下列溶液中分别加入足量的铁粉,充分作用后,溶液中的阳离子总物质的量明显减少,该溶液是( )
A.CuCl2
B.HCl
C.FeCl3
D.MgCl2
16.北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的球碳盐K3C60.实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构分析正确的是( )
A.K3C60中既有离子键又有极性键
B.1mol
K3C60中含有的离子数目为63×6.02×1023
C.该晶体在熔融状态下能导电
D.该物质的化学式可写作KC20
17.某有机物不能发生的化学反应是( )
A.消去反应
B.取代反应
C.氧化反应
D.加成反应
18.对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)+Q,下列叙述正确的是( )
A.达到化学平衡时4v正(O2)=5v逆(NO)
B.若单位时间内生成xmol
NO的同时,消耗xmol
NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大
19.如图所示是298K时N2与H2反应过程中,能量变化的曲线图.下列叙述正确的是( )
A.该反应的热化学方程式为:N2+3H2?2NH3△H=﹣92
kJ/mol
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在温度、体积一定的条件下,通入1mol
N2和3mol
H2反应后放出的热量为Q1kJ,若通入2mol
N2和6mol
H2反应后放出的热量为Q2kJ,则184>Q2>2Q1
20.由H2,Cl2,O2组成的混合气体,在一定条件下恰好完全反应生成盐酸(无气体剩余)则原混合气体中H2,Cl2,O2的物质的量之比可能是( )
A.3:2:1
B.6:1:2
C.5:3:1
D.7:4:1
二、解答题(共4小题,满分60分)
21.已知:有机化合物A的分子式为C3H6O,能发生银镜反应;C分子中共有14个碳原子。各有机物间有如图转化关系。
(1)写出反应类型:反应①
,反应②
。
(2)B分子中官能团的名称是
。D物质的类别是
。
(3)写出E的结构简式:
。
(4)写出下列反应的化学方程式:A→B
。B→C
。
(5)B→C反应中浓硫酸的作用是
。
(6)若C8H8Cl2苯环上的一溴取代物只有一种,其可能的结构除了外,再写出两种
、
。(用结构简式表示)
22.铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.实验室现有下列试剂:0.01mol/L
酸性KMnO4溶液、0.1mol/L
KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水.请你协助他们探究所得溶液和气体的成分.
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有
中的一种或两种.
【实验探究】
实验操作
预期现象
结论
验证猜想Ⅰ
步骤①:取少量0.01mol/L酸性KMnO4溶液,滴入所得溶液
步骤②:
含有Fe3+
验证猜想Ⅱ
将所得气体通入如图装置:
含有两种气体
【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:
.
23.(1)合成氨的工业生产中,进行氨合成反应的装置名称是
,该装置中设置热交换器的目的是
,在生产工艺中,采用了原料气循环使用的方法,其目的是
。
(2)在一定体积的密闭容器中,有如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g)。其化学平衡常数K和温度的关系如表:
t/℃
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
①该反应的化学平衡常数表达式为K=
。
②该反应为
反应。(填“吸热”“放热”)
③向上述平衡体系中加入CO2,达新平衡后H2的转化率
。(选填:“增大”、“不变”“减小”)
④反应达平衡后,向容器中通入与平衡混合气组成、比例相同的气体,达到新平衡时与原平衡相比,有关说法正确的是
。
A.反应物转化率增大
B.逆反应速率增大
C.各物质的比例不变
D.c(CO2)增大、c(CO)减小
⑤某温度下,平衡浓度符合:3[c(CO2)?c(H2)]=5[c(CO)?c(H2O)],此温度为
℃。
24.(1)氮元素在元素周期表中的位置为
。
(2)氮元素原子核外电子排布式为
,有
种形状的电子云。
(3)氮元素气态氢化物的电子式为
。
与氮元素同主族的磷元素化合物有如下反应,其中反应物有:PH3、H2SO4、KClO3;生成物有:K2SO4、H3PO4、H2O和一种未知物质X。
(4)已知KClO3在反应中得到电子,则该反应的还原剂是
。
(5)已知0.2mol
KClO3在反应中得到1mol电子生成X,则X的化学式为
。
(6)完成并配平上述反应的化学方程式,标出电子转移方向和数目:
。
(7)根据上述反应可推知
。(填序号)
A.氧化性:KClO3>H3PO4
B.氧化性:KClO3>H2O
C.还原性:PH3>X
D.还原性:PH3>K2SO4
(8)在该反应中转移电子2mol时,生成H3PO4
mol。
2020-2021学年上海市崇明区高三(上)期末化学试卷(一模)
参考答案与试题解析
一、选择题(共20小题,每小题2分,满分40分)
1.【解答】解:A.金刚石是碳的单质,属于非金属单质,故A错误;
B.反应中存在元素化合价的变化,是氧化还原反应,故B正确;
C.由分析可知,另一种化合物为NaCl,故C正确;
D.由质量守恒可知,制造过程中元素种类没有改变,故D正确;
故选:A。
2.【解答】解:A.S元素的化合价降低,需加还原剂,故A不选;
B.可发生自身氧化还原反应实现转化,故B不选;
C.S元素的化合价升高,需要加氧化剂,故C选;
D.无元素的化合价变化,不发生氧化还原反应,故D不选;
故选:C。
3.【解答】解:已知某卤族元素位于周期表中第三周期,则该原子为氯原子,有3个电子层,最外层有7个电子,结构示意图正确为:,
故选:C。
4.【解答】解:两个实验中,过氧化氢体积相同,催化剂相同,但浓度不同,则该实验探究影响反应速率的因素是浓度,浓度不同,反应速率不同。
故选:D。
5.【解答】解:A.Al与稀硫酸可发生反应至反应结束,不能用铝制容器盛装,故A不选;
B.常温下Al遇浓硫酸发生钝化,生成致密的氧化膜阻止反应的进一步发生,能用铝制容器盛装,故B选;
C.Al与盐酸可发生反应至反应结束,不能用铝制容器盛装,故C不选;
D.Al与NaOH溶液可发生反应至反应结束,不能用铝制容器盛装,故D不选;
故选:B。
6.【解答】解:A.含有碳碳双键,所以能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故A正确;
B.分子中含有1个具有甲烷结构的碳原子且这1个碳原子都连接4个碳原子,则该分子中所有碳原子不能共平面,故B错误;
C.根据结构简式确定分子式为C14H14,故C错误;
D.豪猪烯和乙烯结构不相似,所以二者不互为同系物,故D错误;
故选:A。
7.【解答】解:A.铁与稀盐酸反应,离子方程式:Fe+2H+═Fe2++H2↑,故A错误;
B.硝酸银溶液中加入铁粉,离子方程式:2Ag++Fe═Fe2++2Ag,故B错误;
C.硫酸氢钠为强电解质,完全电离,电离方程式:NaHSO4═Na++H++SO42﹣,故C正确;
D.碳酸氢钠的电离方程式:NaHCO3═Na++HCO3﹣,故D错误。
故选:C。
8.【解答】解:A.氯水中含有氯气和水和次氯酸分子,共三种分子,故A错误;
B.氯水中含有盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性,所以新制氯水可使蓝色石蕊试纸先变红后褪色,故B正确;
C.次氯酸见光分解生成氯化氢和氧气,所以光照新制氯水有气泡逸出,该气体是氧气,故C错误;
D.次氯酸见光分解生成氯化氢和氧气,所以新制氯水在密闭无色玻璃瓶中放置数天后酸性将增强,故D错误。
故选:B。
9.【解答】解:A.干燥气体时导管长进短出,图中进气方向不合理,故A错误;
B.氨气极易溶于水,图中装置易发生倒吸,故B错误;
C.蒸馏时温度计测定馏分的温度,则温度计水银球应在支管口处,故C错误;
D.二氧化硫与NaOH反应,四氯化碳可隔绝气体与溶液,可吸收尾气且防止倒吸,故D正确;
故选:D。
10.【解答】解:弱酸性或中性条件下,钢铁发生吸氧腐蚀,负极上铁失电子发生氧化反应,负极反应式为Fe﹣2e﹣═Fe2+,正极上氧气得电子和水反应生成氢氧根离子,所以正极反应式为O2+2H2O+4e﹣═OH﹣,
故选:B。
11.【解答】解:①电解质的强弱与溶解性无关,不溶于水的盐可能是强电解质,CaCO3、BaSO4均是强电解质,故①错误;
②绝大多数的盐属于强电解质,少部分盐属于弱电解质,如醋酸铅就属于弱电解质,故②错误;
③弱电解质包括弱酸、弱碱和少部分盐以及水,故③正确;
④强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度,H+浓度与酸的浓度、分子中氢离子的个数以及电离程度有关,与电解质的强弱无关,故④错误;
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子,故⑤正确;
⑥酸为共价化合物,在熔融态时均不导电,只有溶于水时才导电,故⑥错误;
故选:C。
12.【解答】解:A.SO2+Na2CO3=Na2SO3+CO2,无化合价变化,不属于氧化还原反应,故A错误;
B.SO2+2H2S=2H2O+3S↓中二氧化硫的硫元素化合价降低,体现氧化性,故B错误;
C.SO2+2NaOH=Na2SO3+H2O,无化合价变化,不属于氧化还原反应,故C错误;
D.SO2+2H2O+Cl2=H2SO4+2HCl中二氧化硫的硫元素化合价升高,体现还原性,故D正确;
故选:D。
13.【解答】解:A.合成氨生产过程中将NH3液化分离,减小氨气的浓度会导致正逆反应速率减慢,但平衡向正反应方向移动,提高了N2、H2的转化率,故A错误;
B.联合制碱法生产工艺中循环使用食盐,其目的是提高食盐的利用率,故B正确;
C.虽然从合成塔出来的混合气体中NH3只占15%,但由于原料气N2和H2循环使用和不断分离出液氨,所以生产NH3的效率还是很高的,故C错误;
D.联合制碱法中关键的一步是饱和氯化钠溶液中先通入氨气再通入CO2,故D错误;
故选:B。
14.【解答】解:A.18g的D2O的物质的量为=0.9mol,故含质子数为9NA,18g
T2O的物质的量为=0.81mol,故含质子数为8.1NA,故A错误;
B.溶液体积不明确,故溶液中总的OH﹣的物质的量和个数无法计算,故B错误;
C.过氧化钠与水反应时发生歧化反应,2Na2O2+2H2O═4NaOH+O2↑,﹣1价升高到0价,同时降低到﹣2价,所以每生成0.1mol氧气转移的电子数为0.2NA,故C正确;
D.氮气和氢气合成氨
N2+3H2?2NH3是可逆反应,不能进行彻底,所以0.1
mol
N2与0.3
mol
H2充分反应后生成NH3的分子数小于0.2NA,转移电子的数目小于0.6NA,故D错误,
故选:C。
15.【解答】解:A.金属铁会将溶液中的铜离子以金属铜的形式置换出来:Fe+Cu2+═Fe2++Cu,溶液中的阳离子总物质的量不变,故A错误;
B.金属铁可以和盐酸反应生成氯化亚铁和氢气:Fe+2H+═Fe2++H2↑,溶液中的阳离子总物质的量明显减少,故B正确;
C.金属铁可以和三价铁离子之间反应生成亚铁离子:Fe+2Fe3+═3Fe2+,溶液中的阳离子总物质的量增加,故C错误;
D.金属铁和氯化镁之间不反应,溶液中的阳离子总物质的量不变,故D错误。
故选:B。
16.【解答】解:A.该物质中K+和C603﹣之间存在离子键、C原子之间存在非极性共价键,故A错误;
B.1个
K3C60中存在3个离子键,所以1mol
K3C60中含有的离子数目为3×6.02×1023,故B错误;
C.含有自由移动离子或电子的物质能导电,熔融状态下的K3C60中含有自由移动的离子,所以能导电,故C正确;
D.该物质的化学式是由3个K+和一个C603﹣构成的,不能写成KC20,故D错误;
故选:C。
17.【解答】解:A.连接醇羟基的碳原子相邻碳原子上不含氢原子,则不能发生消去反应,故A错误;
B.含有醇羟基,所以能发生取代反应,故B正确;
C.含有碳碳双键且连接醇羟基的碳原子上含有H原子,所以能发生氧化反应,故C正确;
D.含有碳碳双键,所以能发生加成反应,故D正确;
故选:A。
18.【解答】解:A.由于v逆(O2):v逆(NO)=5:4,故4v逆(O2)=5v逆(NO),而4v正(O2)=5v逆(NO),则v正(O2)=v逆(O2),说明可逆反应到达平衡,故A正确;
B.生成xmol
NO的同时,需要消耗xmol
NH3,均表示正反应速率,反应一旦发生,始终按该比例关系进行,不能说明可逆反应到达平衡,故B错误;
C.增加容器体积,各组分浓度减小,正、逆反应速率都减小,压强减小,平衡正向移动,逆反应速率减小的更多,故C错误;
D.升高温度,正、逆反应速率都增大,正反应为放热反应,平衡逆向移动,逆反应速率增大更多,故D错误;
故选:A。
19.【解答】解:A、该反应的热化学方程式为:N2
(g)+3H2(g)?2NH3
(g)△H=﹣92KJ/mol;故A错误;
B、催化剂降低反应的活化能,改变反应速率不改变平衡,a曲线是未加入催化剂时的能量变化曲线,b曲线是加入催化剂时的能量变化曲线,故B错误;
C、催化剂只能降低正逆反应的活化能,对反应物和生成物的总能量无影响,故对反应热无影响,故C错误;
D、向密闭容器中通入1mol
N2和3mol
H2,不可能完全转化,所以达到平衡时放出热量Q1kJ;另一容积相同的密闭容器中通入2mol
N2和6mol
H2,达到平衡时原平衡相同,则放出热量应该是2QkJ,通入2mol
N2和6mol
H2的压强比通入1mol
N2和3mol
H2的大了,平衡还会向正向移动,放出的热量还会增大,但由于是可逆反应,反应不能进行彻底,故184KJ>Q2,即184>Q2>2Q1,故D正确。
故选:D。
20.【解答】解:发生反应:2H2+O22H2O、H2+Cl22HCl,恰好完全反应生成盐酸且三种气体没有剩余,由方程式可得:n(H2)=n(Cl2)+2n(O2),
A.3≠2+1×2,故A不符合;
B.6≠1+2×2,故B不符合;
C.5=3+1×2,故C符合;
D.7≠4+1×2,故D不符合;
故选:C。
二、解答题(共4小题,满分60分)
21.【解答】解:(1)①②的反应类型分别为消去反应、水解或取代反应,
故答案为:消去反应;水解或取代反应;
(2)B分子中官能团的名称是羟基,D物质的类别是醛,
故答案为:羟基;醛;
(3)E的结构简式为,
故答案为:;
(4)A→B的化学反应为CH3CH2CHO+H2CH3CH2CH2OH,B→C的化学反应为,
故答案为:CH3CH2CHO+H2CH3CH2CH2OH;;
(5)B→C反应中浓硫酸的作用是催化作用、吸水作用,
故答案为:催化作用、吸水作用;
(6)若C8H8Cl2苯环上的一溴取代物只有一种,说明苯环上只有一种H原子,结构应对称,可能的结构有、、、,
故答案为:;。
22.【解答】解:【提出猜想】浓硫酸和铁反应生成二氧化硫,稀硫酸和铁反应生成氢气,所以所得气体中可能含有SO2、H2,
故答案为:SO2、H2;
【实验探究】
验证猜想Ⅰ、酸性高锰酸钾有强氧化性,二价铁离子有还原性,所以酸性高锰酸钾能和二价铁离子发生氧化还原反应,如果步骤①溶液紫红色褪去,说明含有二价铁离子,否则没有.
碘化钾有还原性,三价铁离子有氧化性,碘离子和三价铁离子能发生氧化还原反应生成单质碘,碘遇淀粉变蓝色,所以步骤②另取少量所得溶液,滴加KI溶液和淀粉溶液,如果溶液变为蓝色,说明含有三价铁离子,否则没有,
故答案为:溶液紫红色褪去;含有Fe2+;另取少量所得溶液,滴加KI溶液和淀粉溶液;溶液变为蓝色;
猜想Ⅱ、二氧化硫有还原性,能和强氧化性的物质发生氧化还原反应,如能使酸性高锰酸钾溶液褪色,氢气不能使酸性高锰酸钾溶液褪色,但氢气不易溶于水,所以如果甲中KMnO4溶液褪色,说明含有二氧化硫;乙中KMnO4溶液颜色不变,说明二氧化硫完全被吸收,如果试管中收集气体,只能是氢气,
故答案为:甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体;
【问题讨论】
双氧水具有氧化性,二价铁离子有还原性,双氧水和二价铁离子能发生氧化还原反应生成三价铁离子,KSCN只能检验三价铁离子不能检验二价铁离子,所以若溶液中含有Fe3+则无法检验溶液中是否含有Fe2+,所以该观点不正确,
故答案为:不正确,若溶液中含有Fe3+则无法检验溶液中是否含有Fe2+.
23.【解答】解:(1)合成氨的工业生产中,进行氨合成反应的装置名称是合成塔,该装置中设置热交换器的目的是利用反应余热、节约能源,在生产工艺中,采用了原料气循环使用的方法,其目的是提高原料的利用率,
故答案为:合成塔;利用反应余热、节约能源;提高原料的利用率;
(2)①K为生成物浓度幂之积与反应物浓度幂之积的比,则K=,
故答案为:;
②由表中数据可知,温度越高、K越大,则升高温度平衡正向移动,正反应为吸热反应,
故答案为:吸热;
③加入CO2,促进氢气的转化,则氢气的转化率增大,
故答案为:增大;
④平衡后,向容器中通入与平衡混合气组成、比例相同的气体,可看成增大压强,平衡不移动,二者为等效平衡,则正逆反应速率均增大,各物质的比例不变,且转化率不变、平衡浓度相同,
故答案为:BC;
⑤平衡浓度符合:3[c(CO2)?c(H2)]=5[c(CO)?c(H2O)],可知K==0.6,由表中数据可知温度为700℃,
故答案为:700。
24.【解答】解:(1)氮在周期表中第二周期VA族,
故答案为:第二周期VA族;
(2)氮元素原子核外电子排布式为1s22s22p3可知氮原子核外有s、p两种不同的电子云形状,
故答案为:1s22s22p3;2;
(3)氮元素气态氢化物为NH3,其电子式为,
故答案为:;
(4)反应前后磷元素化合价升高(﹣3到+5),所以还原剂是PH3,
故答案为:PH3;
(5)已知0.2molKClO3在反应中得到1mol电子,所以一个氯原子得5个电子,化合价降低5,所以生成物中氯元素为零价,
故答案为:Cl2;
(6)KClO3具有强氧化性,PH3具有强还原性,由(5)可知KClO3被还原为Cl2,此过程中P由﹣3价升高至+5价,转移8e﹣,Cl由+5价降低至0价,转移5e﹣电子,则电子转移的最小公倍数为40,据此配平可得方程式为5PH3+4H2SO4+8KClO3=4K2SO4+5H3PO4+4H2O+4Cl2,共转移40e﹣,单线桥为,
故答案为:;
(7)由反应可以判断氧化剂是KClO3,氧化产物是H3PO4,氧化剂氧化性大于氧化产物,所以A正确,还原剂是PH3,还原产物是X,还原剂的还原性大于还原产物,所以C正确,
故答案为:AC;
(8)由,可知每转移40摩尔电子,生成磷酸5摩尔,所以转移电子2mol时,生成H3PO40.25mol,
故答案为:0.25。
一、选择题(共20小题,每小题2分,满分40分)
1.中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,立即被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些“理解”,你认为其中错误的是( )
A.金刚石属于金属单质
B.这个反应是氧化还原反应
C.另一种化合物为NaCl
D.制造过程中元素种类没有改变
2.下列变化需要加入氧化剂才能实现的转化是( )
A.浓H2SO4→SO2
B.KClO3→O2
C.H2S→SO2
D.HCO3﹣→CO2
3.已知某卤族元素位于周期表中第三周期,该元素原子结构示意图正确的是( )
A.
B.
C.
D.
4.控制变量法是化学实验的常用方法之一,如图所示实验探究影响反应速率的因素是( )
A.催化剂
B.温度
C.压强
D.浓度
5.常温下,下列溶液能用铝制容器盛装的是( )
A.稀硫酸
B.浓硫酸
C.盐酸
D.氢氧化钠的溶液
6.豪猪烯(hericenes),形状宛如伏地伸刺的动物,其键线式如图。有关豪猪烯的说法正确的是( )
A.豪猪烯能使酸性高锰酸钾溶液褪色
B.豪猪烯分子中所有原子在同一平面
C.豪猪烯的分子式为:C14H20
D.豪猪烯与乙烯互为同系物
7.下列离子方程式或电离方程式书写正确的是( )
A.铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑
B.硝酸银溶液中加入铁粉:Ag++Fe═Fe2++Ag
C.硫酸氢钠的电离方程式:NaHSO4═Na++H++SO42﹣
D.碳酸氢钠的电离方程式:NaHCO3═Na++H++CO32﹣
8.关于氯水的叙述中,正确的是( )
A.新制氯水中只含Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照新制氯水有气泡逸出,该气体是Cl2
D.新制氯水在密闭无色玻璃瓶中放置数天后酸性将减弱
9.用如下实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
A.干燥Cl2
B.吸收NH3
C.蒸馏液体混合物
D.吸收SO2
10.钢铁在中性条件下发生电化学腐蚀时,正极上的电极反应式为( )
A.2H++2e﹣═H2↑
B.O2+2H2O+4e﹣═4OH﹣
C.Fe﹣2e﹣═Fe2+
D.Fe﹣3e﹣═Fe3+
11.下列说法正确的一组是( )
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②盐都是强电解质
③弱酸、弱碱和水都是弱电解质
④强酸溶液的导电性一定强于弱酸溶液的导电性
⑤电解质溶液能导电的原因是溶液中有自由移动的阴、阳离子
⑥熔融的电解质都能导电.
A.①③⑤⑥
B.②④⑤⑥
C.③⑤
D.③⑥
12.二氧化硫体现还原性的反应是( )
A.SO2+Na2CO3=Na2SO3+CO2
B.SO2+2H2S=2H2O+3S↓
C.SO2+2NaOH=Na2SO3+H2O
D.SO2+2H2O+Cl2=H2SO4+2HCl
13.关于合成氨和联合制纯碱工业生产的叙述中,正确的是( )
A.合成氨生产过程中将NH3液化分离,可加大正反应速率
B.联合制碱法生产工艺相对于氨碱法生产工艺,其优点之一是提高了食盐的利用率
C.合成氨反应产物混合气体中NH3只占15%左右,所以合成氨生产中氢气的利用率都很低
D.联合制碱法中关键的一步是向分离出NaHCO3晶体后的母液中不断地通入CO2
14.NA为阿伏加德罗常数,以下说法正确的是( )
A.18g
D2O和18g
T2O中含有的质子数均为10NA
B.0.5mol?L﹣1Ba(OH)2溶液中含有的OH﹣的数目为NA
C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
D.某密闭容器盛有0.1mol
N2和0.3mol
H2,在一定条件下充分反应,转移电子的数目为0.6NA
15.下列溶液中分别加入足量的铁粉,充分作用后,溶液中的阳离子总物质的量明显减少,该溶液是( )
A.CuCl2
B.HCl
C.FeCl3
D.MgCl2
16.北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的球碳盐K3C60.实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构分析正确的是( )
A.K3C60中既有离子键又有极性键
B.1mol
K3C60中含有的离子数目为63×6.02×1023
C.该晶体在熔融状态下能导电
D.该物质的化学式可写作KC20
17.某有机物不能发生的化学反应是( )
A.消去反应
B.取代反应
C.氧化反应
D.加成反应
18.对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)+Q,下列叙述正确的是( )
A.达到化学平衡时4v正(O2)=5v逆(NO)
B.若单位时间内生成xmol
NO的同时,消耗xmol
NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大
19.如图所示是298K时N2与H2反应过程中,能量变化的曲线图.下列叙述正确的是( )
A.该反应的热化学方程式为:N2+3H2?2NH3△H=﹣92
kJ/mol
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在温度、体积一定的条件下,通入1mol
N2和3mol
H2反应后放出的热量为Q1kJ,若通入2mol
N2和6mol
H2反应后放出的热量为Q2kJ,则184>Q2>2Q1
20.由H2,Cl2,O2组成的混合气体,在一定条件下恰好完全反应生成盐酸(无气体剩余)则原混合气体中H2,Cl2,O2的物质的量之比可能是( )
A.3:2:1
B.6:1:2
C.5:3:1
D.7:4:1
二、解答题(共4小题,满分60分)
21.已知:有机化合物A的分子式为C3H6O,能发生银镜反应;C分子中共有14个碳原子。各有机物间有如图转化关系。
(1)写出反应类型:反应①
,反应②
。
(2)B分子中官能团的名称是
。D物质的类别是
。
(3)写出E的结构简式:
。
(4)写出下列反应的化学方程式:A→B
。B→C
。
(5)B→C反应中浓硫酸的作用是
。
(6)若C8H8Cl2苯环上的一溴取代物只有一种,其可能的结构除了外,再写出两种
、
。(用结构简式表示)
22.铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.实验室现有下列试剂:0.01mol/L
酸性KMnO4溶液、0.1mol/L
KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水.请你协助他们探究所得溶液和气体的成分.
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有
中的一种或两种.
【实验探究】
实验操作
预期现象
结论
验证猜想Ⅰ
步骤①:取少量0.01mol/L酸性KMnO4溶液,滴入所得溶液
步骤②:
含有Fe3+
验证猜想Ⅱ
将所得气体通入如图装置:
含有两种气体
【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:
.
23.(1)合成氨的工业生产中,进行氨合成反应的装置名称是
,该装置中设置热交换器的目的是
,在生产工艺中,采用了原料气循环使用的方法,其目的是
。
(2)在一定体积的密闭容器中,有如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g)。其化学平衡常数K和温度的关系如表:
t/℃
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
①该反应的化学平衡常数表达式为K=
。
②该反应为
反应。(填“吸热”“放热”)
③向上述平衡体系中加入CO2,达新平衡后H2的转化率
。(选填:“增大”、“不变”“减小”)
④反应达平衡后,向容器中通入与平衡混合气组成、比例相同的气体,达到新平衡时与原平衡相比,有关说法正确的是
。
A.反应物转化率增大
B.逆反应速率增大
C.各物质的比例不变
D.c(CO2)增大、c(CO)减小
⑤某温度下,平衡浓度符合:3[c(CO2)?c(H2)]=5[c(CO)?c(H2O)],此温度为
℃。
24.(1)氮元素在元素周期表中的位置为
。
(2)氮元素原子核外电子排布式为
,有
种形状的电子云。
(3)氮元素气态氢化物的电子式为
。
与氮元素同主族的磷元素化合物有如下反应,其中反应物有:PH3、H2SO4、KClO3;生成物有:K2SO4、H3PO4、H2O和一种未知物质X。
(4)已知KClO3在反应中得到电子,则该反应的还原剂是
。
(5)已知0.2mol
KClO3在反应中得到1mol电子生成X,则X的化学式为
。
(6)完成并配平上述反应的化学方程式,标出电子转移方向和数目:
。
(7)根据上述反应可推知
。(填序号)
A.氧化性:KClO3>H3PO4
B.氧化性:KClO3>H2O
C.还原性:PH3>X
D.还原性:PH3>K2SO4
(8)在该反应中转移电子2mol时,生成H3PO4
mol。
2020-2021学年上海市崇明区高三(上)期末化学试卷(一模)
参考答案与试题解析
一、选择题(共20小题,每小题2分,满分40分)
1.【解答】解:A.金刚石是碳的单质,属于非金属单质,故A错误;
B.反应中存在元素化合价的变化,是氧化还原反应,故B正确;
C.由分析可知,另一种化合物为NaCl,故C正确;
D.由质量守恒可知,制造过程中元素种类没有改变,故D正确;
故选:A。
2.【解答】解:A.S元素的化合价降低,需加还原剂,故A不选;
B.可发生自身氧化还原反应实现转化,故B不选;
C.S元素的化合价升高,需要加氧化剂,故C选;
D.无元素的化合价变化,不发生氧化还原反应,故D不选;
故选:C。
3.【解答】解:已知某卤族元素位于周期表中第三周期,则该原子为氯原子,有3个电子层,最外层有7个电子,结构示意图正确为:,
故选:C。
4.【解答】解:两个实验中,过氧化氢体积相同,催化剂相同,但浓度不同,则该实验探究影响反应速率的因素是浓度,浓度不同,反应速率不同。
故选:D。
5.【解答】解:A.Al与稀硫酸可发生反应至反应结束,不能用铝制容器盛装,故A不选;
B.常温下Al遇浓硫酸发生钝化,生成致密的氧化膜阻止反应的进一步发生,能用铝制容器盛装,故B选;
C.Al与盐酸可发生反应至反应结束,不能用铝制容器盛装,故C不选;
D.Al与NaOH溶液可发生反应至反应结束,不能用铝制容器盛装,故D不选;
故选:B。
6.【解答】解:A.含有碳碳双键,所以能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故A正确;
B.分子中含有1个具有甲烷结构的碳原子且这1个碳原子都连接4个碳原子,则该分子中所有碳原子不能共平面,故B错误;
C.根据结构简式确定分子式为C14H14,故C错误;
D.豪猪烯和乙烯结构不相似,所以二者不互为同系物,故D错误;
故选:A。
7.【解答】解:A.铁与稀盐酸反应,离子方程式:Fe+2H+═Fe2++H2↑,故A错误;
B.硝酸银溶液中加入铁粉,离子方程式:2Ag++Fe═Fe2++2Ag,故B错误;
C.硫酸氢钠为强电解质,完全电离,电离方程式:NaHSO4═Na++H++SO42﹣,故C正确;
D.碳酸氢钠的电离方程式:NaHCO3═Na++HCO3﹣,故D错误。
故选:C。
8.【解答】解:A.氯水中含有氯气和水和次氯酸分子,共三种分子,故A错误;
B.氯水中含有盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性,所以新制氯水可使蓝色石蕊试纸先变红后褪色,故B正确;
C.次氯酸见光分解生成氯化氢和氧气,所以光照新制氯水有气泡逸出,该气体是氧气,故C错误;
D.次氯酸见光分解生成氯化氢和氧气,所以新制氯水在密闭无色玻璃瓶中放置数天后酸性将增强,故D错误。
故选:B。
9.【解答】解:A.干燥气体时导管长进短出,图中进气方向不合理,故A错误;
B.氨气极易溶于水,图中装置易发生倒吸,故B错误;
C.蒸馏时温度计测定馏分的温度,则温度计水银球应在支管口处,故C错误;
D.二氧化硫与NaOH反应,四氯化碳可隔绝气体与溶液,可吸收尾气且防止倒吸,故D正确;
故选:D。
10.【解答】解:弱酸性或中性条件下,钢铁发生吸氧腐蚀,负极上铁失电子发生氧化反应,负极反应式为Fe﹣2e﹣═Fe2+,正极上氧气得电子和水反应生成氢氧根离子,所以正极反应式为O2+2H2O+4e﹣═OH﹣,
故选:B。
11.【解答】解:①电解质的强弱与溶解性无关,不溶于水的盐可能是强电解质,CaCO3、BaSO4均是强电解质,故①错误;
②绝大多数的盐属于强电解质,少部分盐属于弱电解质,如醋酸铅就属于弱电解质,故②错误;
③弱电解质包括弱酸、弱碱和少部分盐以及水,故③正确;
④强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度,H+浓度与酸的浓度、分子中氢离子的个数以及电离程度有关,与电解质的强弱无关,故④错误;
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子,故⑤正确;
⑥酸为共价化合物,在熔融态时均不导电,只有溶于水时才导电,故⑥错误;
故选:C。
12.【解答】解:A.SO2+Na2CO3=Na2SO3+CO2,无化合价变化,不属于氧化还原反应,故A错误;
B.SO2+2H2S=2H2O+3S↓中二氧化硫的硫元素化合价降低,体现氧化性,故B错误;
C.SO2+2NaOH=Na2SO3+H2O,无化合价变化,不属于氧化还原反应,故C错误;
D.SO2+2H2O+Cl2=H2SO4+2HCl中二氧化硫的硫元素化合价升高,体现还原性,故D正确;
故选:D。
13.【解答】解:A.合成氨生产过程中将NH3液化分离,减小氨气的浓度会导致正逆反应速率减慢,但平衡向正反应方向移动,提高了N2、H2的转化率,故A错误;
B.联合制碱法生产工艺中循环使用食盐,其目的是提高食盐的利用率,故B正确;
C.虽然从合成塔出来的混合气体中NH3只占15%,但由于原料气N2和H2循环使用和不断分离出液氨,所以生产NH3的效率还是很高的,故C错误;
D.联合制碱法中关键的一步是饱和氯化钠溶液中先通入氨气再通入CO2,故D错误;
故选:B。
14.【解答】解:A.18g的D2O的物质的量为=0.9mol,故含质子数为9NA,18g
T2O的物质的量为=0.81mol,故含质子数为8.1NA,故A错误;
B.溶液体积不明确,故溶液中总的OH﹣的物质的量和个数无法计算,故B错误;
C.过氧化钠与水反应时发生歧化反应,2Na2O2+2H2O═4NaOH+O2↑,﹣1价升高到0价,同时降低到﹣2价,所以每生成0.1mol氧气转移的电子数为0.2NA,故C正确;
D.氮气和氢气合成氨
N2+3H2?2NH3是可逆反应,不能进行彻底,所以0.1
mol
N2与0.3
mol
H2充分反应后生成NH3的分子数小于0.2NA,转移电子的数目小于0.6NA,故D错误,
故选:C。
15.【解答】解:A.金属铁会将溶液中的铜离子以金属铜的形式置换出来:Fe+Cu2+═Fe2++Cu,溶液中的阳离子总物质的量不变,故A错误;
B.金属铁可以和盐酸反应生成氯化亚铁和氢气:Fe+2H+═Fe2++H2↑,溶液中的阳离子总物质的量明显减少,故B正确;
C.金属铁可以和三价铁离子之间反应生成亚铁离子:Fe+2Fe3+═3Fe2+,溶液中的阳离子总物质的量增加,故C错误;
D.金属铁和氯化镁之间不反应,溶液中的阳离子总物质的量不变,故D错误。
故选:B。
16.【解答】解:A.该物质中K+和C603﹣之间存在离子键、C原子之间存在非极性共价键,故A错误;
B.1个
K3C60中存在3个离子键,所以1mol
K3C60中含有的离子数目为3×6.02×1023,故B错误;
C.含有自由移动离子或电子的物质能导电,熔融状态下的K3C60中含有自由移动的离子,所以能导电,故C正确;
D.该物质的化学式是由3个K+和一个C603﹣构成的,不能写成KC20,故D错误;
故选:C。
17.【解答】解:A.连接醇羟基的碳原子相邻碳原子上不含氢原子,则不能发生消去反应,故A错误;
B.含有醇羟基,所以能发生取代反应,故B正确;
C.含有碳碳双键且连接醇羟基的碳原子上含有H原子,所以能发生氧化反应,故C正确;
D.含有碳碳双键,所以能发生加成反应,故D正确;
故选:A。
18.【解答】解:A.由于v逆(O2):v逆(NO)=5:4,故4v逆(O2)=5v逆(NO),而4v正(O2)=5v逆(NO),则v正(O2)=v逆(O2),说明可逆反应到达平衡,故A正确;
B.生成xmol
NO的同时,需要消耗xmol
NH3,均表示正反应速率,反应一旦发生,始终按该比例关系进行,不能说明可逆反应到达平衡,故B错误;
C.增加容器体积,各组分浓度减小,正、逆反应速率都减小,压强减小,平衡正向移动,逆反应速率减小的更多,故C错误;
D.升高温度,正、逆反应速率都增大,正反应为放热反应,平衡逆向移动,逆反应速率增大更多,故D错误;
故选:A。
19.【解答】解:A、该反应的热化学方程式为:N2
(g)+3H2(g)?2NH3
(g)△H=﹣92KJ/mol;故A错误;
B、催化剂降低反应的活化能,改变反应速率不改变平衡,a曲线是未加入催化剂时的能量变化曲线,b曲线是加入催化剂时的能量变化曲线,故B错误;
C、催化剂只能降低正逆反应的活化能,对反应物和生成物的总能量无影响,故对反应热无影响,故C错误;
D、向密闭容器中通入1mol
N2和3mol
H2,不可能完全转化,所以达到平衡时放出热量Q1kJ;另一容积相同的密闭容器中通入2mol
N2和6mol
H2,达到平衡时原平衡相同,则放出热量应该是2QkJ,通入2mol
N2和6mol
H2的压强比通入1mol
N2和3mol
H2的大了,平衡还会向正向移动,放出的热量还会增大,但由于是可逆反应,反应不能进行彻底,故184KJ>Q2,即184>Q2>2Q1,故D正确。
故选:D。
20.【解答】解:发生反应:2H2+O22H2O、H2+Cl22HCl,恰好完全反应生成盐酸且三种气体没有剩余,由方程式可得:n(H2)=n(Cl2)+2n(O2),
A.3≠2+1×2,故A不符合;
B.6≠1+2×2,故B不符合;
C.5=3+1×2,故C符合;
D.7≠4+1×2,故D不符合;
故选:C。
二、解答题(共4小题,满分60分)
21.【解答】解:(1)①②的反应类型分别为消去反应、水解或取代反应,
故答案为:消去反应;水解或取代反应;
(2)B分子中官能团的名称是羟基,D物质的类别是醛,
故答案为:羟基;醛;
(3)E的结构简式为,
故答案为:;
(4)A→B的化学反应为CH3CH2CHO+H2CH3CH2CH2OH,B→C的化学反应为,
故答案为:CH3CH2CHO+H2CH3CH2CH2OH;;
(5)B→C反应中浓硫酸的作用是催化作用、吸水作用,
故答案为:催化作用、吸水作用;
(6)若C8H8Cl2苯环上的一溴取代物只有一种,说明苯环上只有一种H原子,结构应对称,可能的结构有、、、,
故答案为:;。
22.【解答】解:【提出猜想】浓硫酸和铁反应生成二氧化硫,稀硫酸和铁反应生成氢气,所以所得气体中可能含有SO2、H2,
故答案为:SO2、H2;
【实验探究】
验证猜想Ⅰ、酸性高锰酸钾有强氧化性,二价铁离子有还原性,所以酸性高锰酸钾能和二价铁离子发生氧化还原反应,如果步骤①溶液紫红色褪去,说明含有二价铁离子,否则没有.
碘化钾有还原性,三价铁离子有氧化性,碘离子和三价铁离子能发生氧化还原反应生成单质碘,碘遇淀粉变蓝色,所以步骤②另取少量所得溶液,滴加KI溶液和淀粉溶液,如果溶液变为蓝色,说明含有三价铁离子,否则没有,
故答案为:溶液紫红色褪去;含有Fe2+;另取少量所得溶液,滴加KI溶液和淀粉溶液;溶液变为蓝色;
猜想Ⅱ、二氧化硫有还原性,能和强氧化性的物质发生氧化还原反应,如能使酸性高锰酸钾溶液褪色,氢气不能使酸性高锰酸钾溶液褪色,但氢气不易溶于水,所以如果甲中KMnO4溶液褪色,说明含有二氧化硫;乙中KMnO4溶液颜色不变,说明二氧化硫完全被吸收,如果试管中收集气体,只能是氢气,
故答案为:甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体;
【问题讨论】
双氧水具有氧化性,二价铁离子有还原性,双氧水和二价铁离子能发生氧化还原反应生成三价铁离子,KSCN只能检验三价铁离子不能检验二价铁离子,所以若溶液中含有Fe3+则无法检验溶液中是否含有Fe2+,所以该观点不正确,
故答案为:不正确,若溶液中含有Fe3+则无法检验溶液中是否含有Fe2+.
23.【解答】解:(1)合成氨的工业生产中,进行氨合成反应的装置名称是合成塔,该装置中设置热交换器的目的是利用反应余热、节约能源,在生产工艺中,采用了原料气循环使用的方法,其目的是提高原料的利用率,
故答案为:合成塔;利用反应余热、节约能源;提高原料的利用率;
(2)①K为生成物浓度幂之积与反应物浓度幂之积的比,则K=,
故答案为:;
②由表中数据可知,温度越高、K越大,则升高温度平衡正向移动,正反应为吸热反应,
故答案为:吸热;
③加入CO2,促进氢气的转化,则氢气的转化率增大,
故答案为:增大;
④平衡后,向容器中通入与平衡混合气组成、比例相同的气体,可看成增大压强,平衡不移动,二者为等效平衡,则正逆反应速率均增大,各物质的比例不变,且转化率不变、平衡浓度相同,
故答案为:BC;
⑤平衡浓度符合:3[c(CO2)?c(H2)]=5[c(CO)?c(H2O)],可知K==0.6,由表中数据可知温度为700℃,
故答案为:700。
24.【解答】解:(1)氮在周期表中第二周期VA族,
故答案为:第二周期VA族;
(2)氮元素原子核外电子排布式为1s22s22p3可知氮原子核外有s、p两种不同的电子云形状,
故答案为:1s22s22p3;2;
(3)氮元素气态氢化物为NH3,其电子式为,
故答案为:;
(4)反应前后磷元素化合价升高(﹣3到+5),所以还原剂是PH3,
故答案为:PH3;
(5)已知0.2molKClO3在反应中得到1mol电子,所以一个氯原子得5个电子,化合价降低5,所以生成物中氯元素为零价,
故答案为:Cl2;
(6)KClO3具有强氧化性,PH3具有强还原性,由(5)可知KClO3被还原为Cl2,此过程中P由﹣3价升高至+5价,转移8e﹣,Cl由+5价降低至0价,转移5e﹣电子,则电子转移的最小公倍数为40,据此配平可得方程式为5PH3+4H2SO4+8KClO3=4K2SO4+5H3PO4+4H2O+4Cl2,共转移40e﹣,单线桥为,
故答案为:;
(7)由反应可以判断氧化剂是KClO3,氧化产物是H3PO4,氧化剂氧化性大于氧化产物,所以A正确,还原剂是PH3,还原产物是X,还原剂的还原性大于还原产物,所以C正确,
故答案为:AC;
(8)由,可知每转移40摩尔电子,生成磷酸5摩尔,所以转移电子2mol时,生成H3PO40.25mol,
故答案为:0.25。
同课章节目录
