2020-2021学年天津市滨海七校高三(上)期末化学试卷(Word+答案)
文档属性
| 名称 | 2020-2021学年天津市滨海七校高三(上)期末化学试卷(Word+答案) |  | |
| 格式 | zip | ||
| 文件大小 | 322.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-06 17:03:35 | ||
图片预览



文档简介
2020-2021学年天津市滨海七校高三(上)期末化学试卷
一、选择题(共12小题,每小题3分,满分36分)
1.我国改革开放40年以来取得了许多世界瞩目的科技成果。下列有关说法中正确的是( )
A
搭载有新型钛合金材料Ti﹣62A载人舱的“奋斗者”号潜水器完成万米深潜海试任务
钛元素位于元素周期表第四周期ⅡB族
B
嫦娥五号探测器镂空的主体框架上分布着钛合金和铝合金材料
合金具有硬度大、密度大、耐腐蚀等性能
C
国产大飞机C919用到的氮化硅陶瓷
该陶瓷属于有机合成高分子材料
D
中国天眼传输信息用的光纤材料
光纤材料的主要成分是二氧化硅
A.A
B.B
C.C
D.D
2.下列表示不正确的是( )
A.次氯酸的电子式
B.丁烷的球棍模型
C.乙烯的结构简式CH2=CH2
D.R2+离子核外有a个电子,b个中子,R原子可表示为:R
3.下列有关物质的类别、用途及原理均正确的是( )
选项
物质
类别
用途
原理
A
Na2O2
碱性氧化物
潜水艇中作为供氧剂
Na2O2与CO2反应生成O2
B
FeCl3
盐
刻制印刷电路板
Fe3+的氧化性强于Cu2+
C
SO2
酸性氧化物
漂白纸浆、毛、丝等
SO2具有强氧化性
D
Na2CO3
盐
治疗胃酸过多
HCl的酸性强于H2CO3
A.A
B.B
C.C
D.D
4.北京冬奥会将于2022年举办,绿色环保是主要理念。在场馆建设中用到的一种耐腐、耐高温的表面涂料是以某双环烯酯为原料制得,该双环烯酯的结构如图所示。下列说法正确的是( )
A.该双环烯酯的分子式为C14H20O2
B.1mol该双环烯酯能与3mol
H2发生加成反应
C.该双环烯酯分子中π键数目为3mol
D.该双环烯酯的一氯代物有9种
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.将1mol
SO2通入水中,H2SO3、HSO3﹣、SO32﹣粒子数之和为NA
B.标准状况下,22.4L
HF溶于水,溶液中HF与F﹣数目之和为NA
C.将1mol
NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
D.100g质量分数为46%的乙醇溶液中含有氢原子的数目为6NA
6.下列说法正确的是( )
A.金属阳离子只能存在于离子晶体中
B.CO32﹣的立体构型为平面三角形,中心原子的杂化方式为sp2
C.将一定体积和浓度的KMnO4酸性溶液与一定量的草酸溶液混合,当0.01mol
KMnO4被还原时,强酸提供的H+的物质的量为0.08mol
D.用惰性电极电解200mL
1mol/L的CuSO4溶液,通电一段时间,当电路中转移0.6mol电子时,相同条件下两极分别产生的V(H2):V(O2)=1:1
7.A、B、C、X均为中学化学常见物质,它们之间有如图转化关系(副产物已略去),下列相关叙述不正确的是( )
A.若X是空气中存在的强氧化性无色气体单质,则A可以是C、Na、S、N2
B.若X是黄绿色气体单质,则A可以是Fe
C.若X为强碱溶液;A为盐,其阳离子半径是第三周期离子半径最小的。则反应②的离子方程式为:Al(OH)3+OH﹣═AlO2﹣+2H2O
D.若X为溶液,其溶质常做制冷剂;A能使品红褪色,加热后又回复原色,则反应①的离子方程式为SO2+NH3?H2O═NH4++HSO3﹣
8.如表实验操作、现象与结论均正确的是( )
选项
操作
现象
结论
A
如图,为验证牺牲阳极的阴极保护,向Fe电极附近的溶液中滴加K3[Fe(CN)6]溶液
铁电极表面生成蓝色沉淀
在该原电池中Fe作负极
B
常温下,将打磨后的铝片放入浓硝酸中
无明显现象
常温下铝与浓硝酸不反应
C
向装有X溶液的试管中滴入稀NaOH溶液,将湿润的红色石蕊试纸靠近试管口
无明显现象
X溶液中无NH4+
D
向Na2CO3溶液中逐滴滴入同浓度、同体积的水杨酸()溶液
无气体产生
电离常数:K1(碳酸)>K2(水杨酸)
A.A
B.B
C.C
D.D
9.能正确表示下列反应的离子方程式是( )
A.FeSO4溶液暴露在空气中:12Fe2++3O2+6H2O═8Fe3++4Fe(OH)3↓
B.过氧化钠固体与水反应:2O22﹣+2H2O═4OH﹣+O2↑
C.向1mL
0.5mol/L
NaHCO3溶液中滴加1mL
0.5mol/L
CaCl2溶液出现白色沉淀:CO32﹣+Ca2+═CaCO3↓
D.向次氯酸钠溶液中通入少量SO2:ClO﹣+SO2+H2O═Cl﹣+SO42﹣+2H+
10.电镀废液中Cr2O72﹣可通过下列反应转化成铬黄(PbCrO4):Cr2O72﹣(aq)+2Pb2+(aq)+H2O(l)?2PbCrO4(s)+2H+(aq)△H<0,达到平衡。说法正确的是( )
A.移走PbCrO4(s),Cr2O72﹣的转化率升高
B.加入少量NaOH固体,自然沉降后,溶液颜色变深
C.加入Pb(NO3)2固体,平衡逆向移动
D.降低温度,该反应的平衡常数K=增大
11.我国科学家研发了一种水系可逆Zn﹣CO2电池,电池工作时,复合膜(由a、b膜复合而成)层间的H2O解离成H+和OH﹣,在外加电场中可透过相应的离子膜定向移动。当闭合K1时,Zn﹣CO2电池工作原理如图所示,下列说法不正确的是( )
A.a膜是阳离子膜,b膜是阴离子膜
B.放电时负极的电极反应式为Zn+4OH﹣﹣2e﹣═Zn(OH)42﹣
C.充电时CO2在多孔Pd纳米片表面转化为甲酸
D.外电路中每通过1mol电子,复合膜层间有1mol
H2O解离
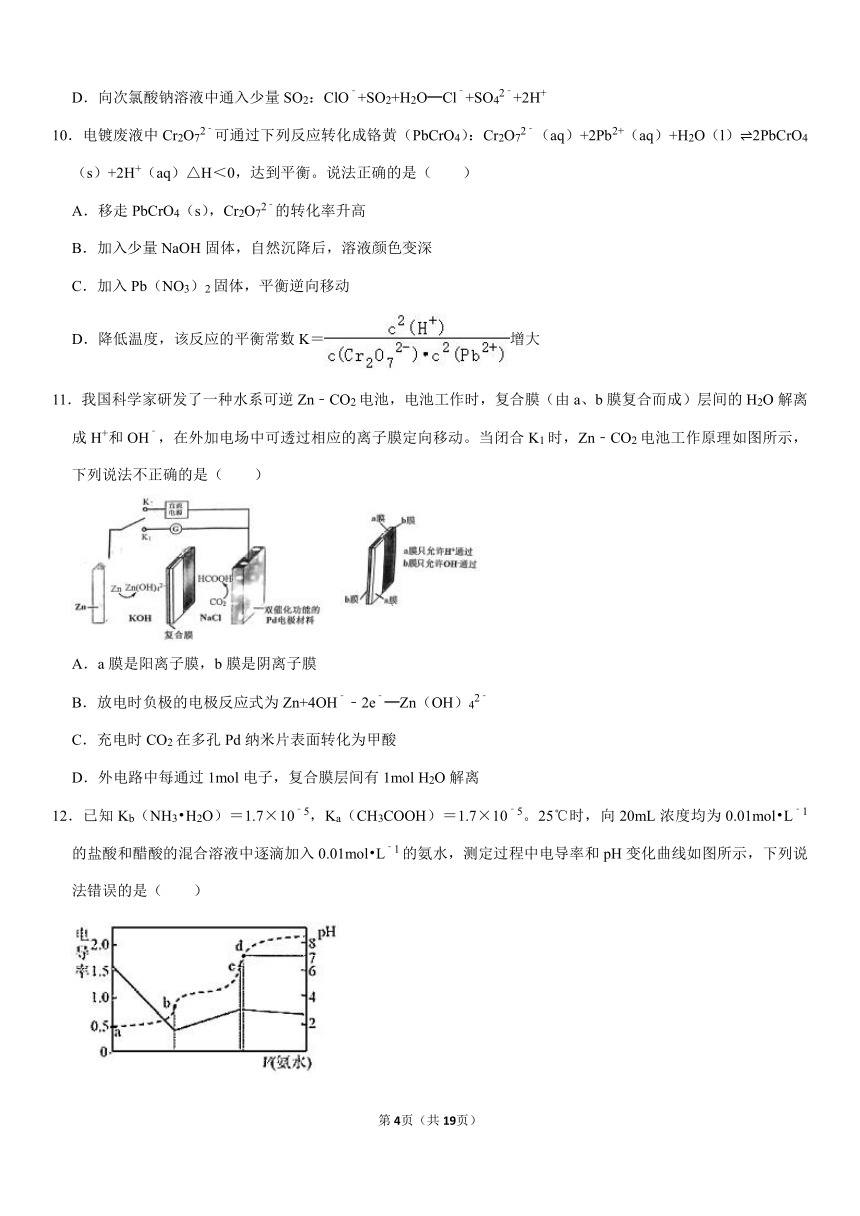
12.已知Kb(NH3?H2O)=1.7×10﹣5,Ka(CH3COOH)=1.7×10﹣5。25℃时,向20mL浓度均为0.01mol?L﹣1的盐酸和醋酸的混合溶液中逐滴加入0.01mol?L﹣1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法错误的是( )
A.a点溶液中,c(CH3COO﹣)数量级约为10﹣5
B.b点溶液中,c(Cl﹣)>c(NH4+)>c(CH3COOH)>c(H+)>c(OH﹣)
C.c点溶液中,c(NH4+)+c(NH3?H2O)=c(CH3COO﹣)+c(CH3COOH)
D.d点溶液中,c(NH4+)=c(CH3COOH)+2c(CH3COO﹣)
二、解答题(共4小题,满分64分)
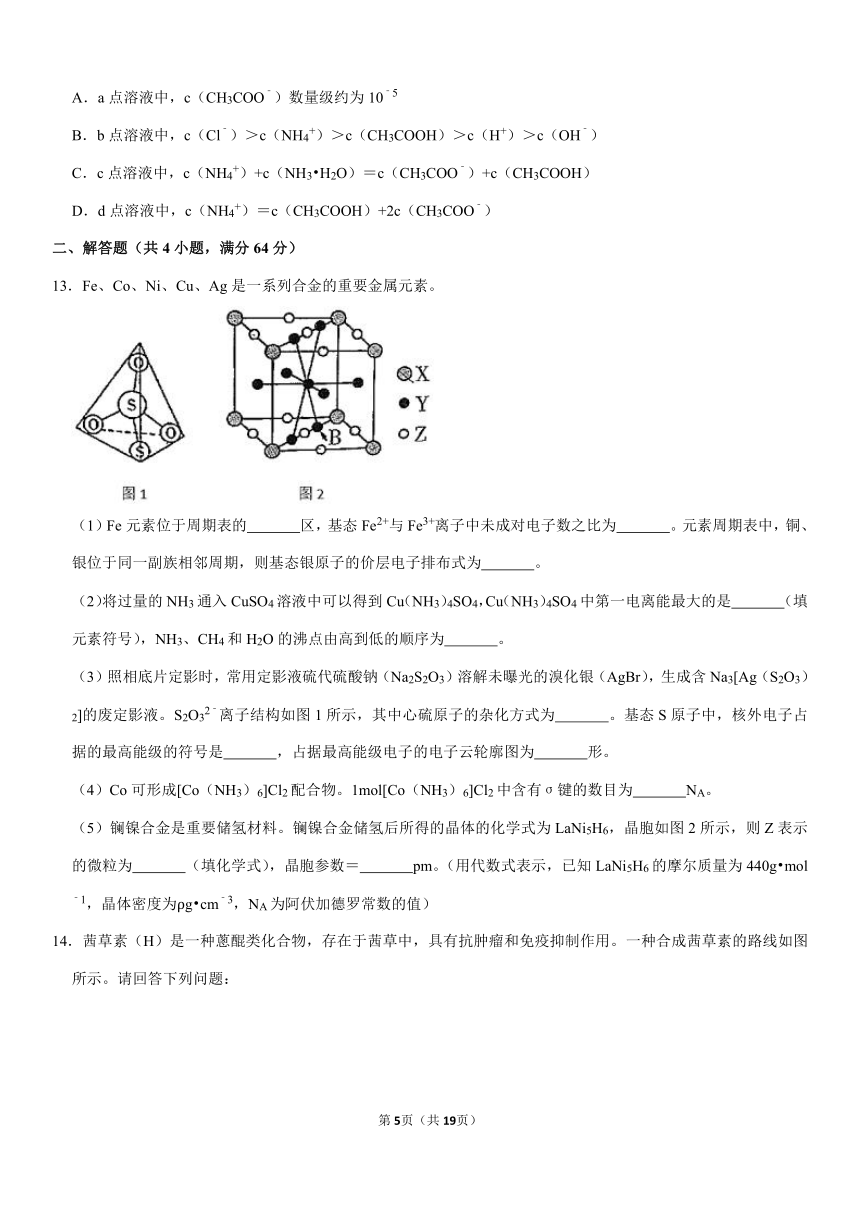
13.Fe、Co、Ni、Cu、Ag是一系列合金的重要金属元素。
(1)Fe元素位于周期表的
区,基态Fe2+与Fe3+离子中未成对电子数之比为
。元素周期表中,铜、银位于同一副族相邻周期,则基态银原子的价层电子排布式为
。
(2)将过量的NH3通入CuSO4溶液中可以得到Cu(NH3)4SO4,Cu(NH3)4SO4中第一电离能最大的是
(填元素符号),NH3、CH4和H2O的沸点由高到低的顺序为
。
(3)照相底片定影时,常用定影液硫代硫酸钠(Na2S2O3)溶解未曝光的溴化银(AgBr),生成含Na3[Ag(S2O3)2]的废定影液。S2O32﹣离子结构如图1所示,其中心硫原子的杂化方式为
。基态S原子中,核外电子占据的最高能级的符号是
,占据最高能级电子的电子云轮廓图为
形。
(4)Co可形成[Co(NH3)6]Cl2配合物。1mol[Co(NH3)6]Cl2中含有σ键的数目为
NA。
(5)镧镍合金是重要储氢材料。镧镍合金储氢后所得的晶体的化学式为LaNi5H6,晶胞如图2所示,则Z表示的微粒为
(填化学式),晶胞参数=
pm。(用代数式表示,已知LaNi5H6的摩尔质量为440g?mol﹣1,晶体密度为ρg?cm﹣3,NA为阿伏加德罗常数的值)
14.茜草素(H)是一种蔥醌类化合物,存在于茜草中,具有抗肿瘤和免疫抑制作用。一种合成茜草素的路线如图所示。请回答下列问题:
已知:①;
②;
③RCOOHRCOClRCOR1。
(1)H中所含官能团的名称是
。
(2)C的核磁共振氢谱中峰面积之比为
。
(3)F→H的反应类型是
。
(4)书写下列化学方程式:A→R
,C→D
。
(5)芳香族化合物Y是B的同分异构体,写出所有符合下列条件的Y的结构简式:
。
①1mol
Y最多能消耗2mol
Na或1mol
NaOH;
②Y能与FeCl3溶液发生显色反应;
③苯环上有两种氢。
(6)以和HOOC﹣CH=CH﹣COOH为原料,设计五步合成
。(参照以上合成路线,无机试剂和不超过2个碳的有机试剂任选)
15.研究人员从处理废旧线路板后的固体残渣(含SnO2、PbO2等)中进一步回收金属锡(Sn),一种回收流程如图1。
已知:ⅰ.50Sn、82Pb为ⅣA族元素;
ⅱ.SnO2、PbO2与强碱反应生成盐和水。
ⅲ.+2价Sn不稳定,与空气接触容易氧化为+4价锡
(1)SnO2与稀NaOH反应的离子方程式为
。
(2)滤液1中加入Na2S的目的是除铅,将相关方程式补充完整:
Na2PbO3+
Na2S+
═PbS↓+S↓+
(3)不同溶剂中Na2SnO3的溶解度随温度变化如图2。
①相同温度下,Na2SnO3的溶解度随NaOH浓度增大而减小,结合平衡移动原理解释原因:
。
②操作Ⅲ的具体方法为
。
(4)测定粗锡中Sn的纯度:在强酸性环境中将ag粗锡样品溶解(此时Sn全部转化成Sn2+),迅速加入过量NH4Fe(SO4)2溶液,以二苯胺磺酸钠为指示剂,用0.1000mol?L﹣1K2Cr2O7标准溶液滴定至终点。消耗K2Cr2O7溶液的体积如图3所示,计算Sn的纯度。
已知:Sn2++2Fe3+═Sn4++2Fe2+;Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O
①溶解粗锡时不宜选用浓盐酸,理由是
。
②二苯胺磺酸钠是一种氧化还原指示剂,滴定终点时因发生
反应而变色。(填写“氧化”或“还原”)
③滴定终点时消耗K2Cr2O7标准溶液体积
mL,粗锡样品中Sn的纯度为
。(用质量分数表示)
④下列操作会导致样品中Sn的测定结果偏高的是
。(填选项字母)
a.上述实验中若缓慢加入NH4Fe(SO4)2溶液
b.盛标准K2Cr2O7标准溶液的滴定管尖嘴部分有气泡未排除就开始滴定
c.实验用的酸式滴定管、锥形瓶水洗后均未润洗
16.“Cl化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、HCHO、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。请回答下列问题:
Ⅰ.反应的热化学方程式为CO2(g)+2H2(g)?CH2O(g)+H2O(g)△H。
(1)已知:①CH2O(g)+O2(g)═CO2(g)+H2O(g)△H1=﹣480kJ/mol②相关化学键的键能数据如表所示:
化学键
O=O
H﹣H
O﹣H
键能/kJ?mol﹣1
498
436
464
则CO2(g)+2H2(g)?CH2O(g)+H2O(g)△H=
。
(2)一定条件下,将n(CO2):n(H2)=1:2的混合气体充入恒温恒容的密闭容器中,发生反应CO2(g)+2H2(g)?CH2O(g)+H2O(g)。
①下列说明反应已经达到平衡状态的是
。(填选项字母)
a.容器内气体密度保持不变
b.H2O的体积分数保持不变
c.该反应的平衡常数保持不变
d.混合气体的平均相对分子质量不变
②下列措施既能提高H2的转化率又能加快反应速率的是
(填选项字母)。
a.升高温度
b.使用高效催化剂
c.缩小容器体积
d.扩大容器体积
Ⅱ.向体积为1L的恒容密闭容器中充入bmol
CO和2bmol
H2,发生反应CO(g)+2H2(g)?CH3OH(g)。实验测定CH3OH的平衡产率随温度、压强的变化关系如图所示。请回答:
(3)①该反应属于
(填“吸”或“放”)热反应;P1
P2。(填“>”、“<”或“=”)
②已知A点CH3OH的平衡产率为0.25,求100℃时,该反应平衡常数K=
。(用含b的代数式表示)
③求A点CO的物质的量分数=
。
Ⅲ.多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。电解装置中分别以多晶Cu和铂为电极材料,用阴离子交换膜分隔开阴、阳极室,阴、阳极室的KHCO3溶液的浓度(约0.1mol?L﹣1左右)基本保持不变。并向某极室内持续通入CO2,温度控制在10℃左右。
(4)通入CO2的电极为
(填“阴极”或“阳极”),生成C2H4的电极反应式为
。
2020-2021学年天津市滨海七校高三(上)期末化学试卷
试题解析
一、选择题(共12小题,每小题3分,满分36分)
1.解:A.钛的原子序数为22,位于第四周期,最外层有4个电子,钛元素位于元素周期表第四周期IVB族,故A错误;
B.钛和铝的相对原子质量比较小,钛合金和铝合金密度小、硬度大、耐腐蚀,故B错误;
C.氮化硅属于无机物,不属于有机合成高分子材料,故C错误;
D.二氧化硅晶体能传递光信号,是制造光导纤维的主要原料,故D正确;
故选:D。
2.解:A.次氯酸中O最外层2个单电子,分别与H和Cl形成共价键,电子式为,故A错误;
B.丁烷的球棍模型为,故B正确;
C.乙烯是含有2个碳原子的单烯烃,其结构简式为CH2=CH2,故C正确;
D.R2+离子核外有a个电子,R原子的核外电子总数=质子数=a+2,其质量数为a+2+b,则R原子可表示为:R,故D正确;
故选:A。
3.解:A.过氧化钠与水反应生成氢氧化钠与氧气,故不属于碱性氧化物,故A错误;
B.氯化铁属于盐,Fe3+的氧化性强于Cu2+,氯化铁能与Cu反应生成氯化亚铁与氯化铜,可以刻制印刷电路板,故B正确;
C.二氧化硫与有色物质化合为不稳定的无色物质,与二氧化硫的氧化性无关,且二氧化硫没有强氧化性,故C错误;
D.碳酸钠溶液碱性强,具有腐蚀性,不能用于治疗胃酸过多,碳酸氢钠可用于治疗胃酸过多,故D错误;
故选:B。
4.解:A.该双环烯酯的分子式为C14H20O2,故A正确;
B.碳碳双键能与H2发生加成反应,酯基中碳氧双键不能与H2反应,因此1mol该双环烯酯能与2molH2发生加成反应,故B错误;
C.双键中含有一个π键,单键中不含π键,该分子中含有三个双键,则该分子中含有3个π键,故C错误;
D.该分子中含有13种氢原子,所以一氯代物有13种,故D错误;
故选:A。
5.解:A.二氧化硫和水的反应是可逆反应,故溶液中含二氧化硫分子,故溶液中H2SO3、HSO3﹣、SO32﹣粒子数之和小于NA,故A错误;
B.标况下HF为液体,故22.4LHF的物质的量大于1mol,则溶液中HF与F﹣数目之和大于NA,故B错误;
C.将1mol
NH4NO3溶于稀氨水中使溶液呈中性,则溶液中存在电荷守恒:[H+]+[NH4+]=[NO3﹣]+[OH﹣],溶液呈中性,则铵根离子浓度等于硝酸根离子浓度,溶液体积相等,则铵根离子数目等于硝酸根离子数,为1mol,溶液中NH4+数目为NA,故C正确;
D.100g质量分数为46%的乙醇溶液中含有溶质CH3CH2OH的质量是46g,物质的量是1mol,其中含有H原子是6mol,溶剂H2O质量是m(H2O)=100g﹣46g=54g,其物质的量是3mol,其中含有H原子的物质的量是6mol,则100g该溶液中含有H原子总物质的量是12mol,则含有的氢原子数目为12NA,故D错误。
故选:C。
6.解:A.金属晶体是由金属阳离子和自由电子构成的,所以金属阳离子可能还存在于金属晶体中,故A错误;
B.CO32﹣中C原子价层电子对个数=3+=3且不含孤电子对,根据价层电子对互斥理论判断该离子空间构型为平面三角形、中心原子杂化方式为sp2,故B正确;
C.该反应离子方程式为6H++2MnO4﹣+5H2C2O4═10CO2↑+2Mn2++8H2O,由方程式中KMnO4与H+的关系式计算消耗n(H+)=3n(KMnO4)=3×0.01mol=0.03mol,故C错误;
D.n(Cu2+)=n(CuSO4)=1mol/L×0.2L=0.2mol,如果Cu2+完全放电,Cu2+转移电子物质的量=0.2mol×2=0.4mol,当电路中转移0.6mol电子时,阴极上H+得到0.2mol电子,生成0.1mol氢气,阳极上转移0.6mol电子时生成氧气物质的量==0.15mol,相同条件下生成气体体积之比等于气体物质的量之比,则相同条件下两极分别产生的V(H2):V(O2)=0.1mol:0.15mol=2:3,故D错误;
故选:B。
7.解:A.若X是空气中存在的强氧化性无色气体单质,则X为氧气,碳与氧气反应生成CO,CO能与氧气反应生成二氧化碳;Na与氧气反应生成氧化钠,氧化钠与氧气反应生成过氧化钠;S和氧气反应生成二氧化硫,二氧化硫和氧气反应生成三氧化硫;N2和氧气反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,均符合转化关系,故A正确;
B.X是黄绿色气体单质,则X为氯气,若A为铁,则B为氯化铁,氯化铁不能与氯气反应,不符合转化关系,故B错误;
C.若X为强碱溶液,A为盐,其阳离子半径是第三周期离子半径最小的,则A为铝盐,B为氢氧化铝,反应②的离子方程式为:Al(OH)3+OH﹣═AlO2﹣+2H2O,故C正确;
D.若X为溶液,其溶质常做制冷剂,A能使品红褪色,加热后又回复原色,则A为二氧化硫、X为氨水、B为亚硫酸氢铵、C为亚硫酸铵,反应①的离子方程式为:SO2+NH3?H2O═NH4++HSO3﹣,故D正确;
故选:B。
8.解:A.由图可知,牺牲阳极的阴极保护中被保护的Fe电极是正极,Zn电极是负极,不会产生Fe2+,滴加K3[Fe(CN)6]溶液不会有蓝色沉淀现象出现,故A错误;
B.铝在浓硝酸中会钝化,没有明显现象,但钝化不是不反应,而是铝在浓硝酸中发生反应生成一层致密的氧化物保护膜,阻止内部金属继续反应,故B错误;
C.滴入稀的氢氧化钠溶液,可能生成一水合氨,湿润的红色石蕊试纸靠近试管口,试纸没有明显现象,但原溶液中可能含有铵根离子,故C错误;
D.向Na2CO3溶液中逐滴滴入同浓度、同体积的水杨酸溶液,没有气泡产生,说明水杨酸和Na2CO3不能反应生成碳酸,根据强酸制弱酸的原理,碳酸的酸性大于水杨酸,即电离常数:K1(碳酸)>K(水杨酸),故D正确;
故选:A。
9.解:A.FeSO4酸性溶液暴露在空气中被氧化成硫酸铁、氢氧化铁,该反应的离子方程式为:12Fe2++3O2+6H2O═8Fe3++4Fe(OH)3↓,故A正确;
B.过氧化钠固体与水反应,过氧化钠不能写成离子,离子方程式为:2Na2O2+2H2O═4OH﹣+O2↑+4Na+,故B错误;
C.NaHCO3溶液与CaCl2溶液反应生成白色沉淀为碳酸钙、气体为二氧化碳,发生CaCl2+2NaHCO3=CaCO3↓+2NaCl+CO2↑+H2O,离子方程式为:2HCO3﹣+Ca2+═CaCO3↓+CO2↑+H2O,故C错误;
D.向次氯酸钠溶液中通入少量的SO2,发生反应的离子方程式为:H2O+3ClO﹣+SO2═SO42﹣+Cl﹣+2HClO,故D错误;
故选:A。
10.解:A.PbCrO4(s)是固体,不影响平衡移动,则移走PbCrO4(s),Cr2O72﹣的转化率不变,故A错误;
B.加入少量NaOH固体,NaOH和H+反应导致溶液中c(H+)减小,平衡正向移动,溶液颜色变浅,故B错误;
C.加入Pb(NO3)2固体导致溶液中c(Pb2+)增大,则平衡正向移动,故C错误;
D.降低温度平衡正向移动,则生成物浓度增大而反应物浓度减小,所以该反应的平衡常数K=增大,故D正确;
故选:D。
11.解:A.复合膜中H2O解离成H+和OH﹣,根据图中复合膜中H+通过a膜、OH﹣通过b膜可知,a膜是阳离子膜,b膜是阴离子膜,故A正确;
B.放电时,阳离子移向正极、阴离子移向负极,图中H+通过a膜移向多孔Pd纳米片、OH﹣通过b膜移向Zn,则Zn为负极、多孔Pd纳米片为正极,负极上Zn失去电子生成Zn(OH)42﹣,负极电极反应为Zn+4OH﹣﹣2e﹣═Zn(OH)42﹣,故B正确;
C.原电池中Zn为负极、多孔Pd纳米片为正极,充电时Zn为阴极、多孔Pd纳米片为阳极,阳极上HCOOH发生失去电子的氧化反应生成CO2,故C错误;
D.复合膜中H2O?H++OH﹣,由于电子所带电荷数与H+或OH﹣所带电荷数相等,所以外电路中每通过1mol电子,通过a膜的H+或通过b膜的OH﹣物质的量均为1mol,即复合膜层间有1mol
H2O解离,故D正确;
故选:C。
12.解:A.由CH3COOH的电离平衡常数表达式可知,c(CH3COO﹣)=≈=1.7×10﹣5,故A正确;
B.b点溶质为等浓度氯化铵和醋酸,Ka(CH3COOH)=1.7×10﹣5,Kh(NH4+)=×10﹣9,Ka(CH3COOH)>Kh(NH4+),醋酸电离程度大于NH4+水解程度,则c(NH4+)>c(CH3COOH),溶液显酸性,所以就有c(Cl﹣)>c(NH4+)>c(CH3COOH)>c(H+)>c(OH﹣),故B正确;
C.c点溶液中恰好生成等量的NH4Cl和CH3COONH4,根据物料守恒:2c(Cl﹣)=c(NH4+)+c(NH3?H2O),2c(CH3COOH)+2c(CH3COO﹣)=c(NH4+)+c(NH3?H2O),c(Cl﹣)=c(CH3COO﹣)+c(CH3COOH)所以有c(NH4+)+c(NH3?H2O)=c(Cl﹣)+c(CH3COO﹣)+c(CH3COOH),故C错误;
D.d点溶质为氯化铵、醋酸铵和一水合氨的中性溶液,d点溶液中的pH=7,c(OH﹣)=c(H+),根据电荷守恒c(H+)+c(NH4+)=c(Cl﹣)+c(CH3COO﹣)+c(OH﹣)可知:c(NH4+)=c(Cl﹣)+c(CH3COO﹣),由c点可知物料守恒得,c(Cl﹣)=c(CH3COO﹣)+c(CH3COOH),所以就有c(NH4+)=c(CH3COOH)+2c(CH3COO﹣),故D正确;
故选:C。
二、解答题(共4小题,满分64分)
13.解:(1)铁在第四周期第ⅤⅢ族,价电子排布为3d64s2,则Fe元素位于周期表的d区,基态Fe2+与Fe3+的核外电子排布式分别为[Ar]3d6、[Ar]d5,则未成对电子数之比为4:5,铜位于第四周期第IB族,价层电子排布式为3d104s1,则同族下一周期Ag的价层电子排布式为4d105s1,
故答案为:d;4:5;4d105s1;
(2)Cu(NH3)4SO4由Cu、H、N、S、O五种元素组成,Cu、H为正价,第一电离能相对较小,O、S位于同一主族,O的第一电离能大于S,N、O位于同一周期,但N原子最外层达到半饱和的稳定结构,难以失去电子,则第一电离能大小为N>O,即Cu、H、N、S、O五种元素中第一电离能最大是N;CH4分子间只有分子间作用力,NH3和H2O分子间还存在氢键,则CH4的沸点小,并且NH3和H2O平均每个分子含氢键数:冰中2个、液氨只有1个,则冰气化要克服的氢键能大于液氨,所以NH3、CH4和H2O的沸点由高到低的顺序为H2O>NH3>CH4,
故答案为:N;H2O>NH3>CH4;
(3)由图可知,S2O32﹣离子中S原子的构型为四面体结构,VSEPR模型为四面体,杂化方式为sp3,S原子的价电子排布式为3s23p4,最高能层为3p,p轨道的电子云轮廓图为哑铃形(或纺锤形),
故答案为:sp3;3p;哑铃(或纺锤);
(4)配离子[Co(NH3)6]2+中,NH3与Co2+形成配位键,配位数为6,形成6个σ键,一个NH3分子中含有3个N﹣H键、含有3个σ键,即一个[Co(NH3)6]2+中含有σ键的数目为6+3×6=24,所以1mol[Co(NH3)6]Cl2中含有σ键24mol,数目为24NA,
故答案为:24;
(5)晶胞中X数目=8×=1、Y数目=1+8×=5、Z数目=8×+2×=3,结合化学式LaNi5(H2)3,可知X代表La、Y代表Ni、Z代表H2,设晶胞参数为x,晶胞体积V=x3,晶胞的质量m=nM=mol×440g?mol﹣1=g,ρV=m,即ρx3g=g,解得x=cm=×1010pm,即晶胞边长为×1010pm,
故答案为:H2;×1010。
14.解:(1)由结构可知,H中所含官能团的名称是:羟基、羰基,
故答案为:羟基、羰基;
(2)C存在如图所示对称结构:,苯环上有2种氢,﹣CHO中有1种氢,含有的氢原子数目之比为2:2:2=1:1:1,故C的核磁共振氢谱中峰面积之比为1:1:1,
故答案为:1:1:1;
(3)F→H是与发生取代反应生成H,
故答案为:取代反应;
(4)A→R的化学方程式为:;C→D的化学方程式为:,
故答案为:n;;
(5)B为,芳香族化合物Y是B的同分异构体,Y能与FeCl3溶液发生显色反应,1mol
Y最多能消耗2mol
Na或1mol
NaOH,说明Y含有1个酚羟基、1个醇羟基,且Y苯环上有两种氢,则苯环有2个不同的取代基且处于对位,可能的结构简式为:、,
故答案为:、;
(6)与溴发生加成反应生成,发生消去反应生成,HOOC﹣CH=CH﹣COOH与SOCl2反应生成ClOC﹣CH=CH﹣COCl,与ClOC﹣CH=CH﹣COCl发生加成反应生成,与CH3OH发生酯化反应生成,合成路线为:,
故答案为:。
15.解:(1)二氧化锡与NaOH反应的离子方程式为SnO2+2OH﹣=SnO32﹣+H2O,
故答案为:SnO2+2OH﹣=SnO32﹣+H2O;
(2)反应中Pb化合价降低,S化合价升高,按照氧化还原的相关规律即可配平,其完整的化学方程式为Na2PbO3+Na2S+3H2O═PbS↓+S↓+6NaOH,
故答案为:2;3H2O;6NaOH;
(3)①在Na2SnO3溶液中,存在水解平衡SnO32﹣+H2O?HSnO3﹣+OH﹣,相同温度下NaOH浓度越大对水解抑制能力越强,使平衡逆向移动,Na2SnO3溶解度降低,
故答案为:相同温度下NaOH浓度越大对水解抑制能力越强,使平衡逆向移动,Na2SnO3溶解度降低;
②操作Ⅱ得到的溶液为NaOH和Na2SnO3的混合液,需加入SnO2除去溶液中的NaOH,其操作为向滤液2中加入过量SnO2,反应完全后过滤,加入少许浓氨水,降低Na2SnO3的溶解度,加热浓缩、冷却结晶、过滤、洗涤、干燥得到Na2SnO3固体,
故答案为:向滤液2中加入过量SnO2,反应完全后过滤,加入少许浓氨水,加热浓缩、冷却结晶、过滤、洗涤、干燥得到Na2SnO3固体;
(4)①用浓盐酸溶解时,引入氯离子,氧化时消耗的氧化剂的量偏多,使测量结果偏高,
故答案为:引入氯离子,氧化时消耗的氧化剂的量偏多,使测量结果偏高;
②因K2Cr2O7具有强氧化性,终点时二苯胺磺酸钠被氧化而变色,说明二苯胺磺酸钠具有还原性,
故答案为:氧化;
③滴定管初读数为0.80mL,末读数为22.80mL,故标准液的体积为22.80﹣0.80=22.00mL;根据反应式可建立关系Cr2O72﹣~3Sn,n(Sn)=3n(Cr2O72﹣)=3×0.1×22.00×10﹣3mol,Sn的质量为m=nM=(3×0.1×22.00×10﹣3×119)g=0.7854g,Sn的质量分数为×100%=%,
故答案为:22.00;%;
④根据Cr2O72﹣~3Sn,可知标准液体积与Sn的质量分数成正比;
a.缓慢加入NH4Fe(SO4)2,溶液中Sn2+易被空气中的氧气氧化成Sn4+,使溶液中的Fe2+量变少,消耗的标准液体积偏小,导致结果偏低;
b.盛标准K2Cr2O7标准溶液的滴定管尖嘴处有气泡,初读数偏小,标准液体积偏大,结果偏大;
c.酸式滴定管用于盛装标准液,未润洗则使标准液被稀释,消耗的标准液体积偏大,使结果偏高;
故答案为:bc。
16.解:Ⅰ.(1)表中数据可知反应①O2(g)+2H2(g)=2H2O(g)△H=反应物总键能﹣生成物总键能=498kJ/mol+2×436kJ/mol﹣4×464kJ/mol=﹣486kJ/mol,
②CH2O(g)+O2(g)═CO2(g)+H2O(g)△H1=﹣480kJ/mol,
结合盖斯定律①﹣②计算得到CO2(g)+2H2(g)?CH2O(g)+H2O(g)△H=﹣6kJ/mol,
故答案为:﹣6kJ/mol;
(2)①a.恒容容器中各物质均为气体,容器内气体密度始终保持不变,所以容器内气体密度保持不变的状态不一定是平衡状态,故a错误;
b.H2O的体积分数保持不变,符合平衡状态的特征,反应一定达到平衡状态,故b正确;
c.平衡常数只与温度有关,温度一定时该反应的平衡常数始终保持不变,所以不能确定反应是否达到平衡状态,故c错误;
d.恒容容器中气体物质的质量不变,反应正向气体的物质的量减小,所以混合气体的平均相对分子质量不变的状态是平衡状态,故d正确;
故答案为:bd;
②a.该反应正向放热,升高温度,反应速率加快,但平衡逆向移动,氢气的转化率降低,故a不选;
b.催化剂可加快反应速率,但不改变化学平衡移动,不能提高转化率,故b不选;
c.该反应正向体积减小,缩小容器体积,平衡正向移动,并且反应速率加快,故c选;
d.扩大容器体积,平衡逆向移动,氢气的转化率和反应速率均降低,故d不选;
故答案为:c;
Ⅱ.(3)①图象分析可知,随温度升高,甲醇产率减小,说明升温平衡逆向进行,正反应为放热反应,图象分析可知相同温度、P2压强下,一氧化碳转化率大于P1压强下一氧化碳转化率,反应是气体体积减小的反应,压强增大平衡正向进行,所以P1<P2,
故答案为:<;
②向1L恒容密闭容器中充入bmol
CO与2bmol
H2,已知A点CH3OH的平衡产率为0.25,结合三行计算,列式得到:
CO(g)+2H2(g)=CH3OH(g)
起始量(mol/L):b
2b
0
转化量(mol/L):0.25b
0.5b
0.25
b
平衡量(mol/L):0.75b
1.5b
0.25b
平衡常数K===,
故答案为:;
③A点CO的物质的量分数=×100%=30%,
故答案为:30%;
Ⅲ.电解池的阴极发生得电子的还原反应,所以CO2还原为C2H4的反应在阴极上进行,电极反应式为14CO2+12e﹣+8H2O=C2H4+12HCO3﹣,
故答案为:阴极;14CO2+12e﹣+8H2O=C2H4+12HCO3﹣。
第1页(共1页)
一、选择题(共12小题,每小题3分,满分36分)
1.我国改革开放40年以来取得了许多世界瞩目的科技成果。下列有关说法中正确的是( )
A
搭载有新型钛合金材料Ti﹣62A载人舱的“奋斗者”号潜水器完成万米深潜海试任务
钛元素位于元素周期表第四周期ⅡB族
B
嫦娥五号探测器镂空的主体框架上分布着钛合金和铝合金材料
合金具有硬度大、密度大、耐腐蚀等性能
C
国产大飞机C919用到的氮化硅陶瓷
该陶瓷属于有机合成高分子材料
D
中国天眼传输信息用的光纤材料
光纤材料的主要成分是二氧化硅
A.A
B.B
C.C
D.D
2.下列表示不正确的是( )
A.次氯酸的电子式
B.丁烷的球棍模型
C.乙烯的结构简式CH2=CH2
D.R2+离子核外有a个电子,b个中子,R原子可表示为:R
3.下列有关物质的类别、用途及原理均正确的是( )
选项
物质
类别
用途
原理
A
Na2O2
碱性氧化物
潜水艇中作为供氧剂
Na2O2与CO2反应生成O2
B
FeCl3
盐
刻制印刷电路板
Fe3+的氧化性强于Cu2+
C
SO2
酸性氧化物
漂白纸浆、毛、丝等
SO2具有强氧化性
D
Na2CO3
盐
治疗胃酸过多
HCl的酸性强于H2CO3
A.A
B.B
C.C
D.D
4.北京冬奥会将于2022年举办,绿色环保是主要理念。在场馆建设中用到的一种耐腐、耐高温的表面涂料是以某双环烯酯为原料制得,该双环烯酯的结构如图所示。下列说法正确的是( )
A.该双环烯酯的分子式为C14H20O2
B.1mol该双环烯酯能与3mol
H2发生加成反应
C.该双环烯酯分子中π键数目为3mol
D.该双环烯酯的一氯代物有9种
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.将1mol
SO2通入水中,H2SO3、HSO3﹣、SO32﹣粒子数之和为NA
B.标准状况下,22.4L
HF溶于水,溶液中HF与F﹣数目之和为NA
C.将1mol
NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
D.100g质量分数为46%的乙醇溶液中含有氢原子的数目为6NA
6.下列说法正确的是( )
A.金属阳离子只能存在于离子晶体中
B.CO32﹣的立体构型为平面三角形,中心原子的杂化方式为sp2
C.将一定体积和浓度的KMnO4酸性溶液与一定量的草酸溶液混合,当0.01mol
KMnO4被还原时,强酸提供的H+的物质的量为0.08mol
D.用惰性电极电解200mL
1mol/L的CuSO4溶液,通电一段时间,当电路中转移0.6mol电子时,相同条件下两极分别产生的V(H2):V(O2)=1:1
7.A、B、C、X均为中学化学常见物质,它们之间有如图转化关系(副产物已略去),下列相关叙述不正确的是( )
A.若X是空气中存在的强氧化性无色气体单质,则A可以是C、Na、S、N2
B.若X是黄绿色气体单质,则A可以是Fe
C.若X为强碱溶液;A为盐,其阳离子半径是第三周期离子半径最小的。则反应②的离子方程式为:Al(OH)3+OH﹣═AlO2﹣+2H2O
D.若X为溶液,其溶质常做制冷剂;A能使品红褪色,加热后又回复原色,则反应①的离子方程式为SO2+NH3?H2O═NH4++HSO3﹣
8.如表实验操作、现象与结论均正确的是( )
选项
操作
现象
结论
A
如图,为验证牺牲阳极的阴极保护,向Fe电极附近的溶液中滴加K3[Fe(CN)6]溶液
铁电极表面生成蓝色沉淀
在该原电池中Fe作负极
B
常温下,将打磨后的铝片放入浓硝酸中
无明显现象
常温下铝与浓硝酸不反应
C
向装有X溶液的试管中滴入稀NaOH溶液,将湿润的红色石蕊试纸靠近试管口
无明显现象
X溶液中无NH4+
D
向Na2CO3溶液中逐滴滴入同浓度、同体积的水杨酸()溶液
无气体产生
电离常数:K1(碳酸)>K2(水杨酸)
A.A
B.B
C.C
D.D
9.能正确表示下列反应的离子方程式是( )
A.FeSO4溶液暴露在空气中:12Fe2++3O2+6H2O═8Fe3++4Fe(OH)3↓
B.过氧化钠固体与水反应:2O22﹣+2H2O═4OH﹣+O2↑
C.向1mL
0.5mol/L
NaHCO3溶液中滴加1mL
0.5mol/L
CaCl2溶液出现白色沉淀:CO32﹣+Ca2+═CaCO3↓
D.向次氯酸钠溶液中通入少量SO2:ClO﹣+SO2+H2O═Cl﹣+SO42﹣+2H+
10.电镀废液中Cr2O72﹣可通过下列反应转化成铬黄(PbCrO4):Cr2O72﹣(aq)+2Pb2+(aq)+H2O(l)?2PbCrO4(s)+2H+(aq)△H<0,达到平衡。说法正确的是( )
A.移走PbCrO4(s),Cr2O72﹣的转化率升高
B.加入少量NaOH固体,自然沉降后,溶液颜色变深
C.加入Pb(NO3)2固体,平衡逆向移动
D.降低温度,该反应的平衡常数K=增大
11.我国科学家研发了一种水系可逆Zn﹣CO2电池,电池工作时,复合膜(由a、b膜复合而成)层间的H2O解离成H+和OH﹣,在外加电场中可透过相应的离子膜定向移动。当闭合K1时,Zn﹣CO2电池工作原理如图所示,下列说法不正确的是( )
A.a膜是阳离子膜,b膜是阴离子膜
B.放电时负极的电极反应式为Zn+4OH﹣﹣2e﹣═Zn(OH)42﹣
C.充电时CO2在多孔Pd纳米片表面转化为甲酸
D.外电路中每通过1mol电子,复合膜层间有1mol
H2O解离
12.已知Kb(NH3?H2O)=1.7×10﹣5,Ka(CH3COOH)=1.7×10﹣5。25℃时,向20mL浓度均为0.01mol?L﹣1的盐酸和醋酸的混合溶液中逐滴加入0.01mol?L﹣1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法错误的是( )
A.a点溶液中,c(CH3COO﹣)数量级约为10﹣5
B.b点溶液中,c(Cl﹣)>c(NH4+)>c(CH3COOH)>c(H+)>c(OH﹣)
C.c点溶液中,c(NH4+)+c(NH3?H2O)=c(CH3COO﹣)+c(CH3COOH)
D.d点溶液中,c(NH4+)=c(CH3COOH)+2c(CH3COO﹣)
二、解答题(共4小题,满分64分)
13.Fe、Co、Ni、Cu、Ag是一系列合金的重要金属元素。
(1)Fe元素位于周期表的
区,基态Fe2+与Fe3+离子中未成对电子数之比为
。元素周期表中,铜、银位于同一副族相邻周期,则基态银原子的价层电子排布式为
。
(2)将过量的NH3通入CuSO4溶液中可以得到Cu(NH3)4SO4,Cu(NH3)4SO4中第一电离能最大的是
(填元素符号),NH3、CH4和H2O的沸点由高到低的顺序为
。
(3)照相底片定影时,常用定影液硫代硫酸钠(Na2S2O3)溶解未曝光的溴化银(AgBr),生成含Na3[Ag(S2O3)2]的废定影液。S2O32﹣离子结构如图1所示,其中心硫原子的杂化方式为
。基态S原子中,核外电子占据的最高能级的符号是
,占据最高能级电子的电子云轮廓图为
形。
(4)Co可形成[Co(NH3)6]Cl2配合物。1mol[Co(NH3)6]Cl2中含有σ键的数目为
NA。
(5)镧镍合金是重要储氢材料。镧镍合金储氢后所得的晶体的化学式为LaNi5H6,晶胞如图2所示,则Z表示的微粒为
(填化学式),晶胞参数=
pm。(用代数式表示,已知LaNi5H6的摩尔质量为440g?mol﹣1,晶体密度为ρg?cm﹣3,NA为阿伏加德罗常数的值)
14.茜草素(H)是一种蔥醌类化合物,存在于茜草中,具有抗肿瘤和免疫抑制作用。一种合成茜草素的路线如图所示。请回答下列问题:
已知:①;
②;
③RCOOHRCOClRCOR1。
(1)H中所含官能团的名称是
。
(2)C的核磁共振氢谱中峰面积之比为
。
(3)F→H的反应类型是
。
(4)书写下列化学方程式:A→R
,C→D
。
(5)芳香族化合物Y是B的同分异构体,写出所有符合下列条件的Y的结构简式:
。
①1mol
Y最多能消耗2mol
Na或1mol
NaOH;
②Y能与FeCl3溶液发生显色反应;
③苯环上有两种氢。
(6)以和HOOC﹣CH=CH﹣COOH为原料,设计五步合成
。(参照以上合成路线,无机试剂和不超过2个碳的有机试剂任选)
15.研究人员从处理废旧线路板后的固体残渣(含SnO2、PbO2等)中进一步回收金属锡(Sn),一种回收流程如图1。
已知:ⅰ.50Sn、82Pb为ⅣA族元素;
ⅱ.SnO2、PbO2与强碱反应生成盐和水。
ⅲ.+2价Sn不稳定,与空气接触容易氧化为+4价锡
(1)SnO2与稀NaOH反应的离子方程式为
。
(2)滤液1中加入Na2S的目的是除铅,将相关方程式补充完整:
Na2PbO3+
Na2S+
═PbS↓+S↓+
(3)不同溶剂中Na2SnO3的溶解度随温度变化如图2。
①相同温度下,Na2SnO3的溶解度随NaOH浓度增大而减小,结合平衡移动原理解释原因:
。
②操作Ⅲ的具体方法为
。
(4)测定粗锡中Sn的纯度:在强酸性环境中将ag粗锡样品溶解(此时Sn全部转化成Sn2+),迅速加入过量NH4Fe(SO4)2溶液,以二苯胺磺酸钠为指示剂,用0.1000mol?L﹣1K2Cr2O7标准溶液滴定至终点。消耗K2Cr2O7溶液的体积如图3所示,计算Sn的纯度。
已知:Sn2++2Fe3+═Sn4++2Fe2+;Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O
①溶解粗锡时不宜选用浓盐酸,理由是
。
②二苯胺磺酸钠是一种氧化还原指示剂,滴定终点时因发生
反应而变色。(填写“氧化”或“还原”)
③滴定终点时消耗K2Cr2O7标准溶液体积
mL,粗锡样品中Sn的纯度为
。(用质量分数表示)
④下列操作会导致样品中Sn的测定结果偏高的是
。(填选项字母)
a.上述实验中若缓慢加入NH4Fe(SO4)2溶液
b.盛标准K2Cr2O7标准溶液的滴定管尖嘴部分有气泡未排除就开始滴定
c.实验用的酸式滴定管、锥形瓶水洗后均未润洗
16.“Cl化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、HCHO、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。请回答下列问题:
Ⅰ.反应的热化学方程式为CO2(g)+2H2(g)?CH2O(g)+H2O(g)△H。
(1)已知:①CH2O(g)+O2(g)═CO2(g)+H2O(g)△H1=﹣480kJ/mol②相关化学键的键能数据如表所示:
化学键
O=O
H﹣H
O﹣H
键能/kJ?mol﹣1
498
436
464
则CO2(g)+2H2(g)?CH2O(g)+H2O(g)△H=
。
(2)一定条件下,将n(CO2):n(H2)=1:2的混合气体充入恒温恒容的密闭容器中,发生反应CO2(g)+2H2(g)?CH2O(g)+H2O(g)。
①下列说明反应已经达到平衡状态的是
。(填选项字母)
a.容器内气体密度保持不变
b.H2O的体积分数保持不变
c.该反应的平衡常数保持不变
d.混合气体的平均相对分子质量不变
②下列措施既能提高H2的转化率又能加快反应速率的是
(填选项字母)。
a.升高温度
b.使用高效催化剂
c.缩小容器体积
d.扩大容器体积
Ⅱ.向体积为1L的恒容密闭容器中充入bmol
CO和2bmol
H2,发生反应CO(g)+2H2(g)?CH3OH(g)。实验测定CH3OH的平衡产率随温度、压强的变化关系如图所示。请回答:
(3)①该反应属于
(填“吸”或“放”)热反应;P1
P2。(填“>”、“<”或“=”)
②已知A点CH3OH的平衡产率为0.25,求100℃时,该反应平衡常数K=
。(用含b的代数式表示)
③求A点CO的物质的量分数=
。
Ⅲ.多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。电解装置中分别以多晶Cu和铂为电极材料,用阴离子交换膜分隔开阴、阳极室,阴、阳极室的KHCO3溶液的浓度(约0.1mol?L﹣1左右)基本保持不变。并向某极室内持续通入CO2,温度控制在10℃左右。
(4)通入CO2的电极为
(填“阴极”或“阳极”),生成C2H4的电极反应式为
。
2020-2021学年天津市滨海七校高三(上)期末化学试卷
试题解析
一、选择题(共12小题,每小题3分,满分36分)
1.解:A.钛的原子序数为22,位于第四周期,最外层有4个电子,钛元素位于元素周期表第四周期IVB族,故A错误;
B.钛和铝的相对原子质量比较小,钛合金和铝合金密度小、硬度大、耐腐蚀,故B错误;
C.氮化硅属于无机物,不属于有机合成高分子材料,故C错误;
D.二氧化硅晶体能传递光信号,是制造光导纤维的主要原料,故D正确;
故选:D。
2.解:A.次氯酸中O最外层2个单电子,分别与H和Cl形成共价键,电子式为,故A错误;
B.丁烷的球棍模型为,故B正确;
C.乙烯是含有2个碳原子的单烯烃,其结构简式为CH2=CH2,故C正确;
D.R2+离子核外有a个电子,R原子的核外电子总数=质子数=a+2,其质量数为a+2+b,则R原子可表示为:R,故D正确;
故选:A。
3.解:A.过氧化钠与水反应生成氢氧化钠与氧气,故不属于碱性氧化物,故A错误;
B.氯化铁属于盐,Fe3+的氧化性强于Cu2+,氯化铁能与Cu反应生成氯化亚铁与氯化铜,可以刻制印刷电路板,故B正确;
C.二氧化硫与有色物质化合为不稳定的无色物质,与二氧化硫的氧化性无关,且二氧化硫没有强氧化性,故C错误;
D.碳酸钠溶液碱性强,具有腐蚀性,不能用于治疗胃酸过多,碳酸氢钠可用于治疗胃酸过多,故D错误;
故选:B。
4.解:A.该双环烯酯的分子式为C14H20O2,故A正确;
B.碳碳双键能与H2发生加成反应,酯基中碳氧双键不能与H2反应,因此1mol该双环烯酯能与2molH2发生加成反应,故B错误;
C.双键中含有一个π键,单键中不含π键,该分子中含有三个双键,则该分子中含有3个π键,故C错误;
D.该分子中含有13种氢原子,所以一氯代物有13种,故D错误;
故选:A。
5.解:A.二氧化硫和水的反应是可逆反应,故溶液中含二氧化硫分子,故溶液中H2SO3、HSO3﹣、SO32﹣粒子数之和小于NA,故A错误;
B.标况下HF为液体,故22.4LHF的物质的量大于1mol,则溶液中HF与F﹣数目之和大于NA,故B错误;
C.将1mol
NH4NO3溶于稀氨水中使溶液呈中性,则溶液中存在电荷守恒:[H+]+[NH4+]=[NO3﹣]+[OH﹣],溶液呈中性,则铵根离子浓度等于硝酸根离子浓度,溶液体积相等,则铵根离子数目等于硝酸根离子数,为1mol,溶液中NH4+数目为NA,故C正确;
D.100g质量分数为46%的乙醇溶液中含有溶质CH3CH2OH的质量是46g,物质的量是1mol,其中含有H原子是6mol,溶剂H2O质量是m(H2O)=100g﹣46g=54g,其物质的量是3mol,其中含有H原子的物质的量是6mol,则100g该溶液中含有H原子总物质的量是12mol,则含有的氢原子数目为12NA,故D错误。
故选:C。
6.解:A.金属晶体是由金属阳离子和自由电子构成的,所以金属阳离子可能还存在于金属晶体中,故A错误;
B.CO32﹣中C原子价层电子对个数=3+=3且不含孤电子对,根据价层电子对互斥理论判断该离子空间构型为平面三角形、中心原子杂化方式为sp2,故B正确;
C.该反应离子方程式为6H++2MnO4﹣+5H2C2O4═10CO2↑+2Mn2++8H2O,由方程式中KMnO4与H+的关系式计算消耗n(H+)=3n(KMnO4)=3×0.01mol=0.03mol,故C错误;
D.n(Cu2+)=n(CuSO4)=1mol/L×0.2L=0.2mol,如果Cu2+完全放电,Cu2+转移电子物质的量=0.2mol×2=0.4mol,当电路中转移0.6mol电子时,阴极上H+得到0.2mol电子,生成0.1mol氢气,阳极上转移0.6mol电子时生成氧气物质的量==0.15mol,相同条件下生成气体体积之比等于气体物质的量之比,则相同条件下两极分别产生的V(H2):V(O2)=0.1mol:0.15mol=2:3,故D错误;
故选:B。
7.解:A.若X是空气中存在的强氧化性无色气体单质,则X为氧气,碳与氧气反应生成CO,CO能与氧气反应生成二氧化碳;Na与氧气反应生成氧化钠,氧化钠与氧气反应生成过氧化钠;S和氧气反应生成二氧化硫,二氧化硫和氧气反应生成三氧化硫;N2和氧气反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,均符合转化关系,故A正确;
B.X是黄绿色气体单质,则X为氯气,若A为铁,则B为氯化铁,氯化铁不能与氯气反应,不符合转化关系,故B错误;
C.若X为强碱溶液,A为盐,其阳离子半径是第三周期离子半径最小的,则A为铝盐,B为氢氧化铝,反应②的离子方程式为:Al(OH)3+OH﹣═AlO2﹣+2H2O,故C正确;
D.若X为溶液,其溶质常做制冷剂,A能使品红褪色,加热后又回复原色,则A为二氧化硫、X为氨水、B为亚硫酸氢铵、C为亚硫酸铵,反应①的离子方程式为:SO2+NH3?H2O═NH4++HSO3﹣,故D正确;
故选:B。
8.解:A.由图可知,牺牲阳极的阴极保护中被保护的Fe电极是正极,Zn电极是负极,不会产生Fe2+,滴加K3[Fe(CN)6]溶液不会有蓝色沉淀现象出现,故A错误;
B.铝在浓硝酸中会钝化,没有明显现象,但钝化不是不反应,而是铝在浓硝酸中发生反应生成一层致密的氧化物保护膜,阻止内部金属继续反应,故B错误;
C.滴入稀的氢氧化钠溶液,可能生成一水合氨,湿润的红色石蕊试纸靠近试管口,试纸没有明显现象,但原溶液中可能含有铵根离子,故C错误;
D.向Na2CO3溶液中逐滴滴入同浓度、同体积的水杨酸溶液,没有气泡产生,说明水杨酸和Na2CO3不能反应生成碳酸,根据强酸制弱酸的原理,碳酸的酸性大于水杨酸,即电离常数:K1(碳酸)>K(水杨酸),故D正确;
故选:A。
9.解:A.FeSO4酸性溶液暴露在空气中被氧化成硫酸铁、氢氧化铁,该反应的离子方程式为:12Fe2++3O2+6H2O═8Fe3++4Fe(OH)3↓,故A正确;
B.过氧化钠固体与水反应,过氧化钠不能写成离子,离子方程式为:2Na2O2+2H2O═4OH﹣+O2↑+4Na+,故B错误;
C.NaHCO3溶液与CaCl2溶液反应生成白色沉淀为碳酸钙、气体为二氧化碳,发生CaCl2+2NaHCO3=CaCO3↓+2NaCl+CO2↑+H2O,离子方程式为:2HCO3﹣+Ca2+═CaCO3↓+CO2↑+H2O,故C错误;
D.向次氯酸钠溶液中通入少量的SO2,发生反应的离子方程式为:H2O+3ClO﹣+SO2═SO42﹣+Cl﹣+2HClO,故D错误;
故选:A。
10.解:A.PbCrO4(s)是固体,不影响平衡移动,则移走PbCrO4(s),Cr2O72﹣的转化率不变,故A错误;
B.加入少量NaOH固体,NaOH和H+反应导致溶液中c(H+)减小,平衡正向移动,溶液颜色变浅,故B错误;
C.加入Pb(NO3)2固体导致溶液中c(Pb2+)增大,则平衡正向移动,故C错误;
D.降低温度平衡正向移动,则生成物浓度增大而反应物浓度减小,所以该反应的平衡常数K=增大,故D正确;
故选:D。
11.解:A.复合膜中H2O解离成H+和OH﹣,根据图中复合膜中H+通过a膜、OH﹣通过b膜可知,a膜是阳离子膜,b膜是阴离子膜,故A正确;
B.放电时,阳离子移向正极、阴离子移向负极,图中H+通过a膜移向多孔Pd纳米片、OH﹣通过b膜移向Zn,则Zn为负极、多孔Pd纳米片为正极,负极上Zn失去电子生成Zn(OH)42﹣,负极电极反应为Zn+4OH﹣﹣2e﹣═Zn(OH)42﹣,故B正确;
C.原电池中Zn为负极、多孔Pd纳米片为正极,充电时Zn为阴极、多孔Pd纳米片为阳极,阳极上HCOOH发生失去电子的氧化反应生成CO2,故C错误;
D.复合膜中H2O?H++OH﹣,由于电子所带电荷数与H+或OH﹣所带电荷数相等,所以外电路中每通过1mol电子,通过a膜的H+或通过b膜的OH﹣物质的量均为1mol,即复合膜层间有1mol
H2O解离,故D正确;
故选:C。
12.解:A.由CH3COOH的电离平衡常数表达式可知,c(CH3COO﹣)=≈=1.7×10﹣5,故A正确;
B.b点溶质为等浓度氯化铵和醋酸,Ka(CH3COOH)=1.7×10﹣5,Kh(NH4+)=×10﹣9,Ka(CH3COOH)>Kh(NH4+),醋酸电离程度大于NH4+水解程度,则c(NH4+)>c(CH3COOH),溶液显酸性,所以就有c(Cl﹣)>c(NH4+)>c(CH3COOH)>c(H+)>c(OH﹣),故B正确;
C.c点溶液中恰好生成等量的NH4Cl和CH3COONH4,根据物料守恒:2c(Cl﹣)=c(NH4+)+c(NH3?H2O),2c(CH3COOH)+2c(CH3COO﹣)=c(NH4+)+c(NH3?H2O),c(Cl﹣)=c(CH3COO﹣)+c(CH3COOH)所以有c(NH4+)+c(NH3?H2O)=c(Cl﹣)+c(CH3COO﹣)+c(CH3COOH),故C错误;
D.d点溶质为氯化铵、醋酸铵和一水合氨的中性溶液,d点溶液中的pH=7,c(OH﹣)=c(H+),根据电荷守恒c(H+)+c(NH4+)=c(Cl﹣)+c(CH3COO﹣)+c(OH﹣)可知:c(NH4+)=c(Cl﹣)+c(CH3COO﹣),由c点可知物料守恒得,c(Cl﹣)=c(CH3COO﹣)+c(CH3COOH),所以就有c(NH4+)=c(CH3COOH)+2c(CH3COO﹣),故D正确;
故选:C。
二、解答题(共4小题,满分64分)
13.解:(1)铁在第四周期第ⅤⅢ族,价电子排布为3d64s2,则Fe元素位于周期表的d区,基态Fe2+与Fe3+的核外电子排布式分别为[Ar]3d6、[Ar]d5,则未成对电子数之比为4:5,铜位于第四周期第IB族,价层电子排布式为3d104s1,则同族下一周期Ag的价层电子排布式为4d105s1,
故答案为:d;4:5;4d105s1;
(2)Cu(NH3)4SO4由Cu、H、N、S、O五种元素组成,Cu、H为正价,第一电离能相对较小,O、S位于同一主族,O的第一电离能大于S,N、O位于同一周期,但N原子最外层达到半饱和的稳定结构,难以失去电子,则第一电离能大小为N>O,即Cu、H、N、S、O五种元素中第一电离能最大是N;CH4分子间只有分子间作用力,NH3和H2O分子间还存在氢键,则CH4的沸点小,并且NH3和H2O平均每个分子含氢键数:冰中2个、液氨只有1个,则冰气化要克服的氢键能大于液氨,所以NH3、CH4和H2O的沸点由高到低的顺序为H2O>NH3>CH4,
故答案为:N;H2O>NH3>CH4;
(3)由图可知,S2O32﹣离子中S原子的构型为四面体结构,VSEPR模型为四面体,杂化方式为sp3,S原子的价电子排布式为3s23p4,最高能层为3p,p轨道的电子云轮廓图为哑铃形(或纺锤形),
故答案为:sp3;3p;哑铃(或纺锤);
(4)配离子[Co(NH3)6]2+中,NH3与Co2+形成配位键,配位数为6,形成6个σ键,一个NH3分子中含有3个N﹣H键、含有3个σ键,即一个[Co(NH3)6]2+中含有σ键的数目为6+3×6=24,所以1mol[Co(NH3)6]Cl2中含有σ键24mol,数目为24NA,
故答案为:24;
(5)晶胞中X数目=8×=1、Y数目=1+8×=5、Z数目=8×+2×=3,结合化学式LaNi5(H2)3,可知X代表La、Y代表Ni、Z代表H2,设晶胞参数为x,晶胞体积V=x3,晶胞的质量m=nM=mol×440g?mol﹣1=g,ρV=m,即ρx3g=g,解得x=cm=×1010pm,即晶胞边长为×1010pm,
故答案为:H2;×1010。
14.解:(1)由结构可知,H中所含官能团的名称是:羟基、羰基,
故答案为:羟基、羰基;
(2)C存在如图所示对称结构:,苯环上有2种氢,﹣CHO中有1种氢,含有的氢原子数目之比为2:2:2=1:1:1,故C的核磁共振氢谱中峰面积之比为1:1:1,
故答案为:1:1:1;
(3)F→H是与发生取代反应生成H,
故答案为:取代反应;
(4)A→R的化学方程式为:;C→D的化学方程式为:,
故答案为:n;;
(5)B为,芳香族化合物Y是B的同分异构体,Y能与FeCl3溶液发生显色反应,1mol
Y最多能消耗2mol
Na或1mol
NaOH,说明Y含有1个酚羟基、1个醇羟基,且Y苯环上有两种氢,则苯环有2个不同的取代基且处于对位,可能的结构简式为:、,
故答案为:、;
(6)与溴发生加成反应生成,发生消去反应生成,HOOC﹣CH=CH﹣COOH与SOCl2反应生成ClOC﹣CH=CH﹣COCl,与ClOC﹣CH=CH﹣COCl发生加成反应生成,与CH3OH发生酯化反应生成,合成路线为:,
故答案为:。
15.解:(1)二氧化锡与NaOH反应的离子方程式为SnO2+2OH﹣=SnO32﹣+H2O,
故答案为:SnO2+2OH﹣=SnO32﹣+H2O;
(2)反应中Pb化合价降低,S化合价升高,按照氧化还原的相关规律即可配平,其完整的化学方程式为Na2PbO3+Na2S+3H2O═PbS↓+S↓+6NaOH,
故答案为:2;3H2O;6NaOH;
(3)①在Na2SnO3溶液中,存在水解平衡SnO32﹣+H2O?HSnO3﹣+OH﹣,相同温度下NaOH浓度越大对水解抑制能力越强,使平衡逆向移动,Na2SnO3溶解度降低,
故答案为:相同温度下NaOH浓度越大对水解抑制能力越强,使平衡逆向移动,Na2SnO3溶解度降低;
②操作Ⅱ得到的溶液为NaOH和Na2SnO3的混合液,需加入SnO2除去溶液中的NaOH,其操作为向滤液2中加入过量SnO2,反应完全后过滤,加入少许浓氨水,降低Na2SnO3的溶解度,加热浓缩、冷却结晶、过滤、洗涤、干燥得到Na2SnO3固体,
故答案为:向滤液2中加入过量SnO2,反应完全后过滤,加入少许浓氨水,加热浓缩、冷却结晶、过滤、洗涤、干燥得到Na2SnO3固体;
(4)①用浓盐酸溶解时,引入氯离子,氧化时消耗的氧化剂的量偏多,使测量结果偏高,
故答案为:引入氯离子,氧化时消耗的氧化剂的量偏多,使测量结果偏高;
②因K2Cr2O7具有强氧化性,终点时二苯胺磺酸钠被氧化而变色,说明二苯胺磺酸钠具有还原性,
故答案为:氧化;
③滴定管初读数为0.80mL,末读数为22.80mL,故标准液的体积为22.80﹣0.80=22.00mL;根据反应式可建立关系Cr2O72﹣~3Sn,n(Sn)=3n(Cr2O72﹣)=3×0.1×22.00×10﹣3mol,Sn的质量为m=nM=(3×0.1×22.00×10﹣3×119)g=0.7854g,Sn的质量分数为×100%=%,
故答案为:22.00;%;
④根据Cr2O72﹣~3Sn,可知标准液体积与Sn的质量分数成正比;
a.缓慢加入NH4Fe(SO4)2,溶液中Sn2+易被空气中的氧气氧化成Sn4+,使溶液中的Fe2+量变少,消耗的标准液体积偏小,导致结果偏低;
b.盛标准K2Cr2O7标准溶液的滴定管尖嘴处有气泡,初读数偏小,标准液体积偏大,结果偏大;
c.酸式滴定管用于盛装标准液,未润洗则使标准液被稀释,消耗的标准液体积偏大,使结果偏高;
故答案为:bc。
16.解:Ⅰ.(1)表中数据可知反应①O2(g)+2H2(g)=2H2O(g)△H=反应物总键能﹣生成物总键能=498kJ/mol+2×436kJ/mol﹣4×464kJ/mol=﹣486kJ/mol,
②CH2O(g)+O2(g)═CO2(g)+H2O(g)△H1=﹣480kJ/mol,
结合盖斯定律①﹣②计算得到CO2(g)+2H2(g)?CH2O(g)+H2O(g)△H=﹣6kJ/mol,
故答案为:﹣6kJ/mol;
(2)①a.恒容容器中各物质均为气体,容器内气体密度始终保持不变,所以容器内气体密度保持不变的状态不一定是平衡状态,故a错误;
b.H2O的体积分数保持不变,符合平衡状态的特征,反应一定达到平衡状态,故b正确;
c.平衡常数只与温度有关,温度一定时该反应的平衡常数始终保持不变,所以不能确定反应是否达到平衡状态,故c错误;
d.恒容容器中气体物质的质量不变,反应正向气体的物质的量减小,所以混合气体的平均相对分子质量不变的状态是平衡状态,故d正确;
故答案为:bd;
②a.该反应正向放热,升高温度,反应速率加快,但平衡逆向移动,氢气的转化率降低,故a不选;
b.催化剂可加快反应速率,但不改变化学平衡移动,不能提高转化率,故b不选;
c.该反应正向体积减小,缩小容器体积,平衡正向移动,并且反应速率加快,故c选;
d.扩大容器体积,平衡逆向移动,氢气的转化率和反应速率均降低,故d不选;
故答案为:c;
Ⅱ.(3)①图象分析可知,随温度升高,甲醇产率减小,说明升温平衡逆向进行,正反应为放热反应,图象分析可知相同温度、P2压强下,一氧化碳转化率大于P1压强下一氧化碳转化率,反应是气体体积减小的反应,压强增大平衡正向进行,所以P1<P2,
故答案为:<;
②向1L恒容密闭容器中充入bmol
CO与2bmol
H2,已知A点CH3OH的平衡产率为0.25,结合三行计算,列式得到:
CO(g)+2H2(g)=CH3OH(g)
起始量(mol/L):b
2b
0
转化量(mol/L):0.25b
0.5b
0.25
b
平衡量(mol/L):0.75b
1.5b
0.25b
平衡常数K===,
故答案为:;
③A点CO的物质的量分数=×100%=30%,
故答案为:30%;
Ⅲ.电解池的阴极发生得电子的还原反应,所以CO2还原为C2H4的反应在阴极上进行,电极反应式为14CO2+12e﹣+8H2O=C2H4+12HCO3﹣,
故答案为:阴极;14CO2+12e﹣+8H2O=C2H4+12HCO3﹣。
第1页(共1页)
同课章节目录
