吉林省长春市2020-2021学年第二学期九年级化学开学考试试题(word版,含答案)
文档属性
| 名称 | 吉林省长春市2020-2021学年第二学期九年级化学开学考试试题(word版,含答案) | 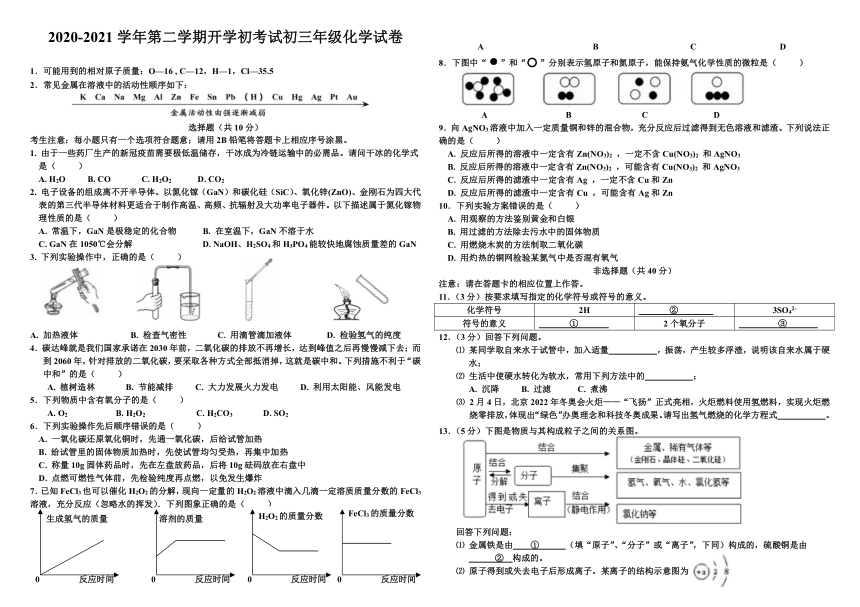 | |
| 格式 | docx | ||
| 文件大小 | 413.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-11 11:38:59 | ||
图片预览

文档简介
11950700122428002020-2021学年第二学期开学初考试初三年级化学试卷
1.可能用到的相对原子质量:O—16 , C—12,H—1,Cl—35.5
6254752159002.常见金属在溶液中的活动性顺序如下:
选择题(共10分)
考生注意:每小题只有一个选项符合题意;请用2B铅笔将答题卡上相应序号涂黑。
1. 由于一些药厂生产的新冠疫苗需要极低温储存,干冰成为冷链运输中的必需品。请问干冰的化学式是( )
A. H2O B. CO C. H2O2 D. CO2
2. 电子设备的组成离不开半导体。以氮化镓(GaN)和碳化硅(SiC)、氧化锌(ZnO)、金刚石为四大代表的第三代半导体材料更适合于制作高温、高频、抗辐射及大功率电子器件。以下描述属于氮化镓物理性质的是( )
A. 常温下,GaN是极稳定的化合物 B. 在室温下,GaN不溶于水
C. GaN在1050℃会分解 D. NaOH、H2SO4和H3PO4能较快地腐蚀质量差的GaN
32632651123953. 下列实验操作中,正确的是( )
507301510414016173452349518351553340
4608830111125
A. 加热液体 B. 检查气密性 C. 用滴管滴加液体 D. 检验氢气的纯度
4.碳达峰就是我们国家承诺在2030年前,二氧化碳的排放不再增长,达到峰值之后再慢慢减下去;而到2060年,针对排放的二氧化碳,要采取各种方式全部抵消掉,这就是碳中和。下列措施不利于“碳中和”的是( )
A. 植树造林 B. 节能减排 C. 大力发展火力发电 D. 利用太阳能、风能发电
5.下列物质中含有氧分子的是( )
A. O2 B. H2O2 C. H2CO3 D. SO2
6.下列实验操作先后顺序错误的是( )
A. 一氧化碳还原氧化铜时,先通一氧化碳,后给试管加热
B. 给试管里的固体物质加热时,先使试管均匀受热,再集中加热
C. 称量10g固体药品时,先在左盘放药品,后将10g砝码放在右盘中
D. 点燃可燃性气体前,先检验纯度再点燃,以免发生爆炸
FeCl3的质量分数
溶剂的质量
H2O2的质量分数
0 反应时间
0 反应时间
0 反应时间
0 反应时间
生成氢气的质量
7.已知FeCl3也可以催化H2O2的分解,现向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3溶液,充分反应(忽略水的挥发).下列图象正确的是( )
A B C D
8.下图中“ ”和“ ”分别表示氢原子和氮原子,能保持氨气化学性质的微粒是( )
37769804191027095454127515462254127530988041275
A B C D
9.向AgNO3溶液中加入一定质量铜和锌的混合物,充分反应后过滤得到无色溶液和滤渣。下列说法正确的是( )
A. 反应后所得的溶液中一定含有Zn(NO3)2 ,一定不含Cu(NO3)2 和AgNO3
B. 反应后所得的溶液中一定含有Zn(NO3)2 ,可能含有Cu(NO3)2 和AgNO3
C. 反应后所得的滤渣中一定含有Ag ,一定不含Cu和Zn
D. 反应后所得的滤渣中一定含有Cu ,可能含有Ag和Zn
10.下列实验方案错误的是( )
A. 用观察的方法鉴别黄金和白银
B. 用过滤的方法除去污水中的固体物质
C. 用燃烧木炭的方法制取二氧化碳
D. 用灼热的铜网检验某氮气中是否混有氧气
非选择题(共40分)
注意:请在答题卡的相应位置上作答。
11.(3分)按要求填写指定的化学符号或符号的意义。
化学符号
2H
②
3SO42-
符号的意义
①
2个氧分子
③
12.(3分)回答下列问题。
⑴ 某同学取自来水于试管中,加入适量 ,振荡,产生较多浮渣,说明该自来水属于硬水;
⑵ 生活中使硬水转化为软水,常用下列方法中的 ;
A. 沉降 B. 过滤 C. 煮沸
⑶ 2月4日,北京2022年冬奥会火炬——“飞扬”正式亮相,火炬燃料使用氢燃料,实现火炬燃烧零排放,体现出“绿色”办奥理念和科技冬奥成果。请写出氢气燃烧的化学方程式 。
35369521780513.(5分)下图是物质与其构成粒子之间的关系图。
回答下列问题:
⑴ 金属铁是由 ① (填“原子”、“分子”或“离子”,下同)构成的,硫酸铜是由
386207020955 ② 构成的。
⑵ 原子得到或失去电子后形成离子。某离子的结构示意图为
①当a= 时,该粒子是原子。
②当a=8时,该粒子是 (填“原子”、“阳离子”或“阴离子”),其符号为 。
4445016637014.(4分)元素周期表是学习和研究化学的重要工具。请分析图中信息回答下列问题:
⑴ 原子序数等于原子的质子数,则一个磷原子含有 个质子;
⑵ 某元素所在的周期数等于该原子的电子层数,则硫元素位于第 周期;
⑶ 元素的化学性质主要是由该元素的原子最外层电子数决定的,氟元素与表中的 元素
的化学性质相似;
⑷ 原子的电子层数越多,原子的半径越大;氯原子的原子半径 氧原子的原子半径。
(选填“>”、“=”或“<”)
15.(3分)请解释下列有关事实:
⑴ 生铁和钢的性能不同,因为二者的 不同;
⑵ 水和过氧化氢的化学性质不同,因为构成它们的 不同;
⑶ 氧元素和硫元素属于不同种元素,因为氧原子和硫原子的 不同。
16.(4分)用铝丝、洁净的铜丝、稀盐酸、硝酸银溶液,验证Al、Cu、Ag的金属活动性顺序。
⑴ 把打磨过的铝丝和洁净的铜丝分别浸入稀盐酸中,观察到 ① ,由此验证金属活动性顺序为 Al>(H)>Cu;铝与稀盐酸反应的基本反应类型是 ② ;铝丝使用前需要用砂纸打磨,目的是 ③ ;
⑵ 为了达到实验目的,除⑴中实验外,还需要进行的实验是 。
41719519367517.(5分)下图是某化学反应过程的微观模拟图,请结合图示回答问题。
⑴ 写出该微观模拟图所表示的化学反应方程式 ;
⑵ 分析图中信息可知,反应中有剩余的物质,其化学式为 ;
⑶ 从微观角度看,化学反应的实质是 ;
⑷ 从宏观角度看,判断该变化是化学变化的依据是 ;
⑸ 美国“毅力”号火星车携带了一个名为MOXIE的设备,可以将火星大气中的二氧化碳转化为氧气,请从元素角度解释该反应为何能发生: 。
4003675-4508518.(3分)KNO3和NaCl的溶解度曲线如右图所示。
⑴ 10℃时,KNO3的溶解度为 g;
⑵ 20℃时,KNO3饱和溶液中溶质的质量分数约为24%,若升温
到35℃,溶液中溶质的质量分数约为 ;
⑶ 现有40℃时KNO3的饱和溶液和NaCl的饱和溶液。
温度改变时不考虑水的蒸发,下列关系一定成立的是 。
A. 40℃时,溶液中溶质的质量KNO3>NaCl
B. 分别在40℃恒温蒸发等质量的水,析出晶体质量KNO3>NaCl
C. 分别降温到20℃,析出晶体质量KNO3>NaCl
D. 分别降温到20℃后,过滤后得到的溶液的溶质的质量分数KNO349276015875019.(3分)已知:白磷的着火点为40℃。用下图所示实验验证可燃物燃烧的条件。
A B C D
⑴ 实验B与D进行对比,可以验证燃烧条件之一: ;
⑵ 能验证可燃物燃烧需要O2的实验现象是 ;
⑶ A~D中,可不做的实验是 (填序号)。
20.(4分)某小组同学利用加热氯酸钾(KClO3)和二氧化锰(MnO2)固体混合物制取氧气,
448310170180回答下列问题:
⑴ 上图中仪器a的名称是 ;
⑵ 写出加热氯酸钾(KClO3)和二氧化锰(MnO2)混合物发生的化学反应方程式 ;
⑶ 氧气的密度比空气略大,则可用装置 ① 收集氧气,判断氧气收集满的操作是 ② 。
21.(3分)实验室利用石灰石和稀盐酸反应制取CO2气体。请计算制取2.2g CO2气体,至少需要多少克稀盐酸(溶质质量分数为10%)与足量的石灰石反应?
答案
1-5DBBCA
6-10CBAAC
11①2个氢原子
②2O2
③3个硫酸根离子
12⑴ 肥皂水
⑵ C
819785161290
⑶ 2H2+O2 2H2O
13⑴①原子 ②离子
⑵①10 ②阴离子 O2-
14⑴15
⑵3(或三)
⑶Cl
⑷>
15⑴含碳量
⑵分子
⑶质子数
16⑴①铝丝表面有气泡产生,铜丝无变化
②置换
③除去表面致密的氧化铝薄膜
⑵将铜丝放入硝酸银溶液中
878205144780
17⑴ 2CO+O2 2CO2
⑵O2
⑶分子破裂为原子,原子重新组合
⑷有新物质生成
⑸二氧化碳中含氧元素,根据化学反应前后元素守恒,可以制取出氧气
18⑴20
⑵24%
⑶BD
19⑴温度达到着火点
⑵C中白磷不燃烧,D中白磷燃烧
⑶A
20⑴试管
724535137160
⑵2KClO3 2KCl+3O2↑
⑶带火星木条放瓶口
21解:设需要盐酸质量为x
CaCO3+2HCl = CaCl2+H2O+CO2↑
73 44
x×10% 2.2g
=
73 44
x×10% 2.2g
x=36.5g
答:需要盐酸质量为36.5g。
1.可能用到的相对原子质量:O—16 , C—12,H—1,Cl—35.5
6254752159002.常见金属在溶液中的活动性顺序如下:
选择题(共10分)
考生注意:每小题只有一个选项符合题意;请用2B铅笔将答题卡上相应序号涂黑。
1. 由于一些药厂生产的新冠疫苗需要极低温储存,干冰成为冷链运输中的必需品。请问干冰的化学式是( )
A. H2O B. CO C. H2O2 D. CO2
2. 电子设备的组成离不开半导体。以氮化镓(GaN)和碳化硅(SiC)、氧化锌(ZnO)、金刚石为四大代表的第三代半导体材料更适合于制作高温、高频、抗辐射及大功率电子器件。以下描述属于氮化镓物理性质的是( )
A. 常温下,GaN是极稳定的化合物 B. 在室温下,GaN不溶于水
C. GaN在1050℃会分解 D. NaOH、H2SO4和H3PO4能较快地腐蚀质量差的GaN
32632651123953. 下列实验操作中,正确的是( )
507301510414016173452349518351553340
4608830111125
A. 加热液体 B. 检查气密性 C. 用滴管滴加液体 D. 检验氢气的纯度
4.碳达峰就是我们国家承诺在2030年前,二氧化碳的排放不再增长,达到峰值之后再慢慢减下去;而到2060年,针对排放的二氧化碳,要采取各种方式全部抵消掉,这就是碳中和。下列措施不利于“碳中和”的是( )
A. 植树造林 B. 节能减排 C. 大力发展火力发电 D. 利用太阳能、风能发电
5.下列物质中含有氧分子的是( )
A. O2 B. H2O2 C. H2CO3 D. SO2
6.下列实验操作先后顺序错误的是( )
A. 一氧化碳还原氧化铜时,先通一氧化碳,后给试管加热
B. 给试管里的固体物质加热时,先使试管均匀受热,再集中加热
C. 称量10g固体药品时,先在左盘放药品,后将10g砝码放在右盘中
D. 点燃可燃性气体前,先检验纯度再点燃,以免发生爆炸
FeCl3的质量分数
溶剂的质量
H2O2的质量分数
0 反应时间
0 反应时间
0 反应时间
0 反应时间
生成氢气的质量
7.已知FeCl3也可以催化H2O2的分解,现向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3溶液,充分反应(忽略水的挥发).下列图象正确的是( )
A B C D
8.下图中“ ”和“ ”分别表示氢原子和氮原子,能保持氨气化学性质的微粒是( )
37769804191027095454127515462254127530988041275
A B C D
9.向AgNO3溶液中加入一定质量铜和锌的混合物,充分反应后过滤得到无色溶液和滤渣。下列说法正确的是( )
A. 反应后所得的溶液中一定含有Zn(NO3)2 ,一定不含Cu(NO3)2 和AgNO3
B. 反应后所得的溶液中一定含有Zn(NO3)2 ,可能含有Cu(NO3)2 和AgNO3
C. 反应后所得的滤渣中一定含有Ag ,一定不含Cu和Zn
D. 反应后所得的滤渣中一定含有Cu ,可能含有Ag和Zn
10.下列实验方案错误的是( )
A. 用观察的方法鉴别黄金和白银
B. 用过滤的方法除去污水中的固体物质
C. 用燃烧木炭的方法制取二氧化碳
D. 用灼热的铜网检验某氮气中是否混有氧气
非选择题(共40分)
注意:请在答题卡的相应位置上作答。
11.(3分)按要求填写指定的化学符号或符号的意义。
化学符号
2H
②
3SO42-
符号的意义
①
2个氧分子
③
12.(3分)回答下列问题。
⑴ 某同学取自来水于试管中,加入适量 ,振荡,产生较多浮渣,说明该自来水属于硬水;
⑵ 生活中使硬水转化为软水,常用下列方法中的 ;
A. 沉降 B. 过滤 C. 煮沸
⑶ 2月4日,北京2022年冬奥会火炬——“飞扬”正式亮相,火炬燃料使用氢燃料,实现火炬燃烧零排放,体现出“绿色”办奥理念和科技冬奥成果。请写出氢气燃烧的化学方程式 。
35369521780513.(5分)下图是物质与其构成粒子之间的关系图。
回答下列问题:
⑴ 金属铁是由 ① (填“原子”、“分子”或“离子”,下同)构成的,硫酸铜是由
386207020955 ② 构成的。
⑵ 原子得到或失去电子后形成离子。某离子的结构示意图为
①当a= 时,该粒子是原子。
②当a=8时,该粒子是 (填“原子”、“阳离子”或“阴离子”),其符号为 。
4445016637014.(4分)元素周期表是学习和研究化学的重要工具。请分析图中信息回答下列问题:
⑴ 原子序数等于原子的质子数,则一个磷原子含有 个质子;
⑵ 某元素所在的周期数等于该原子的电子层数,则硫元素位于第 周期;
⑶ 元素的化学性质主要是由该元素的原子最外层电子数决定的,氟元素与表中的 元素
的化学性质相似;
⑷ 原子的电子层数越多,原子的半径越大;氯原子的原子半径 氧原子的原子半径。
(选填“>”、“=”或“<”)
15.(3分)请解释下列有关事实:
⑴ 生铁和钢的性能不同,因为二者的 不同;
⑵ 水和过氧化氢的化学性质不同,因为构成它们的 不同;
⑶ 氧元素和硫元素属于不同种元素,因为氧原子和硫原子的 不同。
16.(4分)用铝丝、洁净的铜丝、稀盐酸、硝酸银溶液,验证Al、Cu、Ag的金属活动性顺序。
⑴ 把打磨过的铝丝和洁净的铜丝分别浸入稀盐酸中,观察到 ① ,由此验证金属活动性顺序为 Al>(H)>Cu;铝与稀盐酸反应的基本反应类型是 ② ;铝丝使用前需要用砂纸打磨,目的是 ③ ;
⑵ 为了达到实验目的,除⑴中实验外,还需要进行的实验是 。
41719519367517.(5分)下图是某化学反应过程的微观模拟图,请结合图示回答问题。
⑴ 写出该微观模拟图所表示的化学反应方程式 ;
⑵ 分析图中信息可知,反应中有剩余的物质,其化学式为 ;
⑶ 从微观角度看,化学反应的实质是 ;
⑷ 从宏观角度看,判断该变化是化学变化的依据是 ;
⑸ 美国“毅力”号火星车携带了一个名为MOXIE的设备,可以将火星大气中的二氧化碳转化为氧气,请从元素角度解释该反应为何能发生: 。
4003675-4508518.(3分)KNO3和NaCl的溶解度曲线如右图所示。
⑴ 10℃时,KNO3的溶解度为 g;
⑵ 20℃时,KNO3饱和溶液中溶质的质量分数约为24%,若升温
到35℃,溶液中溶质的质量分数约为 ;
⑶ 现有40℃时KNO3的饱和溶液和NaCl的饱和溶液。
温度改变时不考虑水的蒸发,下列关系一定成立的是 。
A. 40℃时,溶液中溶质的质量KNO3>NaCl
B. 分别在40℃恒温蒸发等质量的水,析出晶体质量KNO3>NaCl
C. 分别降温到20℃,析出晶体质量KNO3>NaCl
D. 分别降温到20℃后,过滤后得到的溶液的溶质的质量分数KNO3
A B C D
⑴ 实验B与D进行对比,可以验证燃烧条件之一: ;
⑵ 能验证可燃物燃烧需要O2的实验现象是 ;
⑶ A~D中,可不做的实验是 (填序号)。
20.(4分)某小组同学利用加热氯酸钾(KClO3)和二氧化锰(MnO2)固体混合物制取氧气,
448310170180回答下列问题:
⑴ 上图中仪器a的名称是 ;
⑵ 写出加热氯酸钾(KClO3)和二氧化锰(MnO2)混合物发生的化学反应方程式 ;
⑶ 氧气的密度比空气略大,则可用装置 ① 收集氧气,判断氧气收集满的操作是 ② 。
21.(3分)实验室利用石灰石和稀盐酸反应制取CO2气体。请计算制取2.2g CO2气体,至少需要多少克稀盐酸(溶质质量分数为10%)与足量的石灰石反应?
答案
1-5DBBCA
6-10CBAAC
11①2个氢原子
②2O2
③3个硫酸根离子
12⑴ 肥皂水
⑵ C
819785161290
⑶ 2H2+O2 2H2O
13⑴①原子 ②离子
⑵①10 ②阴离子 O2-
14⑴15
⑵3(或三)
⑶Cl
⑷>
15⑴含碳量
⑵分子
⑶质子数
16⑴①铝丝表面有气泡产生,铜丝无变化
②置换
③除去表面致密的氧化铝薄膜
⑵将铜丝放入硝酸银溶液中
878205144780
17⑴ 2CO+O2 2CO2
⑵O2
⑶分子破裂为原子,原子重新组合
⑷有新物质生成
⑸二氧化碳中含氧元素,根据化学反应前后元素守恒,可以制取出氧气
18⑴20
⑵24%
⑶BD
19⑴温度达到着火点
⑵C中白磷不燃烧,D中白磷燃烧
⑶A
20⑴试管
724535137160
⑵2KClO3 2KCl+3O2↑
⑶带火星木条放瓶口
21解:设需要盐酸质量为x
CaCO3+2HCl = CaCl2+H2O+CO2↑
73 44
x×10% 2.2g
=
73 44
x×10% 2.2g
x=36.5g
答:需要盐酸质量为36.5g。
同课章节目录
