2020-2021学年安徽省阜阳市高三(上)期末化学试卷(Word+答案)
文档属性
| 名称 | 2020-2021学年安徽省阜阳市高三(上)期末化学试卷(Word+答案) |  | |
| 格式 | zip | ||
| 文件大小 | 221.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-06 20:41:52 | ||
图片预览




文档简介
2020-2021学年安徽省阜阳市高三(上)期末化学试卷
一、选择题(共7小题,每小题6分,满分42分)
1.铅白[2PbCO3?Pb(OH)2]是油画中一种重要的白色颜料,但用铅白作画,日久易变黑(主要成分为PbS),这种现象在书画术语中叫作“返铅”。书画修复中有一种方法是用双氧水清洗使之恢复白色。下列有关叙述正确的是( )
A.铅白长时间放置于空气中会被氧气氧化
B.铅白耐强酸耐强碱
C.用双氧水清洗是利用双氧水的还原性
D.2PbCO3?Pb(OH)2中铅的质量分数低于PbCO3?Pb(OH)2中铅的质量分数
2.是合成平喘药沙丁胺醇的中间体,可由如图路线合成。下列叙述正确的是( )
A.Y分子中所有原子不可能在同一平面上
B.Z的分子式为C12H12O5
C.X是乙醇的同系物
D.X的一氯代物只有2种
3.下列反应方程式能解释相应实验现象的是( )
选项
实验现象
反应方程式
A
向含KIO3的食盐中加入稀硫酸,用玻璃棒蘸取上述溶液点在淀粉一KI试纸上,试纸变蓝
IO3﹣+5I﹣+6H+═3I2+3H2O
B
酸性KMnO4溶液与H2O2混合产生大量气体
2H2O22H2O+O2↑
C
碳酸钠溶液表面收集的乙酸乙酯层振荡后变薄并有气泡产生
2H++CO32﹣═CO2↑+H2O
D
加热时,将SO2通入装有CuO的试管中,黑色固体变为红色,将红色固体溶于水,溶液呈蓝色,并仍有少量不溶物
SO2+CuOCu+SO3
A.A
B.B
C.C
D.D
4.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.常温下,pH=5的盐酸中,水电离出的H+数目为10﹣9NA
B.5.2g苯乙烯()中含碳碳双键的数目为0.2NA
C.4.6g
Na与足量O2反应生成Na2O和Na2O2,反应中转移的电子数为0.2NA
D.由100mL
0.1mol?L﹣1NH3?H2O吸收足量SO2得到的NH4HSO3溶液中,NH4+的数目为0.01NA
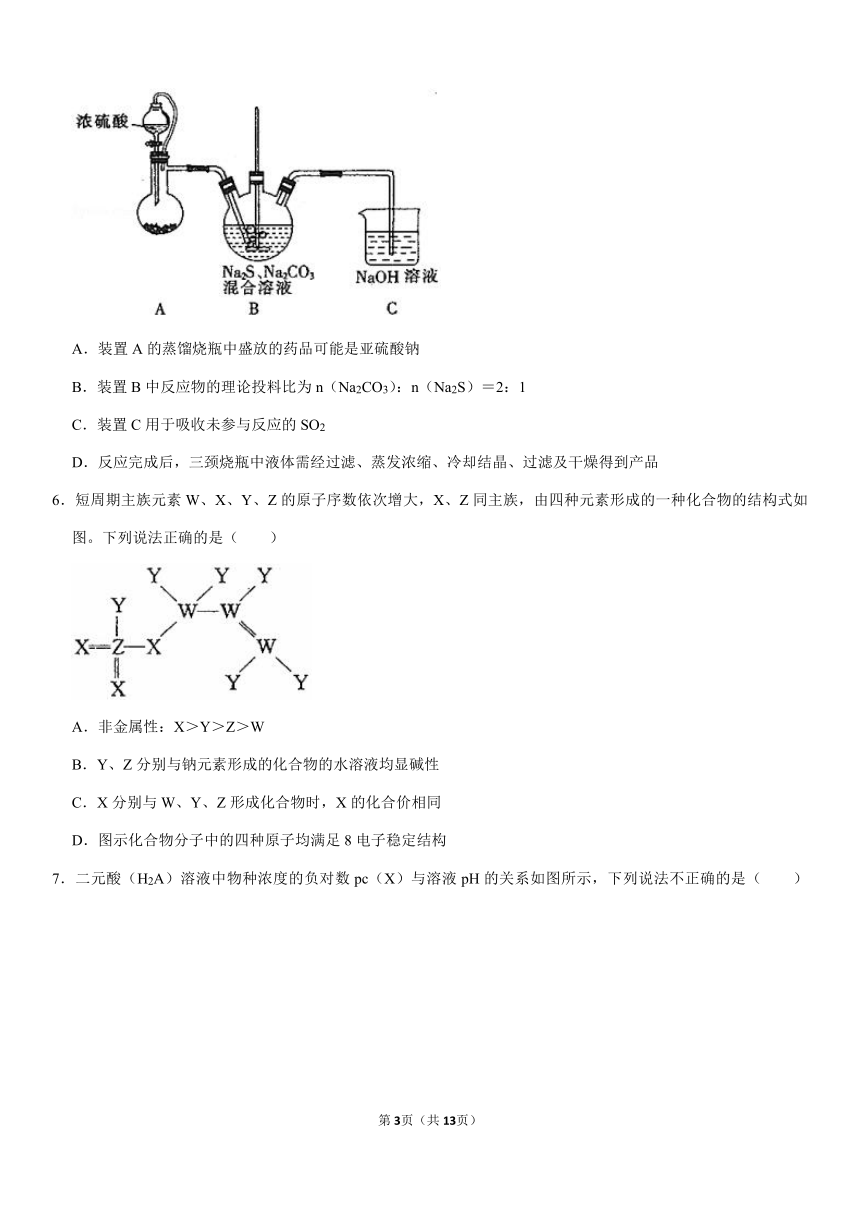
5.实验室可用下列装置(夹持装置已略,无加热装置)制备少量Na2S2O3?5H2O。已知Na2SO3在溶液中易结块。下列说法不正确的是( )
A.装置A的蒸馏烧瓶中盛放的药品可能是亚硫酸钠
B.装置B中反应物的理论投料比为n(Na2CO3):n(Na2S)=2:1
C.装置C用于吸收未参与反应的SO2
D.反应完成后,三颈烧瓶中液体需经过滤、蒸发浓缩、冷却结晶、过滤及干燥得到产品
6.短周期主族元素W、X、Y、Z的原子序数依次增大,X、Z同主族,由四种元素形成的一种化合物的结构式如图。下列说法正确的是( )
A.非金属性:X>Y>Z>W
B.Y、Z分别与钠元素形成的化合物的水溶液均显碱性
C.X分别与W、Y、Z形成化合物时,X的化合价相同
D.图示化合物分子中的四种原子均满足8电子稳定结构
7.二元酸(H2A)溶液中物种浓度的负对数pc(X)与溶液pH的关系如图所示,下列说法不正确的是( )
A.图中均是常温时的数据
B.pKa1(H2A)=6.3,pKa2(H2A)=10.3
C.溶液中可能存在:c(H+)=2c(A2﹣)+c(HA﹣)+c(OH﹣)
D.pH=8的溶液中:c(A2﹣)>c(H2A)>c(HA﹣)
二、非选择题:包括必考题和选考题两部分。(一)必考题
8.PFASS(聚合硫酸铁铝硅)是一种高效混凝剂,由PSA(聚硅酸)与PFAS(聚合硫酸铁铝)按一定比例混合聚合得到,以硫铁矿烧渣(含Fe2O3、FeO、SiO2及Al2O3)和水玻璃为原料制取PFASS的工艺流程如图。
已知:①碱化度B=。
②mCaO?nAl2O3难溶于水。
回答下列问题:
(1)“酸溶”时为提高铁、铝的浸出率可采取的措施是
、
。(任写2点)
(2)“过滤”所得滤渣为
。(填化学式)
(3)“氧化”时发生反应的离子方程式为
。
(4)“检测”氧化后溶液中Fe3+、Al3+的浓度,目的是
。
(5)“调节碱化度”时,mCaO?nAl2O3与溶液中H+反应的离子方程式为
。若溶液的碱化度过大,PFASS的产率
(填“增大”、“减小”或“不变”),原因是
。
(6)PFASS的组成可表示为[FeaAlb(OH)c(SO4)d?nSiO2]m,a、b、c、d应满足的关系是
。
9.苯乙酮()广泛用于皂用香精和烟草香精中,可由苯和乙酸酐制备。
已知:
名称
熔点/℃
沸点/℃
密度/(g?mL﹣1)
溶解性
苯
5.5
80.1
0.88
不溶于水,易溶于有机溶剂
苯乙酮
19.6
203
1.03
微溶于水,易溶于有机溶剂
乙酸酐
﹣73
139
1.08
有吸湿性,易溶于有机溶剂
乙酸
16.6
118
1.05
易溶于水,易溶于有机溶剂
步骤Ⅰ:向三颈烧瓶中加入39g苯和44.5g无水氯化铝,在搅拌下滴加25.5g乙酸酐(C4H6O3),在70~80℃下加热45min,发生反应:+(CH3CO)2O+CH3COOH。
步骤Ⅱ:冷却后将反应物倒入100g冰水中,有白色胶状沉淀生成,采用合适的方法处理,水层用苯萃取,合并苯层溶液,再依次用30mL
5%
NaOH溶液和30mL水洗涤,分离出的苯层用无水硫酸镁干燥。
步骤Ⅲ:常压蒸馏回收苯,再收集产品苯乙酮。
请回答下列问题:
(1)AlCl3在反应中作
,步骤Ⅰ中的加热方式为
。
(2)根据上述实验药品的用量,三颈烧瓶的最适宜规格为
。(填标号)
A.100mL
B.250mL
C.500mL
D.1000mL
(3)图示实验装置虚线框内缺少一种仪器,该仪器名称为
。
(4)步骤Ⅱ中生成的白色胶状沉淀的化学式为
,该物质易堵塞滤纸,处理白色胶状沉淀的方法为
。
(5)步骤Ⅱ中用NaOH溶液洗涤的目的是
。
(6)步骤Ⅲ中收集苯乙酮的温度应为
。
(7)实验中收集到24.0mL苯乙酮,则苯乙酮的产率为
。
10.H2是一种清洁能源也是一种重要的化工原料,工业上常利用CO和H2合成可再生能源甲醇。
(1)已知CO(g)、CH3OH(l)的燃烧热(△H)分别为﹣283.0kJ?mol﹣1和﹣726.5kJ?mol﹣1。则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为
。
(2)利用反应CO2(g)+H2(g)?CO(g)+H2O(g)△H,可获得化工原料CO,CO2的平衡转化率与温度的关系如图1。
①△H
(填“>”、“<”或“=”)0。
②240℃时,将3mol
CO2和2mol
H2通入容积为8L的恒容密闭容器中,达到平衡时CO2的转化率为50%。此时该反应的平衡常数K=
。
③该反应在一恒容密闭容器中进行,反应过程如图2,t1时达到平衡,t2时仅改变一个条件,该条件是
。
(3)300℃时,向一体积为10L的恒容密闭容器中充入1.32mol
CH3OH和1.2mol
H2O,发生反应:CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H1=+49kJ?mol﹣1。
①高温下,CH3OH(g)+H2O(g)?CO2(g)+3H2(g)能自发进行的原因是
。
②反应经5min达到平衡,测得H2的物质的量为2.97mol。0~5min内,H2的反应速率为
。
③CH3OH(g)与H2O(g)反应相对于电解水制备H2的优点为
。
11.钒具有广泛用途,钒以+2、+3、+4、+5价的化合物存在,钒的熔点为1890℃。以富钒炉渣(主要含FeO、V2O3)为原料制取粗钒的工艺流程如图。
回答下列问题:
(1)“焙烧”的目的是将FeO、V2O3转化为Fe2O3和可溶性的NaVO3。V2O3中V的化合价为
。已知每生成1mol
Fe2O3,同时生成2mol
NaVO3,此时至少消耗空气
L。(折算成标准状况,氧气体积占空气体积的)
(2)加入Na2CO3“焙烧”时,生成气体M的化学方程式为
。
(3)已知,25℃时,Ksp(NH4VO3)=4×10﹣2,Kb(NH3?H2O)=1.8×10﹣5。“调pH与沉钒”后溶液中VO3﹣的浓度为mol?L﹣1,则“滤液”的pH为
。
(4)铝高温时与V2O5反应的化学方程式为
。
(5)“高温还原”时加入CaO的目的是生成Ca(AlO2)2和
(填化学式),从而随炉渣除去。
(6)工业上通过电解精炼“粗钒”可得到99.5%的纯钒,以熔融LiCl﹣KCl﹣VCl2为电解质溶液。则电源的负板应连
(填“粗钒”或“纯钒”),阴极的电极反应式为
。
2020-2021学年安徽省阜阳市高三(上)期末化学试卷
试题解析
一、选择题(共7小题,每小题6分,满分42分)
1.解:A.铅白长时间放置于空气转变为PbS,Pb化合价不变,不是氧化还原反应,是铅白[2PbCO3?Pb(OH)2]与空气中的少量硫化物反应生成了PbS,故A错误;
B.铅白从组成上看,属于碱式碳酸盐,PbCO3、Pb(OH)2均溶于酸,故B错误;
C.用双氧水清洗是利用双氧水的氧化性,但真正氧化的是硫元素,Pb元素化合价不变,未被氧化,故C错误;
D.2PbCO3?Pb(OH)2中铅的质量分数为×100%=80.1%,PbCO3?Pb(OH)2中铅的质量分数为×100%=81.5%,故D正确。
故选:D。
2.解:A.Y中连接羰基和氯原子的碳原子都采用sp3杂化,都具有甲烷结构特点,甲烷呈正四面体结构,则该分子中所有原子不可能共平面,故A正确;
B.该分子中含有13个C原子、14个H原子、5个O原子,则Z的分子式为C13H14O5,故B错误;
C.X中含有酚羟基和羰基、乙醇中含有醇羟基,二者结构不相似,且分子组成上也不是相差n个﹣CH2原子团,所以二者不是同系物,故C错误;
D.X中除了酚羟基外还含有3种氢原子,所以其一氯代物有3种,故D错误;
故选:A。
3.解:A.由现象可知发生氧化还原反应生成碘,则发生IO3﹣+5I﹣+6H+═3I2+3H2O,故A正确;
B.高锰酸钾可氧化过氧化氢,过氧化氢中O元素的化合价升高,可知有氧气生成,则产生大量气体,故B错误;
C.醋酸与碳酸钠反应生成气体,离子反应为2CH3COOH+CO32﹣═2CH3COO﹣+CO2↑+H2O,故C错误;
D.由现象可知发生SO2+3CuOCuSO4+Cu2O,红色固体不可能为Cu,Cu不溶于水,故D错误;
故选:A。
4.解:A.溶液体积未知,无法计算水电离产生氢离子,故A错误;
B.5.2g苯乙烯()中含碳碳双键的数目为×1×NAmol﹣1=0.05NA,故B错误;
C.钠与氧气反应无论生成氧化钠还是过氧化钠都变为+1价,所以4.6g
Na物质的量为=0.2mol与足量O2反应生成Na2O和Na2O2,反应生成0.2mol钠离子,反应中转移的电子数为0.2NA,故C正确;
D.由100mL
0.1mol?L﹣1NH3?H2O吸收足量SO2得到亚硫酸氢铵物质的量为:0.1L×0.1mol/L=0.01mol,铵根离子为弱碱阳离子,水溶液中部分水解,所以NH4+的数目小于0.01NA,故D错误。
故选:C。
5.解:A.上述分析可知装置A的蒸馏烧瓶中盛放的药品可能是亚硫酸钠,故A正确;
B.装置B中发生的反应为二氧化硫与Na2S、Na2CO3溶液发生反应生成Na2S2O3,CO守恒和电子守恒配平书写反应的化学方程式:4SO2+2Na2S+Na2CO3=CO2+3Na2S2O3,理论投料比为n(Na2CO3):n(Na2S)=1:2,故B错误;
C.装置C用于吸收未参与反应的SO2,防止污染空气,故C正确;
D.二氧化硫和硫化钠发生副反应生成单质硫,另外此时也可能发生副反应生成亚硫酸钠,亚硫酸钠易吸收水结块,故先过滤,再对滤液进行蒸发浓缩、冷却结晶、过滤洗涤、干燥等操作得到产品Na2S2O3?5H2O,故D正确;
故选:B。
6.解:由上述分析可知,W为C、X为O、Y为F、Z为S,
A.同周期从左向右非金属性增强,同主族从上到下非金属性减弱,则非金属性:Y>X>Z>W,故A错误;
B.Y、Z分别与钠元素形成的化合物均为强碱弱酸盐,水溶液均水解显碱性,故B正确;
C.X分别与W、Z形成化合物只X显负价,X与Y形成化合物时X显正价,故C错误;
D.由结构可知,Z不满足8电子稳定结构,故D错误;
故选:B。
7.解:A.由图可知,pH在0~14范围内变化,且pH+pOH=14,则图中均是常温时的数据,故A正确;
B.pH=6.3时pc(H2A)=pc(HA﹣),Ka1(H2A)==c(H+),则pKa1(H2A)=6.3,pH=10.3时pc(HA﹣)=pc(A2﹣),Ka2(H2A)==c(H+),则pKa2(H2A)=10.3,故B正确;
C.只有在H2A溶液中存在c(H+)=2c(A2﹣)+c(HA﹣)+c(OH﹣),故C正确;
D.pH=8的溶液,由图可知负对数pc(X)为pc(HA﹣)<pc(H2A)<pc(A2﹣),则溶液中存在c(A2﹣)<c(H2A)<c(HA﹣),故D错误;
故选:D。
二、非选择题:包括必考题和选考题两部分。(一)必考题
8.解:(1)“酸溶”时为提高铁、铝的浸出率可采取的措施是升高温度、适当增大硫酸浓度等,
故答案为:升高温度;适当增大硫酸浓度;
(2)由分析可知,SiO2不与硫酸反应过滤成为滤渣,
故答案为:SiO2;
(3)滤液中存在Fe2+,加入NaClO3氧化Fe2+,反应的离子方程式为6Fe2++ClO3﹣+6H+=6Fe3++Cl﹣+3H2O,
故答案为:6Fe2++ClO3﹣+6H+=6Fe3++Cl﹣+3H2O;
(4)检测氧化后溶液中Fe3+、Al3+的浓度,能调整溶液的碱化度,以便更好的合成PFAS,
故答案为:更好的合成PFAS;
(5)mCaO?nAl2O3与溶液中H+发生复分解反应,元素价态不变,由元素守恒和电荷守恒可得离子方程式为mCaO?nAl2O3+2(m+3n)H+=mCa2++2nAl3++(m+3n)H2O,若溶液碱性过强,会导致Fe3+变为Fe(OH)3,Al(OH)3变为AlO2﹣,致使PFASS的产率减小,
故答案为:mCaO?nAl2O3+2(m+3n)H+=mCa2++2nAl3++(m+3n)H2O;减小;溶液碱化度过大,会导致Fe3+变为Fe(OH)3,Al(OH)3变为AlO2﹣,致使PFASS的产率减小;
(6)PFASS的组成可表示为[FeaAlb(OH)c(SO4)d?nSiO2]m,化合物不显电性,正负化合价代数和为0,故满足3a+3b=c+2d,
故答案为:3a+3b=c+2d。
9.解:(1)由反应原理:+(CH3CO)2O+CH3COOH,可知氯化铝是反应发生条件,反应前后均存在,故AlCl3在反应中作催化剂;反应控制温度70~80℃,未便于控制温度且未超过100℃,加热方式采取70~80℃水浴加热,
故答案为:催化剂;70~80℃水浴加热;
(2)39g苯的体积约是:≈44.3mL,25.5g乙酸酐的体积约是:≈23.6mL,氯化铝的体积可以忽略,液体总体积约是44.3mL+23.6mL=67.9mL,反应液总体积不超过总容积的,即三颈烧瓶的容积大于≈102mL,故选250mL的三颈烧瓶,
故答案为:B;
(3)苯的沸点为80.1℃,反应控制温度70~80℃,这样苯易挥发,不利于产品的制取,需要冷凝回流装置,即缺少一种仪器为冷凝管,
故答案为:冷凝管;
(4)产物易溶于有机物溶剂,而氯化铝易水解,故冷却后将反应物倒入100g冰水中,产生的白色胶状沉淀是氢氧化铝,氢氧化铝能与酸反应,处理白色胶状沉淀的方法为:加入盐酸,使其溶解,
故答案为:Al(OH)3;加入盐酸,使其溶解;
(5)产物中的乙酸易溶于有机溶剂,苯层溶液含有乙酸,苯层溶液用30mL
5%
NaOH溶液洗涤,主要是除去产品中的乙酸,
故答案为:除去产品中的乙酸;
(6)苯的沸点是80.1℃,而苯乙酮的沸点是203℃,常压蒸馏回收苯,从而获得苯乙酮,需要控制温度80.1℃~203℃,
故答案为:80.1℃~203℃;
(7)39g苯的物质的量为=0.5mol,乙酸酐的物质的量为=0.25mol,由方程式可知苯与乙酸酐按物质的量1:1反应,故苯过量,所以苯乙酮的理论产量为:0.25mol×120g/mol=30g,苯乙酮的实际产量为:24mL×1.03g/mL=24.72g,故苯乙酮的产率为:×100%=82.4%,
故答案为:82.4%。
10.解:(1)CO(g)、CH3OH(l)的燃烧热(△H)分别为﹣283.0kJ?mol﹣1和﹣726.5kJ?mol﹣1,可知①CO(g)+O2(g)=CO2(g)△H=﹣283.0kJ?mol﹣1,②CH3OH(l)+O2(g)=CO2(g)+2H2O(l)△H=﹣726.5kJ?mol﹣1,根据盖斯定律②﹣①得CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=(﹣726.5+283)kJ?mol﹣1=﹣443.5kJ?mol﹣1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣443.5kJ?mol﹣1;
(2)①由图可知,CO2的平衡转化率随着温度升高而增大,说明升高温度,平衡正向移动,则该反应为吸热反应,△H>0,
故答案为:>;
②240℃时,将3mol
CO2和2mol
H2通入容积为8L的恒容密闭容器中,达到平衡时CO2的转化率为50%,
CO2(g)+H2(g)?CO(g)+H2O(g)
起始(mol)
3
2
0
0
转化(mol)
3×50%
1.5
1.5
1.5
平衡(mol)
1.5
0.5
1.5
1.5
K===3,
故答案为:3;
③由图可知,t2时改变条件后,CO2和CO浓度瞬间没有改变,之后CO2的浓度增大,CO浓度减小,说明平衡逆向移动,该反应是吸热反应,则改变的条件有可能是降低温度或分离出氢气或增加水蒸气的浓度,
故答案为;降低温度或分离出氢气或增加水蒸气的浓度;
(3)①该反应△H>0,由于该反应是气体分子数增多的反应,则体系混乱度增大,即该反应是熵增反应,△S>0,所以高温下△H﹣T△S<0,反应自发进行,
故答案为:该反应是熵增反应;
②反应经5min达到平衡,测得H2的物质的量为2.97mol,△n(H2)=2.97mol,v(H2)=0.0594mol/(L?min),
故答案为:0.0594mol/(L?min);
③该反应在一定温度下能自发进行,相对于电解水制备H2消耗大量的电能,该反应耗能更少,
故答案为:前者耗能更少。
11.解:(1)V2O3中O元素为﹣2价,根据化合价代数和为0,可知V元素为+3价;在反应中,FeO、V2O3失电子被O2氧化为Fe2O3和NaVO3,根据得失电子守恒列式得2n(Fe2O3)+2n(NaVO3)=4n(O2),反应中生成1mol
Fe2O3和2mol
NaVO3,代入数据计算得n(O2)=1.5
mol,标准状况下V(O2)=1.5
mol×22.4
L/mol=33.6
L,已知氧气体积占空气体积的,则消耗空气体积=5V(O2)=5×33.6L=168L,
故答案为:+3;168;
(2)加入Na2CO3“焙烧”时,由元素守恒知生成气体为CO2,则发生反应的化学方程式为V2O5+Na2CO32NaVO3+CO2↑,
故答案为:V2O5+Na2CO32NaVO3+CO2↑;
(3)由题意知,Ksp(NH4VO3)=c(NH4+)×c(VO3﹣)=4×10﹣2,其中c(VO3﹣)=mol?L﹣1,则沉钒后溶液中c(NH4+)==mol/L=1.8mol/L,由NH4+的水解方程式NH4++H2O?NH3?H2O+H+,得水解平衡常数Kh===,此时c(NH3?H2O)近似等于c(H+),故==,解得c(H+)=10﹣4.5mol/L,此时溶液pH=﹣lgc(H+)=﹣lg10﹣4.5.=4.5,
故答案为:4.5;
(4)Al活泼性比V强,可从V2O5中置换出V,同时生成Al2O3,发生铝热反应,则发生反应的化学方程式为10Al+3V2O56V+5Al2O3,
故答案为:10Al+3V2O56V+5Al2O3;
(5)高温下CaO能与SiO2反应生成的CaSiO3,加入CaO的目的是为了除去生成的Al2O3和SiO2,所得炉渣为Ca(AlO2)2和CaSiO3,
故答案为:CaSiO3;
(6)电解精炼“粗钒”时粗钒作电解的阳极,连接电源的正极,纯钒作电解的阴极,连接电源的负极,发生还原反应析出V,对应电极反应为V2++2e﹣=V,
故答案为:纯钒;V2++2e﹣=V。
第1页(共1页)
一、选择题(共7小题,每小题6分,满分42分)
1.铅白[2PbCO3?Pb(OH)2]是油画中一种重要的白色颜料,但用铅白作画,日久易变黑(主要成分为PbS),这种现象在书画术语中叫作“返铅”。书画修复中有一种方法是用双氧水清洗使之恢复白色。下列有关叙述正确的是( )
A.铅白长时间放置于空气中会被氧气氧化
B.铅白耐强酸耐强碱
C.用双氧水清洗是利用双氧水的还原性
D.2PbCO3?Pb(OH)2中铅的质量分数低于PbCO3?Pb(OH)2中铅的质量分数
2.是合成平喘药沙丁胺醇的中间体,可由如图路线合成。下列叙述正确的是( )
A.Y分子中所有原子不可能在同一平面上
B.Z的分子式为C12H12O5
C.X是乙醇的同系物
D.X的一氯代物只有2种
3.下列反应方程式能解释相应实验现象的是( )
选项
实验现象
反应方程式
A
向含KIO3的食盐中加入稀硫酸,用玻璃棒蘸取上述溶液点在淀粉一KI试纸上,试纸变蓝
IO3﹣+5I﹣+6H+═3I2+3H2O
B
酸性KMnO4溶液与H2O2混合产生大量气体
2H2O22H2O+O2↑
C
碳酸钠溶液表面收集的乙酸乙酯层振荡后变薄并有气泡产生
2H++CO32﹣═CO2↑+H2O
D
加热时,将SO2通入装有CuO的试管中,黑色固体变为红色,将红色固体溶于水,溶液呈蓝色,并仍有少量不溶物
SO2+CuOCu+SO3
A.A
B.B
C.C
D.D
4.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.常温下,pH=5的盐酸中,水电离出的H+数目为10﹣9NA
B.5.2g苯乙烯()中含碳碳双键的数目为0.2NA
C.4.6g
Na与足量O2反应生成Na2O和Na2O2,反应中转移的电子数为0.2NA
D.由100mL
0.1mol?L﹣1NH3?H2O吸收足量SO2得到的NH4HSO3溶液中,NH4+的数目为0.01NA
5.实验室可用下列装置(夹持装置已略,无加热装置)制备少量Na2S2O3?5H2O。已知Na2SO3在溶液中易结块。下列说法不正确的是( )
A.装置A的蒸馏烧瓶中盛放的药品可能是亚硫酸钠
B.装置B中反应物的理论投料比为n(Na2CO3):n(Na2S)=2:1
C.装置C用于吸收未参与反应的SO2
D.反应完成后,三颈烧瓶中液体需经过滤、蒸发浓缩、冷却结晶、过滤及干燥得到产品
6.短周期主族元素W、X、Y、Z的原子序数依次增大,X、Z同主族,由四种元素形成的一种化合物的结构式如图。下列说法正确的是( )
A.非金属性:X>Y>Z>W
B.Y、Z分别与钠元素形成的化合物的水溶液均显碱性
C.X分别与W、Y、Z形成化合物时,X的化合价相同
D.图示化合物分子中的四种原子均满足8电子稳定结构
7.二元酸(H2A)溶液中物种浓度的负对数pc(X)与溶液pH的关系如图所示,下列说法不正确的是( )
A.图中均是常温时的数据
B.pKa1(H2A)=6.3,pKa2(H2A)=10.3
C.溶液中可能存在:c(H+)=2c(A2﹣)+c(HA﹣)+c(OH﹣)
D.pH=8的溶液中:c(A2﹣)>c(H2A)>c(HA﹣)
二、非选择题:包括必考题和选考题两部分。(一)必考题
8.PFASS(聚合硫酸铁铝硅)是一种高效混凝剂,由PSA(聚硅酸)与PFAS(聚合硫酸铁铝)按一定比例混合聚合得到,以硫铁矿烧渣(含Fe2O3、FeO、SiO2及Al2O3)和水玻璃为原料制取PFASS的工艺流程如图。
已知:①碱化度B=。
②mCaO?nAl2O3难溶于水。
回答下列问题:
(1)“酸溶”时为提高铁、铝的浸出率可采取的措施是
、
。(任写2点)
(2)“过滤”所得滤渣为
。(填化学式)
(3)“氧化”时发生反应的离子方程式为
。
(4)“检测”氧化后溶液中Fe3+、Al3+的浓度,目的是
。
(5)“调节碱化度”时,mCaO?nAl2O3与溶液中H+反应的离子方程式为
。若溶液的碱化度过大,PFASS的产率
(填“增大”、“减小”或“不变”),原因是
。
(6)PFASS的组成可表示为[FeaAlb(OH)c(SO4)d?nSiO2]m,a、b、c、d应满足的关系是
。
9.苯乙酮()广泛用于皂用香精和烟草香精中,可由苯和乙酸酐制备。
已知:
名称
熔点/℃
沸点/℃
密度/(g?mL﹣1)
溶解性
苯
5.5
80.1
0.88
不溶于水,易溶于有机溶剂
苯乙酮
19.6
203
1.03
微溶于水,易溶于有机溶剂
乙酸酐
﹣73
139
1.08
有吸湿性,易溶于有机溶剂
乙酸
16.6
118
1.05
易溶于水,易溶于有机溶剂
步骤Ⅰ:向三颈烧瓶中加入39g苯和44.5g无水氯化铝,在搅拌下滴加25.5g乙酸酐(C4H6O3),在70~80℃下加热45min,发生反应:+(CH3CO)2O+CH3COOH。
步骤Ⅱ:冷却后将反应物倒入100g冰水中,有白色胶状沉淀生成,采用合适的方法处理,水层用苯萃取,合并苯层溶液,再依次用30mL
5%
NaOH溶液和30mL水洗涤,分离出的苯层用无水硫酸镁干燥。
步骤Ⅲ:常压蒸馏回收苯,再收集产品苯乙酮。
请回答下列问题:
(1)AlCl3在反应中作
,步骤Ⅰ中的加热方式为
。
(2)根据上述实验药品的用量,三颈烧瓶的最适宜规格为
。(填标号)
A.100mL
B.250mL
C.500mL
D.1000mL
(3)图示实验装置虚线框内缺少一种仪器,该仪器名称为
。
(4)步骤Ⅱ中生成的白色胶状沉淀的化学式为
,该物质易堵塞滤纸,处理白色胶状沉淀的方法为
。
(5)步骤Ⅱ中用NaOH溶液洗涤的目的是
。
(6)步骤Ⅲ中收集苯乙酮的温度应为
。
(7)实验中收集到24.0mL苯乙酮,则苯乙酮的产率为
。
10.H2是一种清洁能源也是一种重要的化工原料,工业上常利用CO和H2合成可再生能源甲醇。
(1)已知CO(g)、CH3OH(l)的燃烧热(△H)分别为﹣283.0kJ?mol﹣1和﹣726.5kJ?mol﹣1。则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为
。
(2)利用反应CO2(g)+H2(g)?CO(g)+H2O(g)△H,可获得化工原料CO,CO2的平衡转化率与温度的关系如图1。
①△H
(填“>”、“<”或“=”)0。
②240℃时,将3mol
CO2和2mol
H2通入容积为8L的恒容密闭容器中,达到平衡时CO2的转化率为50%。此时该反应的平衡常数K=
。
③该反应在一恒容密闭容器中进行,反应过程如图2,t1时达到平衡,t2时仅改变一个条件,该条件是
。
(3)300℃时,向一体积为10L的恒容密闭容器中充入1.32mol
CH3OH和1.2mol
H2O,发生反应:CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H1=+49kJ?mol﹣1。
①高温下,CH3OH(g)+H2O(g)?CO2(g)+3H2(g)能自发进行的原因是
。
②反应经5min达到平衡,测得H2的物质的量为2.97mol。0~5min内,H2的反应速率为
。
③CH3OH(g)与H2O(g)反应相对于电解水制备H2的优点为
。
11.钒具有广泛用途,钒以+2、+3、+4、+5价的化合物存在,钒的熔点为1890℃。以富钒炉渣(主要含FeO、V2O3)为原料制取粗钒的工艺流程如图。
回答下列问题:
(1)“焙烧”的目的是将FeO、V2O3转化为Fe2O3和可溶性的NaVO3。V2O3中V的化合价为
。已知每生成1mol
Fe2O3,同时生成2mol
NaVO3,此时至少消耗空气
L。(折算成标准状况,氧气体积占空气体积的)
(2)加入Na2CO3“焙烧”时,生成气体M的化学方程式为
。
(3)已知,25℃时,Ksp(NH4VO3)=4×10﹣2,Kb(NH3?H2O)=1.8×10﹣5。“调pH与沉钒”后溶液中VO3﹣的浓度为mol?L﹣1,则“滤液”的pH为
。
(4)铝高温时与V2O5反应的化学方程式为
。
(5)“高温还原”时加入CaO的目的是生成Ca(AlO2)2和
(填化学式),从而随炉渣除去。
(6)工业上通过电解精炼“粗钒”可得到99.5%的纯钒,以熔融LiCl﹣KCl﹣VCl2为电解质溶液。则电源的负板应连
(填“粗钒”或“纯钒”),阴极的电极反应式为
。
2020-2021学年安徽省阜阳市高三(上)期末化学试卷
试题解析
一、选择题(共7小题,每小题6分,满分42分)
1.解:A.铅白长时间放置于空气转变为PbS,Pb化合价不变,不是氧化还原反应,是铅白[2PbCO3?Pb(OH)2]与空气中的少量硫化物反应生成了PbS,故A错误;
B.铅白从组成上看,属于碱式碳酸盐,PbCO3、Pb(OH)2均溶于酸,故B错误;
C.用双氧水清洗是利用双氧水的氧化性,但真正氧化的是硫元素,Pb元素化合价不变,未被氧化,故C错误;
D.2PbCO3?Pb(OH)2中铅的质量分数为×100%=80.1%,PbCO3?Pb(OH)2中铅的质量分数为×100%=81.5%,故D正确。
故选:D。
2.解:A.Y中连接羰基和氯原子的碳原子都采用sp3杂化,都具有甲烷结构特点,甲烷呈正四面体结构,则该分子中所有原子不可能共平面,故A正确;
B.该分子中含有13个C原子、14个H原子、5个O原子,则Z的分子式为C13H14O5,故B错误;
C.X中含有酚羟基和羰基、乙醇中含有醇羟基,二者结构不相似,且分子组成上也不是相差n个﹣CH2原子团,所以二者不是同系物,故C错误;
D.X中除了酚羟基外还含有3种氢原子,所以其一氯代物有3种,故D错误;
故选:A。
3.解:A.由现象可知发生氧化还原反应生成碘,则发生IO3﹣+5I﹣+6H+═3I2+3H2O,故A正确;
B.高锰酸钾可氧化过氧化氢,过氧化氢中O元素的化合价升高,可知有氧气生成,则产生大量气体,故B错误;
C.醋酸与碳酸钠反应生成气体,离子反应为2CH3COOH+CO32﹣═2CH3COO﹣+CO2↑+H2O,故C错误;
D.由现象可知发生SO2+3CuOCuSO4+Cu2O,红色固体不可能为Cu,Cu不溶于水,故D错误;
故选:A。
4.解:A.溶液体积未知,无法计算水电离产生氢离子,故A错误;
B.5.2g苯乙烯()中含碳碳双键的数目为×1×NAmol﹣1=0.05NA,故B错误;
C.钠与氧气反应无论生成氧化钠还是过氧化钠都变为+1价,所以4.6g
Na物质的量为=0.2mol与足量O2反应生成Na2O和Na2O2,反应生成0.2mol钠离子,反应中转移的电子数为0.2NA,故C正确;
D.由100mL
0.1mol?L﹣1NH3?H2O吸收足量SO2得到亚硫酸氢铵物质的量为:0.1L×0.1mol/L=0.01mol,铵根离子为弱碱阳离子,水溶液中部分水解,所以NH4+的数目小于0.01NA,故D错误。
故选:C。
5.解:A.上述分析可知装置A的蒸馏烧瓶中盛放的药品可能是亚硫酸钠,故A正确;
B.装置B中发生的反应为二氧化硫与Na2S、Na2CO3溶液发生反应生成Na2S2O3,CO守恒和电子守恒配平书写反应的化学方程式:4SO2+2Na2S+Na2CO3=CO2+3Na2S2O3,理论投料比为n(Na2CO3):n(Na2S)=1:2,故B错误;
C.装置C用于吸收未参与反应的SO2,防止污染空气,故C正确;
D.二氧化硫和硫化钠发生副反应生成单质硫,另外此时也可能发生副反应生成亚硫酸钠,亚硫酸钠易吸收水结块,故先过滤,再对滤液进行蒸发浓缩、冷却结晶、过滤洗涤、干燥等操作得到产品Na2S2O3?5H2O,故D正确;
故选:B。
6.解:由上述分析可知,W为C、X为O、Y为F、Z为S,
A.同周期从左向右非金属性增强,同主族从上到下非金属性减弱,则非金属性:Y>X>Z>W,故A错误;
B.Y、Z分别与钠元素形成的化合物均为强碱弱酸盐,水溶液均水解显碱性,故B正确;
C.X分别与W、Z形成化合物只X显负价,X与Y形成化合物时X显正价,故C错误;
D.由结构可知,Z不满足8电子稳定结构,故D错误;
故选:B。
7.解:A.由图可知,pH在0~14范围内变化,且pH+pOH=14,则图中均是常温时的数据,故A正确;
B.pH=6.3时pc(H2A)=pc(HA﹣),Ka1(H2A)==c(H+),则pKa1(H2A)=6.3,pH=10.3时pc(HA﹣)=pc(A2﹣),Ka2(H2A)==c(H+),则pKa2(H2A)=10.3,故B正确;
C.只有在H2A溶液中存在c(H+)=2c(A2﹣)+c(HA﹣)+c(OH﹣),故C正确;
D.pH=8的溶液,由图可知负对数pc(X)为pc(HA﹣)<pc(H2A)<pc(A2﹣),则溶液中存在c(A2﹣)<c(H2A)<c(HA﹣),故D错误;
故选:D。
二、非选择题:包括必考题和选考题两部分。(一)必考题
8.解:(1)“酸溶”时为提高铁、铝的浸出率可采取的措施是升高温度、适当增大硫酸浓度等,
故答案为:升高温度;适当增大硫酸浓度;
(2)由分析可知,SiO2不与硫酸反应过滤成为滤渣,
故答案为:SiO2;
(3)滤液中存在Fe2+,加入NaClO3氧化Fe2+,反应的离子方程式为6Fe2++ClO3﹣+6H+=6Fe3++Cl﹣+3H2O,
故答案为:6Fe2++ClO3﹣+6H+=6Fe3++Cl﹣+3H2O;
(4)检测氧化后溶液中Fe3+、Al3+的浓度,能调整溶液的碱化度,以便更好的合成PFAS,
故答案为:更好的合成PFAS;
(5)mCaO?nAl2O3与溶液中H+发生复分解反应,元素价态不变,由元素守恒和电荷守恒可得离子方程式为mCaO?nAl2O3+2(m+3n)H+=mCa2++2nAl3++(m+3n)H2O,若溶液碱性过强,会导致Fe3+变为Fe(OH)3,Al(OH)3变为AlO2﹣,致使PFASS的产率减小,
故答案为:mCaO?nAl2O3+2(m+3n)H+=mCa2++2nAl3++(m+3n)H2O;减小;溶液碱化度过大,会导致Fe3+变为Fe(OH)3,Al(OH)3变为AlO2﹣,致使PFASS的产率减小;
(6)PFASS的组成可表示为[FeaAlb(OH)c(SO4)d?nSiO2]m,化合物不显电性,正负化合价代数和为0,故满足3a+3b=c+2d,
故答案为:3a+3b=c+2d。
9.解:(1)由反应原理:+(CH3CO)2O+CH3COOH,可知氯化铝是反应发生条件,反应前后均存在,故AlCl3在反应中作催化剂;反应控制温度70~80℃,未便于控制温度且未超过100℃,加热方式采取70~80℃水浴加热,
故答案为:催化剂;70~80℃水浴加热;
(2)39g苯的体积约是:≈44.3mL,25.5g乙酸酐的体积约是:≈23.6mL,氯化铝的体积可以忽略,液体总体积约是44.3mL+23.6mL=67.9mL,反应液总体积不超过总容积的,即三颈烧瓶的容积大于≈102mL,故选250mL的三颈烧瓶,
故答案为:B;
(3)苯的沸点为80.1℃,反应控制温度70~80℃,这样苯易挥发,不利于产品的制取,需要冷凝回流装置,即缺少一种仪器为冷凝管,
故答案为:冷凝管;
(4)产物易溶于有机物溶剂,而氯化铝易水解,故冷却后将反应物倒入100g冰水中,产生的白色胶状沉淀是氢氧化铝,氢氧化铝能与酸反应,处理白色胶状沉淀的方法为:加入盐酸,使其溶解,
故答案为:Al(OH)3;加入盐酸,使其溶解;
(5)产物中的乙酸易溶于有机溶剂,苯层溶液含有乙酸,苯层溶液用30mL
5%
NaOH溶液洗涤,主要是除去产品中的乙酸,
故答案为:除去产品中的乙酸;
(6)苯的沸点是80.1℃,而苯乙酮的沸点是203℃,常压蒸馏回收苯,从而获得苯乙酮,需要控制温度80.1℃~203℃,
故答案为:80.1℃~203℃;
(7)39g苯的物质的量为=0.5mol,乙酸酐的物质的量为=0.25mol,由方程式可知苯与乙酸酐按物质的量1:1反应,故苯过量,所以苯乙酮的理论产量为:0.25mol×120g/mol=30g,苯乙酮的实际产量为:24mL×1.03g/mL=24.72g,故苯乙酮的产率为:×100%=82.4%,
故答案为:82.4%。
10.解:(1)CO(g)、CH3OH(l)的燃烧热(△H)分别为﹣283.0kJ?mol﹣1和﹣726.5kJ?mol﹣1,可知①CO(g)+O2(g)=CO2(g)△H=﹣283.0kJ?mol﹣1,②CH3OH(l)+O2(g)=CO2(g)+2H2O(l)△H=﹣726.5kJ?mol﹣1,根据盖斯定律②﹣①得CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=(﹣726.5+283)kJ?mol﹣1=﹣443.5kJ?mol﹣1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣443.5kJ?mol﹣1;
(2)①由图可知,CO2的平衡转化率随着温度升高而增大,说明升高温度,平衡正向移动,则该反应为吸热反应,△H>0,
故答案为:>;
②240℃时,将3mol
CO2和2mol
H2通入容积为8L的恒容密闭容器中,达到平衡时CO2的转化率为50%,
CO2(g)+H2(g)?CO(g)+H2O(g)
起始(mol)
3
2
0
0
转化(mol)
3×50%
1.5
1.5
1.5
平衡(mol)
1.5
0.5
1.5
1.5
K===3,
故答案为:3;
③由图可知,t2时改变条件后,CO2和CO浓度瞬间没有改变,之后CO2的浓度增大,CO浓度减小,说明平衡逆向移动,该反应是吸热反应,则改变的条件有可能是降低温度或分离出氢气或增加水蒸气的浓度,
故答案为;降低温度或分离出氢气或增加水蒸气的浓度;
(3)①该反应△H>0,由于该反应是气体分子数增多的反应,则体系混乱度增大,即该反应是熵增反应,△S>0,所以高温下△H﹣T△S<0,反应自发进行,
故答案为:该反应是熵增反应;
②反应经5min达到平衡,测得H2的物质的量为2.97mol,△n(H2)=2.97mol,v(H2)=0.0594mol/(L?min),
故答案为:0.0594mol/(L?min);
③该反应在一定温度下能自发进行,相对于电解水制备H2消耗大量的电能,该反应耗能更少,
故答案为:前者耗能更少。
11.解:(1)V2O3中O元素为﹣2价,根据化合价代数和为0,可知V元素为+3价;在反应中,FeO、V2O3失电子被O2氧化为Fe2O3和NaVO3,根据得失电子守恒列式得2n(Fe2O3)+2n(NaVO3)=4n(O2),反应中生成1mol
Fe2O3和2mol
NaVO3,代入数据计算得n(O2)=1.5
mol,标准状况下V(O2)=1.5
mol×22.4
L/mol=33.6
L,已知氧气体积占空气体积的,则消耗空气体积=5V(O2)=5×33.6L=168L,
故答案为:+3;168;
(2)加入Na2CO3“焙烧”时,由元素守恒知生成气体为CO2,则发生反应的化学方程式为V2O5+Na2CO32NaVO3+CO2↑,
故答案为:V2O5+Na2CO32NaVO3+CO2↑;
(3)由题意知,Ksp(NH4VO3)=c(NH4+)×c(VO3﹣)=4×10﹣2,其中c(VO3﹣)=mol?L﹣1,则沉钒后溶液中c(NH4+)==mol/L=1.8mol/L,由NH4+的水解方程式NH4++H2O?NH3?H2O+H+,得水解平衡常数Kh===,此时c(NH3?H2O)近似等于c(H+),故==,解得c(H+)=10﹣4.5mol/L,此时溶液pH=﹣lgc(H+)=﹣lg10﹣4.5.=4.5,
故答案为:4.5;
(4)Al活泼性比V强,可从V2O5中置换出V,同时生成Al2O3,发生铝热反应,则发生反应的化学方程式为10Al+3V2O56V+5Al2O3,
故答案为:10Al+3V2O56V+5Al2O3;
(5)高温下CaO能与SiO2反应生成的CaSiO3,加入CaO的目的是为了除去生成的Al2O3和SiO2,所得炉渣为Ca(AlO2)2和CaSiO3,
故答案为:CaSiO3;
(6)电解精炼“粗钒”时粗钒作电解的阳极,连接电源的正极,纯钒作电解的阴极,连接电源的负极,发生还原反应析出V,对应电极反应为V2++2e﹣=V,
故答案为:纯钒;V2++2e﹣=V。
第1页(共1页)
同课章节目录
