1.1.1《元素周期表》PPT课件(新人教版-必修2)
文档属性
| 名称 | 1.1.1《元素周期表》PPT课件(新人教版-必修2) |  | |
| 格式 | zip | ||
| 文件大小 | 766.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-02 23:48:08 | ||
图片预览







文档简介
(共29张PPT)
新课标人教版课件系列
《高中化学》
必修2
1.1.2《元素周期表》
第一章 《物质结构 元素周期律》
第一节《元素周期表》 第1课时
学习目标
知识与能力
1、了解元素周期表的结构和元素在元素周期表中的位置。
2、通过探究元素的性质与原子结构,进一步理解元素周期表。
3、充分发挥学生的主动性,培养实践能力和归纳能力。
教学重点:
元素周期表的结构。
教学难点:
元素在周期表中的位置。
3、元素性质变化规律
课堂练习一
一、元素周期表
1、编排原则
2、元素周期表的结构
知识回顾:原子的组成
*长沙市同升湖国际实验学校高中部理综组高一年级备课组 朱富生
4、位、构、性的关系
课堂练习二
我们不烦来看一看:
我们前辈是如何来认识原子的
温故知新
1、公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即原子。
2、 19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
历史回顾
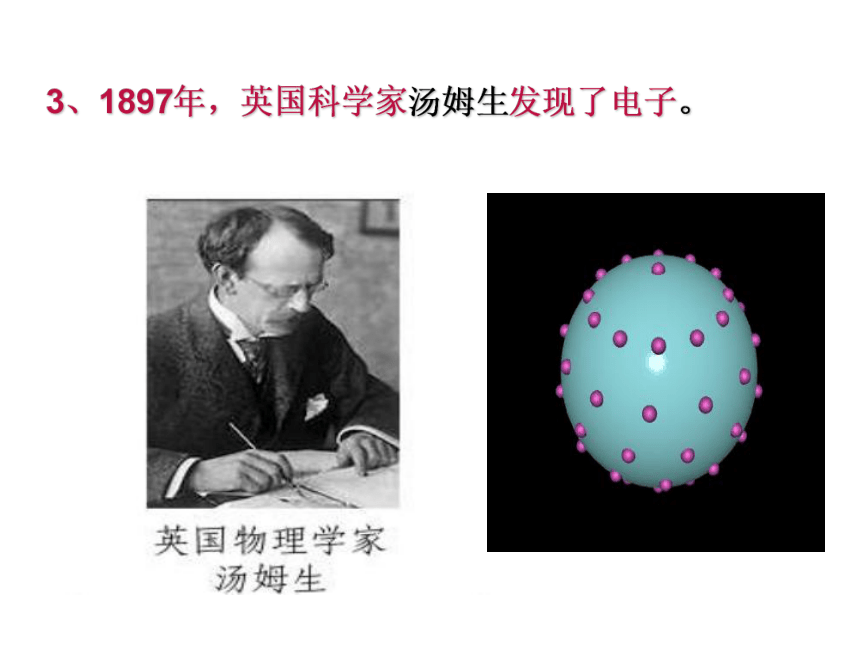
3、1897年,英国科学家汤姆生发现了电子。
人类探索自然的努力自古就有,并且也从没有停止。前辈为人类认识世界,进而改造世界,作出了突出的贡献,为我们留下的不只是物质财富,还有巨大的精神财富,在他们的精神感召下,我们难道不应加倍努力学习吗?
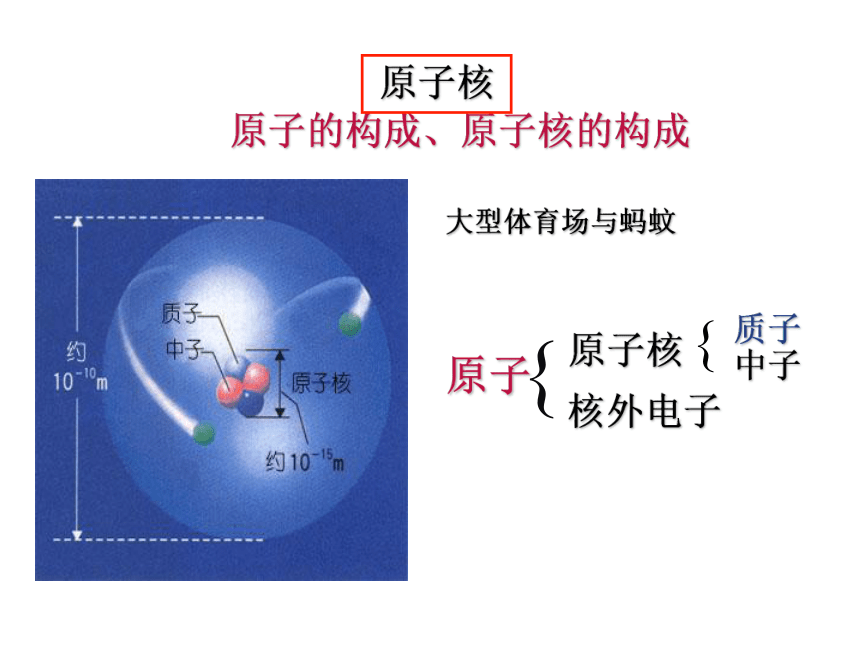
原子的构成、原子核的构成
原子
原子核
核外电子
质子
中子
{
{
大型体育场与蚂蚊
原子核
1个质子带一个单位正电荷
1个电子带一个单位负电荷
中子不带电
质子、中子、电子的电性和电量怎样?
构成原子的
粒子 电子 原子核
质子 中子
电性和电量
1个电子带一个单位负电荷
1个质子带一个单位正电荷
不显电性
质量/kg
9.109×10-31 1.673×10-27
1.675×10-27
相对质量① 1/1836
1.007
1.008
构成原子的粒子及其性质
X
A
Z
——元素符号
质量数 ——
核电荷数 ——
(核内质子数)
a
b
+
d
X
c+
-
-
a——代表质量数;
b——代表核电荷数;
c——代表离子的电荷数;
d——代表化合价
a b c d各代表什么
请看下列表示
Z 决定元素种类
原子组成的表示方法
思考与交流
核电荷数(Z)=核内质子数=核外电子数
质量数(A)= 质子数(Z)+ 中子数(N)
离子电荷数=原子核内质子数
与核外电子总数之差
请同学们辨析:核电荷数就是质子数和中子数之和及原子核内所有质子和中子的相对质量取近似整数值加起来所得的数值,叫质量数。
1. 氧原子的质量数为16,质子数为8,那么它的中子数是多少?
( 8 )
2. 钠原子的质量数为23,中子数为12,那么它的质子数是多少?核外电子数是多少?
( 11, 11 )
3. 硫的二价阴离子的核外电子数是18,中子数为17,那么它的质量数是多少?
( 33 )
解:因为 S2- 的核外电子数是18,即硫原子得到 2 个电子后,是18,那么硫原子的核外电子数是16,则16+17=33。
练习一
元素的性质取决于原子核外电子的排布——用原子结构示意图表示
练习:画1~18号元素的原子结构示意图
1869年,俄国化学家门捷列夫通过分类、归纳、制出了第一张元素周期表,揭示了化学元素的内在联系,使其构成了一个完整的体系(不但将当时已发现的63种列在表中,还留下了一些空格,预示这些元素的存在),成为化学发展史上的一个重要里程碑。
同电子层——同横行
同最外层电子——同纵行
1869年门捷列夫在继承和分析了前人工作的基础上,对大量实验事实进行了订正、分析和概括,成功地对元素进行了科学分类。他总结出一条规律:元素(以及由它所形成的单质和化合物)的性质随着相对原子质量的递增而呈现周期性的变化。这就是元素周期律。
他还预言了一些未知元素的性质都得到了证实。但是由于时代的局限,门捷列夫揭示的元素内在联系的规律还是初步的,他未能认识到形成元素性质周期性变化的根本原因。
周期表的编排原则
1、按照原子序数递增的顺序从左到右排列将电子层数相同的元素排成一个横行
2、把最外层电子数相同的元素(个别例外)
按电子层数递增的顺序从上到下排成纵行
一、元素周期表
周期表的结构
周
期
表
7个周期
7个主族:由短周期和长周期
元素共同构成的族(IA~VIIA)
7个副族:仅由长周期构成的族
(ⅠB~ⅦB)
VIII族(3个纵行):Fe、Co、Ni等9种元素
横的方面
(7个横行)
纵的方面
(18个纵行)
零族:稀有气体元素
1234567
2种元素
8种元素
8种元素
18种元素
18种元素
32种元素
26种元素
短周期
长周期
不完全周期
小 结
元素周期表的结构:
七主七副七周期,
熟记:
三个短周期,七个主族和
零族的元素符号和名称。
Ⅷ族零族镧锕系。
零族元素(稀有气体)的原子序数
小 结
七个周期分长短 三短三长一不全
十八纵行十六族 七主七副八和零
1、氦元素原子最外层有两个电子,为什么
不把它排在ⅡA族?
最外层填充两个电子已达饱和,性质与ⅡA
族的元素完全不同。
3、请描述出Na、C、Al、S在周期表中的位置。
2、哪周期元素种类最多?族呢?
思考与回答
1、请大家根据元素周期表,完成下表内容。
类别 周期序数 起止元素 包括元素种数 核外电子层数
短周期 1 H—He
2 Li—Ne
3 Na—Ar
长周期 4 K—Kr
5 Rb—Xe
6 Cs—Rn
不完全周期 7 Fr—112号
2
8
8
18
18
32
26
1
2
3
4
5
6
7
练习二
2、推算原子序数为6,13,34,53,88,82的
元素在周期表中的位置。
第6号元素: 6-2=4 第二周期第ⅣA 族。
第13号元素: 13-10=3 第三周期第ⅢA 族。
第34号元素: 34-18=16 第四周期第ⅥA 族。
第53号元素: 53-36=17 第五周期第ⅦA 族。
第88号元素: 88-86 =2 第七周期第ⅡA 族。
第82号元素: 82-54 =28
第六周期第ⅣA 族。
28-14=14
课堂练习
3、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)
2 3 4
11
19
2
10 11
18 19
6
11 12 13
24
6 7
14
31 32
D
课堂练习
4、在短周期元素中,原子最外电子层只有1个或2个电子的元素是 ( )
A.金属元素
B.稀有气体元素
C.非金属元素
D.无法确定为哪一类元素
D
课堂练习
5、第三周期第IVA族的元素原子序数是:
Na元素的原子序数为11,相邻的同族元素的原子序数是:
短周期元素中,族序数=周期序数的元素有:
族序数等于周期序数2倍的元素有:
周期序数=族序数2倍的有:
14
3、19
H、Be 、 Al
C S
Li、Ca
课堂练习
6、下列说法中正确的是( )
A.每一周期的元素都是从碱金属开始,最后以稀有气体结束
B.同一周期中(除第一周期外),从左到右,各元素原子核的电子数都是从1个逐渐增加到8个
C.第二、三周期上下相邻元素的原子核外电子数相差8个
D.第七周期只有23种元素
C
课堂练习
7、某元素X,它的原子最外层电子数是次外层电子数的2倍,则X在周期表中位于( )
A.第二周期 B.第三周期
C.ⅣA族 D.ⅥA族
A C
课堂练习
8、A、B、C是周期表中相邻的三种元素,其中A、B是同周期,B、C是同主族。此三种元素原子最外层电子数之和为17,质子数之和为31,则A、B、C分别为什么元素?
观察,可得A是氮元素
B是氧元素
C是硫元素
7N 8O
14P 16S
课堂练习
布置作业
1、熟记1~36号元素顺序和符号
2、熟记主族和零族元素名称和符号
3、P.11 2 做在作业本上。
新课标人教版课件系列
《高中化学》
必修2
1.1.2《元素周期表》
第一章 《物质结构 元素周期律》
第一节《元素周期表》 第1课时
学习目标
知识与能力
1、了解元素周期表的结构和元素在元素周期表中的位置。
2、通过探究元素的性质与原子结构,进一步理解元素周期表。
3、充分发挥学生的主动性,培养实践能力和归纳能力。
教学重点:
元素周期表的结构。
教学难点:
元素在周期表中的位置。
3、元素性质变化规律
课堂练习一
一、元素周期表
1、编排原则
2、元素周期表的结构
知识回顾:原子的组成
*长沙市同升湖国际实验学校高中部理综组高一年级备课组 朱富生
4、位、构、性的关系
课堂练习二
我们不烦来看一看:
我们前辈是如何来认识原子的
温故知新
1、公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即原子。
2、 19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
历史回顾
3、1897年,英国科学家汤姆生发现了电子。
人类探索自然的努力自古就有,并且也从没有停止。前辈为人类认识世界,进而改造世界,作出了突出的贡献,为我们留下的不只是物质财富,还有巨大的精神财富,在他们的精神感召下,我们难道不应加倍努力学习吗?
原子的构成、原子核的构成
原子
原子核
核外电子
质子
中子
{
{
大型体育场与蚂蚊
原子核
1个质子带一个单位正电荷
1个电子带一个单位负电荷
中子不带电
质子、中子、电子的电性和电量怎样?
构成原子的
粒子 电子 原子核
质子 中子
电性和电量
1个电子带一个单位负电荷
1个质子带一个单位正电荷
不显电性
质量/kg
9.109×10-31 1.673×10-27
1.675×10-27
相对质量① 1/1836
1.007
1.008
构成原子的粒子及其性质
X
A
Z
——元素符号
质量数 ——
核电荷数 ——
(核内质子数)
a
b
+
d
X
c+
-
-
a——代表质量数;
b——代表核电荷数;
c——代表离子的电荷数;
d——代表化合价
a b c d各代表什么
请看下列表示
Z 决定元素种类
原子组成的表示方法
思考与交流
核电荷数(Z)=核内质子数=核外电子数
质量数(A)= 质子数(Z)+ 中子数(N)
离子电荷数=原子核内质子数
与核外电子总数之差
请同学们辨析:核电荷数就是质子数和中子数之和及原子核内所有质子和中子的相对质量取近似整数值加起来所得的数值,叫质量数。
1. 氧原子的质量数为16,质子数为8,那么它的中子数是多少?
( 8 )
2. 钠原子的质量数为23,中子数为12,那么它的质子数是多少?核外电子数是多少?
( 11, 11 )
3. 硫的二价阴离子的核外电子数是18,中子数为17,那么它的质量数是多少?
( 33 )
解:因为 S2- 的核外电子数是18,即硫原子得到 2 个电子后,是18,那么硫原子的核外电子数是16,则16+17=33。
练习一
元素的性质取决于原子核外电子的排布——用原子结构示意图表示
练习:画1~18号元素的原子结构示意图
1869年,俄国化学家门捷列夫通过分类、归纳、制出了第一张元素周期表,揭示了化学元素的内在联系,使其构成了一个完整的体系(不但将当时已发现的63种列在表中,还留下了一些空格,预示这些元素的存在),成为化学发展史上的一个重要里程碑。
同电子层——同横行
同最外层电子——同纵行
1869年门捷列夫在继承和分析了前人工作的基础上,对大量实验事实进行了订正、分析和概括,成功地对元素进行了科学分类。他总结出一条规律:元素(以及由它所形成的单质和化合物)的性质随着相对原子质量的递增而呈现周期性的变化。这就是元素周期律。
他还预言了一些未知元素的性质都得到了证实。但是由于时代的局限,门捷列夫揭示的元素内在联系的规律还是初步的,他未能认识到形成元素性质周期性变化的根本原因。
周期表的编排原则
1、按照原子序数递增的顺序从左到右排列将电子层数相同的元素排成一个横行
2、把最外层电子数相同的元素(个别例外)
按电子层数递增的顺序从上到下排成纵行
一、元素周期表
周期表的结构
周
期
表
7个周期
7个主族:由短周期和长周期
元素共同构成的族(IA~VIIA)
7个副族:仅由长周期构成的族
(ⅠB~ⅦB)
VIII族(3个纵行):Fe、Co、Ni等9种元素
横的方面
(7个横行)
纵的方面
(18个纵行)
零族:稀有气体元素
1234567
2种元素
8种元素
8种元素
18种元素
18种元素
32种元素
26种元素
短周期
长周期
不完全周期
小 结
元素周期表的结构:
七主七副七周期,
熟记:
三个短周期,七个主族和
零族的元素符号和名称。
Ⅷ族零族镧锕系。
零族元素(稀有气体)的原子序数
小 结
七个周期分长短 三短三长一不全
十八纵行十六族 七主七副八和零
1、氦元素原子最外层有两个电子,为什么
不把它排在ⅡA族?
最外层填充两个电子已达饱和,性质与ⅡA
族的元素完全不同。
3、请描述出Na、C、Al、S在周期表中的位置。
2、哪周期元素种类最多?族呢?
思考与回答
1、请大家根据元素周期表,完成下表内容。
类别 周期序数 起止元素 包括元素种数 核外电子层数
短周期 1 H—He
2 Li—Ne
3 Na—Ar
长周期 4 K—Kr
5 Rb—Xe
6 Cs—Rn
不完全周期 7 Fr—112号
2
8
8
18
18
32
26
1
2
3
4
5
6
7
练习二
2、推算原子序数为6,13,34,53,88,82的
元素在周期表中的位置。
第6号元素: 6-2=4 第二周期第ⅣA 族。
第13号元素: 13-10=3 第三周期第ⅢA 族。
第34号元素: 34-18=16 第四周期第ⅥA 族。
第53号元素: 53-36=17 第五周期第ⅦA 族。
第88号元素: 88-86 =2 第七周期第ⅡA 族。
第82号元素: 82-54 =28
第六周期第ⅣA 族。
28-14=14
课堂练习
3、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)
2 3 4
11
19
2
10 11
18 19
6
11 12 13
24
6 7
14
31 32
D
课堂练习
4、在短周期元素中,原子最外电子层只有1个或2个电子的元素是 ( )
A.金属元素
B.稀有气体元素
C.非金属元素
D.无法确定为哪一类元素
D
课堂练习
5、第三周期第IVA族的元素原子序数是:
Na元素的原子序数为11,相邻的同族元素的原子序数是:
短周期元素中,族序数=周期序数的元素有:
族序数等于周期序数2倍的元素有:
周期序数=族序数2倍的有:
14
3、19
H、Be 、 Al
C S
Li、Ca
课堂练习
6、下列说法中正确的是( )
A.每一周期的元素都是从碱金属开始,最后以稀有气体结束
B.同一周期中(除第一周期外),从左到右,各元素原子核的电子数都是从1个逐渐增加到8个
C.第二、三周期上下相邻元素的原子核外电子数相差8个
D.第七周期只有23种元素
C
课堂练习
7、某元素X,它的原子最外层电子数是次外层电子数的2倍,则X在周期表中位于( )
A.第二周期 B.第三周期
C.ⅣA族 D.ⅥA族
A C
课堂练习
8、A、B、C是周期表中相邻的三种元素,其中A、B是同周期,B、C是同主族。此三种元素原子最外层电子数之和为17,质子数之和为31,则A、B、C分别为什么元素?
观察,可得A是氮元素
B是氧元素
C是硫元素
7N 8O
14P 16S
课堂练习
布置作业
1、熟记1~36号元素顺序和符号
2、熟记主族和零族元素名称和符号
3、P.11 2 做在作业本上。
