高中化学人教版(2019)必修第一册4.3 化学键(教学课件)-(19张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册4.3 化学键(教学课件)-(19张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-15 07:46:33 | ||
图片预览





文档简介
第四章 物质结构 元素周期律
第三节 化学键
离子键
电子式
共价键
化学键
目 录
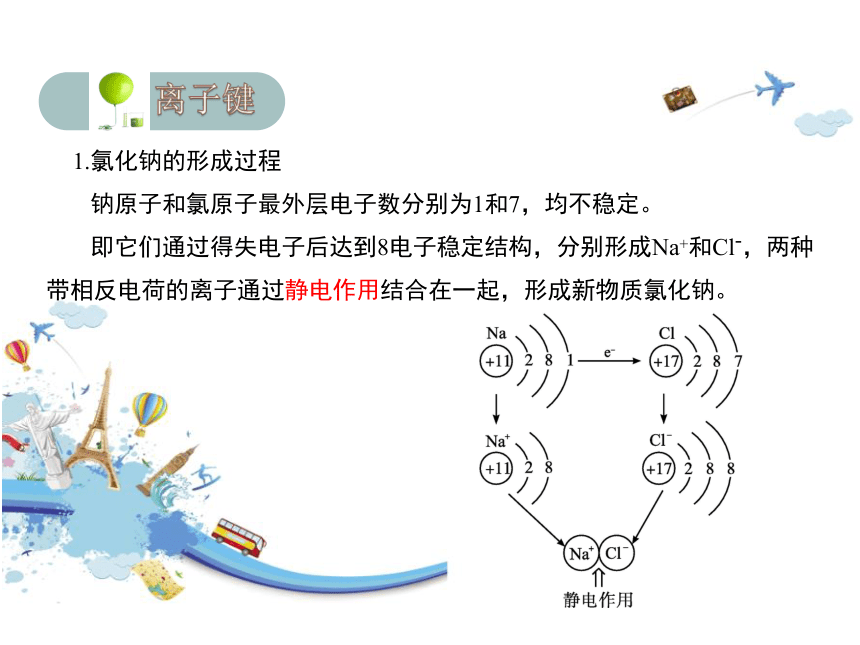
1.氯化钠的形成过程
钠原子和氯原子最外层电子数分别为1和7,均不稳定。
即它们通过得失电子后达到8电子稳定结构,分别形成Na+和Cl-,两种带相反电荷的离子通过静电作用结合在一起,形成新物质氯化钠。
2.离子键
(1)定义:带相反电荷离子之间的相互作用。
(2)成键三要素
①成键粒子:阳离子和阴离子。
②成键本质:静电作用(包括静电引力和静电斥力)。
③成键元素:一般是活泼金属元素与活泼非金属元素。
3.离子化合物
(1)定义:由离子键构成的化合物。
(2)常见类型 ①强碱:如NaOH、KOH等。
②绝大多数盐:如NaCl、K2SO4等。
③活泼金属氧化物:如K2O、Na2O、MgO等。
(3)性质 ①离子化合物中离子键一般比较牢固,破坏它需要很高
的能量,所以离子化合物的熔点一般较高,常温下为固体。
②离子化合物在溶于水或受热熔化时,离子键被破坏,形成自
由移动的阴、阳离子,能够导电。
(1)离子键存在的前提是必须有阴、阳离子。若没有阴、阳离子则没有离子键,若有离子键,则一定有阴、阳离子。
(2)并不是所有的金属与非金属化合都能形成离子键,一般活泼金属与活泼非金属化合能形成离子键,如AlCl3晶体中就没有离子键。
(3)只有非金属元素也可能形成离子键,如NH4Cl晶体中, 与Cl-间的相互作用就是离子键。
1.电子式
在元素符号周围用“·”或“×”来表示原子的最外层电子(价电子)的式子。
2.用电子式表示离子化合物的形成过程
1.共价键
(1)定义:原子间通过共用电子对所形成的相互作用。
(2)成键粒子:原子。
(3)成键元素:一般是同种或不同种的非金属元素。
(4)分类:
2.含有共价键分子的表示方法
(1)用电子式表示分子的形成过程
(2)常见分子的结构。
分子具有一定的空间结构,如CO2是直线形,H2O呈V形,CH4呈正四面体形等。通过现代实验手段(如X射线衍射法等)可以测定某些分子的结构。
(3)以共价键形成的分子及其结构
1.定义
分子内相邻的原子之间强烈的相互作用。
2.分类
3.化学反应的本质
一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。
第三节 化学键
离子键
电子式
共价键
化学键
目 录
1.氯化钠的形成过程
钠原子和氯原子最外层电子数分别为1和7,均不稳定。
即它们通过得失电子后达到8电子稳定结构,分别形成Na+和Cl-,两种带相反电荷的离子通过静电作用结合在一起,形成新物质氯化钠。
2.离子键
(1)定义:带相反电荷离子之间的相互作用。
(2)成键三要素
①成键粒子:阳离子和阴离子。
②成键本质:静电作用(包括静电引力和静电斥力)。
③成键元素:一般是活泼金属元素与活泼非金属元素。
3.离子化合物
(1)定义:由离子键构成的化合物。
(2)常见类型 ①强碱:如NaOH、KOH等。
②绝大多数盐:如NaCl、K2SO4等。
③活泼金属氧化物:如K2O、Na2O、MgO等。
(3)性质 ①离子化合物中离子键一般比较牢固,破坏它需要很高
的能量,所以离子化合物的熔点一般较高,常温下为固体。
②离子化合物在溶于水或受热熔化时,离子键被破坏,形成自
由移动的阴、阳离子,能够导电。
(1)离子键存在的前提是必须有阴、阳离子。若没有阴、阳离子则没有离子键,若有离子键,则一定有阴、阳离子。
(2)并不是所有的金属与非金属化合都能形成离子键,一般活泼金属与活泼非金属化合能形成离子键,如AlCl3晶体中就没有离子键。
(3)只有非金属元素也可能形成离子键,如NH4Cl晶体中, 与Cl-间的相互作用就是离子键。
1.电子式
在元素符号周围用“·”或“×”来表示原子的最外层电子(价电子)的式子。
2.用电子式表示离子化合物的形成过程
1.共价键
(1)定义:原子间通过共用电子对所形成的相互作用。
(2)成键粒子:原子。
(3)成键元素:一般是同种或不同种的非金属元素。
(4)分类:
2.含有共价键分子的表示方法
(1)用电子式表示分子的形成过程
(2)常见分子的结构。
分子具有一定的空间结构,如CO2是直线形,H2O呈V形,CH4呈正四面体形等。通过现代实验手段(如X射线衍射法等)可以测定某些分子的结构。
(3)以共价键形成的分子及其结构
1.定义
分子内相邻的原子之间强烈的相互作用。
2.分类
3.化学反应的本质
一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。
