高中化学人教版(2019)必修第一册3.2 金属材料(教学课件)-(19张PPT)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册3.2 金属材料(教学课件)-(19张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 5.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-16 15:31:20 | ||
图片预览






文档简介
第三章 铁 金属材料
第二节 金属材料
合金的定义、性质
铁合金
铝和铝合金
物质的量在化学方程式计算中的应用
目 录
1.定义:由两种或两种以上的 与 (或 )熔合而成的具有 的物质。
2.性质:合金具有许多优良的物理、化学或机械性能,在许多方面不同于各成分金属。
(1)硬度:合金的硬度一般 成分金属。
(2)熔点:合金的熔点多数 成分金属。
金属
金属
非金属
金属特性
大于
低于
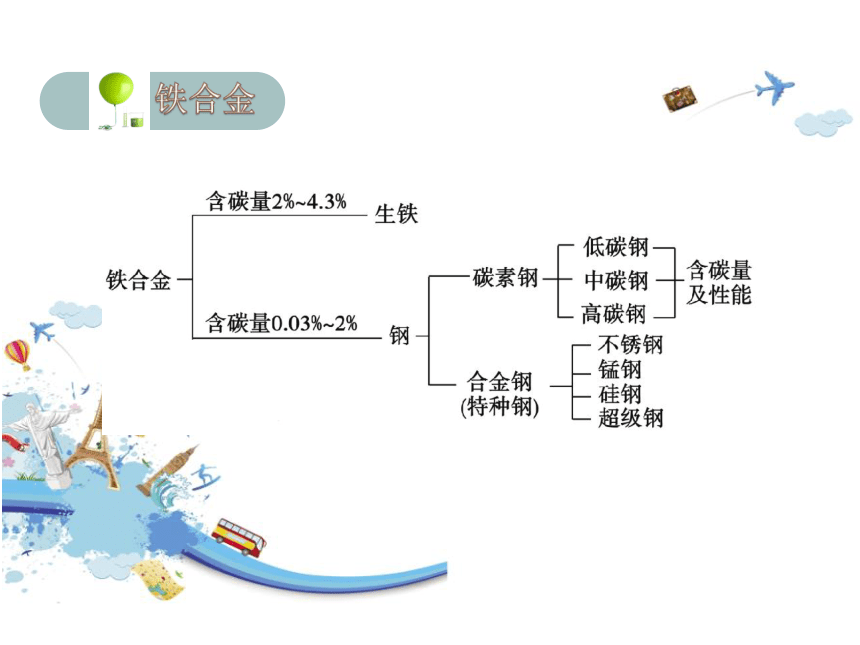
生铁硬度大、抗压,性脆、可以铸造成型,是制造机座、管道的重要材料。
低碳钢韧性、焊接性好,但强度低,用于制造钢板、钢丝和钢管等。
中碳钢强度高,韧性及加工性好,用于制造钢轨、车轮和建材。
高碳钢硬而脆,热处理后弹性好,用于制造器械、弹簧和刀具等。
不锈钢性质稳定,不易生锈,具有很强的抗腐蚀能力。多用于制造医
疗器材、厨房用具和餐具和地铁列车的车体等。
铝是地壳中含量最多的金属。铝性质活泼,铝和铝合金制品比较稳定的原因是表面覆盖着致密的 薄膜,保护内部金属。
氧化铝
铝的物理性质
颜色
状态
硬度
密度
熔点
沸点
金属性质
银白色,金属光泽
固体
较小
2.7g/cm3
660℃
2467℃
良好的导电性、导热性、延展性
氧化铝的物理性质
颜色
状态
硬度
溶解性
熔点
白色
固体
很大
难溶于水
2050℃
【实验3-4】在一支试管中加入5ml盐酸,再向试管中放入一小块铝片,观察并记录现象。过一段时间后,将点燃的木条放在试管口,观察现象。
实验现象:铝片溶解,试管中有气泡产生。点燃
的木条放在试管口时发出爆鸣声。
Al?O? + 6HCl = 2AlCl? + 3H?O
2Al +6HCl = 2AlCl?+ 3H?↑
【实验3-5】在两支试管中分别加入少量的NaOH溶液,然后向其中一支试管中放入一小块铝片,向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。观察现象。过一段时间后,将点燃的木条分别放在两支试管口,观察现象。
实验现象:
第一支试管中开始没有气泡,一段时间后才产生
气泡,铝片溶解,点燃的木条放在试管口时发出
爆鸣声。
第二支试管中立即产生气泡,铝片溶解,点燃的
木条放在试管口时发出爆鸣声。
Al?O? + 2NaOH = 2NaAlO?(偏铝酸钠)+ H?O
2Al + 2H?O + 2NaOH =2NaAlO?+ 3H?↑
总结:像Al2O3这类既能与酸反应生成盐和水,又能与碱反应
生成盐和水的氧化物,叫做两性氧化物。
常见的铝合金
(1)铝合金中,常会有的合金元素: Cu、Mg、Si、Mn、Zn及稀土元素等。
(2)硬铝中含有的合金元素: Cu、Mg、Mn、Si。
铝合金的性质及用途:铝合金具有密度小、强度高、塑性好、
易于成型、制造工艺简单、成本低廉等特点。主要用于建筑业、
容器制造、交通运输及电子行业。
根据化学方程式计算的基本步骤
以钠和水的反应为例
2Na + 2H2O==2NaOH + H2↑
化学计量数 2 2 2 1
扩大到原
来的NA倍 2×NA 2×NA 2×NA 1×NA
物质的量 2 mol 2 mol 2 mol 1 mol
结论:化学方程式中各物质的化学计量数之比=参加反应的物质的微粒个数之比 = 参加反应的物质的物质的量之比 = 参加反应的气体体积(相同状况)之比。
化学计算中常用的三种方法
(1)关系式法
当已知物和未知物之间是靠多个反应来联系时,只需直接
确定已知量和未知量之间的比例关系,即“关系式”。如把CO
还原Fe2O3生成的CO2通入澄清石灰水中,求生成沉淀的量,根
据化学方程式知3CO~3CO2~3CaCO3,即CO~CaCO3。
(2)守恒法
①质量守恒
宏观特征:反应前后元素的质量守恒。
微观守恒:反应前后各元素的原子个数守恒。
②得失电子守恒
氧化还原反应中,氧化剂得电子总数等于还原剂失电子总数。
③电荷守恒
ⅰ.电解质溶液中,阴离子所带负电荷总数等于阳离子所带正电荷总数。
ⅱ.离子方程式中,反应物所带电荷总数与生成物所带电荷总数相等且
电性相同。
(3)差量法
根据化学反应前后物质的有关物理量发生的变化,找出所谓“理论差量”,如反应前后的质量差、物质的量差、气体体积差等。该差量的大小与反应物的有关量成正比。差量法就是借助这种比例关系,解决一定量变的计算题。
例如,把一铁棒插入CuSO4溶液中,过一段时间取出,铁棒质量增加了4 g,据此可求出参加反应的Fe的质量。
Fe+CuSO4=FeSO4+Cu Δm(质量增加)
56 64 64-56=8
m(Fe) 4 g
第二节 金属材料
合金的定义、性质
铁合金
铝和铝合金
物质的量在化学方程式计算中的应用
目 录
1.定义:由两种或两种以上的 与 (或 )熔合而成的具有 的物质。
2.性质:合金具有许多优良的物理、化学或机械性能,在许多方面不同于各成分金属。
(1)硬度:合金的硬度一般 成分金属。
(2)熔点:合金的熔点多数 成分金属。
金属
金属
非金属
金属特性
大于
低于
生铁硬度大、抗压,性脆、可以铸造成型,是制造机座、管道的重要材料。
低碳钢韧性、焊接性好,但强度低,用于制造钢板、钢丝和钢管等。
中碳钢强度高,韧性及加工性好,用于制造钢轨、车轮和建材。
高碳钢硬而脆,热处理后弹性好,用于制造器械、弹簧和刀具等。
不锈钢性质稳定,不易生锈,具有很强的抗腐蚀能力。多用于制造医
疗器材、厨房用具和餐具和地铁列车的车体等。
铝是地壳中含量最多的金属。铝性质活泼,铝和铝合金制品比较稳定的原因是表面覆盖着致密的 薄膜,保护内部金属。
氧化铝
铝的物理性质
颜色
状态
硬度
密度
熔点
沸点
金属性质
银白色,金属光泽
固体
较小
2.7g/cm3
660℃
2467℃
良好的导电性、导热性、延展性
氧化铝的物理性质
颜色
状态
硬度
溶解性
熔点
白色
固体
很大
难溶于水
2050℃
【实验3-4】在一支试管中加入5ml盐酸,再向试管中放入一小块铝片,观察并记录现象。过一段时间后,将点燃的木条放在试管口,观察现象。
实验现象:铝片溶解,试管中有气泡产生。点燃
的木条放在试管口时发出爆鸣声。
Al?O? + 6HCl = 2AlCl? + 3H?O
2Al +6HCl = 2AlCl?+ 3H?↑
【实验3-5】在两支试管中分别加入少量的NaOH溶液,然后向其中一支试管中放入一小块铝片,向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。观察现象。过一段时间后,将点燃的木条分别放在两支试管口,观察现象。
实验现象:
第一支试管中开始没有气泡,一段时间后才产生
气泡,铝片溶解,点燃的木条放在试管口时发出
爆鸣声。
第二支试管中立即产生气泡,铝片溶解,点燃的
木条放在试管口时发出爆鸣声。
Al?O? + 2NaOH = 2NaAlO?(偏铝酸钠)+ H?O
2Al + 2H?O + 2NaOH =2NaAlO?+ 3H?↑
总结:像Al2O3这类既能与酸反应生成盐和水,又能与碱反应
生成盐和水的氧化物,叫做两性氧化物。
常见的铝合金
(1)铝合金中,常会有的合金元素: Cu、Mg、Si、Mn、Zn及稀土元素等。
(2)硬铝中含有的合金元素: Cu、Mg、Mn、Si。
铝合金的性质及用途:铝合金具有密度小、强度高、塑性好、
易于成型、制造工艺简单、成本低廉等特点。主要用于建筑业、
容器制造、交通运输及电子行业。
根据化学方程式计算的基本步骤
以钠和水的反应为例
2Na + 2H2O==2NaOH + H2↑
化学计量数 2 2 2 1
扩大到原
来的NA倍 2×NA 2×NA 2×NA 1×NA
物质的量 2 mol 2 mol 2 mol 1 mol
结论:化学方程式中各物质的化学计量数之比=参加反应的物质的微粒个数之比 = 参加反应的物质的物质的量之比 = 参加反应的气体体积(相同状况)之比。
化学计算中常用的三种方法
(1)关系式法
当已知物和未知物之间是靠多个反应来联系时,只需直接
确定已知量和未知量之间的比例关系,即“关系式”。如把CO
还原Fe2O3生成的CO2通入澄清石灰水中,求生成沉淀的量,根
据化学方程式知3CO~3CO2~3CaCO3,即CO~CaCO3。
(2)守恒法
①质量守恒
宏观特征:反应前后元素的质量守恒。
微观守恒:反应前后各元素的原子个数守恒。
②得失电子守恒
氧化还原反应中,氧化剂得电子总数等于还原剂失电子总数。
③电荷守恒
ⅰ.电解质溶液中,阴离子所带负电荷总数等于阳离子所带正电荷总数。
ⅱ.离子方程式中,反应物所带电荷总数与生成物所带电荷总数相等且
电性相同。
(3)差量法
根据化学反应前后物质的有关物理量发生的变化,找出所谓“理论差量”,如反应前后的质量差、物质的量差、气体体积差等。该差量的大小与反应物的有关量成正比。差量法就是借助这种比例关系,解决一定量变的计算题。
例如,把一铁棒插入CuSO4溶液中,过一段时间取出,铁棒质量增加了4 g,据此可求出参加反应的Fe的质量。
Fe+CuSO4=FeSO4+Cu Δm(质量增加)
56 64 64-56=8
m(Fe) 4 g
