高中化学人教版(2019)必修第一册3.1 铁及其化合物(教学课件)-(19张PPT)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册3.1 铁及其化合物(教学课件)-(19张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-16 15:32:38 | ||
图片预览






文档简介
第三章 铁 金属材料
第一节 铁及其化合物
铁的单质
铁的氧化物
铁的氢氧化物
铁盐和亚铁盐
目 录
1.铁元素的存在
铁在地壳中的含量仅次于氧、硅和___,居第___位,主要以___价和___价化合物的形式存在。
2.物理性质
铁有_______和_______,铁能导电,但导电性不如铜和铝。铁能被
磁铁吸引。
铝
四
+2
+3
延展性
导热性
3.化学性质
(1)铁与非金属单质、酸、盐溶液的反应
铁与非金属单质反应:4Fe + 3O2 =2 Fe2O3
铁与酸反应:Fe +2 HCl=FeCl2+H2 ↑
铁与盐溶液反应:Fe+CuSO4 = Cu+FeSO4。
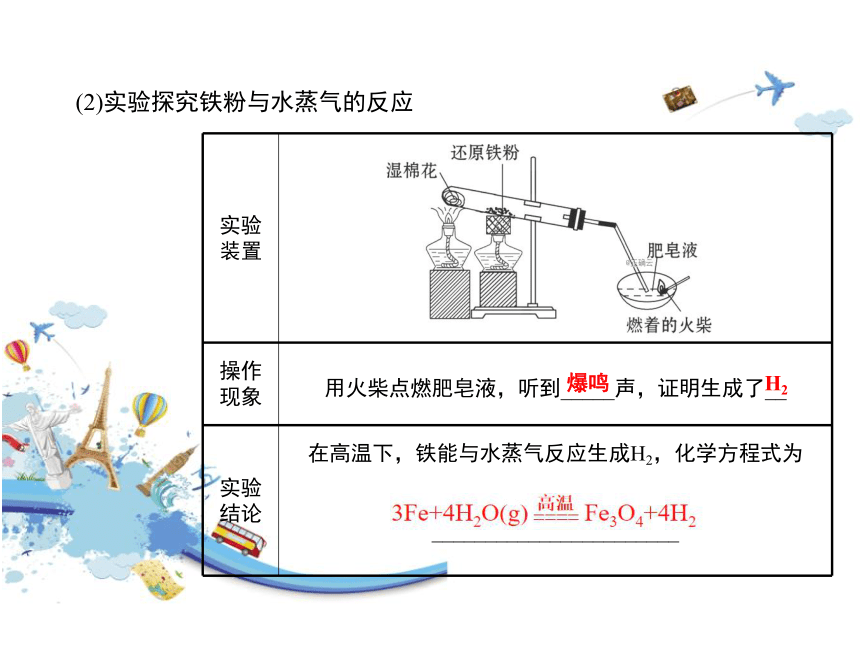
(2)实验探究铁粉与水蒸气的反应
实验装置
操作现象
用火柴点燃肥皂液,听到_____声,证明生成了__
实验结论
在高温下,铁能与水蒸气反应生成H2,化学方程式为
_______________________
爆鸣
H2
化学式
FeO
Fe2O3
Fe3O4
俗 称
_____
___________
颜色和状态
黑色粉末
_____色
粉末
黑色晶体
铁的价态
+2价
+3价
+2价、+3价
水溶性
_____
_____
_____
铁红
磁性氧化铁
红棕
不溶
不溶
不溶
(1)物理性质
(2)化学性质
①稳定性: Fe2O3、Fe3O4较稳定; FeO不稳定,受热能氧化为Fe3O4。
②与酸反应:FeO、Fe2O3都是碱性氧化物,都能与酸反应生成盐和水。分别写出它们与盐酸反应的离子方程式:
FeO+2H+ = Fe2++H2O、Fe2O3+6H+ = 2Fe3++3H2O。
【实验3-1】Fe(OH)2和Fe(OH)3的制备
实验操作
实验现象
结论(用方程式表示)
试管中有红褐色沉淀产生
Fe3++3OH- = Fe(OH)3↓
试管中先生成白色沉淀,迅速变成灰绿色,最后变成红褐色
Fe2++2OH- = Fe(OH)2↓(白色)、4Fe(OH)2+O2+2H2O = 4Fe(OH)3
1.防止Fe(OH)2氧化的方法
(1)将配制溶液的蒸馏水煮沸,除去其中的氧气。
(2)将盛有NaOH溶液的胶头滴管尖端插入试管内的亚铁盐溶液底部,并慢慢挤出NaOH溶液。
(3)在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。
(4)在亚铁盐溶液上面加保护层,如苯、植物油等。
2.实验装置的改进
【实验3-2】
实验操作
实验现象
结论及分析
加入KSCN溶液后,溶液呈______色
Fe3+遇KSCN溶液时,溶液变成________
加入铁粉后,溶液由黄色变为绿色,再加入KSCN溶液后,溶液无变化
Fe2+遇KSCN溶液时,溶液__________,故可用KSCN溶液检验Fe3+
红
红色
不变色
【实验3-3】在盛有2mL FeCl3溶液的试管中,加入少量铁粉,振荡试管。充分反应后,滴入几滴KSCN溶液,观察并记录实验现象。把上层清液倒入另一支试管中,再滴入几滴氯水,又有什么现象。
现象
离子方程式
加入铁粉
溶液由棕黄色变成浅绿色
2Fe3++Fe=3Fe2+
滴入KSCN溶液
无明显变化
滴入氯水
溶液变为红色
2Fe2++Cl2=2Fe3++2Cl-
Fe3++3SCN-=Fe(SCN)3
实验结论:Fe3+遇到较强的还原剂时,会被还原成Fe2+;Fe2+在较强的
氧化剂作用下会被氧化成Fe3+ 。在一定条件下,三者可以
相互转化。
(1)直接观察颜色
(2)利用氢氧化物沉淀的颜色
(3)利用显色反应
(4)利用Fe2+的还原性
(5)利用Fe3+的氧化性
第一节 铁及其化合物
铁的单质
铁的氧化物
铁的氢氧化物
铁盐和亚铁盐
目 录
1.铁元素的存在
铁在地壳中的含量仅次于氧、硅和___,居第___位,主要以___价和___价化合物的形式存在。
2.物理性质
铁有_______和_______,铁能导电,但导电性不如铜和铝。铁能被
磁铁吸引。
铝
四
+2
+3
延展性
导热性
3.化学性质
(1)铁与非金属单质、酸、盐溶液的反应
铁与非金属单质反应:4Fe + 3O2 =2 Fe2O3
铁与酸反应:Fe +2 HCl=FeCl2+H2 ↑
铁与盐溶液反应:Fe+CuSO4 = Cu+FeSO4。
(2)实验探究铁粉与水蒸气的反应
实验装置
操作现象
用火柴点燃肥皂液,听到_____声,证明生成了__
实验结论
在高温下,铁能与水蒸气反应生成H2,化学方程式为
_______________________
爆鸣
H2
化学式
FeO
Fe2O3
Fe3O4
俗 称
_____
___________
颜色和状态
黑色粉末
_____色
粉末
黑色晶体
铁的价态
+2价
+3价
+2价、+3价
水溶性
_____
_____
_____
铁红
磁性氧化铁
红棕
不溶
不溶
不溶
(1)物理性质
(2)化学性质
①稳定性: Fe2O3、Fe3O4较稳定; FeO不稳定,受热能氧化为Fe3O4。
②与酸反应:FeO、Fe2O3都是碱性氧化物,都能与酸反应生成盐和水。分别写出它们与盐酸反应的离子方程式:
FeO+2H+ = Fe2++H2O、Fe2O3+6H+ = 2Fe3++3H2O。
【实验3-1】Fe(OH)2和Fe(OH)3的制备
实验操作
实验现象
结论(用方程式表示)
试管中有红褐色沉淀产生
Fe3++3OH- = Fe(OH)3↓
试管中先生成白色沉淀,迅速变成灰绿色,最后变成红褐色
Fe2++2OH- = Fe(OH)2↓(白色)、4Fe(OH)2+O2+2H2O = 4Fe(OH)3
1.防止Fe(OH)2氧化的方法
(1)将配制溶液的蒸馏水煮沸,除去其中的氧气。
(2)将盛有NaOH溶液的胶头滴管尖端插入试管内的亚铁盐溶液底部,并慢慢挤出NaOH溶液。
(3)在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。
(4)在亚铁盐溶液上面加保护层,如苯、植物油等。
2.实验装置的改进
【实验3-2】
实验操作
实验现象
结论及分析
加入KSCN溶液后,溶液呈______色
Fe3+遇KSCN溶液时,溶液变成________
加入铁粉后,溶液由黄色变为绿色,再加入KSCN溶液后,溶液无变化
Fe2+遇KSCN溶液时,溶液__________,故可用KSCN溶液检验Fe3+
红
红色
不变色
【实验3-3】在盛有2mL FeCl3溶液的试管中,加入少量铁粉,振荡试管。充分反应后,滴入几滴KSCN溶液,观察并记录实验现象。把上层清液倒入另一支试管中,再滴入几滴氯水,又有什么现象。
现象
离子方程式
加入铁粉
溶液由棕黄色变成浅绿色
2Fe3++Fe=3Fe2+
滴入KSCN溶液
无明显变化
滴入氯水
溶液变为红色
2Fe2++Cl2=2Fe3++2Cl-
Fe3++3SCN-=Fe(SCN)3
实验结论:Fe3+遇到较强的还原剂时,会被还原成Fe2+;Fe2+在较强的
氧化剂作用下会被氧化成Fe3+ 。在一定条件下,三者可以
相互转化。
(1)直接观察颜色
(2)利用氢氧化物沉淀的颜色
(3)利用显色反应
(4)利用Fe2+的还原性
(5)利用Fe3+的氧化性
