高中化学人教版(2019)必修第一册4.2 元素周期律(教学课件)-(28张PPT)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册4.2 元素周期律(教学课件)-(28张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 6.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-16 00:00:00 | ||
图片预览






文档简介
第四章 物质结构 元素周期律
第二节 元素周期律
元素原子结构与化合价的周期性变化
第三周期元素性质的递变
元素周期律
元素周期表和元素周期律的应用
目 录
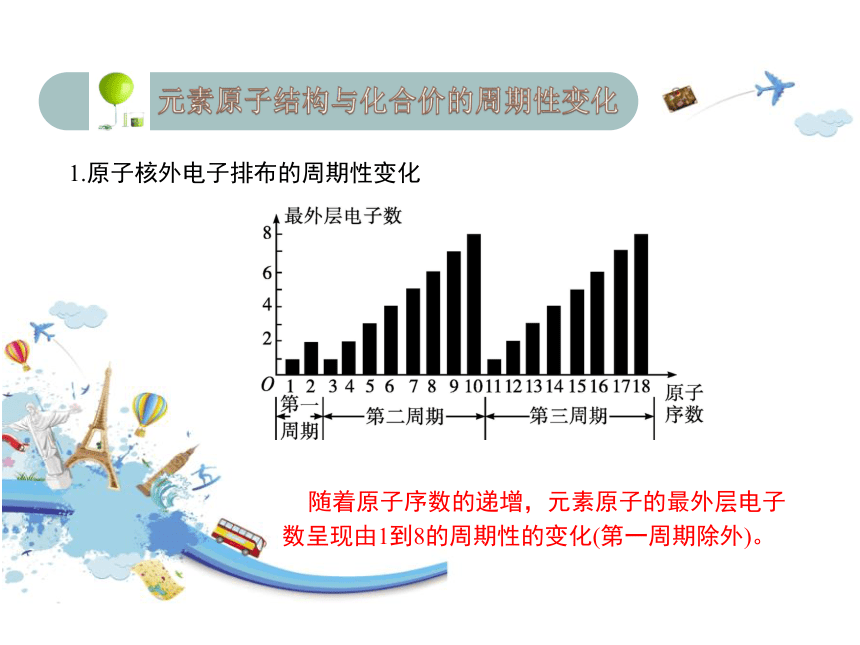
1.原子核外电子排布的周期性变化
随着原子序数的递增,元素原子的最外层电子数呈现由1到8的周期性的变化(第一周期除外)。
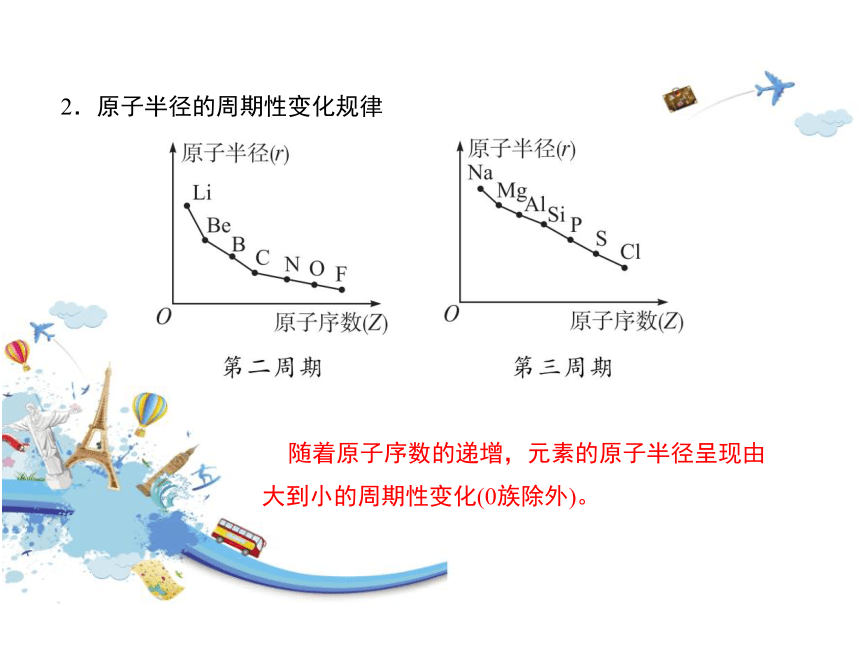
2.原子半径的周期性变化规律
随着原子序数的递增,元素的原子半径呈现由大到小的周期性变化(0族除外)。
同周期主族元素的原子电子层数相同,从左到右,核电荷数依次增大,核对外层电子的引力依次增强,所以半径依次减小。
3.元素化合价的周期性变化
随着原子序数的递增,元素的最高正价呈现由+1价到+7价、最低负价呈现由-4价到-1价的周期性变化。
不是。因为O、F原子半径小,原子核对外层电子的吸引能力强,不能失去电子,故氧一般不显正化合价,氟无正化合价。
1.钠、镁、铝金属性强弱比较
(1)实验①中,钠熔成小球,浮于水面,四处游动,发出“嘶嘶”的响声,反应后溶液加酚酞溶液变红。该实验说明钠与冷水反应剧烈,反应的化学方程式为2Na+2H2O══2NaOH+H2↑。
(2)实验②中,加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为粉红色。该实验说明镁与冷水几乎不反应,能与热水反应,反应的化学方
程式为: Mg+2H2O Mg(OH)2+H2↑。
(3)实验③中,向Al(OH)3沉淀中分别滴加2 mol·L-1盐酸和2 mol·L-1 NaOH溶液,都出现溶解现象,相应的离子方程式为
(4)实验④中,向Mg(OH)2沉淀中分别滴加2 mol·L-1盐酸和2 mol·L-1 NaOH溶液,其中滴加稀盐酸的试管内的沉淀溶解,相应的离子方程式为Mg(OH)2+2H+══Mg2++2H2O;滴加NaOH溶液的试管内无明显变化。
结论:钠、镁、铝的最高价氧化物对应的水化物的碱性由强到弱的顺序为NaOH>Mg(OH)2>Al(OH)3。
钠、镁、铝的金属性由强到弱的顺序为Na>Mg>Al。
2.Si、P、S、Cl的非金属性的递变规律
非金属元素
Si
P
S
Cl
最高价氧化物对应的水化物(含氧酸)的酸性强弱
H2SiO3:弱酸
H3PO4:中强酸
H2SO4:强酸
HClO4:强酸
(酸性比H2SO4强)
酸性:HClO4>H2SO4>H3PO4>H2SiO3
结论
Si、P、S、Cl的非金属性逐渐增强
3.同周期元素性质递变规律
定义:元素的性质随着原子序数的递增而呈周期性的变化。
实质:元素性质的周期性变化是原子的核外电子排布周期性
变化的必然结果。?
内容
同周期(从左到右,稀有气体元素除外)
同主族(从上到下)
离子
阳离子氧化性
增强
减弱
阴离子还原性
减弱
增强
氢化物
稳定性
增强
减弱
还原性
减弱
增强
最高价氧化物的水化物
酸性
增强
减弱
碱性
减弱
增强
1.同周期——“序大径小”(不考虑稀有气体元素)
(1)规律:同周期,从左往右,原子半径逐渐减小。
(2)举例:第三周期中r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)。
2.同主族——“序大径大”
(1)规律:同主族,从上到下,原子(或离子)半径逐渐增大。
(2)举例:r(Li)3.同元素
(1)同种元素的原子和离子半径比较——“阴大阳小”。
某原子与其离子半径比较,其阴离子半径大于该原子半径,阳离子半径小于该原子半径。
如:r(Na+)r(Cl)。
(2)同种元素不同价态的阳离子半径比较规律——“数大径小”。
带电荷数越多,粒子半径越小。如:r(Fe3+)4.同结构——“序大径小”
(1)规律:电子层结构相同的离子,核电荷数越大,离子半径越小。
(2)举例:r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。
“一看”电子层数:当最外层电子数相同时,电子层数越多,半径越大。
“二看”核电荷数:当电子层数相同时,核电荷数越大,半径越小。
“三看”核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
一、元素的金属性、非金属性变化
1.金属与非金属的划分
(1)虚线的左下方是金属元素(氢除外),虚线右上方是非金属元素,最右一个纵列是稀有气体元素。
(2)位于分界线附近元素的性质:既表现出一定的金属性,又表现出一定的非金属性。?
2.元素化合价与元素在周期表中的位置关系
(1)主族元素最高正化合价=族序数=最外层电子(价电子)数。
(2)非金属元素的化合价:
①最高正化合价等于原子所能失去或偏移的最外层电子数。
②负化合价等于使原子达到8电子稳定结构所需得到的电子数(H为2电子稳定结构)。
③同一元素的最高正化合价与负化合价的绝对值之和等于8。
二、元素周期表和元素周期律的应用
(1)预测未知元素的性质。
依据:同主族元素性质的递变规律。
如根据卤族元素的性质递变规律,可推知At2应为有色固体,与氢难化合,HAt不稳定,水溶液呈酸性,AgAt不溶于水等。
(2)比较元素的性质。
依据:元素周期律。
如比较H2SO4和H2SeO4的酸性强弱,因为S、Se同主族,从上
至下,元素的非金属性减弱,最高价氧化物对应的水化物
酸性减弱,故酸性:H2SO4>H2SeO4。
(3)解释实验现象:如氟气通入氯化钠溶液中,不是置换出氯气,而是与水发生剧烈反应,由元素非金属性的递变规律知氟元素的非金属性最强,氟气是氧化性最强的非金属单质。
(4)指导其他与化学相关的科学技术。如在周期表中金属与非金属的分界处,可以找到半导体材料。在过渡元素中寻找制造催化剂和耐高温、耐腐蚀合金的元素。
1.“位置”“结构”“性质”之间的关系的解读
第二节 元素周期律
元素原子结构与化合价的周期性变化
第三周期元素性质的递变
元素周期律
元素周期表和元素周期律的应用
目 录
1.原子核外电子排布的周期性变化
随着原子序数的递增,元素原子的最外层电子数呈现由1到8的周期性的变化(第一周期除外)。
2.原子半径的周期性变化规律
随着原子序数的递增,元素的原子半径呈现由大到小的周期性变化(0族除外)。
同周期主族元素的原子电子层数相同,从左到右,核电荷数依次增大,核对外层电子的引力依次增强,所以半径依次减小。
3.元素化合价的周期性变化
随着原子序数的递增,元素的最高正价呈现由+1价到+7价、最低负价呈现由-4价到-1价的周期性变化。
不是。因为O、F原子半径小,原子核对外层电子的吸引能力强,不能失去电子,故氧一般不显正化合价,氟无正化合价。
1.钠、镁、铝金属性强弱比较
(1)实验①中,钠熔成小球,浮于水面,四处游动,发出“嘶嘶”的响声,反应后溶液加酚酞溶液变红。该实验说明钠与冷水反应剧烈,反应的化学方程式为2Na+2H2O══2NaOH+H2↑。
(2)实验②中,加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为粉红色。该实验说明镁与冷水几乎不反应,能与热水反应,反应的化学方
程式为: Mg+2H2O Mg(OH)2+H2↑。
(3)实验③中,向Al(OH)3沉淀中分别滴加2 mol·L-1盐酸和2 mol·L-1 NaOH溶液,都出现溶解现象,相应的离子方程式为
(4)实验④中,向Mg(OH)2沉淀中分别滴加2 mol·L-1盐酸和2 mol·L-1 NaOH溶液,其中滴加稀盐酸的试管内的沉淀溶解,相应的离子方程式为Mg(OH)2+2H+══Mg2++2H2O;滴加NaOH溶液的试管内无明显变化。
结论:钠、镁、铝的最高价氧化物对应的水化物的碱性由强到弱的顺序为NaOH>Mg(OH)2>Al(OH)3。
钠、镁、铝的金属性由强到弱的顺序为Na>Mg>Al。
2.Si、P、S、Cl的非金属性的递变规律
非金属元素
Si
P
S
Cl
最高价氧化物对应的水化物(含氧酸)的酸性强弱
H2SiO3:弱酸
H3PO4:中强酸
H2SO4:强酸
HClO4:强酸
(酸性比H2SO4强)
酸性:HClO4>H2SO4>H3PO4>H2SiO3
结论
Si、P、S、Cl的非金属性逐渐增强
3.同周期元素性质递变规律
定义:元素的性质随着原子序数的递增而呈周期性的变化。
实质:元素性质的周期性变化是原子的核外电子排布周期性
变化的必然结果。?
内容
同周期(从左到右,稀有气体元素除外)
同主族(从上到下)
离子
阳离子氧化性
增强
减弱
阴离子还原性
减弱
增强
氢化物
稳定性
增强
减弱
还原性
减弱
增强
最高价氧化物的水化物
酸性
增强
减弱
碱性
减弱
增强
1.同周期——“序大径小”(不考虑稀有气体元素)
(1)规律:同周期,从左往右,原子半径逐渐减小。
(2)举例:第三周期中r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)。
2.同主族——“序大径大”
(1)规律:同主族,从上到下,原子(或离子)半径逐渐增大。
(2)举例:r(Li)
(1)同种元素的原子和离子半径比较——“阴大阳小”。
某原子与其离子半径比较,其阴离子半径大于该原子半径,阳离子半径小于该原子半径。
如:r(Na+)
(2)同种元素不同价态的阳离子半径比较规律——“数大径小”。
带电荷数越多,粒子半径越小。如:r(Fe3+)
(1)规律:电子层结构相同的离子,核电荷数越大,离子半径越小。
(2)举例:r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。
“一看”电子层数:当最外层电子数相同时,电子层数越多,半径越大。
“二看”核电荷数:当电子层数相同时,核电荷数越大,半径越小。
“三看”核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
一、元素的金属性、非金属性变化
1.金属与非金属的划分
(1)虚线的左下方是金属元素(氢除外),虚线右上方是非金属元素,最右一个纵列是稀有气体元素。
(2)位于分界线附近元素的性质:既表现出一定的金属性,又表现出一定的非金属性。?
2.元素化合价与元素在周期表中的位置关系
(1)主族元素最高正化合价=族序数=最外层电子(价电子)数。
(2)非金属元素的化合价:
①最高正化合价等于原子所能失去或偏移的最外层电子数。
②负化合价等于使原子达到8电子稳定结构所需得到的电子数(H为2电子稳定结构)。
③同一元素的最高正化合价与负化合价的绝对值之和等于8。
二、元素周期表和元素周期律的应用
(1)预测未知元素的性质。
依据:同主族元素性质的递变规律。
如根据卤族元素的性质递变规律,可推知At2应为有色固体,与氢难化合,HAt不稳定,水溶液呈酸性,AgAt不溶于水等。
(2)比较元素的性质。
依据:元素周期律。
如比较H2SO4和H2SeO4的酸性强弱,因为S、Se同主族,从上
至下,元素的非金属性减弱,最高价氧化物对应的水化物
酸性减弱,故酸性:H2SO4>H2SeO4。
(3)解释实验现象:如氟气通入氯化钠溶液中,不是置换出氯气,而是与水发生剧烈反应,由元素非金属性的递变规律知氟元素的非金属性最强,氟气是氧化性最强的非金属单质。
(4)指导其他与化学相关的科学技术。如在周期表中金属与非金属的分界处,可以找到半导体材料。在过渡元素中寻找制造催化剂和耐高温、耐腐蚀合金的元素。
1.“位置”“结构”“性质”之间的关系的解读
