1.1.2《元素的性质与原子结构》PPT课件(新人教版-必修2)
文档属性
| 名称 | 1.1.2《元素的性质与原子结构》PPT课件(新人教版-必修2) |

|
|
| 格式 | zip | ||
| 文件大小 | 427.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-03 00:00:00 | ||
图片预览









文档简介
(共35张PPT)
新课标人教版课件系列
《高中化学》
必修2
1.1.2《元素的性质
与原子结构》
第一章 《物质结构 元素周期律》
第一节《元素周期表》 第2课时
教学目标
知识与能力
1、通过探究元素的性质与原子结构,进一步理解元素周期表。
2、熟悉元素在周期表中的位置及原子结构与性质的关系。
3、培养学生的实践能力和归纳能力。
重点和难点:
元素在周期表中的位置和原子结构与性质的关系及同主族元素性质的递变规律。
[归纳与整理]
(二)编排原则:
⑴ 按原子序数的递增顺序从左到右排列
⑵ 将电子层数相同的元素排列成一个横行
⑶ 把最外层电子数相同的元素按电子层数
递增的顺序从上到下排成纵行。
(一)关系:
原子序数=核电荷数=质子数=核外电子数
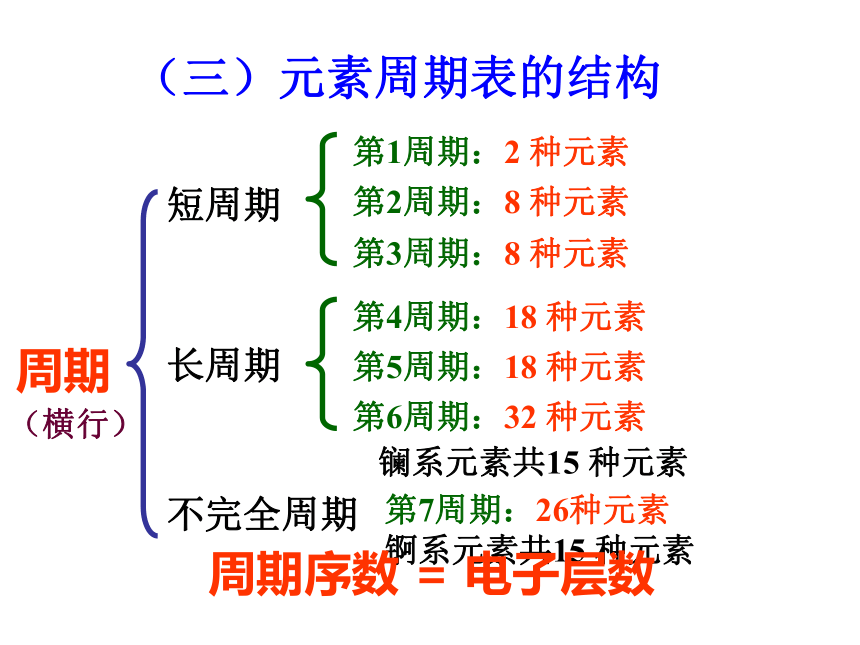
(三)元素周期表的结构
周期
短周期
长周期
第1周期:2 种元素
第2周期:8 种元素
第3周期:8 种元素
第4周期:18 种元素
第5周期:18 种元素
第6周期:32 种元素
不完全周期
第7周期:26种元素
镧系元素共15 种元素
锕系元素共15 种元素
周期序数 = 电子层数
(横行)
(三)元素周期表的结构
族
主族:
副族:
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
第VIII 族:
稀有气体元素
主族序数=最外层电子数
(纵行)
零族:
共七个主族
ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB
共七个副族
三个纵行(8、9、10)
课堂练习
Y
+53
2
8
18
18
7
第三周期第IA族
第五周期第VIIA族
2.主族元素在周期表中的位置取决于该元素的( )
A. 相对原子质量和核外电子数
B. 电子层数和最外层电子数
C. 相对原子质量的最外层电子数
D. 电子层数的次外层电子数
B
X
1.已知某主族元素的原子结构示意图如 下,判断其位于第几周期?第几族?
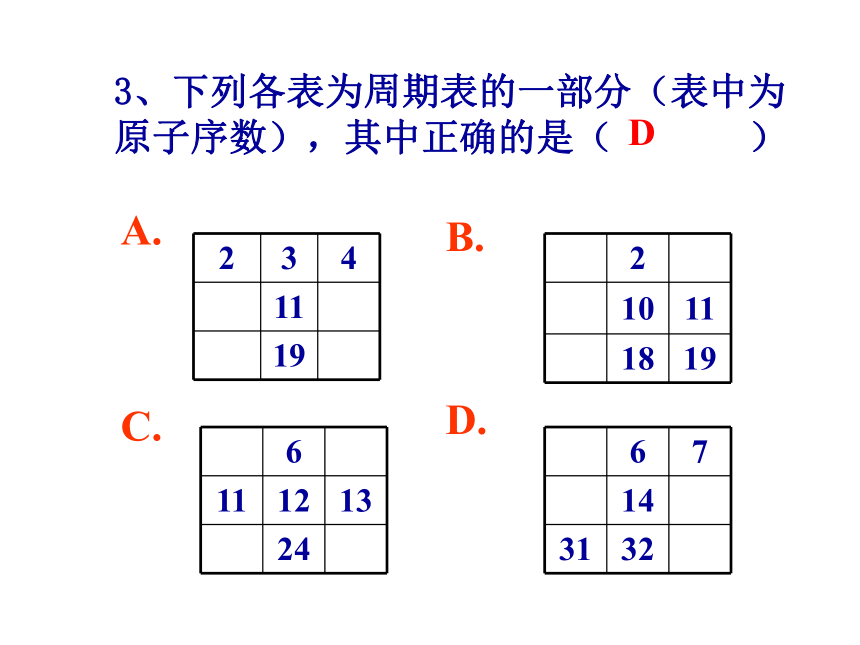
3、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
2 3 4
11
19
2
10 11
18 19
6
11 12 13
24
6 7
14
31 32
D
A.
B.
C.
D.
4、在短周期元素中,原子最外电子层只有1个或2个电子的元素是 ( )
A.金属元素
B.稀有气体元素
C.非金属元素
D.无法确定为哪一类元素
D
5、元素X的原子获得3个电子或元素Y的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同。X、Y两种元素的单质在高温下得到的化合物的化学式为_______,元素X在周期表中是第____族。元素Y在周期表中位于第____周期。
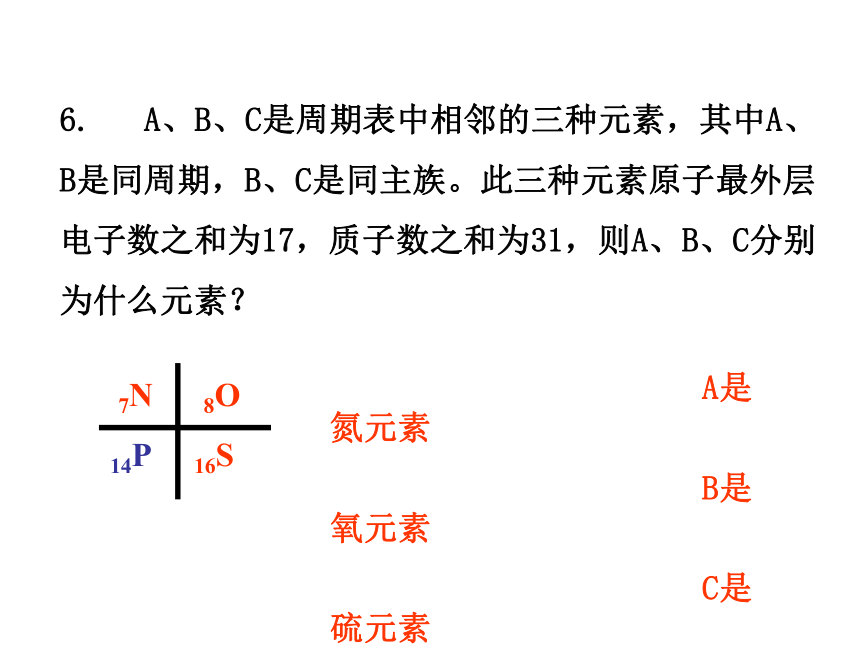
6. A、B、C是周期表中相邻的三种元素,其中A、B是同周期,B、C是同主族。此三种元素原子最外层电子数之和为17,质子数之和为31,则A、B、C分别为什么元素?
A是氮元素
B是氧元素
C是硫元素
7N 8O
14P 16S
二、元素的性质与原子结构
1、碱金属元素
第二课时
碱金属元素单质
Rb
[思考与交流]
科学探究:完成课本第5页的表.
我们把ⅠA 称为碱金属族,为什么要把它们编在一个族呢?请同学们画出碱金属的原子结构示意图,比较碱金属原子结构的共同之处 。
1、碱金属元素的原子结构
思考: 碱金属原子结构有何异同?
①相同点:碱金属元素原子结构的 相同, 都为 。
②递变性:从Li到Cs,碱金属元素的原子结
构中, 依次增多,原子半径依次
。
最外层电子数
1个
电子层数
增大
物质的性质主要取决于原子的最外层电子数,从碱金属元素原子的结构可推知其化学性质如何?有什么相似性吗?
最外层上都只有1个电子,化学反应中易失去1个电子,形成+1价的阳离子,单质体现还原性,并能与氧气等非金属元素及水发生化学反应。
取一小块钾,擦干表面的煤油后放在石棉网上加热,观察现象。同钠与氧气的反应比较。
钠在空气中的燃烧
钾在空气中的燃烧
钠 钾
与氧气反应 剧烈燃烧,
火焰呈 色,
生成 色的固体 剧烈燃烧,火焰呈 色
钠、钾化学性质比较
黄
淡黄
紫
元素 条件 现象 产物 结论
Li
Na 加热 燃烧,剧烈 Na2O2
K 稍加热 燃烧,更剧烈 更复杂的氧化物KO2
Rb
Cs
(1)与非金属的反应(以O2为例)
从Li—Cs,随电子层数的递增,还原性(金属性)逐渐增强。
加热
燃烧,较不剧烈
Li2O
接触空气不加热
剧烈
更复杂的氧化物
接触空气不加热
剧烈
更复杂的氧化物
钠、钾与水的反应
与水反应 在水面上、
成银白色、在水面上四处 、滴入酚酞溶液呈 色 在水面上、 成银白色、在水面上四处 、
滴入酚酞溶液
呈 色,有微弱爆炸
钠 钾
浮
熔
游动
红
钠、钾与水的反应
浮
熔
游动
红
元素 现象 产物 结论
Li
Na
K
Rb
Cs
从Li—Cs,随电子层数的递增,还原性(金属性)逐渐增强。
会反应,比Na缓慢
遇水燃烧,甚至爆炸
对应的碱和氢气
剧烈反应,有“浮、熔、游、红、鸣”现象
更剧烈,气体会燃烧,轻微爆炸
碱金属元素从上到下(Li 、Na、K、Rb、Cs),随着核电荷数的增加,碱金属元素原子的电子层数逐渐 ,原子半径逐渐 ,原子核对 的引力逐渐减弱,原子失电子的能力逐渐 。
增多
最外层电子
增强
元素的金属性逐渐 ,金属单质的还原性逐渐 ,与水和氧气的反应越来越 ,生成的氧化物越来越 。最高价氧化物对应水化物的碱性越来越 。
增强
剧烈
复杂
强
增大
增强
元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的难易程度。置换出氢越容易,则金属性越强。
已知金属A可与冷水反应,金属B和热水才能反应,金属C和水不能反应,判断金属A、B、C金属性强弱如何?
金属性 A 〉 B 〉 C
元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的难易程度。置换出氢越容易,则金属性越强。
2、根据金属元素最高价氧化物对应水化物碱性强弱。碱性越强,则原金属元素的金属性越强。
已知NaOH为强碱、Mg(OH)2为中强碱、 Al(OH)3为两性氢氧化物,则Na、Mg、Al的金属性强弱顺序如何?
金属性 Na 〉Mg 〉Al
元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的难易程度。置换出氢越容易,则金属性越强。
2、根据金属元素最高价氧化物对应水化物碱性强弱。碱性越强,则原金属元素的金属性越强。
3、可以根据对应阳离子的氧化性强弱判断。金属阳离子氧化性越弱,则元素金属性越强。
氧化性 Al3+﹥Mg2+﹥Na+ ,则元素金属性顺序为
Na﹥Mg﹥Al
碱金属的物理性质
有何相似性和递变性?
碱金属的物理性质的比较
相
似
点
递变性
颜色
硬度
密度
熔沸点
导电导热性
密度变化
熔沸点变化
Li Na K Rb Cs
柔软
较小
较低
强
逐渐增大(K特殊)
单质的熔沸点逐渐降低
均为银白色(Cs略带金色)
1.锂电池是一种高能电池。
锂有机化学中重要的催化剂。
锂制造氢弹不可缺少的材料。
锂是优质的高能燃料(已经
用于宇宙飞船、人造卫星和
超声速飞机)。
3.铷铯主要用于制备光电管、真空管。铯原子钟是目前最准确的计时仪器。
2.钾的化合物最大用途是做钾肥。硝酸钾还用于做火药。
碱金属元素的用途:
课堂练习:
1:碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列预言错误的是:
A.在碱金属中它具有最大的原子半径
B.它的氢氧化物化学式为FrOH,是一种极强的碱
C.钫在空气中燃烧时,只生成化学式为Fr2O的
氧化物
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸.
C
2.下列关于钾、钠、铷、铯的说法中,不正确的是:( )
A.原子半径随核电荷数的增大而增大
B.单质的密度均小于1
C.其氢氧化物中,碱性最强的CsOH
D.氧化能力最强的是钠离子
3. 钠、钾保存在煤油里,锂是否也可保存在煤油里 (煤油的密度为0.78g/cm3)
少量的锂可保存在密度更小的石蜡油里。
BD
新课标人教版课件系列
《高中化学》
必修2
1.1.2《元素的性质
与原子结构》
第一章 《物质结构 元素周期律》
第一节《元素周期表》 第2课时
教学目标
知识与能力
1、通过探究元素的性质与原子结构,进一步理解元素周期表。
2、熟悉元素在周期表中的位置及原子结构与性质的关系。
3、培养学生的实践能力和归纳能力。
重点和难点:
元素在周期表中的位置和原子结构与性质的关系及同主族元素性质的递变规律。
[归纳与整理]
(二)编排原则:
⑴ 按原子序数的递增顺序从左到右排列
⑵ 将电子层数相同的元素排列成一个横行
⑶ 把最外层电子数相同的元素按电子层数
递增的顺序从上到下排成纵行。
(一)关系:
原子序数=核电荷数=质子数=核外电子数
(三)元素周期表的结构
周期
短周期
长周期
第1周期:2 种元素
第2周期:8 种元素
第3周期:8 种元素
第4周期:18 种元素
第5周期:18 种元素
第6周期:32 种元素
不完全周期
第7周期:26种元素
镧系元素共15 种元素
锕系元素共15 种元素
周期序数 = 电子层数
(横行)
(三)元素周期表的结构
族
主族:
副族:
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
第VIII 族:
稀有气体元素
主族序数=最外层电子数
(纵行)
零族:
共七个主族
ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB
共七个副族
三个纵行(8、9、10)
课堂练习
Y
+53
2
8
18
18
7
第三周期第IA族
第五周期第VIIA族
2.主族元素在周期表中的位置取决于该元素的( )
A. 相对原子质量和核外电子数
B. 电子层数和最外层电子数
C. 相对原子质量的最外层电子数
D. 电子层数的次外层电子数
B
X
1.已知某主族元素的原子结构示意图如 下,判断其位于第几周期?第几族?
3、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
2 3 4
11
19
2
10 11
18 19
6
11 12 13
24
6 7
14
31 32
D
A.
B.
C.
D.
4、在短周期元素中,原子最外电子层只有1个或2个电子的元素是 ( )
A.金属元素
B.稀有气体元素
C.非金属元素
D.无法确定为哪一类元素
D
5、元素X的原子获得3个电子或元素Y的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同。X、Y两种元素的单质在高温下得到的化合物的化学式为_______,元素X在周期表中是第____族。元素Y在周期表中位于第____周期。
6. A、B、C是周期表中相邻的三种元素,其中A、B是同周期,B、C是同主族。此三种元素原子最外层电子数之和为17,质子数之和为31,则A、B、C分别为什么元素?
A是氮元素
B是氧元素
C是硫元素
7N 8O
14P 16S
二、元素的性质与原子结构
1、碱金属元素
第二课时
碱金属元素单质
Rb
[思考与交流]
科学探究:完成课本第5页的表.
我们把ⅠA 称为碱金属族,为什么要把它们编在一个族呢?请同学们画出碱金属的原子结构示意图,比较碱金属原子结构的共同之处 。
1、碱金属元素的原子结构
思考: 碱金属原子结构有何异同?
①相同点:碱金属元素原子结构的 相同, 都为 。
②递变性:从Li到Cs,碱金属元素的原子结
构中, 依次增多,原子半径依次
。
最外层电子数
1个
电子层数
增大
物质的性质主要取决于原子的最外层电子数,从碱金属元素原子的结构可推知其化学性质如何?有什么相似性吗?
最外层上都只有1个电子,化学反应中易失去1个电子,形成+1价的阳离子,单质体现还原性,并能与氧气等非金属元素及水发生化学反应。
取一小块钾,擦干表面的煤油后放在石棉网上加热,观察现象。同钠与氧气的反应比较。
钠在空气中的燃烧
钾在空气中的燃烧
钠 钾
与氧气反应 剧烈燃烧,
火焰呈 色,
生成 色的固体 剧烈燃烧,火焰呈 色
钠、钾化学性质比较
黄
淡黄
紫
元素 条件 现象 产物 结论
Li
Na 加热 燃烧,剧烈 Na2O2
K 稍加热 燃烧,更剧烈 更复杂的氧化物KO2
Rb
Cs
(1)与非金属的反应(以O2为例)
从Li—Cs,随电子层数的递增,还原性(金属性)逐渐增强。
加热
燃烧,较不剧烈
Li2O
接触空气不加热
剧烈
更复杂的氧化物
接触空气不加热
剧烈
更复杂的氧化物
钠、钾与水的反应
与水反应 在水面上、
成银白色、在水面上四处 、滴入酚酞溶液呈 色 在水面上、 成银白色、在水面上四处 、
滴入酚酞溶液
呈 色,有微弱爆炸
钠 钾
浮
熔
游动
红
钠、钾与水的反应
浮
熔
游动
红
元素 现象 产物 结论
Li
Na
K
Rb
Cs
从Li—Cs,随电子层数的递增,还原性(金属性)逐渐增强。
会反应,比Na缓慢
遇水燃烧,甚至爆炸
对应的碱和氢气
剧烈反应,有“浮、熔、游、红、鸣”现象
更剧烈,气体会燃烧,轻微爆炸
碱金属元素从上到下(Li 、Na、K、Rb、Cs),随着核电荷数的增加,碱金属元素原子的电子层数逐渐 ,原子半径逐渐 ,原子核对 的引力逐渐减弱,原子失电子的能力逐渐 。
增多
最外层电子
增强
元素的金属性逐渐 ,金属单质的还原性逐渐 ,与水和氧气的反应越来越 ,生成的氧化物越来越 。最高价氧化物对应水化物的碱性越来越 。
增强
剧烈
复杂
强
增大
增强
元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的难易程度。置换出氢越容易,则金属性越强。
已知金属A可与冷水反应,金属B和热水才能反应,金属C和水不能反应,判断金属A、B、C金属性强弱如何?
金属性 A 〉 B 〉 C
元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的难易程度。置换出氢越容易,则金属性越强。
2、根据金属元素最高价氧化物对应水化物碱性强弱。碱性越强,则原金属元素的金属性越强。
已知NaOH为强碱、Mg(OH)2为中强碱、 Al(OH)3为两性氢氧化物,则Na、Mg、Al的金属性强弱顺序如何?
金属性 Na 〉Mg 〉Al
元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的难易程度。置换出氢越容易,则金属性越强。
2、根据金属元素最高价氧化物对应水化物碱性强弱。碱性越强,则原金属元素的金属性越强。
3、可以根据对应阳离子的氧化性强弱判断。金属阳离子氧化性越弱,则元素金属性越强。
氧化性 Al3+﹥Mg2+﹥Na+ ,则元素金属性顺序为
Na﹥Mg﹥Al
碱金属的物理性质
有何相似性和递变性?
碱金属的物理性质的比较
相
似
点
递变性
颜色
硬度
密度
熔沸点
导电导热性
密度变化
熔沸点变化
Li Na K Rb Cs
柔软
较小
较低
强
逐渐增大(K特殊)
单质的熔沸点逐渐降低
均为银白色(Cs略带金色)
1.锂电池是一种高能电池。
锂有机化学中重要的催化剂。
锂制造氢弹不可缺少的材料。
锂是优质的高能燃料(已经
用于宇宙飞船、人造卫星和
超声速飞机)。
3.铷铯主要用于制备光电管、真空管。铯原子钟是目前最准确的计时仪器。
2.钾的化合物最大用途是做钾肥。硝酸钾还用于做火药。
碱金属元素的用途:
课堂练习:
1:碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列预言错误的是:
A.在碱金属中它具有最大的原子半径
B.它的氢氧化物化学式为FrOH,是一种极强的碱
C.钫在空气中燃烧时,只生成化学式为Fr2O的
氧化物
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸.
C
2.下列关于钾、钠、铷、铯的说法中,不正确的是:( )
A.原子半径随核电荷数的增大而增大
B.单质的密度均小于1
C.其氢氧化物中,碱性最强的CsOH
D.氧化能力最强的是钠离子
3. 钠、钾保存在煤油里,锂是否也可保存在煤油里 (煤油的密度为0.78g/cm3)
少量的锂可保存在密度更小的石蜡油里。
BD
