1.3.1《离子键》PPT课件(新人教版-必修2)
文档属性
| 名称 | 1.3.1《离子键》PPT课件(新人教版-必修2) |  | |
| 格式 | zip | ||
| 文件大小 | 430.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-03 11:09:40 | ||
图片预览






文档简介
(共19张PPT)
新课标人教版课件系列
《高中化学》
必修2
1.3.1《离子键》
第一章 物质结构 元素周期律 第三节《化学键》 第1课时
教学目标
知识与技能:
1.理解化学反应速率的概念和影响的外界条件。2.能设计并完成一些化学实验。
过程与方法:
1.重视培养学生科学探究的基本方法。2.通过实验分析影响化学反应速率的外界条件。
情感、态度与价值观:
有参与化学科技活动的热情,有将化学知识应用于生产、生活实践的意识,能够对与化学有关的社会和生活问题做出合理的判断。
教学重点:化学反应速率概念;了解影响化学反应速率的因素。
教学难点:影响化学反应速率的因素
教具准备:多媒体课件、投影仪。
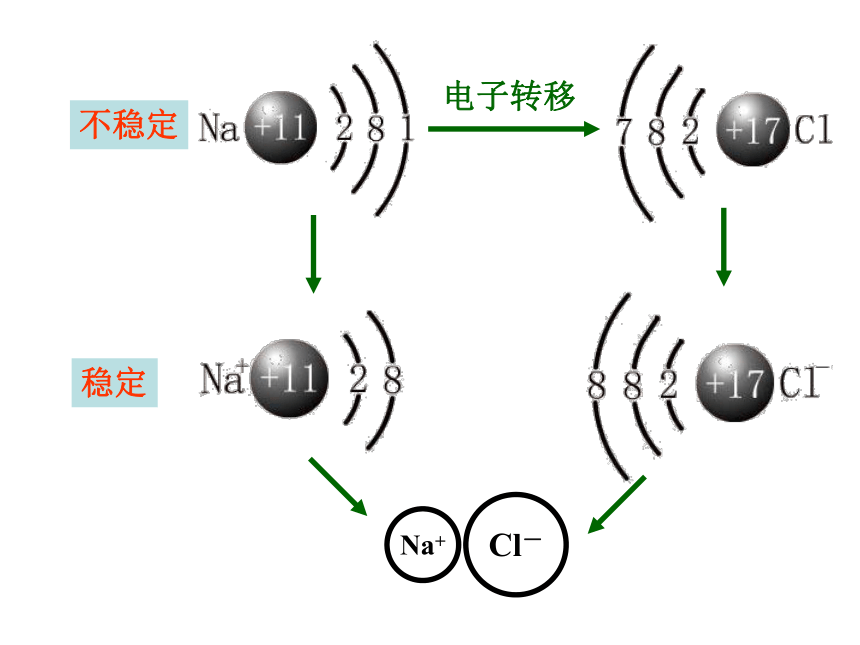
钠在氯气中燃烧
剧烈燃烧,发出淡黄色的火焰,有大量的白烟。
Na+
Cl-
电子转移
不稳定
稳定
定义: 使阴阳离子结合成化合物的静电作用,叫做离子键。
成键微粒:阴阳离子
相互作用:静电作用(静电引力和斥力)
成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。
含有离子键的化合物就是离子化合物。
离子键
使阴阳离子结合成化合物的静电作用,叫 做离子键。
思考
哪些物质能形成离子键?
活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)之间的化合物。
活泼的金属元素和酸根离子形成的盐
铵盐和酸根离子(或活泼非金属元素)形成的盐。
在元素符号周围用“ · ”或“×”来表示
原子最外层电子的式子,叫电子式。
H ·
Na ·
·Mg ·
·Ca ·
·O·
··
··
Cl ·
··
··
··
原子的电子式:
离子的电子式:
H+
Na+
Mg2+
Ca2+
[ O ]2-
··
··
:
:
[ Cl ]-
··
··
:
:
(1)原子的电子式:常把其最外层电子数用小黑点“.”或小叉“×”来表示。
(2)阳离子的电子式:不要求画出离子最外层电子数,只要在元素、符号右上角标出“n+”电荷字样。
(3)阴离子的电子式:不但要画出最外层电子数,而且还应用于括号“[ ]”括起来,并在右上角标出“n·-”电荷字样。
电子式
[ 练习] 写出下列微粒的电子式:
硫原子, 溴原子, 硫离子, 溴离子
·S·
··
··
Br ·
··
··
··
[ S ]2-
··
··
:
:
[ Br ]-
··
··
:
:
用电子式可以直观地
看到原子结构特点与键之间的关系。
表示出原子之间是怎样结合的
离子化合物的电子式:由阴、阳离子的电子式组成,但对相同离子不能合并
AB型
AB2型
A2B型
用 电子式 表示 离子化合物 的 形成过程
用电子式表示氯化钠的形成过程
用电子式表示氯化钙的形成过程
··
Cl :
··
··
·
Na ·
+
→
[ Cl ]-
··
:
:
Na+
+
+
→
·Ca·
Ca2+
Cl ·
··
··
··
Cl :
··
··
·
[ Cl ]-
··
··
:
:
[ Cl ]-
··
··
:
:
注意点
1 离子须注明电荷数;
2 相同的原子可以合并写,相同的离子要单个写;
3.阴离子要用方括号括起;
4.不能把 “→”写成 “ ==”
5.用箭头表明电子转移方向(也可不标)
[ 练习] ⑴ 用电子式表示氧化镁的形成过程
⑵ 用电子式表示硫化钾的形成过程
箭头左方相同的微粒可以合并,
箭头右方相同的微粒不可以合并。
注
意
· O ·
··
··
· Mg ·
+
→
Mg2+
[ o ]2-
··
··
:
:
+
· S ·
··
··
2K·
→
K+
K+
[ S ]2-
··
··
:
:
使阴阳离子结合成化合物的静电作用,叫做离子键。
含有离子键的化合物一定是离子化合物
区分: 用电子式表示物质
用电子式表示物质形成过程
作业
⑴ 用电子式表示下列物质的形成过程
KF Na2S MgBr2 Na3P
兴宁一中高一化学备课组
思考
在氯化钠晶体中,Na+和Cl- 间存在哪些力?
Na+离子和Cl-离子间的静电相互吸引作用
不可能!因阴阳离子接近到某一定距离时,吸引
和排斥作用达到平衡,阴阳离子间形成稳定的化
学键。
阴阳离子结合在一起,彼此电荷是否会中和呢?
阴阳离子间电子与电子、原子核与原子核间的相互排斥作用
新课标人教版课件系列
《高中化学》
必修2
1.3.1《离子键》
第一章 物质结构 元素周期律 第三节《化学键》 第1课时
教学目标
知识与技能:
1.理解化学反应速率的概念和影响的外界条件。2.能设计并完成一些化学实验。
过程与方法:
1.重视培养学生科学探究的基本方法。2.通过实验分析影响化学反应速率的外界条件。
情感、态度与价值观:
有参与化学科技活动的热情,有将化学知识应用于生产、生活实践的意识,能够对与化学有关的社会和生活问题做出合理的判断。
教学重点:化学反应速率概念;了解影响化学反应速率的因素。
教学难点:影响化学反应速率的因素
教具准备:多媒体课件、投影仪。
钠在氯气中燃烧
剧烈燃烧,发出淡黄色的火焰,有大量的白烟。
Na+
Cl-
电子转移
不稳定
稳定
定义: 使阴阳离子结合成化合物的静电作用,叫做离子键。
成键微粒:阴阳离子
相互作用:静电作用(静电引力和斥力)
成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。
含有离子键的化合物就是离子化合物。
离子键
使阴阳离子结合成化合物的静电作用,叫 做离子键。
思考
哪些物质能形成离子键?
活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)之间的化合物。
活泼的金属元素和酸根离子形成的盐
铵盐和酸根离子(或活泼非金属元素)形成的盐。
在元素符号周围用“ · ”或“×”来表示
原子最外层电子的式子,叫电子式。
H ·
Na ·
·Mg ·
·Ca ·
·O·
··
··
Cl ·
··
··
··
原子的电子式:
离子的电子式:
H+
Na+
Mg2+
Ca2+
[ O ]2-
··
··
:
:
[ Cl ]-
··
··
:
:
(1)原子的电子式:常把其最外层电子数用小黑点“.”或小叉“×”来表示。
(2)阳离子的电子式:不要求画出离子最外层电子数,只要在元素、符号右上角标出“n+”电荷字样。
(3)阴离子的电子式:不但要画出最外层电子数,而且还应用于括号“[ ]”括起来,并在右上角标出“n·-”电荷字样。
电子式
[ 练习] 写出下列微粒的电子式:
硫原子, 溴原子, 硫离子, 溴离子
·S·
··
··
Br ·
··
··
··
[ S ]2-
··
··
:
:
[ Br ]-
··
··
:
:
用电子式可以直观地
看到原子结构特点与键之间的关系。
表示出原子之间是怎样结合的
离子化合物的电子式:由阴、阳离子的电子式组成,但对相同离子不能合并
AB型
AB2型
A2B型
用 电子式 表示 离子化合物 的 形成过程
用电子式表示氯化钠的形成过程
用电子式表示氯化钙的形成过程
··
Cl :
··
··
·
Na ·
+
→
[ Cl ]-
··
:
:
Na+
+
+
→
·Ca·
Ca2+
Cl ·
··
··
··
Cl :
··
··
·
[ Cl ]-
··
··
:
:
[ Cl ]-
··
··
:
:
注意点
1 离子须注明电荷数;
2 相同的原子可以合并写,相同的离子要单个写;
3.阴离子要用方括号括起;
4.不能把 “→”写成 “ ==”
5.用箭头表明电子转移方向(也可不标)
[ 练习] ⑴ 用电子式表示氧化镁的形成过程
⑵ 用电子式表示硫化钾的形成过程
箭头左方相同的微粒可以合并,
箭头右方相同的微粒不可以合并。
注
意
· O ·
··
··
· Mg ·
+
→
Mg2+
[ o ]2-
··
··
:
:
+
· S ·
··
··
2K·
→
K+
K+
[ S ]2-
··
··
:
:
使阴阳离子结合成化合物的静电作用,叫做离子键。
含有离子键的化合物一定是离子化合物
区分: 用电子式表示物质
用电子式表示物质形成过程
作业
⑴ 用电子式表示下列物质的形成过程
KF Na2S MgBr2 Na3P
兴宁一中高一化学备课组
思考
在氯化钠晶体中,Na+和Cl- 间存在哪些力?
Na+离子和Cl-离子间的静电相互吸引作用
不可能!因阴阳离子接近到某一定距离时,吸引
和排斥作用达到平衡,阴阳离子间形成稳定的化
学键。
阴阳离子结合在一起,彼此电荷是否会中和呢?
阴阳离子间电子与电子、原子核与原子核间的相互排斥作用
