2.2.1《化学能与电能的相互转化》PPT课件(新人教版-必修2)
文档属性
| 名称 | 2.2.1《化学能与电能的相互转化》PPT课件(新人教版-必修2) |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-03 11:09:40 | ||
图片预览







文档简介
(共32张PPT)
新课标人教版课件系列
《高中化学》
必修2
2.2.1《化学能与电能的
相互转化》
第二章 化学反应与能量 第一节《化学能与电能》 第1课时
教学目标
知识与技能
1. 获得化学能与电能转化的化学实验的基础知识和基本技能,学习实验研究的方法,能设计并完成化学能与电能转化的化学实验。2.形成原电池的概念,探究构成原电池的条件。
过程与方法
1.经历对化学能与电能转化的化学实验探究的过程,进一步理解探究的意义,学习科学探究的基本方法,提高科学探究的能力。2.能对自己的探究原电池概念及形成条件的学习过程进行计划、反思、评价、和调控,提高自主学习化学的能力。
情感、态度与价值观:
赞赏化学科学对个人生活和社会发展的贡献,关注能源问题,形成正确能源观。
教学重点:原电池的概念与构成的条件。
教学难点:用已经学过的有关知识探究化学能转化成电能的条件和装置。
有些人把能源分为一次能源和二次能
源,请问太阳能和电能属于那一类呢?
一次能源:直接从自然界取得的能源,
例如流水、风力、原煤、石油、天然
气、天然铀矿等。
想一想
二次能源:一次能源经过加工、转换得到的能源,例如电力、蒸汽等。
【资料卡片】
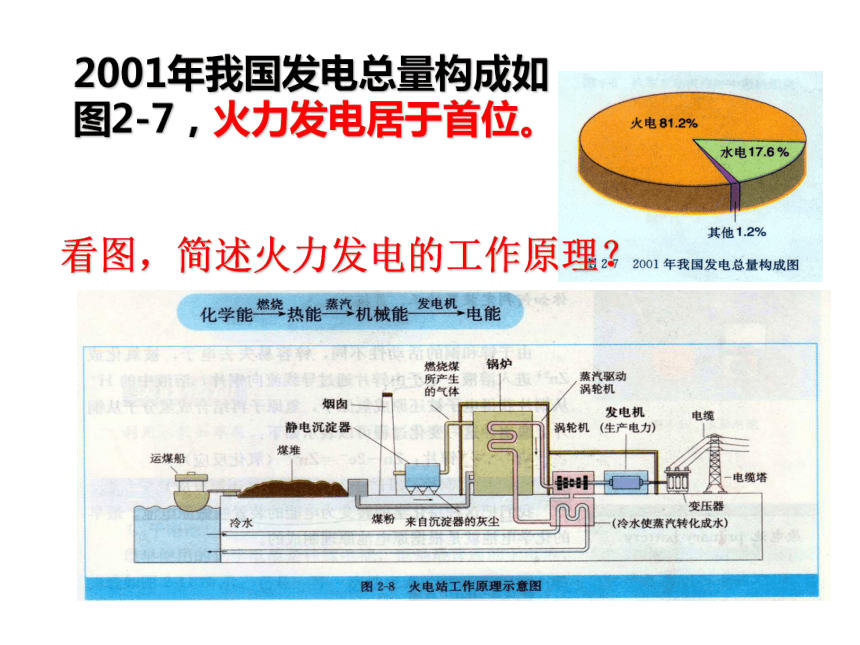
2001年我国发电总量构成如图2-7,火力发电居于首位。
看图,简述火力发电的工作原理?
思考:
1.煤燃烧的本质是什么?
氧化剂与还原剂之间发生电子转移,即
氧化还原反应。
2.请大家根据图2-8分析火力发电具有那些
缺点?
3.能否将化学能直接转变为电能供我们使用呢?
产生二氧化硫和氮的氧化物,导致空气污染,也会造成酸雨,破坏生态环境;会产生二氧化碳,会使地球的温室效应恶化。
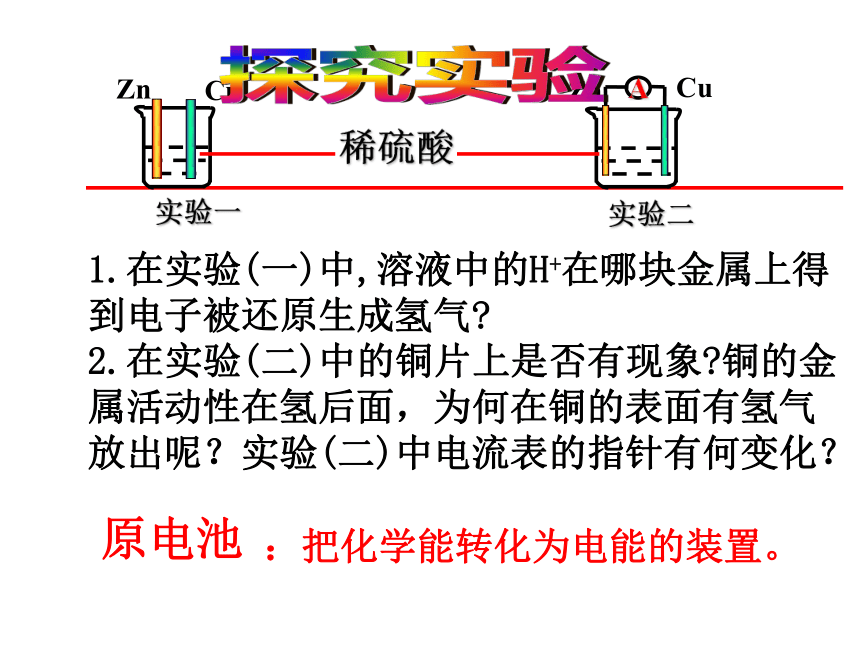
1.在实验(一)中,溶液中的H+在哪块金属上得到电子被还原生成氢气
2.在实验(二)中的铜片上是否有现象 铜的金属活动性在氢后面,为何在铜的表面有氢气放出呢?实验(二)中电流表的指针有何变化?
实验一
Zn
Cu
Zn
Cu
实验二
A
原电池
:把化学能转化为电能的装置。
稀硫酸
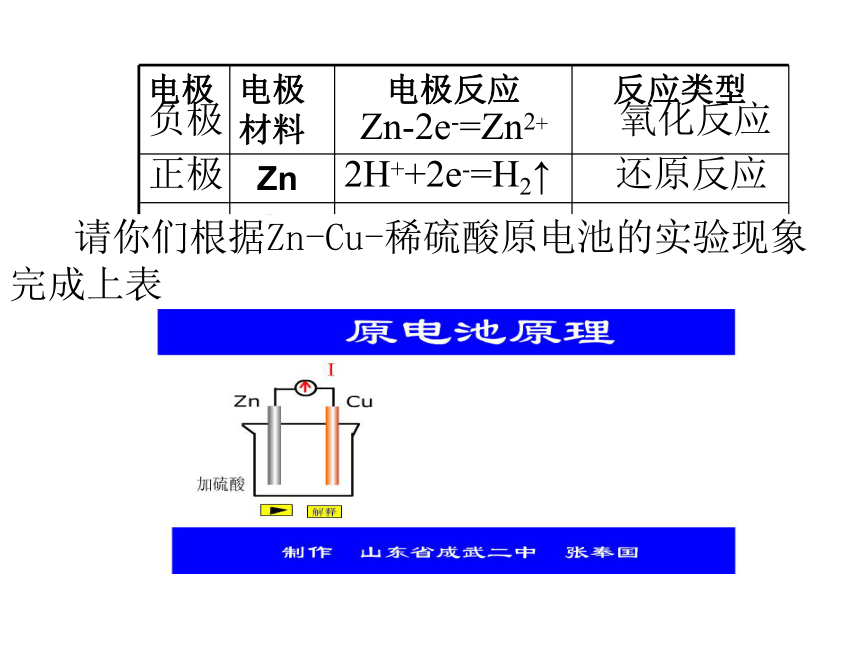
电极 电极材料 电极反应 反应类型
Zn
Cu
Zn-2e-=Zn2+
氧化反应
2H++2e-=H2↑
还原反应
负极
正极
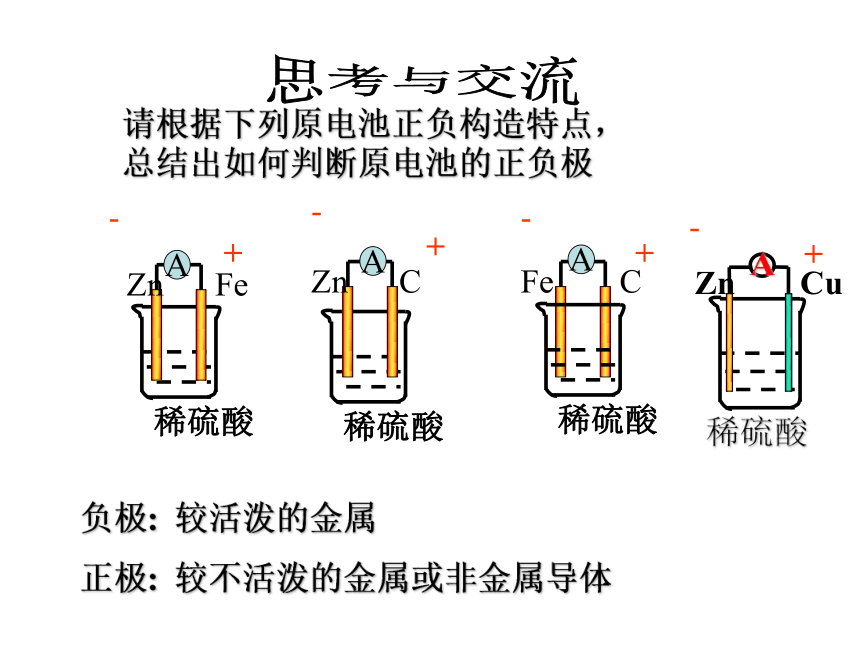
负极: 较活泼的金属
正极: 较不活泼的金属或非金属导体
Zn
Cu
A
-
+
稀硫酸
Zn
Fe
A
稀硫酸
C
Zn
Fe
C
A
稀硫酸
-
+
-
+
-
+
A
请根据下列原电池正负构造特点,
总结出如何判断原电池的正负极
稀硫酸
判断原电池正、负极的方法
1、由组成原电池的两极材料判断:
一般是活泼的金属为负极
活泼性较弱的金属或能导电的非金属为正极
2、根据电流方向或电子流动方向判断:
电流是由正极流向负极;
电子流动方向是由负极流向正极。
3、根据原电池两极发生的变化来判断:
原电池的负极总是失电子发生氧化反应,
正极总是得电子发生还原反应。
【归纳小结】
4、电极反应现象.
不断溶解,质量减少为负极;有气体产生,或质量增加或不变为正极
1、下列四个装置中,导线中的电子由左边一极流向右边一极的是( )
稀H2SO4
Zn
Zn
(A)
稀H2SO4
Cu
Zn
(B)
稀H2SO4
Zn
C
(C)
C
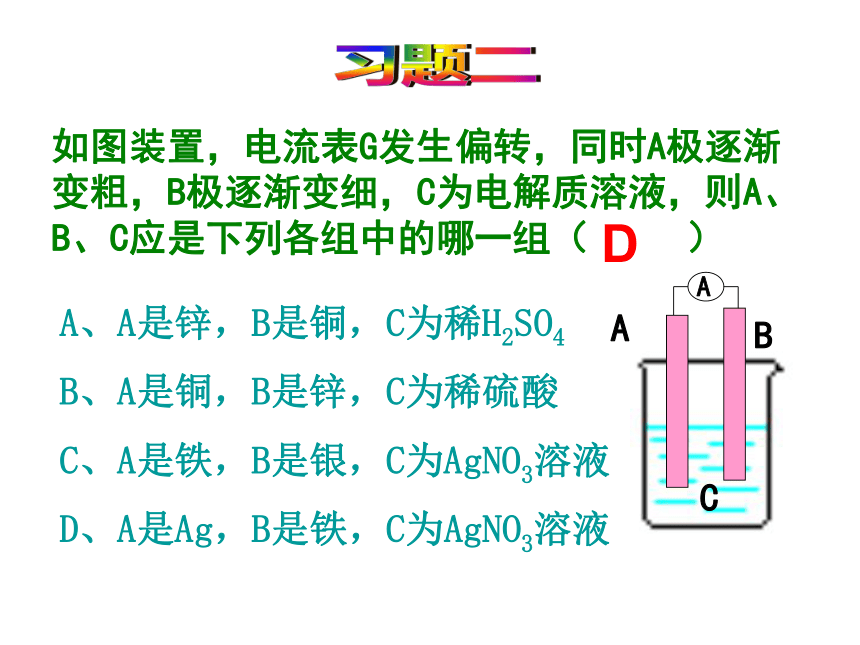
如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组( )
A、A是锌,B是铜,C为稀H2SO4
B、A是铜,B是锌,C为稀硫酸
C、A是铁,B是银,C为AgNO3溶液
D、A是Ag,B是铁,C为AgNO3溶液
A
C
A
B
D
请判断下列原电池的正负极情况和
电流方向
硫酸铜
Zn
Fe
A
硫酸铜
Zn
C
A
Fe
C
A
硫酸铜
-
+
-
+
-
+
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y是电池的负极。X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>X
C
因为X置换出Z,所以金属性X>Z
负极的金属较活泼,所以Y>X
下 页
上 页
首 页
小 结
结 束
把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
B
1、原电池:
把化学能转化为电能的装置
2、原电池原理
原电池
负极(较活泼金属)
正极(较不活泼金属或非金属导体)
3、判断原电池正、负极的方法
较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过导线流向较不活泼的金属(正极)
1、由组成原电池的两极材料判断;
2、根据电流方向或电子流动方向判断;
3、根据原电池两极发生的变化来判断;
4、电极反应现象.
活负惰正
Cu—Cu与稀硫酸进行实验.
Zn—石墨与稀硫酸进行实验.
Fe—Al与稀硫酸进行实验.
Cu—Zn与乙醇进行实验.
Cu—Zn与一个西红柿(或一个苹果)进行实验.
Cu—石墨与稀硫酸进行实验.
要注意指针的偏转方向,判断正负极
原电池设计思路:
1.能自发进行的氧化还原反应
2.通常须两个活性不同的电极
3.电解质溶液
4.还原剂在负极失电子,发生氧化反应,氧化剂在正极得电子,发生还原反应.
Fe
比Fe不活泼的金属或石墨
CuSO4 、CuCl2等
负极:
正极:
电解质溶液:
思 考 题
请根据反应:Fe+Cu2+=Fe2++Cu
设计原电池,你有哪些可行方案
Cu2+溶液
思 考 题
请根据反应2Fe3++Fe=3Fe2+
设计原电池,你有哪些可行方案
Fe-Cu FeCl3
Fe-C Fe(NO3)3
Fe-Ag Fe(SO4)3
通过上述实验设计,试说明化学电池由几部分构成,它的组成条件是什么?
【思考与交流】
Zn
二.构成原电池的条件:
1、自发进行的氧化还原反应
2、有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。
(一般负极与电解质发生氧化还原反应)
3、两极材料均插入电解质溶液中。
4、两极相连形成闭合回路。
1、下列四个装置中,导线中的电子由左边一极流向右边一极的是( )
稀H2SO4
Zn
Zn
(A)
稀H2SO4
Cu
Zn
(B)
稀H2SO4
Zn
C
(C)
C
如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组( )
A、A是锌,B是铜,C为稀H2SO4
B、A是铜,B是锌,C为稀硫酸
C、A是铁,B是银,C为AgNO3溶液
D、A是Ag,B是铁,C为AgNO3溶液
A
C
A
B
D
请判断下列原电池的正负极情况和
电流方向
硫酸铜
Zn
Fe
A
硫酸铜
Zn
C
A
Fe
C
A
硫酸铜
-
+
-
+
-
+
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y是电池的负极。X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>X
C
因为X置换出Z,所以金属性X>Z
负极的金属较活泼,所以Y>X
把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
B
1.下列装置中能组成原电池形成电流的是( )
C
Zn
Cu
H2SO4
A
Zn
Cu
CuSO4
A
Zn
Cu
酒精
A B
Zn
H2SO4
A
Cu
H2SO4
C D
没有形成闭合回路
酒精不是电解质
没有形成闭合回路
你知道了吗?
哈哈!化学也能解决医学问题?
请同学们根据原电池的原理,指出下列原电池的正极与负极分别是什么?写出电极反应式和总反应方程式。
相同条件下,纯锌粒和粗锌粒与同浓度的稀硫酸反应的速率一样吗?为什么?假如要求你设计实验来证明你的观点,你的实验方案是怎样的?证据和结论又是什么?
新课标人教版课件系列
《高中化学》
必修2
2.2.1《化学能与电能的
相互转化》
第二章 化学反应与能量 第一节《化学能与电能》 第1课时
教学目标
知识与技能
1. 获得化学能与电能转化的化学实验的基础知识和基本技能,学习实验研究的方法,能设计并完成化学能与电能转化的化学实验。2.形成原电池的概念,探究构成原电池的条件。
过程与方法
1.经历对化学能与电能转化的化学实验探究的过程,进一步理解探究的意义,学习科学探究的基本方法,提高科学探究的能力。2.能对自己的探究原电池概念及形成条件的学习过程进行计划、反思、评价、和调控,提高自主学习化学的能力。
情感、态度与价值观:
赞赏化学科学对个人生活和社会发展的贡献,关注能源问题,形成正确能源观。
教学重点:原电池的概念与构成的条件。
教学难点:用已经学过的有关知识探究化学能转化成电能的条件和装置。
有些人把能源分为一次能源和二次能
源,请问太阳能和电能属于那一类呢?
一次能源:直接从自然界取得的能源,
例如流水、风力、原煤、石油、天然
气、天然铀矿等。
想一想
二次能源:一次能源经过加工、转换得到的能源,例如电力、蒸汽等。
【资料卡片】
2001年我国发电总量构成如图2-7,火力发电居于首位。
看图,简述火力发电的工作原理?
思考:
1.煤燃烧的本质是什么?
氧化剂与还原剂之间发生电子转移,即
氧化还原反应。
2.请大家根据图2-8分析火力发电具有那些
缺点?
3.能否将化学能直接转变为电能供我们使用呢?
产生二氧化硫和氮的氧化物,导致空气污染,也会造成酸雨,破坏生态环境;会产生二氧化碳,会使地球的温室效应恶化。
1.在实验(一)中,溶液中的H+在哪块金属上得到电子被还原生成氢气
2.在实验(二)中的铜片上是否有现象 铜的金属活动性在氢后面,为何在铜的表面有氢气放出呢?实验(二)中电流表的指针有何变化?
实验一
Zn
Cu
Zn
Cu
实验二
A
原电池
:把化学能转化为电能的装置。
稀硫酸
电极 电极材料 电极反应 反应类型
Zn
Cu
Zn-2e-=Zn2+
氧化反应
2H++2e-=H2↑
还原反应
负极
正极
负极: 较活泼的金属
正极: 较不活泼的金属或非金属导体
Zn
Cu
A
-
+
稀硫酸
Zn
Fe
A
稀硫酸
C
Zn
Fe
C
A
稀硫酸
-
+
-
+
-
+
A
请根据下列原电池正负构造特点,
总结出如何判断原电池的正负极
稀硫酸
判断原电池正、负极的方法
1、由组成原电池的两极材料判断:
一般是活泼的金属为负极
活泼性较弱的金属或能导电的非金属为正极
2、根据电流方向或电子流动方向判断:
电流是由正极流向负极;
电子流动方向是由负极流向正极。
3、根据原电池两极发生的变化来判断:
原电池的负极总是失电子发生氧化反应,
正极总是得电子发生还原反应。
【归纳小结】
4、电极反应现象.
不断溶解,质量减少为负极;有气体产生,或质量增加或不变为正极
1、下列四个装置中,导线中的电子由左边一极流向右边一极的是( )
稀H2SO4
Zn
Zn
(A)
稀H2SO4
Cu
Zn
(B)
稀H2SO4
Zn
C
(C)
C
如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组( )
A、A是锌,B是铜,C为稀H2SO4
B、A是铜,B是锌,C为稀硫酸
C、A是铁,B是银,C为AgNO3溶液
D、A是Ag,B是铁,C为AgNO3溶液
A
C
A
B
D
请判断下列原电池的正负极情况和
电流方向
硫酸铜
Zn
Fe
A
硫酸铜
Zn
C
A
Fe
C
A
硫酸铜
-
+
-
+
-
+
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y是电池的负极。X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>X
C
因为X置换出Z,所以金属性X>Z
负极的金属较活泼,所以Y>X
下 页
上 页
首 页
小 结
结 束
把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
B
1、原电池:
把化学能转化为电能的装置
2、原电池原理
原电池
负极(较活泼金属)
正极(较不活泼金属或非金属导体)
3、判断原电池正、负极的方法
较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过导线流向较不活泼的金属(正极)
1、由组成原电池的两极材料判断;
2、根据电流方向或电子流动方向判断;
3、根据原电池两极发生的变化来判断;
4、电极反应现象.
活负惰正
Cu—Cu与稀硫酸进行实验.
Zn—石墨与稀硫酸进行实验.
Fe—Al与稀硫酸进行实验.
Cu—Zn与乙醇进行实验.
Cu—Zn与一个西红柿(或一个苹果)进行实验.
Cu—石墨与稀硫酸进行实验.
要注意指针的偏转方向,判断正负极
原电池设计思路:
1.能自发进行的氧化还原反应
2.通常须两个活性不同的电极
3.电解质溶液
4.还原剂在负极失电子,发生氧化反应,氧化剂在正极得电子,发生还原反应.
Fe
比Fe不活泼的金属或石墨
CuSO4 、CuCl2等
负极:
正极:
电解质溶液:
思 考 题
请根据反应:Fe+Cu2+=Fe2++Cu
设计原电池,你有哪些可行方案
Cu2+溶液
思 考 题
请根据反应2Fe3++Fe=3Fe2+
设计原电池,你有哪些可行方案
Fe-Cu FeCl3
Fe-C Fe(NO3)3
Fe-Ag Fe(SO4)3
通过上述实验设计,试说明化学电池由几部分构成,它的组成条件是什么?
【思考与交流】
Zn
二.构成原电池的条件:
1、自发进行的氧化还原反应
2、有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。
(一般负极与电解质发生氧化还原反应)
3、两极材料均插入电解质溶液中。
4、两极相连形成闭合回路。
1、下列四个装置中,导线中的电子由左边一极流向右边一极的是( )
稀H2SO4
Zn
Zn
(A)
稀H2SO4
Cu
Zn
(B)
稀H2SO4
Zn
C
(C)
C
如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组( )
A、A是锌,B是铜,C为稀H2SO4
B、A是铜,B是锌,C为稀硫酸
C、A是铁,B是银,C为AgNO3溶液
D、A是Ag,B是铁,C为AgNO3溶液
A
C
A
B
D
请判断下列原电池的正负极情况和
电流方向
硫酸铜
Zn
Fe
A
硫酸铜
Zn
C
A
Fe
C
A
硫酸铜
-
+
-
+
-
+
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y是电池的负极。X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>X
C
因为X置换出Z,所以金属性X>Z
负极的金属较活泼,所以Y>X
把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
B
1.下列装置中能组成原电池形成电流的是( )
C
Zn
Cu
H2SO4
A
Zn
Cu
CuSO4
A
Zn
Cu
酒精
A B
Zn
H2SO4
A
Cu
H2SO4
C D
没有形成闭合回路
酒精不是电解质
没有形成闭合回路
你知道了吗?
哈哈!化学也能解决医学问题?
请同学们根据原电池的原理,指出下列原电池的正极与负极分别是什么?写出电极反应式和总反应方程式。
相同条件下,纯锌粒和粗锌粒与同浓度的稀硫酸反应的速率一样吗?为什么?假如要求你设计实验来证明你的观点,你的实验方案是怎样的?证据和结论又是什么?
