高中化学苏教版(2019)必修第一册 专题1物质的分类及计量 阶段重点突破练(一)(30张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)必修第一册 专题1物质的分类及计量 阶段重点突破练(一)(30张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 570.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-16 00:00:00 | ||
图片预览









文档简介
阶段重点突破练(一)
解析 根据表中信息可判断①中存放的是碱,②中存放的是酸,③中存放的是氧化物,④中存放的是盐。氧化钙属于氧化物,应放在③中;纯碱是碳酸钠,属于盐,应放在④中,故选D。
17
一、物质及其反应的分类
1.某校实验室将试剂分类后放在不同的试剂柜里,已存放的部分试剂如下:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
试剂柜号
①
②
③
④
试剂
NaOH、Ca(OH)2
盐酸、硫酸
MnO2、CuO
NaCl、Na2SO4
该实验室新购进部分氧化钙和纯碱,应将它们分别放在
A.③和① B.④和① C.①和② D.③和④
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
2.下列图示错误的是
√
解析 化合物、盐、钠盐是包含关系。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
3.(不定项)(2019·石家庄高一检测)硝酸钾是一种无氯氮钾复合肥,宜在种植水果、蔬菜、花卉时使用。关于KNO3的说法中,不正确的是
A.从其阳离子看,属于钾盐
B.从其阴离子看,属于硝酸盐
C.它属于纯净物中的无机化合物
D.因为含有氧元素,故它属于氧化物
√
解析 氧化物必须是只含有两种元素,且其中一种是氧元素。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
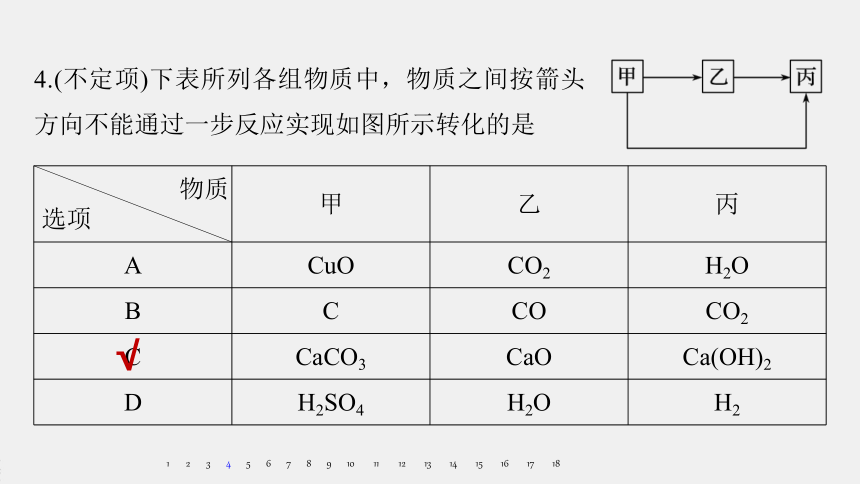
4.(不定项)下表所列各组物质中,物质之间按箭头方向不能通过一步反应实现如图所示转化的是
物质
选项
甲
乙
丙
A
CuO
CO2
H2O
B
C
CO
CO2
C
CaCO3
CaO
Ca(OH)2
D
H2SO4
H2O
H2
√
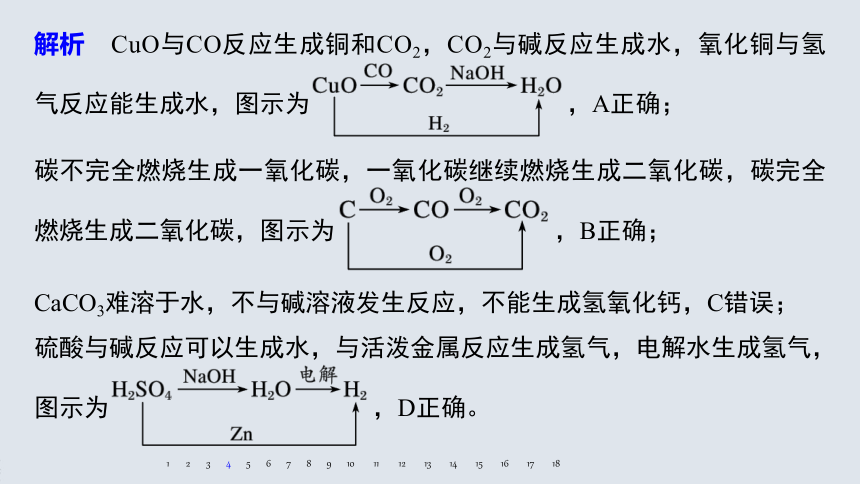
硫酸与碱反应可以生成水,与活泼金属反应生成氢气,电解水生成氢气,图示为 ,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析 CuO与CO反应生成铜和CO2,CO2与碱反应生成水,氧化铜与氢气反应能生成水,图示为 ,A正确;
碳不完全燃烧生成一氧化碳,一氧化碳继续燃烧生成二氧化碳,碳完全燃烧生成二氧化碳,图示为 ,B正确;
CaCO3难溶于水,不与碱溶液发生反应,不能生成氢氧化钙,C错误;
5.下列反应中属于氧化还原反应的是
①H2+Cl2 2HCl
②Al2O3+6HCl===2AlCl3+3H2O
③2HgO 2Hg+O2↑
④CuO+2HNO3===Cu(NO3)2+H2O
⑤MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
A.②④ B.①③④
C.①②③ D.①③⑤
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
6.(2020·承德一中高一期中)下列关于氧化物的叙述正确的是
A.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B.碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物
C.碱性氧化物都能与水化合生成碱
D.酸性氧化物都能与水化合生成酸
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析 金属氧化物可以是碱性氧化物、酸性氧化物或两性氧化物,如:Mn2O7是酸性氧化物,Al2O3是两性氧化物;非金属氧化物可以是不成盐氧化物,如CO属于非金属氧化物但不属于酸性氧化物,故A错误;
碱性氧化物一定是金属氧化物,酸性氧化物可以是金属氧化物,如:Mn2O7是酸性氧化物,故B正确;
碱性氧化物不一定都和水反应生成碱,如Fe2O3是碱性氧化物但不与水反应,故C错误;
酸性氧化物不一定都与水反应生成相应的酸,如SiO2不溶于水,但二氧化硅是酸性氧化物,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
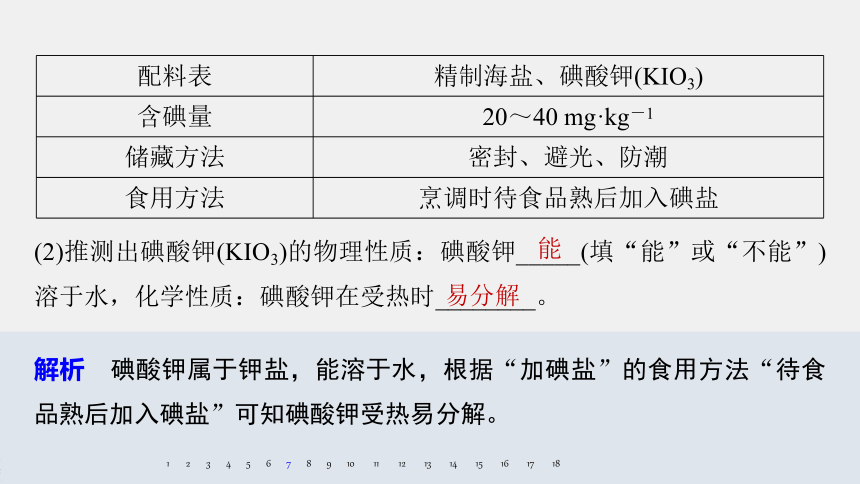
7.下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。
配料表
精制海盐、碘酸钾(KIO3)
含碘量
20~40 mg·kg-1
储藏方法
密封、避光、防潮
食用方法
烹调时待食品熟后加入碘盐
请根据此表,结合中学学过的化学知识,回答下列问题:
(1)据物质分类中的树状分类法的有关知识,在①HIO3、②NaIO3、③KOH、④I2O5、⑤NaCl五种________(填“混合物”“化合物”“盐”或“氧化物”)中,与碘酸钾(KIO3)属于同类物质的是______(填序号)。
化合物
②⑤
解析 五种物质均属于化合物。碘酸钾属于盐,其中属于盐的有②和⑤。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
(2)推测出碘酸钾(KIO3)的物理性质:碘酸钾_____(填“能”或“不能”)溶于水,化学性质:碘酸钾在受热时________。
能
易分解
解析 碘酸钾属于钾盐,能溶于水,根据“加碘盐”的食用方法“待食品熟后加入碘盐”可知碘酸钾受热易分解。
配料表
精制海盐、碘酸钾(KIO3)
含碘量
20~40 mg·kg-1
储藏方法
密封、避光、防潮
食用方法
烹调时待食品熟后加入碘盐
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
二、物质的量的相关概念与定律
8.已知硫酸中含有3.01×1023个氧原子,硫酸的物质的量是
A.0.500 mol B.1.00 mol
C.0.250 mol D.0.125 mol
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
9.(不定项)下列有关摩尔质量的描述或应用正确的是
A.1 mol OH-的质量为17 g
B.二氧化碳的摩尔质量为44 g
C.铁原子的摩尔质量等于它的相对原子质量
D.一个钠原子的质量等于
√
解析 B项,单位应为“g·mol-1”;
C项,没有指出以“g·mol-1”为单位,也没有指出在数值上相等。
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
10.下列说法中不正确的是
A.6.02×1023个钠离子的物质的量为1 mol
B.1 mol氧含6.02×1023个氧分子
C.1 mol 氯化钙里含3 mol离子
D.1 mol H+中含有的氢离子数为NA
√
解析 用摩尔表示物质的量时,要指明微粒的种类。“1 mol氧”没有指明是氧分子还是氧原子。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
11.计算填空:
(1)0.5 mol的Fe含___________个铁原子(用6.02×1023mol-1表示阿伏加德罗常数),质量是____g。
3.01×1023
28
解析 0.5 mol的Fe含有Fe原子数目N=0.5 mol×6.02×1023mol-1=3.01×1023,其质量m=0.5 mol×56 g·mol-1=28 g。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
(2)2 mol CO2中含___mol碳原子_____个氧原子(用NA表示阿伏加德罗常数的值),_____个质子(用NA表示阿伏加德罗常数的值),质量是____g。
2
4NA
44NA
88
解析 每个CO2分子中含有1个C原子、2个O原子,则n(C)=n(CO2)=2 mol,n(O)=2n(CO2)=4 mol,故含有氧原子的数目为4 mol×NA mol-1=4NA,1个CO2分子含有的质子数目为6+8×2=22,2 mol CO2中含44NA个质子,质量为2 mol×44 g·mol-1=88 g。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
(3)已知0.4 mol的CO和CO2的混合气体共14.4 g,则
①CO的质量为______;
解析 设混合气体中CO的物质的量为x mol,CO2的物质的量为y mol,则28 g·mol-1×x mol+44 g·mol-1×y mol=14.4 g,x mol+y mol=0.4 mol,解得x=0.2,y=0.2,则m(CO)=0.2 mol×28 g·mol-1=5.6 g;
②混合气体的平均摩尔质量为___________。
5.6 g
36 g·mol-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
三、物质的分散系
12.(不定项)我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9 m)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列说法中正确的是
A.其分子直径比氯离子小
B.在水中形成的分散系属于悬浊液
C.在水中形成的分散系具有丁达尔效应
D.“钴酞菁”分子能透过滤纸
√
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析 分散质“钴酞菁”分子的直径(1.3×10-9 m)介于1~100 nm之间(大于氯离子的直径),为胶体粒子,其分散系为胶体,能透过滤纸,具有丁达尔效应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
13.FeCl3溶液、Fe(OH)3胶体、Fe(OH)3悬浊液是三种重要的分散系,下列叙述中错误的是
A.Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9
~10-7 m
B.分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应
C.三种分散系的颜色都相同,且均能与盐酸反应,具有吸附性
D.三种分散系均属于混合物
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析 胶体区别于其他分散系的本质是分散质直径在1~100 nm之间,故A项正确;
丁达尔效应是胶体的性质,而溶液和浊液无丁达尔效应,故B项正确;
FeCl3溶液呈棕黄色,Fe(OH)3胶体呈红褐色,颜色不同,故C项错误;
三种分散系都为混合物,故D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
14.(2020·淄博一中高一调研)春秋季节常出现大雾天气,对于这种现象下列说法正确的是
A.大雾是由于空气中的SO2超标造成的
B.大雾可看作是一种分散剂为水的分散系
C.大雾可看作是一种胶体
D.大雾是由于空气中的粉尘超标造成的
√
解析 雾是由悬浮在大气中的微小液滴构成的气溶胶。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
四、电解质及其电离
15.下列状态的物质,既能导电又属于电解质的是
A.氯化钠固体 B.硫酸钾溶液
C.石墨碳棒 D.熔融氢氧化钾
√
解析 氯化钠固体不能导电,是电解质;
硫酸钾溶液能导电,属于混合物,既不是电解质,也不是非电解质;
石墨碳棒是一种单质,能导电,既不是电解质,也不是非电解质。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
16.下列关于酸、碱、盐的各种说法中正确的是
A.电离出的阳离子有H+的化合物叫酸,电离出OH-的化合物叫碱
B.氯化钠溶液在电流的作用下电离出Na+和Cl-
C.化合物电离时,生成金属阳离子(或铵根离子)和酸根阴离子的是盐
D.NaHSO4可以电离出H+,因此NaHSO4属于酸
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析 电离时生成的阳离子只有H+的化合物称为酸,生成的阴离子只有OH-的化合物称为碱,A项错误;
氯化钠溶于水时,在水分子的作用下能电离出Na+和Cl-,电解质的电离无需外加电流,B项错误;
NaHSO4电离出的阳离子除H+外还有Na+,不属于酸,NaHSO4应属于酸式盐,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
17.(不定项)(2019·湖北普通高中协作体联考)下列说法中正确的是
A.在熔融状态下不能导电的物质都不属于电解质
B.稀盐酸在电流的作用下电离出H+和Cl-而导电
C.液态硫酸,固体NaCl不导电,但属于电解质
D.NaOH溶液的导电能力不一定比氨水的强
√
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析 H2SO4在液态时不能导电,但H2SO4为电解质,A项错误;
HCl不需要在电流的作用下就能电离出H+和Cl-而导电,B项错误;
液态硫酸以分子形式存在,固体NaCl没有自由移动的离子,所以二者均不导电,但是二者溶于水,其水溶液均能导电,所以二者均属于电解质,C项正确;
溶液导电能力主要看溶液中自由移动的离子浓度及离子所带电荷数的多少,与电解质强弱没有必然的联系,因此NaOH溶液的导电能力不一定比氨水的强,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
17
18.(2019·山东淄博高青一中检测)Ⅰ.下列物质中:①铜,②稀硫酸,③氯化氢,④氨气,⑤空气,⑥二氧化碳,⑦金属汞(俗称水银),⑧氯化钾,⑨碳酸钙,⑩氯气。
(1)属于混合物的是_______(填序号)。
②⑤
解析 所给物质中属于混合物的有稀硫酸、空气。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
17
(2)属于电解质的是________(填序号);_____(填“是”或“否”)都属于强电解质。
③⑧⑨
是
解析 属于电解质的是酸、碱和盐,所给物质中有HCl、KCl、CaCO3。
解析 能导电的不一定是电解质,电解质也不一定能导电,故能导电的有铜、稀硫酸、金属汞。
(3)能导电的是________(填序号)。
①②⑦
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
17
Ⅱ.写出下列物质在水溶液中的电离方程式:
(1)Ba(OH)2:________________________;
(2)KHSO4:_________________________;
(3)HNO3:__________________________;
(4)Na2CO3:_________________________;
(5)NaHCO3:________________________。
Ba(OH)2===Ba2++2OH-
解析 根据表中信息可判断①中存放的是碱,②中存放的是酸,③中存放的是氧化物,④中存放的是盐。氧化钙属于氧化物,应放在③中;纯碱是碳酸钠,属于盐,应放在④中,故选D。
17
一、物质及其反应的分类
1.某校实验室将试剂分类后放在不同的试剂柜里,已存放的部分试剂如下:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
试剂柜号
①
②
③
④
试剂
NaOH、Ca(OH)2
盐酸、硫酸
MnO2、CuO
NaCl、Na2SO4
该实验室新购进部分氧化钙和纯碱,应将它们分别放在
A.③和① B.④和① C.①和② D.③和④
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
2.下列图示错误的是
√
解析 化合物、盐、钠盐是包含关系。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
3.(不定项)(2019·石家庄高一检测)硝酸钾是一种无氯氮钾复合肥,宜在种植水果、蔬菜、花卉时使用。关于KNO3的说法中,不正确的是
A.从其阳离子看,属于钾盐
B.从其阴离子看,属于硝酸盐
C.它属于纯净物中的无机化合物
D.因为含有氧元素,故它属于氧化物
√
解析 氧化物必须是只含有两种元素,且其中一种是氧元素。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
4.(不定项)下表所列各组物质中,物质之间按箭头方向不能通过一步反应实现如图所示转化的是
物质
选项
甲
乙
丙
A
CuO
CO2
H2O
B
C
CO
CO2
C
CaCO3
CaO
Ca(OH)2
D
H2SO4
H2O
H2
√
硫酸与碱反应可以生成水,与活泼金属反应生成氢气,电解水生成氢气,图示为 ,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析 CuO与CO反应生成铜和CO2,CO2与碱反应生成水,氧化铜与氢气反应能生成水,图示为 ,A正确;
碳不完全燃烧生成一氧化碳,一氧化碳继续燃烧生成二氧化碳,碳完全燃烧生成二氧化碳,图示为 ,B正确;
CaCO3难溶于水,不与碱溶液发生反应,不能生成氢氧化钙,C错误;
5.下列反应中属于氧化还原反应的是
①H2+Cl2 2HCl
②Al2O3+6HCl===2AlCl3+3H2O
③2HgO 2Hg+O2↑
④CuO+2HNO3===Cu(NO3)2+H2O
⑤MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
A.②④ B.①③④
C.①②③ D.①③⑤
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
6.(2020·承德一中高一期中)下列关于氧化物的叙述正确的是
A.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B.碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物
C.碱性氧化物都能与水化合生成碱
D.酸性氧化物都能与水化合生成酸
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析 金属氧化物可以是碱性氧化物、酸性氧化物或两性氧化物,如:Mn2O7是酸性氧化物,Al2O3是两性氧化物;非金属氧化物可以是不成盐氧化物,如CO属于非金属氧化物但不属于酸性氧化物,故A错误;
碱性氧化物一定是金属氧化物,酸性氧化物可以是金属氧化物,如:Mn2O7是酸性氧化物,故B正确;
碱性氧化物不一定都和水反应生成碱,如Fe2O3是碱性氧化物但不与水反应,故C错误;
酸性氧化物不一定都与水反应生成相应的酸,如SiO2不溶于水,但二氧化硅是酸性氧化物,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
7.下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。
配料表
精制海盐、碘酸钾(KIO3)
含碘量
20~40 mg·kg-1
储藏方法
密封、避光、防潮
食用方法
烹调时待食品熟后加入碘盐
请根据此表,结合中学学过的化学知识,回答下列问题:
(1)据物质分类中的树状分类法的有关知识,在①HIO3、②NaIO3、③KOH、④I2O5、⑤NaCl五种________(填“混合物”“化合物”“盐”或“氧化物”)中,与碘酸钾(KIO3)属于同类物质的是______(填序号)。
化合物
②⑤
解析 五种物质均属于化合物。碘酸钾属于盐,其中属于盐的有②和⑤。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
(2)推测出碘酸钾(KIO3)的物理性质:碘酸钾_____(填“能”或“不能”)溶于水,化学性质:碘酸钾在受热时________。
能
易分解
解析 碘酸钾属于钾盐,能溶于水,根据“加碘盐”的食用方法“待食品熟后加入碘盐”可知碘酸钾受热易分解。
配料表
精制海盐、碘酸钾(KIO3)
含碘量
20~40 mg·kg-1
储藏方法
密封、避光、防潮
食用方法
烹调时待食品熟后加入碘盐
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
二、物质的量的相关概念与定律
8.已知硫酸中含有3.01×1023个氧原子,硫酸的物质的量是
A.0.500 mol B.1.00 mol
C.0.250 mol D.0.125 mol
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
9.(不定项)下列有关摩尔质量的描述或应用正确的是
A.1 mol OH-的质量为17 g
B.二氧化碳的摩尔质量为44 g
C.铁原子的摩尔质量等于它的相对原子质量
D.一个钠原子的质量等于
√
解析 B项,单位应为“g·mol-1”;
C项,没有指出以“g·mol-1”为单位,也没有指出在数值上相等。
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
10.下列说法中不正确的是
A.6.02×1023个钠离子的物质的量为1 mol
B.1 mol氧含6.02×1023个氧分子
C.1 mol 氯化钙里含3 mol离子
D.1 mol H+中含有的氢离子数为NA
√
解析 用摩尔表示物质的量时,要指明微粒的种类。“1 mol氧”没有指明是氧分子还是氧原子。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
11.计算填空:
(1)0.5 mol的Fe含___________个铁原子(用6.02×1023mol-1表示阿伏加德罗常数),质量是____g。
3.01×1023
28
解析 0.5 mol的Fe含有Fe原子数目N=0.5 mol×6.02×1023mol-1=3.01×1023,其质量m=0.5 mol×56 g·mol-1=28 g。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
(2)2 mol CO2中含___mol碳原子_____个氧原子(用NA表示阿伏加德罗常数的值),_____个质子(用NA表示阿伏加德罗常数的值),质量是____g。
2
4NA
44NA
88
解析 每个CO2分子中含有1个C原子、2个O原子,则n(C)=n(CO2)=2 mol,n(O)=2n(CO2)=4 mol,故含有氧原子的数目为4 mol×NA mol-1=4NA,1个CO2分子含有的质子数目为6+8×2=22,2 mol CO2中含44NA个质子,质量为2 mol×44 g·mol-1=88 g。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
(3)已知0.4 mol的CO和CO2的混合气体共14.4 g,则
①CO的质量为______;
解析 设混合气体中CO的物质的量为x mol,CO2的物质的量为y mol,则28 g·mol-1×x mol+44 g·mol-1×y mol=14.4 g,x mol+y mol=0.4 mol,解得x=0.2,y=0.2,则m(CO)=0.2 mol×28 g·mol-1=5.6 g;
②混合气体的平均摩尔质量为___________。
5.6 g
36 g·mol-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
三、物质的分散系
12.(不定项)我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9 m)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列说法中正确的是
A.其分子直径比氯离子小
B.在水中形成的分散系属于悬浊液
C.在水中形成的分散系具有丁达尔效应
D.“钴酞菁”分子能透过滤纸
√
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析 分散质“钴酞菁”分子的直径(1.3×10-9 m)介于1~100 nm之间(大于氯离子的直径),为胶体粒子,其分散系为胶体,能透过滤纸,具有丁达尔效应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
13.FeCl3溶液、Fe(OH)3胶体、Fe(OH)3悬浊液是三种重要的分散系,下列叙述中错误的是
A.Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9
~10-7 m
B.分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应
C.三种分散系的颜色都相同,且均能与盐酸反应,具有吸附性
D.三种分散系均属于混合物
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析 胶体区别于其他分散系的本质是分散质直径在1~100 nm之间,故A项正确;
丁达尔效应是胶体的性质,而溶液和浊液无丁达尔效应,故B项正确;
FeCl3溶液呈棕黄色,Fe(OH)3胶体呈红褐色,颜色不同,故C项错误;
三种分散系都为混合物,故D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
14.(2020·淄博一中高一调研)春秋季节常出现大雾天气,对于这种现象下列说法正确的是
A.大雾是由于空气中的SO2超标造成的
B.大雾可看作是一种分散剂为水的分散系
C.大雾可看作是一种胶体
D.大雾是由于空气中的粉尘超标造成的
√
解析 雾是由悬浮在大气中的微小液滴构成的气溶胶。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
四、电解质及其电离
15.下列状态的物质,既能导电又属于电解质的是
A.氯化钠固体 B.硫酸钾溶液
C.石墨碳棒 D.熔融氢氧化钾
√
解析 氯化钠固体不能导电,是电解质;
硫酸钾溶液能导电,属于混合物,既不是电解质,也不是非电解质;
石墨碳棒是一种单质,能导电,既不是电解质,也不是非电解质。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
16.下列关于酸、碱、盐的各种说法中正确的是
A.电离出的阳离子有H+的化合物叫酸,电离出OH-的化合物叫碱
B.氯化钠溶液在电流的作用下电离出Na+和Cl-
C.化合物电离时,生成金属阳离子(或铵根离子)和酸根阴离子的是盐
D.NaHSO4可以电离出H+,因此NaHSO4属于酸
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析 电离时生成的阳离子只有H+的化合物称为酸,生成的阴离子只有OH-的化合物称为碱,A项错误;
氯化钠溶于水时,在水分子的作用下能电离出Na+和Cl-,电解质的电离无需外加电流,B项错误;
NaHSO4电离出的阳离子除H+外还有Na+,不属于酸,NaHSO4应属于酸式盐,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
17.(不定项)(2019·湖北普通高中协作体联考)下列说法中正确的是
A.在熔融状态下不能导电的物质都不属于电解质
B.稀盐酸在电流的作用下电离出H+和Cl-而导电
C.液态硫酸,固体NaCl不导电,但属于电解质
D.NaOH溶液的导电能力不一定比氨水的强
√
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
解析 H2SO4在液态时不能导电,但H2SO4为电解质,A项错误;
HCl不需要在电流的作用下就能电离出H+和Cl-而导电,B项错误;
液态硫酸以分子形式存在,固体NaCl没有自由移动的离子,所以二者均不导电,但是二者溶于水,其水溶液均能导电,所以二者均属于电解质,C项正确;
溶液导电能力主要看溶液中自由移动的离子浓度及离子所带电荷数的多少,与电解质强弱没有必然的联系,因此NaOH溶液的导电能力不一定比氨水的强,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
17
18.(2019·山东淄博高青一中检测)Ⅰ.下列物质中:①铜,②稀硫酸,③氯化氢,④氨气,⑤空气,⑥二氧化碳,⑦金属汞(俗称水银),⑧氯化钾,⑨碳酸钙,⑩氯气。
(1)属于混合物的是_______(填序号)。
②⑤
解析 所给物质中属于混合物的有稀硫酸、空气。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
17
(2)属于电解质的是________(填序号);_____(填“是”或“否”)都属于强电解质。
③⑧⑨
是
解析 属于电解质的是酸、碱和盐,所给物质中有HCl、KCl、CaCO3。
解析 能导电的不一定是电解质,电解质也不一定能导电,故能导电的有铜、稀硫酸、金属汞。
(3)能导电的是________(填序号)。
①②⑦
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
18
17
Ⅱ.写出下列物质在水溶液中的电离方程式:
(1)Ba(OH)2:________________________;
(2)KHSO4:_________________________;
(3)HNO3:__________________________;
(4)Na2CO3:_________________________;
(5)NaHCO3:________________________。
Ba(OH)2===Ba2++2OH-
