高中化学人教版(2019)必修第一册1.3 氧化还原反应(教学课件)-(20张PPT)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册1.3 氧化还原反应(教学课件)-(20张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-16 16:53:35 | ||
图片预览







文档简介
第一章 物质及其变化
第三节 氧化还原反应
氧化还原反应
氧化剂和还原剂
目 录
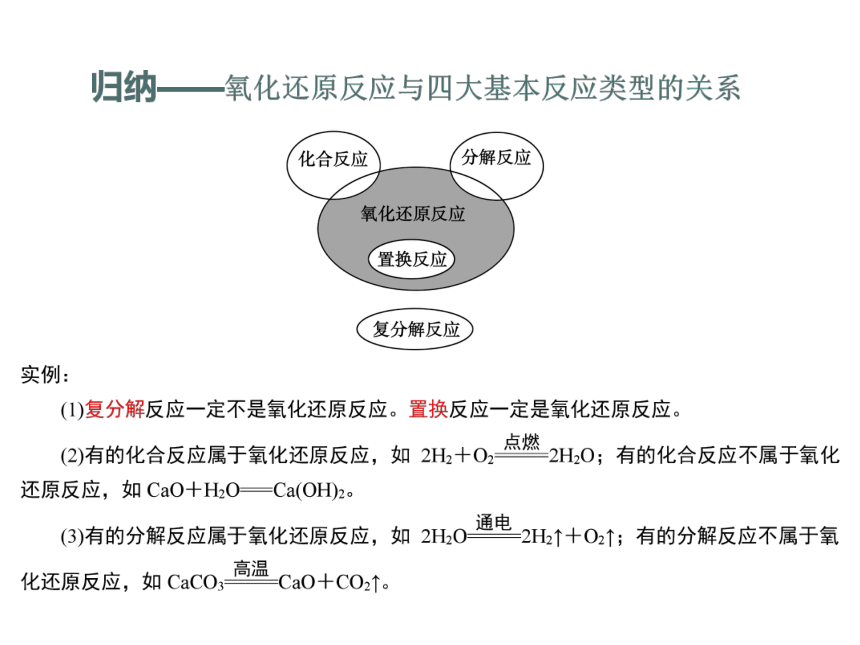
初中阶段我们学习过许多化学反应,根据反应物和生成物的类别以及反应前后物质的种类的多少可以把他们分为四个基本反应类型,但是有一些反应,比如 Fe2O3 + 3CO =2Fe +3CO2 ,它属于以上的四个反应吗?
经过分析,它不属于四个基本反应类型的任何一个,说明上述分类方法不能包括所有反应,所以我们需要制定一个新的分类方法。
得到氧
失去氧
氧化
还原
H2
H2O
CuO
Cu
失去
得到
(2)从得氧失氧的角度分析氧化反应、还原反应。
①氧化反应——________氧的化学反应。
②还原反应——________氧的化学反应。
(3)结论:氧化还原反应——有__________的化学反应。
得到
失去
得失氧
2.从化合价升降的角度认识:
(1)化合价变化分析。
升高
降低
(2)从化合价升降的角度分析氧化反应、还原反应。
①氧化反应——化合价________的化学反应。
②还原反应——化合价________的化学反应。
(3)结论:氧化还原反应——有__________________的化学反应。
升高
降低
元素化合价变化
3.从电子转移的角度认识:
得到
失去
偏离
偏向
偏离
偏向
电子转移(得失或偏移)
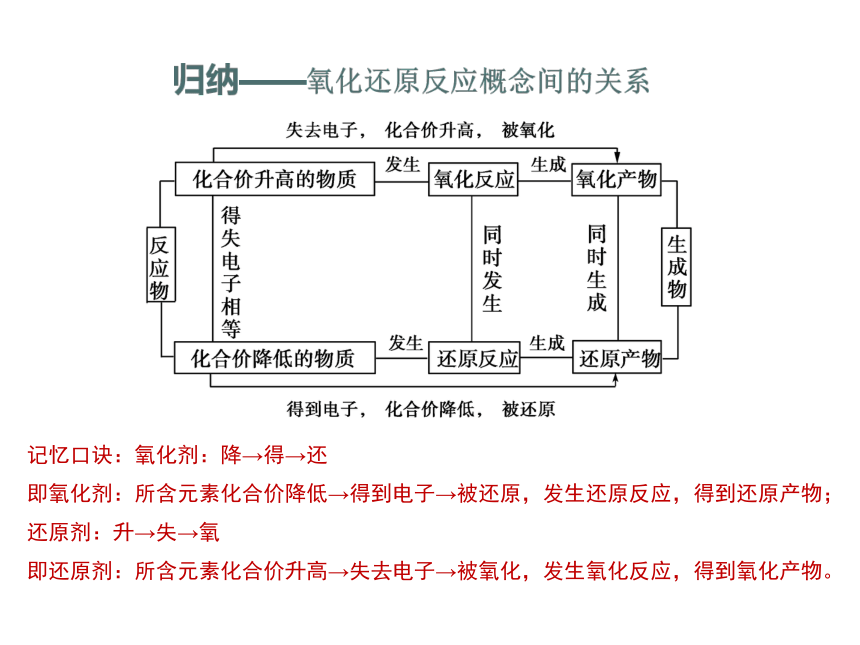
【总结】氧化还原反应
(1)特征:化合价的升降
(2)本质:电子的转移或偏移
记忆口诀:氧化剂:降→得→还
即氧化剂:所含元素化合价降低→得到电子→被还原,发生还原反应,得到还原产物;
还原剂:升→失→氧
即还原剂:所含元素化合价升高→失去电子→被氧化,发生氧化反应,得到氧化产物。
拓展——氧化还原反应中的几个“不一定”
二、氧化还原反应中电子转移方向和数目的表示方法
1.双线桥法
(1)基本步骤
(2)示例。
用双线桥法表示氢气还原氧化铜的电子转移情况:
如
(3)注意事项。
①箭头、箭尾必须对应化合价变化的同种元素。
②必须注明“得”“失”。
③氧化剂和还原剂得、失电子数目要相等。
2.单线桥法
(1)基本步骤
(2)举例:用单线桥法表示铁与盐酸反应的电子转移情况:
如
(3)注意事项。
①单线桥表示反应物中变价元素原子得失电子的情况;
②不需标明“得”或“失”,只标明电子转移总数目;
③箭头标明电子转移的方向;
④单线桥箭头从失电子的元素原子指向得电子的元素原子。
一、氧化剂和还原剂
1.相关概念:
(1)氧化剂:是_________(或电子对偏向)的反应物,具有_________。
(2)还原剂:是_________(或电子对偏离)的反应物,具有_________。
得电子
氧化性
氧化性
氧化性
氧化性
失电子
还原性
2.相应关系:
得
降低
失
升高
二、常见的氧化剂和还原剂
物质种类
常见物质
氧化剂
部分非金属单质
______、Cl2等
含有高价态元素的化合物
__________、__________、____________、FeCl3等
还原剂
活泼的金属单质
Al、Zn、Fe等
某些非金属单质
______、______等
某些非金属氧化物
________、SO2等
O2
浓硫酸
HNO3
KMnO4
C
H2
CO
三、物质氧化性、还原性强弱的比较
1.根据氧化还原反应方程式判断:
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成较弱还原性的还原产物和较弱氧化性的氧化产物。
氧化剂+还原剂=还原被还原产物+氧化被氧化产物
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
特点:比什么性,找什么剂,产物之性小于剂。
2.根据金属、非金属活动性顺序判断:
特点:上左下右可反应,隔之越远越易反应。
即根据活动性顺序,处于上行左侧的单质与下行右侧的离子可以发生反应,且间隔越大越容易反应。
(1)高低规律:最高价态只有氧化性,最低价态只有还原性,中间价态既有氧化性又有还原性。
(2)“价态归中,互不交叉”规律:同种元素不同价态之间发生氧化还原反应时可总结为:价态相邻能共存,价态相间能归中,归中价态不交叉,价升价降只靠拢。
“价态归中,互不交叉”的三种情况:
感谢观看
Thank you for watching
第三节 氧化还原反应
氧化还原反应
氧化剂和还原剂
目 录
初中阶段我们学习过许多化学反应,根据反应物和生成物的类别以及反应前后物质的种类的多少可以把他们分为四个基本反应类型,但是有一些反应,比如 Fe2O3 + 3CO =2Fe +3CO2 ,它属于以上的四个反应吗?
经过分析,它不属于四个基本反应类型的任何一个,说明上述分类方法不能包括所有反应,所以我们需要制定一个新的分类方法。
得到氧
失去氧
氧化
还原
H2
H2O
CuO
Cu
失去
得到
(2)从得氧失氧的角度分析氧化反应、还原反应。
①氧化反应——________氧的化学反应。
②还原反应——________氧的化学反应。
(3)结论:氧化还原反应——有__________的化学反应。
得到
失去
得失氧
2.从化合价升降的角度认识:
(1)化合价变化分析。
升高
降低
(2)从化合价升降的角度分析氧化反应、还原反应。
①氧化反应——化合价________的化学反应。
②还原反应——化合价________的化学反应。
(3)结论:氧化还原反应——有__________________的化学反应。
升高
降低
元素化合价变化
3.从电子转移的角度认识:
得到
失去
偏离
偏向
偏离
偏向
电子转移(得失或偏移)
【总结】氧化还原反应
(1)特征:化合价的升降
(2)本质:电子的转移或偏移
记忆口诀:氧化剂:降→得→还
即氧化剂:所含元素化合价降低→得到电子→被还原,发生还原反应,得到还原产物;
还原剂:升→失→氧
即还原剂:所含元素化合价升高→失去电子→被氧化,发生氧化反应,得到氧化产物。
拓展——氧化还原反应中的几个“不一定”
二、氧化还原反应中电子转移方向和数目的表示方法
1.双线桥法
(1)基本步骤
(2)示例。
用双线桥法表示氢气还原氧化铜的电子转移情况:
如
(3)注意事项。
①箭头、箭尾必须对应化合价变化的同种元素。
②必须注明“得”“失”。
③氧化剂和还原剂得、失电子数目要相等。
2.单线桥法
(1)基本步骤
(2)举例:用单线桥法表示铁与盐酸反应的电子转移情况:
如
(3)注意事项。
①单线桥表示反应物中变价元素原子得失电子的情况;
②不需标明“得”或“失”,只标明电子转移总数目;
③箭头标明电子转移的方向;
④单线桥箭头从失电子的元素原子指向得电子的元素原子。
一、氧化剂和还原剂
1.相关概念:
(1)氧化剂:是_________(或电子对偏向)的反应物,具有_________。
(2)还原剂:是_________(或电子对偏离)的反应物,具有_________。
得电子
氧化性
氧化性
氧化性
氧化性
失电子
还原性
2.相应关系:
得
降低
失
升高
二、常见的氧化剂和还原剂
物质种类
常见物质
氧化剂
部分非金属单质
______、Cl2等
含有高价态元素的化合物
__________、__________、____________、FeCl3等
还原剂
活泼的金属单质
Al、Zn、Fe等
某些非金属单质
______、______等
某些非金属氧化物
________、SO2等
O2
浓硫酸
HNO3
KMnO4
C
H2
CO
三、物质氧化性、还原性强弱的比较
1.根据氧化还原反应方程式判断:
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成较弱还原性的还原产物和较弱氧化性的氧化产物。
氧化剂+还原剂=还原被还原产物+氧化被氧化产物
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
特点:比什么性,找什么剂,产物之性小于剂。
2.根据金属、非金属活动性顺序判断:
特点:上左下右可反应,隔之越远越易反应。
即根据活动性顺序,处于上行左侧的单质与下行右侧的离子可以发生反应,且间隔越大越容易反应。
(1)高低规律:最高价态只有氧化性,最低价态只有还原性,中间价态既有氧化性又有还原性。
(2)“价态归中,互不交叉”规律:同种元素不同价态之间发生氧化还原反应时可总结为:价态相邻能共存,价态相间能归中,归中价态不交叉,价升价降只靠拢。
“价态归中,互不交叉”的三种情况:
感谢观看
Thank you for watching
