高中化学苏教版(2019)必修第一册 专题2 第二单元 第2课时 物质的量浓度的有关计算(70张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)必修第一册 专题2 第二单元 第2课时 物质的量浓度的有关计算(70张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-16 17:42:45 | ||
图片预览










文档简介
第2课时 物质的量浓度的有关计算
1.能从宏观和微观的角度理解微观粒子间的关系。
2.建立n、M、Vm、c之间相互转化关系及进行简单计算的思维模型。
核心素养发展目标
一、溶质物质的量浓度的基本计算
四、化学反应的计算
随堂演练 知识落实
二、溶液的稀释或混合
内
容
索
引
三、物质的量浓度与溶质的质量分数的换算
课时对点练
一、溶质物质的量浓度的基本计算
1.根据定义式计算溶质的物质的量浓度
根据概念表达式cB= ,欲求cB,先求nB和V。
计算溶质的物质的量浓度的关键是从已知条件中找出溶质的物质的量(n)和溶液的体积(V),据此求出溶质的物质的量浓度cB。
例1 已知V L硫酸铁溶液中含Fe3+m g,则该溶液中Fe3+的物质的量浓度
为_____mol·L-1, 的物质的量浓度为______mol·L-1,溶质的物质的
量浓度为_____mol·L-1。
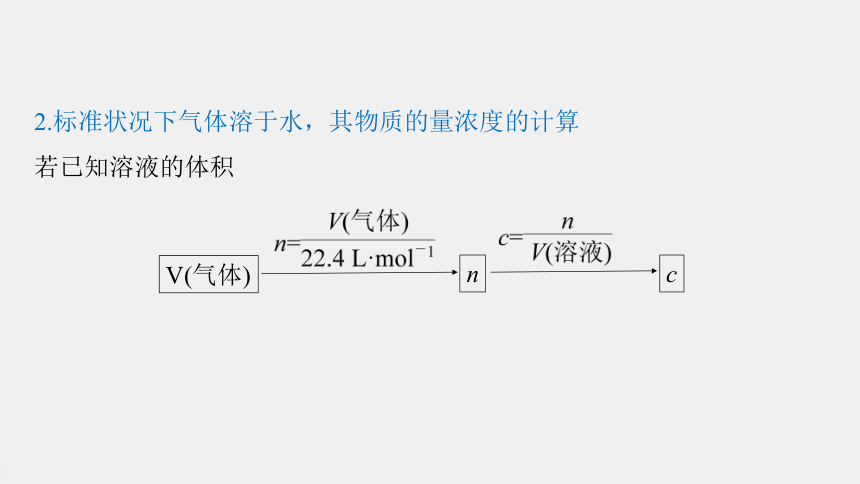
2.标准状况下气体溶于水,其物质的量浓度的计算
若已知溶液的体积
V(气体)
n
c
例2 用1 L水吸收560 L氨气(标准状况),所得氨水的密度是0.90 g·mL-1,求:
(1)氨气的物质的量是_______。
(2)所得氨水的物质的量浓度是_____________。
25 mol
15.79 mol·L-1
1.游泳池里的水一般常加适量的硫酸铜,用以杀灭其中的细菌,而对游泳者的身体无害。现取一水样300 mL,经分析其中含有0.019 2 g Cu2+,则水样中硫酸铜的物质的量浓度为______mol·L-1。
应用体验
0.001
2.在标准状况下的a L 氯化氢气体溶于1 000 g水中,得到的盐酸密度为b g·cm-3,则该盐酸中溶质的物质的量浓度是
√
返回
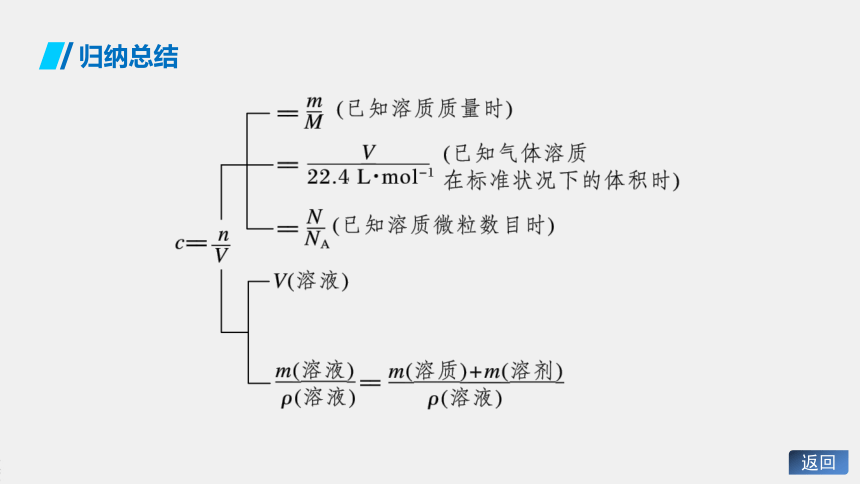
归纳总结
二、溶液的稀释或混合
1.浓溶液稀释
(1)溶质的质量在稀释前后保持不变,即m1w1=m2w2。
(2)溶质的物质的量在稀释前后保持不变,即c1V1=c2V2。
(3)溶液质量守恒,m(稀)=m(浓)+m(水)。
例3 从1 L 1 mol·L-1NaOH溶液中取出100 mL。
(1)取出的这100 mL NaOH溶液的物质的量浓度是_________,含NaOH的质量是______。
1 mol·L-1
4.0 g
解析 m=0.1 L×1 mol·L-1×40 g·mol-1=4.0 g。
(2)若将取出的这100 mL NaOH溶液加水稀释至500 mL,所得溶液中溶质的物质的量浓度是___________。
0.2 mol·L-1
解析 100 mL 氢氧化钠溶液加水稀释至500 mL,氢氧化钠的物质的量不变,由c(浓)·V(浓)=c(稀)·V(稀)可知c(稀)=
=0.2 mol·L-1。
2.相同溶质的两溶液混合
(1)溶质的物质的量不变
c1V1+c2V2=c(混)·V(混);
(2)溶质的质量不变
m1w1+m2w2=m(混)·w(混)。
例4 将0.10 mol·L-1氢氧化钠溶液和0.60 mol·L-1氢氧化钠溶液混合成0.20 mol·L-1的氢氧化钠溶液。求两种溶液的体积比(忽略混合时溶液体积变化)为_____。
4∶1
解析 本题有以下两种解法。
方法1(根据混合前后溶质的物质的量不变,列式求解):设所需0.10 mol·L-1的氢氧化钠溶液和所需0.60 mol·L-1的氢氧化钠溶液的体积分别是V1和V2,根据混合前后溶质的物质的量不变列式得:0.10 mol·L-1·V1+0.60 mol·L-1
·V2=0.20 mol·L-1·(V1+V2),解得: 。
方法2(十字交叉法):
(1)同一溶质、不同浓度的溶液混合,在混合前后溶质的质量、物质的量保持守恒,溶液的质量保持守恒,但溶液的体积一般不守恒。
(2)混合后溶液的体积:①若指出不考虑溶液体积改变,可认为是原溶液的体积之和;
归纳总结
②若给出混合后溶液的密度,应根据V(混)= 来计算。
3.将10 mL 5 mol·L-1盐酸稀释到200 mL,再取出5 mL,这5 mL溶液中溶质的物质的量浓度是
A.0.05 mol·L-1 B.0.25 mol·L-1
C.0.1 mol·L-1 D.0.5 mol·L-1
应用体验
解析 根据稀释定律,c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液):5 mol·L-1×10 mL=c(稀溶液)×200 mL,解得c(稀溶液)=0.25 mol·L-1,从中取出5 mL溶液,其浓度不变。
√
4.将100 mL 0.1 mol·L-1的氯化钡溶液与50 mL 0.2 mol·L-1的氯化钠溶液混合,若不考虑溶液混合时体积的变化,则混合溶液中氯离子浓度是
A.0.2 mol·L-1 B.0.01 mol·L-1
C.0.1 mol·L-1 D.0.02 mol·L-1
解析 混合前后溶质的物质的量不变,混合溶液中氯离子浓度为(100 mL
×2×0.1 mol·L-1+50 mL×0.2 mol·L-1)÷(100 mL+50 mL)=0.2 mol·L-1。
√
返回
三、物质的量浓度与溶质的质量分数的换算
换算公式
M:溶质B的摩尔质量(单位:g·mol-1);ρ:溶液密度(单位:g·mL-1);w:溶质的质量分数。
[问题探究]
已知某溶液的密度为ρ g·mL-1。溶质的质量分数为w,溶液中溶质的摩尔质量为M g·mol-1,求物质的量浓度c。
推导过程:设溶液的体积为V mL,
则溶液的质量m(溶液)=____ g;
溶液中溶质的质量m(溶质)=______g;
ρV
ρVw
溶质的物质的量n(溶质)=______ mol;
溶质的物质的量浓度c=_______ mol·L-1。
5.已知某饱和NaCl溶液的体积为V mL,密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,溶液中NaCl的质量为m g。
应用体验
(1)用m、V表示溶液中溶质的物质的量浓度:____________;
(2)用w、ρ表示溶液中溶质的物质的量浓度:____________;
(3)用c、ρ表示溶液中溶质的质量分数:______________;
(4)用w表示该温度下NaCl的溶解度:__________。
6.市售浓硫酸中溶质的质量分数为98%,密度为1.84 g·cm-3。计算市售浓硫酸中硫酸的物质的量浓度为____________。
18.4 mol·L-1
物质的量浓度与溶质的质量分数之间求算题目的解题思路一般有两个出发点:
归纳总结
(1)由“定义式”出发:物质的量浓度定义的表达式为c= ,由此知,欲求c,先求n及V。
(2)由“变换式”出发:已知质量分数w和溶液密度ρ(或质量与体积),由换算公式c= 计算c。
返回
四、化学反应的计算
aA(g) + bB(g) === cC(g) + dD(g)
化学计
量数比: a ∶ b ∶ c ∶ d
物质的量比:a ∶ b ∶ c ∶ d
气体体积比:a ∶ b ∶ c ∶ d
例5 将1.15 g钠置于足量的水中,充分反应后,生成的NaOH的物质的量是多少?生成的气体在标准状况下占多大体积?已知Na与H2O发生反应:2Na+2H2O===2NaOH+H2↑。
答案 生成0.05 mol NaOH、0.56 L H2
解析 n(Na)= =0.05 mol,
2Na+2H2O===2NaOH+H2↑
2 2 1
0.05 mol n(NaOH) n(H2)
2∶2=0.05 mol∶n(NaOH),
n(NaOH)=0.05 mol;
2∶1=0.05 mol∶n(H2),
n(H2)=0.025 mol,
V(H2)=0.025 mol×22.4 L·mol-1=0.56 L。
物质的量应用于化学方程式计算的解题模型
思维建模
(1)建模依据
化学方程式:H2+Cl2 2HCl
①分子数之比为1∶1∶2;②化学计量数之比为1∶1∶2;③扩大NA倍之比为1∶1∶2;④物质的量之比为1∶1∶2;⑤气体体积之比为1∶1∶2。
(2)解题步骤模型
第一步:将题给其他物理量转化为对应物质的物质的量;
第二步:依据化学方程式求出待求物质的物质的量;
第三步:根据题目要求,再将待求物质的物质的量转化为所求的物理量。
7.过氧化钠能与水反应2Na2O2+2H2O===4NaOH+O2↑,某同学欲用该反应制取标准状况下的氧气1.12 L。
(1)计算需要称取过氧化钠的质量。
应用体验
答案 需称取过氧化钠7.8 g。
(2)反应后生成NaOH的物质的量是多少?
答案 反应后生成0.2 mol NaOH。
解析 n(O2)= =0.05 mol,
2Na2O2+2H2O=== 4NaOH + O2↑
2 4 1
n(Na2O2) n(NaOH) 0.05 mol
2∶1=n(Na2O2)∶0.05 mol,
n(Na2O2)=0.1 mol,
m(Na2O2)=0.1 mol×78 g·mol-1=7.8 g;
4∶1=n(NaOH)∶0.05 mol,
n(NaOH)=0.2 mol。
返回
1
2
3
随堂演练 知识落实
4
1.V L K2SO4溶液中,含有K+ m g,则溶液中 的物质的量浓度为
√
5
2.100 mL溶液中溶有0.1 mol HCl和0.1 mol AlCl3,则该溶液中Cl-的物质的量浓度为
A.0.3 mol·L-1 B.0.4 mol·L-1
C.3.0 mol·L-1 D.4.0 mol·L-1
1
2
3
4
解析 溶液中n(Cl-)=n(HCl)+3n(AlCl3)=0.1 mol+3×0.1 mol=0.4 mol,则c(Cl-)= =4.0 mol·L-1。
√
5
3.某市售盐酸的质量分数为36.5%,密度为1.18 g·cm-3,该盐酸中溶质的物质的量浓度是
A.3 mol·L-1 B.8.4 mol·L-1
C.11.8 mol·L-1 D.0.5 mol·L-1
1
2
3
4
√
5
4.(2020·桂林调研)(1)从2 mol·L-1的KAl(SO4)2溶液中取出a mL稀释到
1
2
3
4
b mL,稀释后所得溶液中c( )为___________。
(2)标准状况下,336 L的NH3溶于1 L水中,若该溶液的密度为a g·cm-3,则其物质的量浓度为______________。
11.95a mol·L-1
5
5.今有11.2 g铁与500 mL的盐酸恰好完全反应。
求:(1)在标准状况下,生成氢气的体积是多少升?
1
2
3
4
5
答案 4.48 L
1
2
3
4
5
Fe + 2HCl===FeCl2+H2↑
1 2 1
0.2 mol n(HCl) n(H2)
n(HCl)=0.4 mol,n(H2)=0.2 mol,
V(H2)=0.2 mol×22.4 L·mol-1=4.48 L。
(2)反应前,盐酸的物质的量浓度是多少?
1
2
3
4
5
答案 0.8 mol·L-1
返回
课时对点练
1
2
3
4
5
6
7
8
9
10
题组一 物质的量浓度的基本计算
1.40 g氢氧化钠固体溶于水配成2 L溶液,其物质的量浓度为
A.0.5 mol·L-1 B.5 mol·L-1
C.10 mol·L-1 D.20 mol·L-1
√
A组 基础对点练
11
2.50 mL 0.6 mol·L-1 氢氧化钠溶液含氢氧化钠的质量为
A.1.2 g B.1.6 g
C.2.0 g D.2.4 g
√
1
2
3
4
5
6
7
8
9
10
解析 氢氧化钠的质量为0.05 L×0.6 mol·L-1×40 g·mol-1=1.2 g。
11
3.标准状况下,500体积的氯化氢气体溶于水形成1体积的盐酸,则盐酸中溶质的物质的量浓度是
1
2
3
4
5
6
7
8
9
10
A.500 mol·L-1 B. mol·L-1
C.5 mol·L-1 D.无法计算
√
11
4.下列各溶液中,Na+的物质的量浓度最大的是
A.4 L 0.5 mol·L-1的NaCl溶液
B.1 L 0.3 mol·L-1的Na2SO4溶液
C.0.8 L 0.4 mol·L-1的NaOH溶液
D.2 L 0.15 mol·L-1的Na3PO4溶液
1
2
3
4
5
6
7
8
9
10
√
11
题组二 溶液的稀释与混合计算
5.(2019·南京高一期中)常温下,欲配制密度为1.1 g·cm-3、浓度为6 mol·L-1的稀盐酸,在体积为100 mL、密度为1.19 g·cm-3、浓度为12 mol·L-1的浓盐酸中需加蒸馏水
A.200 mL B.100 mL C.101 mL D.120 mL
√
1
2
3
4
5
6
7
8
9
10
解析 设加水x mL可配制成V mL 6 mol·L-1稀盐酸,则100 mL×12 mol·L-1=6 mol·L-1×V mL,V=200。体积不能直接加和,可利用质量守恒:200 mL×1.1 g·mL-1=100 mL×1.19 g·mL-1+x mL×1 g·mL-1,x=101,即需加蒸馏水101 mL。
11
1
2
3
4
5
6
7
8
9
10
6.(2019·新乡高一期中)硫酸钠和硫酸溶液等体积混合后,H+浓度为0.3 mol·L-1, 浓度为0.4 mol·L-1,则混合溶液中Na+浓度为
A.0.15 mol·L-1 B.0.2 mol·L-1
C.0.25 mol·L-1 D.0.5 mol·L-1
√
解析 设Na+浓度为x,根据电荷守恒可知,0.3 mol·L-1×1+x×1=0.4 mol·L-1×2,解得x=0.5 mol·L-1。
11
7.物质的量浓度相同的氯化钠、氯化镁、氯化铝三种溶液,当溶液的体积比为3∶2∶1时,三种溶液中氯离子的物质的量之比为
A.1∶1∶1 B.1∶2∶3
C.3∶2∶1 D.3∶4∶3
√
1
2
3
4
5
6
7
8
9
10
11
题组三 物质的量浓度、溶质质量分数的相互换算
8.(2020·武汉调研)如图是病人输液用的葡萄糖(分子式为C6H12O6)注射液的标签上的部分内容。据标签所提供的信息,以下说法错误的是
1
2
3
4
5
6
7
8
9
10
5%葡萄糖注射液
500 mL
【性状】本品为无色或几乎为
无色的透明液体
【规格】500 mL 25 g
【贮藏】密封保存
A.该注射液中葡萄糖的质量分数是5%
B.葡萄糖的摩尔质量为180 g·mol-1
C.该注射液的密度约为1 g·cm-3
D.该注射液中葡萄糖的物质的量浓度
约为0.014 mol·L-1
√
11
解析 由标签所提供的信息可知,该注射液中葡萄糖的质量分数为5%,故A正确;
葡萄糖的摩尔质量为180 g·mol-1,故B正确;
1
2
3
4
5
6
7
8
9
10
5%葡萄糖注射液
500 mL
【性状】本品为无色或几乎为
无色的透明液体
【规格】500 mL 25 g
【贮藏】密封保存
11
9.(2019·甘肃镇原县二中期中)某温度下,在76 g水中溶解24 g CuSO4,恰好达到饱和,假设该溶液密度为1 g·cm-3,求:
(1)该溶液中溶质的质量分数______。
1
2
3
4
5
6
7
8
9
10
24%
解析 在76 g水中溶解24 g CuSO4,该溶液中溶质的质量分数为
×100%=24%。
11
(2)该溶液中溶质的物质的量浓度___________。
1
2
3
4
5
6
7
8
9
10
1.5 mol·L-1
解析 根据(1)可知,该溶液的质量分数为24%、密度为1 g·cm-3,则该溶液中溶质的物质的量浓度为c= mol·L-1=1.5 mol·L-1。
11
(3)取10 mL该溶液加水稀释至200 mL,稀释后的溶液中溶质的物质的量浓度为_____________。
1
2
3
4
5
6
7
8
9
10
0.075 mol·L-1
解析 取10 mL该溶液加水稀释至200 mL,稀释过程中溶质的物质的量
不变,则稀释后的溶液中溶质的物质的量浓度为
=0.075 mol·L-1。
11
题组四 物质的量用于化学方程式的计算
10.在标准状况下,0.224 L CH4气体充分燃烧时,消耗氧气的物质的量为_____ mol,生成水_____ g。
1
2
3
4
5
6
7
8
9
10
0.02
0.36
解析 设消耗氧气的物质的量为x,生成水的质量为y。
CH4 + 2O2 CO2+2H2O
22.4 L 2 mol 36 g
0.224 L x y
解得x=0.02 mol,y=0.36 g。
即消耗0.02 mol O2,生成0.36 g水。
11
11.化学实验中残余的氯气可以用氢氧化钠吸收,以防污染空气。已知Cl2与NaOH发生反应:Cl2+2NaOH===NaCl+NaClO+H2O。若有3.20 g氢氧化钠发生了化学反应,试求:
(1)生成NaCl的质量为_____g。
1
2
3
4
5
6
7
8
9
10
11
2.34
1
2
3
4
5
6
7
8
9
10
11
Cl2 + 2NaOH=== NaCl + NaClO + H2O
1 mol 2 mol 1 mol 1 mol 1 mol
n(Cl2) 0.08 mol n(NaCl) n(NaClO) n(H2O)
得n(NaCl)=0.04 mol,
故m(NaCl)=0.04 mol×58.5 g·mol-1=2.34 g。
(2)生成NaClO的物质的量为____ mol。
1
2
3
4
5
6
7
8
9
10
11
0.04
(3)被吸收的氯气在标准状况下的体积为_____ L。
0.896
1.在0.5 L某浓度的NaCl溶液中含有0.5 mol Na+,下列对该溶液的说法中不正确的是
A.该溶液中溶质的物质的量浓度为1 mol·L-1
B.该溶液中含有58.5 g NaCl
C.配制100 mL该溶液需用5.85 g NaCl
D.量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1 mol
√
B组 综合强化练
1
2
3
4
5
6
7
8
1~4题是单项选择题,5~6题是不定项选择题
1
2
3
4
5
m(NaCl)=0.5 mol×58.5 g·mol-1=29.25 g,B项错误;
100 mL 溶液中含NaCl的质量为5.85 g,物质的量为0.1 mol,C、D项正确。
6
7
8
2.在t ℃时,将a g NH3完全溶于水,得到V mL溶液,该溶液的密度为ρ g·cm-3,质量分数为w,其中含 的物质的量为b mol。下列叙述正确的是
1
2
3
4
5
A.溶质的质量分数w= ×100%
B.溶质的物质的量浓度c= mol·L-1
D.上述溶液中再加入V mL水,所得溶液溶质的质量分数大于0.5w
√
6
7
8
1
2
3
4
5
D项,氨水的密度小于水的密度,加入等体积水混合后,所得溶液溶质的质量分数小于0.5w。
6
7
8
3.一定量的质量分数为10%的NaOH溶液,蒸发掉100 g水后,其质量分数为20%,体积为100 mL,则浓缩后的溶液中NaOH的物质的量浓度为
A.2.2 mol·L-1 B.4 mol·L-1
C.5 mol·L-1 D.6.25 mol·L-1
√
1
2
3
4
5
解析 设原NaOH溶液的质量为x,则x×10%=(x-100 g)×20%,解得x=200 g,溶液中所含NaOH的质量为200 g×10%=20 g,则n(NaOH)=
=0.5 mol。浓缩前后溶液中NaOH的物质的量不变,故浓缩后
的溶液中NaOH的物质的量浓度为 =5 mol·L-1。
6
7
8
4.下列溶液中n(Na+)与100 mL 0.1 mol·L-1的Na2SO4溶液中n(Na+)相同的是
A.100 mL 0.1 mol·L-1的NaCl溶液
B.50 mL 0.2 mol·L-1的NaNO3溶液
C.100 mL 0.1 mol·L-1的NaHSO4溶液
D.200 mL 0.2 mol·L-1的HCl溶液与100 mL 0.2 mol·L-1的NaHCO3溶液
混合
1
2
3
4
5
√
6
7
8
1
2
3
4
5
解析 100 mL 0.1 mol·L-1的Na2SO4溶液中n(Na+)=0.1 mol·L-1×0.1 L×2=0.02 mol。A项,100 mL 0.1 mol·L-1的NaCl溶液中n(Na+)=0.1 mol·L-1
×0.1 L=0.01 mol;
B项,50 mL 0.2 mol·L-1的NaNO3溶液中n(Na+)=0.2 mol·L-1×0.05 L=0.01 mol;
C项,100 mL 0.1 mol·L-1的NaHSO4溶液中n(Na+)=0.1 mol·L-1×0.1 L=0.01 mol;
D项,200 mL 0.2 mol·L-1的HCl溶液与100 mL 0.2 mol·L-1的NaHCO3溶液的混合溶液中n(Na+)=0.2 mol·L-1×0.1 L=0.02 mol。
6
7
8
5.下列说法正确的是
A.0.5 mol·L-1 NaCl溶液中含有1 mol Na+
B.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol·L-1,只有当22.4 L
氨气溶于水制得1 L氨水时,其浓度才是1 mol·L-1
C.在K2SO4和NaCl的中性混合水溶液中,若Na+和 的物质的量相等,
则K+和Cl-的物质的量浓度一定不相等
D.将10 ℃条件下的100 mL 0.35 mol·L-1的KCl饱和溶液蒸发掉5 g水,再
冷却到10 ℃后,溶液的体积小于100 mL,其物质的量浓度仍为
0.35 mol·L-1
1
2
3
4
5
√
6
7
8
√
解析 B项,未指明22.4 L是氨气在标准状况下的体积,氨气的物质的量不一定是1 mol,配制成1 L溶液时,浓度也不一定是1 mol·L-1;
C项,当Na+和 的物质的量相等时,根据化学式中K+和 、Na+与Cl-的比例关系,可得c(K+)∶c(Cl-)=2∶1;
D项,对于10 ℃时0.35 mol·L-1的KCl饱和溶液,蒸发掉水分,温度恢复到10 ℃,必析出KCl晶体,仍为饱和溶液,故浓度不变。
1
2
3
4
5
6
7
8
解析 C项中未说明气体所处的条件。
6.Na2O2可用作特殊环境的供氧剂,如将其用于给潜水艇工作人员供氧,发生的化学反应有:
①2Na2O2+2CO2===2Na2CO3+O2
②2Na2O2+2H2O===4NaOH+O2↑
下列叙述可能错误的是
A.Na2O2要严格密封隔离空气保存
B.该供氧剂使用后的残渣有强腐蚀性
C.若有1 mol Na2O2消耗,提供O2 11.2 L
D.该供氧剂在CO2中质量增加28 g时,生成Na2CO3 1 mol
1
2
3
4
5
6
√
7
8
7.将24.4 g氢氧化钠固体溶于水配成100 mL溶液,其密度为1.219 g·mL-1。
(1)该溶液中氢氧化钠的物质的量浓度为___________。
1
2
3
4
5
6
7
6.1 mol·L-1
解析 24.4 g 氢氧化钠的物质的量为0.61 mol,c(NaOH)=
=6.1 mol·L-1。
(2)该溶液中氢氧化钠的质量分数为_____。
20%
解析 100 mL 氢氧化钠溶液的质量为100 mL×1.219 g·mL-1=121.9 g;氢氧化钠的质量分数为 ×100%≈20%。
8
(3)从该溶液中取出10 mL,含氢氧化钠的质量为______,含氢氧化钠的物质的量为__________。
1
2
3
4
5
6
7
2.44 g
解析 由于整个溶液都是均匀的,所以这10 mL溶液与原100 mL溶液相比,氢氧化钠的质量分数和溶液的密度均相同,但氢氧化钠的质量和物质的量均为原来的 。
(4)将取出的10 mL溶液加水稀释到100 mL,稀释后溶液中氢氧化钠的物质的量浓度为____________。
0.61 mol·L-1
解析 这10 mL溶液中氢氧化钠的物质的量为0.061 mol,稀释到100 mL以后,氢氧化钠的物质的量浓度为 =0.61 mol·L-1。
0.061 mol
8
8.在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
(1)该混合液中,NaCl的物质的量为___ mol,溶质MgCl2的质量为____ g。
1
2
3
4
5
6
7
8
0.4
19.0
解析 根据图像可知钠离子的浓度是1.0 mol·L-1,所以溶液中氯化钠的浓度是1.0 mol·L-1,该混合液中NaCl的物质的量为1.0 mol·L-1×0.4 L=0.4 mol;溶液中镁离子的浓度是0.5 mol·L-1,所以溶液中氯化镁的浓度是0.5 mol·L-1,则溶质MgCl2的质量为0.4 L×0.5 mol·L-1×95 g·mol-1=19.0 g。
(2)该混合液中CaCl2的物质的量为_____ mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为____ mol·L-1。
1
2
3
4
5
6
7
8
0.2
0.2
1
2
3
4
5
6
7
8
解析 溶液中氯离子的浓度是3.0 mol·L-1,所以根据溶液显电中性可知溶液中钙离子的浓度是
·L-1,因此该混合液中CaCl2的物质的量为0.5 mol·L-1×0.4 L=0.2 mol。将该混合液加水稀释至体积为1 L,由于稀释前
后溶质的物质的量不变,则稀释后溶液中Ca2+的
物质的量浓度为 =0.2 mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀____ mol。
1
2
3
4
5
6
7
8
1.2
解析 溶液中氯离子的物质的量是0.4 L×3.0 mol·L-1=1.2 mol,所以根据化学方程式可知,向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到氯化银沉淀的物质的量是1.2 mol。
返回
1.能从宏观和微观的角度理解微观粒子间的关系。
2.建立n、M、Vm、c之间相互转化关系及进行简单计算的思维模型。
核心素养发展目标
一、溶质物质的量浓度的基本计算
四、化学反应的计算
随堂演练 知识落实
二、溶液的稀释或混合
内
容
索
引
三、物质的量浓度与溶质的质量分数的换算
课时对点练
一、溶质物质的量浓度的基本计算
1.根据定义式计算溶质的物质的量浓度
根据概念表达式cB= ,欲求cB,先求nB和V。
计算溶质的物质的量浓度的关键是从已知条件中找出溶质的物质的量(n)和溶液的体积(V),据此求出溶质的物质的量浓度cB。
例1 已知V L硫酸铁溶液中含Fe3+m g,则该溶液中Fe3+的物质的量浓度
为_____mol·L-1, 的物质的量浓度为______mol·L-1,溶质的物质的
量浓度为_____mol·L-1。
2.标准状况下气体溶于水,其物质的量浓度的计算
若已知溶液的体积
V(气体)
n
c
例2 用1 L水吸收560 L氨气(标准状况),所得氨水的密度是0.90 g·mL-1,求:
(1)氨气的物质的量是_______。
(2)所得氨水的物质的量浓度是_____________。
25 mol
15.79 mol·L-1
1.游泳池里的水一般常加适量的硫酸铜,用以杀灭其中的细菌,而对游泳者的身体无害。现取一水样300 mL,经分析其中含有0.019 2 g Cu2+,则水样中硫酸铜的物质的量浓度为______mol·L-1。
应用体验
0.001
2.在标准状况下的a L 氯化氢气体溶于1 000 g水中,得到的盐酸密度为b g·cm-3,则该盐酸中溶质的物质的量浓度是
√
返回
归纳总结
二、溶液的稀释或混合
1.浓溶液稀释
(1)溶质的质量在稀释前后保持不变,即m1w1=m2w2。
(2)溶质的物质的量在稀释前后保持不变,即c1V1=c2V2。
(3)溶液质量守恒,m(稀)=m(浓)+m(水)。
例3 从1 L 1 mol·L-1NaOH溶液中取出100 mL。
(1)取出的这100 mL NaOH溶液的物质的量浓度是_________,含NaOH的质量是______。
1 mol·L-1
4.0 g
解析 m=0.1 L×1 mol·L-1×40 g·mol-1=4.0 g。
(2)若将取出的这100 mL NaOH溶液加水稀释至500 mL,所得溶液中溶质的物质的量浓度是___________。
0.2 mol·L-1
解析 100 mL 氢氧化钠溶液加水稀释至500 mL,氢氧化钠的物质的量不变,由c(浓)·V(浓)=c(稀)·V(稀)可知c(稀)=
=0.2 mol·L-1。
2.相同溶质的两溶液混合
(1)溶质的物质的量不变
c1V1+c2V2=c(混)·V(混);
(2)溶质的质量不变
m1w1+m2w2=m(混)·w(混)。
例4 将0.10 mol·L-1氢氧化钠溶液和0.60 mol·L-1氢氧化钠溶液混合成0.20 mol·L-1的氢氧化钠溶液。求两种溶液的体积比(忽略混合时溶液体积变化)为_____。
4∶1
解析 本题有以下两种解法。
方法1(根据混合前后溶质的物质的量不变,列式求解):设所需0.10 mol·L-1的氢氧化钠溶液和所需0.60 mol·L-1的氢氧化钠溶液的体积分别是V1和V2,根据混合前后溶质的物质的量不变列式得:0.10 mol·L-1·V1+0.60 mol·L-1
·V2=0.20 mol·L-1·(V1+V2),解得: 。
方法2(十字交叉法):
(1)同一溶质、不同浓度的溶液混合,在混合前后溶质的质量、物质的量保持守恒,溶液的质量保持守恒,但溶液的体积一般不守恒。
(2)混合后溶液的体积:①若指出不考虑溶液体积改变,可认为是原溶液的体积之和;
归纳总结
②若给出混合后溶液的密度,应根据V(混)= 来计算。
3.将10 mL 5 mol·L-1盐酸稀释到200 mL,再取出5 mL,这5 mL溶液中溶质的物质的量浓度是
A.0.05 mol·L-1 B.0.25 mol·L-1
C.0.1 mol·L-1 D.0.5 mol·L-1
应用体验
解析 根据稀释定律,c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液):5 mol·L-1×10 mL=c(稀溶液)×200 mL,解得c(稀溶液)=0.25 mol·L-1,从中取出5 mL溶液,其浓度不变。
√
4.将100 mL 0.1 mol·L-1的氯化钡溶液与50 mL 0.2 mol·L-1的氯化钠溶液混合,若不考虑溶液混合时体积的变化,则混合溶液中氯离子浓度是
A.0.2 mol·L-1 B.0.01 mol·L-1
C.0.1 mol·L-1 D.0.02 mol·L-1
解析 混合前后溶质的物质的量不变,混合溶液中氯离子浓度为(100 mL
×2×0.1 mol·L-1+50 mL×0.2 mol·L-1)÷(100 mL+50 mL)=0.2 mol·L-1。
√
返回
三、物质的量浓度与溶质的质量分数的换算
换算公式
M:溶质B的摩尔质量(单位:g·mol-1);ρ:溶液密度(单位:g·mL-1);w:溶质的质量分数。
[问题探究]
已知某溶液的密度为ρ g·mL-1。溶质的质量分数为w,溶液中溶质的摩尔质量为M g·mol-1,求物质的量浓度c。
推导过程:设溶液的体积为V mL,
则溶液的质量m(溶液)=____ g;
溶液中溶质的质量m(溶质)=______g;
ρV
ρVw
溶质的物质的量n(溶质)=______ mol;
溶质的物质的量浓度c=_______ mol·L-1。
5.已知某饱和NaCl溶液的体积为V mL,密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,溶液中NaCl的质量为m g。
应用体验
(1)用m、V表示溶液中溶质的物质的量浓度:____________;
(2)用w、ρ表示溶液中溶质的物质的量浓度:____________;
(3)用c、ρ表示溶液中溶质的质量分数:______________;
(4)用w表示该温度下NaCl的溶解度:__________。
6.市售浓硫酸中溶质的质量分数为98%,密度为1.84 g·cm-3。计算市售浓硫酸中硫酸的物质的量浓度为____________。
18.4 mol·L-1
物质的量浓度与溶质的质量分数之间求算题目的解题思路一般有两个出发点:
归纳总结
(1)由“定义式”出发:物质的量浓度定义的表达式为c= ,由此知,欲求c,先求n及V。
(2)由“变换式”出发:已知质量分数w和溶液密度ρ(或质量与体积),由换算公式c= 计算c。
返回
四、化学反应的计算
aA(g) + bB(g) === cC(g) + dD(g)
化学计
量数比: a ∶ b ∶ c ∶ d
物质的量比:a ∶ b ∶ c ∶ d
气体体积比:a ∶ b ∶ c ∶ d
例5 将1.15 g钠置于足量的水中,充分反应后,生成的NaOH的物质的量是多少?生成的气体在标准状况下占多大体积?已知Na与H2O发生反应:2Na+2H2O===2NaOH+H2↑。
答案 生成0.05 mol NaOH、0.56 L H2
解析 n(Na)= =0.05 mol,
2Na+2H2O===2NaOH+H2↑
2 2 1
0.05 mol n(NaOH) n(H2)
2∶2=0.05 mol∶n(NaOH),
n(NaOH)=0.05 mol;
2∶1=0.05 mol∶n(H2),
n(H2)=0.025 mol,
V(H2)=0.025 mol×22.4 L·mol-1=0.56 L。
物质的量应用于化学方程式计算的解题模型
思维建模
(1)建模依据
化学方程式:H2+Cl2 2HCl
①分子数之比为1∶1∶2;②化学计量数之比为1∶1∶2;③扩大NA倍之比为1∶1∶2;④物质的量之比为1∶1∶2;⑤气体体积之比为1∶1∶2。
(2)解题步骤模型
第一步:将题给其他物理量转化为对应物质的物质的量;
第二步:依据化学方程式求出待求物质的物质的量;
第三步:根据题目要求,再将待求物质的物质的量转化为所求的物理量。
7.过氧化钠能与水反应2Na2O2+2H2O===4NaOH+O2↑,某同学欲用该反应制取标准状况下的氧气1.12 L。
(1)计算需要称取过氧化钠的质量。
应用体验
答案 需称取过氧化钠7.8 g。
(2)反应后生成NaOH的物质的量是多少?
答案 反应后生成0.2 mol NaOH。
解析 n(O2)= =0.05 mol,
2Na2O2+2H2O=== 4NaOH + O2↑
2 4 1
n(Na2O2) n(NaOH) 0.05 mol
2∶1=n(Na2O2)∶0.05 mol,
n(Na2O2)=0.1 mol,
m(Na2O2)=0.1 mol×78 g·mol-1=7.8 g;
4∶1=n(NaOH)∶0.05 mol,
n(NaOH)=0.2 mol。
返回
1
2
3
随堂演练 知识落实
4
1.V L K2SO4溶液中,含有K+ m g,则溶液中 的物质的量浓度为
√
5
2.100 mL溶液中溶有0.1 mol HCl和0.1 mol AlCl3,则该溶液中Cl-的物质的量浓度为
A.0.3 mol·L-1 B.0.4 mol·L-1
C.3.0 mol·L-1 D.4.0 mol·L-1
1
2
3
4
解析 溶液中n(Cl-)=n(HCl)+3n(AlCl3)=0.1 mol+3×0.1 mol=0.4 mol,则c(Cl-)= =4.0 mol·L-1。
√
5
3.某市售盐酸的质量分数为36.5%,密度为1.18 g·cm-3,该盐酸中溶质的物质的量浓度是
A.3 mol·L-1 B.8.4 mol·L-1
C.11.8 mol·L-1 D.0.5 mol·L-1
1
2
3
4
√
5
4.(2020·桂林调研)(1)从2 mol·L-1的KAl(SO4)2溶液中取出a mL稀释到
1
2
3
4
b mL,稀释后所得溶液中c( )为___________。
(2)标准状况下,336 L的NH3溶于1 L水中,若该溶液的密度为a g·cm-3,则其物质的量浓度为______________。
11.95a mol·L-1
5
5.今有11.2 g铁与500 mL的盐酸恰好完全反应。
求:(1)在标准状况下,生成氢气的体积是多少升?
1
2
3
4
5
答案 4.48 L
1
2
3
4
5
Fe + 2HCl===FeCl2+H2↑
1 2 1
0.2 mol n(HCl) n(H2)
n(HCl)=0.4 mol,n(H2)=0.2 mol,
V(H2)=0.2 mol×22.4 L·mol-1=4.48 L。
(2)反应前,盐酸的物质的量浓度是多少?
1
2
3
4
5
答案 0.8 mol·L-1
返回
课时对点练
1
2
3
4
5
6
7
8
9
10
题组一 物质的量浓度的基本计算
1.40 g氢氧化钠固体溶于水配成2 L溶液,其物质的量浓度为
A.0.5 mol·L-1 B.5 mol·L-1
C.10 mol·L-1 D.20 mol·L-1
√
A组 基础对点练
11
2.50 mL 0.6 mol·L-1 氢氧化钠溶液含氢氧化钠的质量为
A.1.2 g B.1.6 g
C.2.0 g D.2.4 g
√
1
2
3
4
5
6
7
8
9
10
解析 氢氧化钠的质量为0.05 L×0.6 mol·L-1×40 g·mol-1=1.2 g。
11
3.标准状况下,500体积的氯化氢气体溶于水形成1体积的盐酸,则盐酸中溶质的物质的量浓度是
1
2
3
4
5
6
7
8
9
10
A.500 mol·L-1 B. mol·L-1
C.5 mol·L-1 D.无法计算
√
11
4.下列各溶液中,Na+的物质的量浓度最大的是
A.4 L 0.5 mol·L-1的NaCl溶液
B.1 L 0.3 mol·L-1的Na2SO4溶液
C.0.8 L 0.4 mol·L-1的NaOH溶液
D.2 L 0.15 mol·L-1的Na3PO4溶液
1
2
3
4
5
6
7
8
9
10
√
11
题组二 溶液的稀释与混合计算
5.(2019·南京高一期中)常温下,欲配制密度为1.1 g·cm-3、浓度为6 mol·L-1的稀盐酸,在体积为100 mL、密度为1.19 g·cm-3、浓度为12 mol·L-1的浓盐酸中需加蒸馏水
A.200 mL B.100 mL C.101 mL D.120 mL
√
1
2
3
4
5
6
7
8
9
10
解析 设加水x mL可配制成V mL 6 mol·L-1稀盐酸,则100 mL×12 mol·L-1=6 mol·L-1×V mL,V=200。体积不能直接加和,可利用质量守恒:200 mL×1.1 g·mL-1=100 mL×1.19 g·mL-1+x mL×1 g·mL-1,x=101,即需加蒸馏水101 mL。
11
1
2
3
4
5
6
7
8
9
10
6.(2019·新乡高一期中)硫酸钠和硫酸溶液等体积混合后,H+浓度为0.3 mol·L-1, 浓度为0.4 mol·L-1,则混合溶液中Na+浓度为
A.0.15 mol·L-1 B.0.2 mol·L-1
C.0.25 mol·L-1 D.0.5 mol·L-1
√
解析 设Na+浓度为x,根据电荷守恒可知,0.3 mol·L-1×1+x×1=0.4 mol·L-1×2,解得x=0.5 mol·L-1。
11
7.物质的量浓度相同的氯化钠、氯化镁、氯化铝三种溶液,当溶液的体积比为3∶2∶1时,三种溶液中氯离子的物质的量之比为
A.1∶1∶1 B.1∶2∶3
C.3∶2∶1 D.3∶4∶3
√
1
2
3
4
5
6
7
8
9
10
11
题组三 物质的量浓度、溶质质量分数的相互换算
8.(2020·武汉调研)如图是病人输液用的葡萄糖(分子式为C6H12O6)注射液的标签上的部分内容。据标签所提供的信息,以下说法错误的是
1
2
3
4
5
6
7
8
9
10
5%葡萄糖注射液
500 mL
【性状】本品为无色或几乎为
无色的透明液体
【规格】500 mL 25 g
【贮藏】密封保存
A.该注射液中葡萄糖的质量分数是5%
B.葡萄糖的摩尔质量为180 g·mol-1
C.该注射液的密度约为1 g·cm-3
D.该注射液中葡萄糖的物质的量浓度
约为0.014 mol·L-1
√
11
解析 由标签所提供的信息可知,该注射液中葡萄糖的质量分数为5%,故A正确;
葡萄糖的摩尔质量为180 g·mol-1,故B正确;
1
2
3
4
5
6
7
8
9
10
5%葡萄糖注射液
500 mL
【性状】本品为无色或几乎为
无色的透明液体
【规格】500 mL 25 g
【贮藏】密封保存
11
9.(2019·甘肃镇原县二中期中)某温度下,在76 g水中溶解24 g CuSO4,恰好达到饱和,假设该溶液密度为1 g·cm-3,求:
(1)该溶液中溶质的质量分数______。
1
2
3
4
5
6
7
8
9
10
24%
解析 在76 g水中溶解24 g CuSO4,该溶液中溶质的质量分数为
×100%=24%。
11
(2)该溶液中溶质的物质的量浓度___________。
1
2
3
4
5
6
7
8
9
10
1.5 mol·L-1
解析 根据(1)可知,该溶液的质量分数为24%、密度为1 g·cm-3,则该溶液中溶质的物质的量浓度为c= mol·L-1=1.5 mol·L-1。
11
(3)取10 mL该溶液加水稀释至200 mL,稀释后的溶液中溶质的物质的量浓度为_____________。
1
2
3
4
5
6
7
8
9
10
0.075 mol·L-1
解析 取10 mL该溶液加水稀释至200 mL,稀释过程中溶质的物质的量
不变,则稀释后的溶液中溶质的物质的量浓度为
=0.075 mol·L-1。
11
题组四 物质的量用于化学方程式的计算
10.在标准状况下,0.224 L CH4气体充分燃烧时,消耗氧气的物质的量为_____ mol,生成水_____ g。
1
2
3
4
5
6
7
8
9
10
0.02
0.36
解析 设消耗氧气的物质的量为x,生成水的质量为y。
CH4 + 2O2 CO2+2H2O
22.4 L 2 mol 36 g
0.224 L x y
解得x=0.02 mol,y=0.36 g。
即消耗0.02 mol O2,生成0.36 g水。
11
11.化学实验中残余的氯气可以用氢氧化钠吸收,以防污染空气。已知Cl2与NaOH发生反应:Cl2+2NaOH===NaCl+NaClO+H2O。若有3.20 g氢氧化钠发生了化学反应,试求:
(1)生成NaCl的质量为_____g。
1
2
3
4
5
6
7
8
9
10
11
2.34
1
2
3
4
5
6
7
8
9
10
11
Cl2 + 2NaOH=== NaCl + NaClO + H2O
1 mol 2 mol 1 mol 1 mol 1 mol
n(Cl2) 0.08 mol n(NaCl) n(NaClO) n(H2O)
得n(NaCl)=0.04 mol,
故m(NaCl)=0.04 mol×58.5 g·mol-1=2.34 g。
(2)生成NaClO的物质的量为____ mol。
1
2
3
4
5
6
7
8
9
10
11
0.04
(3)被吸收的氯气在标准状况下的体积为_____ L。
0.896
1.在0.5 L某浓度的NaCl溶液中含有0.5 mol Na+,下列对该溶液的说法中不正确的是
A.该溶液中溶质的物质的量浓度为1 mol·L-1
B.该溶液中含有58.5 g NaCl
C.配制100 mL该溶液需用5.85 g NaCl
D.量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1 mol
√
B组 综合强化练
1
2
3
4
5
6
7
8
1~4题是单项选择题,5~6题是不定项选择题
1
2
3
4
5
m(NaCl)=0.5 mol×58.5 g·mol-1=29.25 g,B项错误;
100 mL 溶液中含NaCl的质量为5.85 g,物质的量为0.1 mol,C、D项正确。
6
7
8
2.在t ℃时,将a g NH3完全溶于水,得到V mL溶液,该溶液的密度为ρ g·cm-3,质量分数为w,其中含 的物质的量为b mol。下列叙述正确的是
1
2
3
4
5
A.溶质的质量分数w= ×100%
B.溶质的物质的量浓度c= mol·L-1
D.上述溶液中再加入V mL水,所得溶液溶质的质量分数大于0.5w
√
6
7
8
1
2
3
4
5
D项,氨水的密度小于水的密度,加入等体积水混合后,所得溶液溶质的质量分数小于0.5w。
6
7
8
3.一定量的质量分数为10%的NaOH溶液,蒸发掉100 g水后,其质量分数为20%,体积为100 mL,则浓缩后的溶液中NaOH的物质的量浓度为
A.2.2 mol·L-1 B.4 mol·L-1
C.5 mol·L-1 D.6.25 mol·L-1
√
1
2
3
4
5
解析 设原NaOH溶液的质量为x,则x×10%=(x-100 g)×20%,解得x=200 g,溶液中所含NaOH的质量为200 g×10%=20 g,则n(NaOH)=
=0.5 mol。浓缩前后溶液中NaOH的物质的量不变,故浓缩后
的溶液中NaOH的物质的量浓度为 =5 mol·L-1。
6
7
8
4.下列溶液中n(Na+)与100 mL 0.1 mol·L-1的Na2SO4溶液中n(Na+)相同的是
A.100 mL 0.1 mol·L-1的NaCl溶液
B.50 mL 0.2 mol·L-1的NaNO3溶液
C.100 mL 0.1 mol·L-1的NaHSO4溶液
D.200 mL 0.2 mol·L-1的HCl溶液与100 mL 0.2 mol·L-1的NaHCO3溶液
混合
1
2
3
4
5
√
6
7
8
1
2
3
4
5
解析 100 mL 0.1 mol·L-1的Na2SO4溶液中n(Na+)=0.1 mol·L-1×0.1 L×2=0.02 mol。A项,100 mL 0.1 mol·L-1的NaCl溶液中n(Na+)=0.1 mol·L-1
×0.1 L=0.01 mol;
B项,50 mL 0.2 mol·L-1的NaNO3溶液中n(Na+)=0.2 mol·L-1×0.05 L=0.01 mol;
C项,100 mL 0.1 mol·L-1的NaHSO4溶液中n(Na+)=0.1 mol·L-1×0.1 L=0.01 mol;
D项,200 mL 0.2 mol·L-1的HCl溶液与100 mL 0.2 mol·L-1的NaHCO3溶液的混合溶液中n(Na+)=0.2 mol·L-1×0.1 L=0.02 mol。
6
7
8
5.下列说法正确的是
A.0.5 mol·L-1 NaCl溶液中含有1 mol Na+
B.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol·L-1,只有当22.4 L
氨气溶于水制得1 L氨水时,其浓度才是1 mol·L-1
C.在K2SO4和NaCl的中性混合水溶液中,若Na+和 的物质的量相等,
则K+和Cl-的物质的量浓度一定不相等
D.将10 ℃条件下的100 mL 0.35 mol·L-1的KCl饱和溶液蒸发掉5 g水,再
冷却到10 ℃后,溶液的体积小于100 mL,其物质的量浓度仍为
0.35 mol·L-1
1
2
3
4
5
√
6
7
8
√
解析 B项,未指明22.4 L是氨气在标准状况下的体积,氨气的物质的量不一定是1 mol,配制成1 L溶液时,浓度也不一定是1 mol·L-1;
C项,当Na+和 的物质的量相等时,根据化学式中K+和 、Na+与Cl-的比例关系,可得c(K+)∶c(Cl-)=2∶1;
D项,对于10 ℃时0.35 mol·L-1的KCl饱和溶液,蒸发掉水分,温度恢复到10 ℃,必析出KCl晶体,仍为饱和溶液,故浓度不变。
1
2
3
4
5
6
7
8
解析 C项中未说明气体所处的条件。
6.Na2O2可用作特殊环境的供氧剂,如将其用于给潜水艇工作人员供氧,发生的化学反应有:
①2Na2O2+2CO2===2Na2CO3+O2
②2Na2O2+2H2O===4NaOH+O2↑
下列叙述可能错误的是
A.Na2O2要严格密封隔离空气保存
B.该供氧剂使用后的残渣有强腐蚀性
C.若有1 mol Na2O2消耗,提供O2 11.2 L
D.该供氧剂在CO2中质量增加28 g时,生成Na2CO3 1 mol
1
2
3
4
5
6
√
7
8
7.将24.4 g氢氧化钠固体溶于水配成100 mL溶液,其密度为1.219 g·mL-1。
(1)该溶液中氢氧化钠的物质的量浓度为___________。
1
2
3
4
5
6
7
6.1 mol·L-1
解析 24.4 g 氢氧化钠的物质的量为0.61 mol,c(NaOH)=
=6.1 mol·L-1。
(2)该溶液中氢氧化钠的质量分数为_____。
20%
解析 100 mL 氢氧化钠溶液的质量为100 mL×1.219 g·mL-1=121.9 g;氢氧化钠的质量分数为 ×100%≈20%。
8
(3)从该溶液中取出10 mL,含氢氧化钠的质量为______,含氢氧化钠的物质的量为__________。
1
2
3
4
5
6
7
2.44 g
解析 由于整个溶液都是均匀的,所以这10 mL溶液与原100 mL溶液相比,氢氧化钠的质量分数和溶液的密度均相同,但氢氧化钠的质量和物质的量均为原来的 。
(4)将取出的10 mL溶液加水稀释到100 mL,稀释后溶液中氢氧化钠的物质的量浓度为____________。
0.61 mol·L-1
解析 这10 mL溶液中氢氧化钠的物质的量为0.061 mol,稀释到100 mL以后,氢氧化钠的物质的量浓度为 =0.61 mol·L-1。
0.061 mol
8
8.在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
(1)该混合液中,NaCl的物质的量为___ mol,溶质MgCl2的质量为____ g。
1
2
3
4
5
6
7
8
0.4
19.0
解析 根据图像可知钠离子的浓度是1.0 mol·L-1,所以溶液中氯化钠的浓度是1.0 mol·L-1,该混合液中NaCl的物质的量为1.0 mol·L-1×0.4 L=0.4 mol;溶液中镁离子的浓度是0.5 mol·L-1,所以溶液中氯化镁的浓度是0.5 mol·L-1,则溶质MgCl2的质量为0.4 L×0.5 mol·L-1×95 g·mol-1=19.0 g。
(2)该混合液中CaCl2的物质的量为_____ mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为____ mol·L-1。
1
2
3
4
5
6
7
8
0.2
0.2
1
2
3
4
5
6
7
8
解析 溶液中氯离子的浓度是3.0 mol·L-1,所以根据溶液显电中性可知溶液中钙离子的浓度是
·L-1,因此该混合液中CaCl2的物质的量为0.5 mol·L-1×0.4 L=0.2 mol。将该混合液加水稀释至体积为1 L,由于稀释前
后溶质的物质的量不变,则稀释后溶液中Ca2+的
物质的量浓度为 =0.2 mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀____ mol。
1
2
3
4
5
6
7
8
1.2
解析 溶液中氯离子的物质的量是0.4 L×3.0 mol·L-1=1.2 mol,所以根据化学方程式可知,向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到氯化银沉淀的物质的量是1.2 mol。
返回
