高中化学苏教版(2019)必修第一册 专题2 第三单元 第2课时 原子核外电子排布(51张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)必修第一册 专题2 第三单元 第2课时 原子核外电子排布(51张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1014.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-16 17:45:49 | ||
图片预览








文档简介
第2课时 原子核外电子排布
1.了解原子核外电子运动特点。
2.掌握原子核外电子排布规律。
3.能用原子(离子)结构示意图表示常见原子(离子)的核外电子排布。
4.了解微观结构决定宏观性质的规律。
核心素养发展目标
一、核外电子排布
随堂演练 知识落实
课时对点练
二、原子结构与元素性质的关系
内
容
索
引
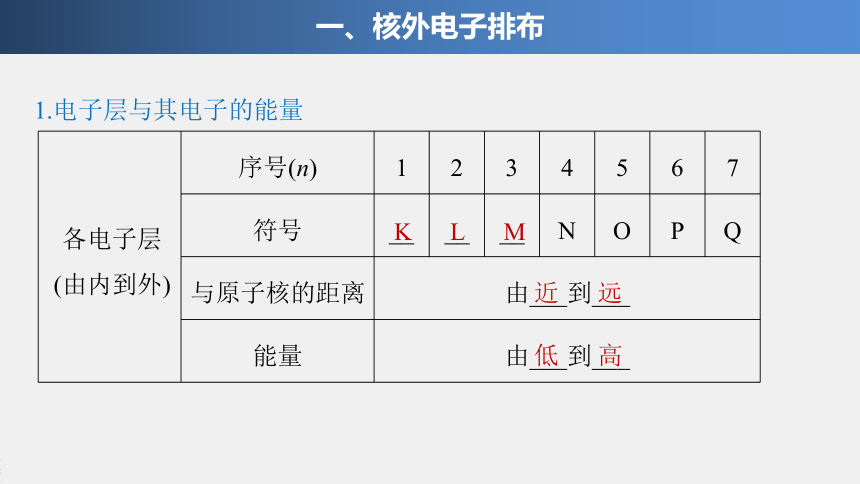
1.电子层与其电子的能量
一、核外电子排布
各电子层
(由内到外)
序号(n)
1
2
3
4
5
6
7
符号
__
__
__
N
O
P
Q
与原子核的距离
由___到___
能量
由___到___
K
L
M
近
远
低
高
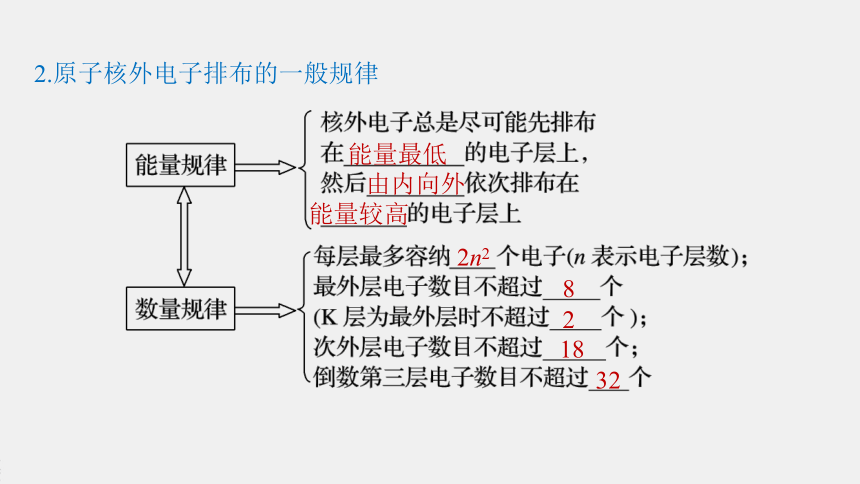
2.原子核外电子排布的一般规律
能量最低
由内向外
能量较高
2n2
8
2
18
32
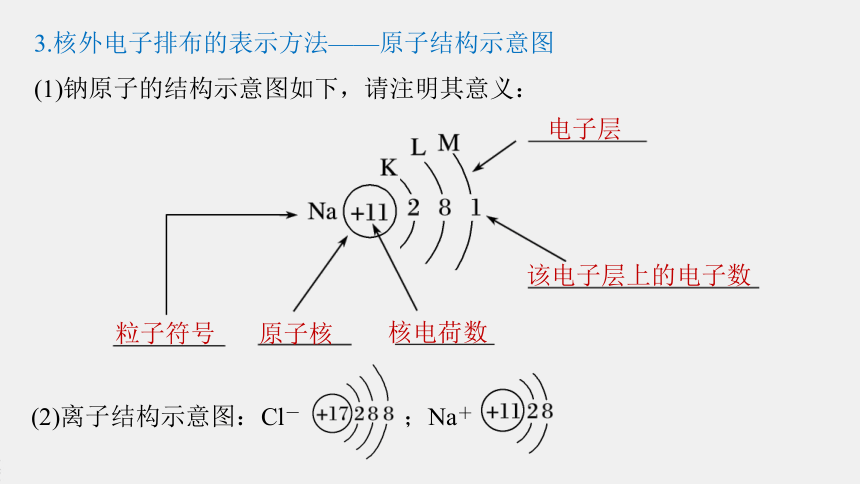
3.核外电子排布的表示方法——原子结构示意图
(1)钠原子的结构示意图如下,请注明其意义:
电子层
该电子层上的电子数
粒子符号
原子核
核电荷数
(2)离子结构示意图:Cl- ;Na+
(1)电子的能量越低,运动区域离核越远( )
(2)在多电子原子里,电子的能量不完全相同( )
判断正误
(3)钾原子的结构示意图为 ( )
(4)M层为最外层时,最多容纳18个电子( )
(5)原子的次外层电子数都为8( )
×
√
×
×
×
1.某元素原子的最外层电子数是次外层的a倍(a>1),则该原子的核内质子数是
A.2a+2 B.2a+10
C.a+2 D.2a
理解应用
解析 原子核外电子的排布规律是:最外层不超过8个,次外层不超过18个,某元素的最外层电子数是次外层的a倍(a>1),所以该元素的次外层只能是K层,2个电子,最外层是L层,电子数是2a,所以该元素的核外电子总数是2a+2,而原子的核内质子数=核外电子数。
√
返回
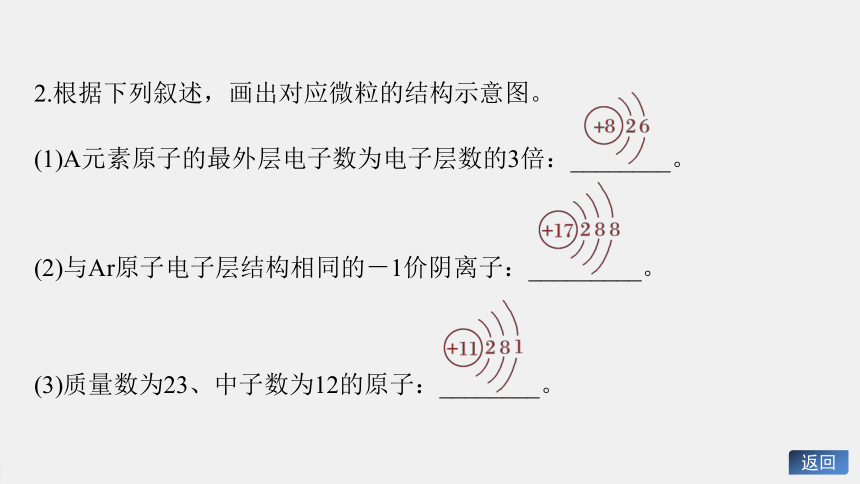
2.根据下列叙述,画出对应微粒的结构示意图。
(1)A元素原子的最外层电子数为电子层数的3倍:________。
(2)与Ar原子电子层结构相同的-1价阴离子:_________。
(3)质量数为23、中子数为12的原子:________。
二、原子结构与元素性质的关系
元素的性质与原子的核外电子排布密切相关,元素的化学性质主要取决于原子的 层电子排布,元素的化合价的数值也与原子的电子层结构特别是 层电子数有关。
1.金属元素原子最外层电子数一般 4,较易 电子,化合价常显__
价,且正化合价=失电子数=最外层电子数。
2.非金属元素原子最外层电子数一般 4,通常易 电子,在化合物中化合价常显 价,且负化合价=-(得电子数)=最外层电子数-8。
最外
最外
小于
失去
正
大于或等于
得到
负
3.稳定结构与不稳定结构
(1)稳定结构:原子最外层有8个电子(He为2)处于稳定状态,既不容易失去电子又不容易得到电子,化学性质稳定(如He、Ne、Ar)。
(2)不稳定结构:原子容易失去电子或得到电子转化为最外电子层上为8(有些为2)个电子的稳定结构(如易失电子的金属元素、易得电子的非金属元素)。
(1)最外层只有1个电子的元素一定是金属元素( )
(2)最外层电子数是次外层电子数2倍的元素的原子容易失去电子成为阳离子( )
(3)S原子的最外层电子数为6,故其最高正价为+6( )
(4)Mg2+、O2-、Ne电子层排布相同,故所含电子总数相等( )
判断正误
×
(5)Na+的结构示意图为 ,最外层达到8电子稳定结构,不易得失电子
( )
(6)元素性质是由最外层电子数决定的,稀有气体元素原子最外层电子都达到2或8个,所以稀有气体很稳定( )
×
√
√
√
√
(2019·陕西黄陵中学高一期末)观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:
理解应用
(1)属于离子结构示意图的是____、____(填字母,下同)。
B
E
解析 根据结构示意图可知A是氯原子,B是氧离子,C是氖原子,D是钠原子,E是镁离子。结构示意图中质子数与核外电子数不相等的是离子。
(2)性质最稳定的原子是____,最容易失去电子的原子是____,最容易得到电子的原子是____。
解析 稀有气体元素原子最外层已达到稳定结构,性质最稳定;金属元素的原子易失去电子,非金属元素的原子易得到电子。
C
D
A
解析 核外有10个电子的离子有氧离子、氟离子、钠离子、镁离子、铝离子。
(3)A、D两种元素形成的化合物在水溶液中的电离方程式:___________
_____。
解析 A、D两种元素形成的化合物为NaCl,NaCl在水溶液中电离出钠离子和氯离子,电离方程式为NaCl===Na++Cl-。
NaCl===Na+
+Cl-
(4)在核电荷数1~18的元素内,列举两个与B核外电子层排布相同的离子,写出离子的符号_____、______________。
Na+
Al3+(合理即可)
返回
1.原子核外每个电子层上均含有2n2个电子的元素是
A.Be B.C C.Ar D.Ne
√
1
2
3
5
随堂演练 知识落实
4
6
解析 n=1,该层电子数为2;n=2,该层电子数为8,即 ,则该元素为Ne。
A. B. C. D.
2.下列各原子结构示意图中所表示的核外电子排布正确的是
1
2
3
5
4
解析 解答此题时应注意:①电子排布遵循能量最低原理;②各电子层最多所能容纳的电子数目为2n2;③原子最外层电子数不能超过8(K层为最外层时不能超过2)。A项不符合能量最低原理,应该先排满K层再排L层,所以错误;
B项不符合各层最多排2n2个电子,K层最多排2个电子,所以错误;
D项不符合最外层最多只能排8个电子,所以错误。
√
6
3.某原子核外共有n个电子层(n>3),则n-1层最多容纳的电子数为
A.8个 B.18个
C.32个 D.2(n-1)2个
√
1
2
3
5
4
6
解析 某原子核外有n个电子层,则n-1层为次外层,最多容纳电子数为18个。
4.下列说法正确的是
A.某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子
B.最外层电子达到稳定结构的微粒只能是稀有气体的原子
C.F-、Na+、Mg2+、Al3+是与Ne原子具有相同电子层结构的离子
D.某元素原子的最外层只有2个电子,则该元素一定是金属元素
√
1
2
3
5
4
6
1
2
3
5
4
6
解析 电子排布为2、8、8结构的微粒还可能为S2-、Cl-等,A项错误;
O2-、F-、Cl-、Li+、Na+、Mg2+等微粒最外层电子数均达到了稳定结构,B项错误;
F-、Na+、Mg2+、Al3+核外电子排布均为2、8结构,与Ne原子的电子层结构相同,C项正确;
He原子的最外层只有2个电子,但He元素是稀有气体元素,D项错误。
5.今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍,A和B分别是
A.硅原子和钠原子 B.硼原子和氢原子
C.氯原子和碳原子 D.碳原子和铝原子
1
2
3
5
4
√
6
解析 设A原子L、M层电子数分别为x、y,依题意,A、B两原子的电子层结构为:
1
2
3
5
4
6
电子层
K
L
M
A原子
2
x
y
B原子
2
2x
y+3
B原子的M层至少有3个电子,因而其L层的电子数必然是8,求得x=4。对A原子来说,L层有4个电子时只能是最外层,即y=0,y+3=3。因此,这两个原子分别为碳原子和铝原子,故D项正确。
1
2
3
5
4
6.写出1~18号元素中符合下列条件的原子(或离子)的微粒符号,并画出其结构示意图。
(1)某元素原子L层上的电子数为K层的3倍:___________。
6
O:
(2)某元素原子L层上的电子数为K层的一半:____________。
Li:
(3)某元素原子得到2个电子后所形成的电子总数与氩原子的电子总数相同
S2-:
的离子:______________。
(4)某元素原子的最外层电子数等于次外层电子数的2倍:__________。
C:
返回
课时对点练
1
2
3
4
5
6
7
8
9
10
题组一 核外电子排布
1.下列说法中肯定错误的是
A.某原子K层上只有1个电子
B.某原子M层上电子数为L层电子数的4倍
C.某离子M层上和L层上的电子数均为K层的4倍
D.某离子的核电荷数与最外层电子数相等
√
A组 基础对点练
1
2
3
4
5
6
7
8
9
10
解析 K、L、M层上最多容纳的电子数分别为2、8、18,K层上可以有1~2个电子,A正确;
当M层上排有电子时,L层上一定排满电子,即L层上的电子数为8,由于18<8×4,故B错误;
当K、L层排满电子,即电子数分别是2、8时,M层上的电子数也可以是8,例如Cl-、K+均属于这种情况,C正确;
O2-的核电荷数与最外层电子数均为8,故D正确。
2.具有下列结构示意图的微粒,既可以是原子又可以是阴离子和阳离子的是
1
2
3
4
5
6
7
8
9
10
A. B. C. D.
√
解析 A项中x=13,为Al原子,错误;
B项中,只能为氮原子,x=7,错误;
C项中,若x=18,为Ar原子,若x=17,为Cl-,若x=19,为K+,正确;
D项中,只能为氯原子,x=17,错误。
3.某元素的原子核外有三个电子层,最外层电子数是4,该原子核内的质子数是
A.14 B.15 C.16 D.17
√
1
2
3
4
5
6
7
8
9
10
解析 核外有三层,最外层上有4个电子,则第一、第二层已排满,每层
电子数分别为2、8、4,则该原子结构示意图为 ,故选A。
4.下列离子中,所带电荷数与该离子的核外电子层数相等的是
A.Al3+ B.Mg2+ C.Be2+ D.H+
1
2
3
4
5
6
7
8
9
10
√
解析 四种离子的核外电子层数分别是2、2、1、0。
5.有A、B、C三种元素,核电荷数均小于18。已知A元素原子的核电荷数大于B元素原子的核电荷数,但两种元素的原子具有相同数目的电子层,A元素最外层电子数为B元素的两倍,A元素原子第三层电子数为第一层电子数的三倍,C元素原子的核电荷数是电子层数的4倍,其质子数为最外层电子数的6倍。请回答下列问题:
1
2
3
4
5
6
7
8
9
10
(1)A的原子结构示意图:_________;A元素的名称:____。
硫
(2)B的原子结构示意图:_________;B元素的名称:_____。
铝
(3)C的离子结构示意图:________;C元素的符号:______。
1
2
3
4
5
6
7
8
9
10
解析 因为最内层最多容纳2个电子,又已知A元素第三层电子数是第一层电子数的3倍,所以第三层电子数为2×3=6,则A为硫。B元素最外层的电子数为6÷2=3,则B为铝。已知C元素原子的核电荷数是电子层数的4倍,质子数为最外层电子数的6倍,4与6的最小公倍数为12,可见该元素原子的核内质子数应为12的倍数,又因为核电荷数小于18,故为Mg元素。
Mg
1
2
3
4
5
6
7
8
9
10
题组二 原子结构与元素性质的关系
6.(2019·丽水高一检测)核电荷数为1~18的元素中,下列叙述正确的是
A.最外层只有6个电子的元素最高正价为+6价
B.核电荷数是7的元素原子容易获得1个电子
C.原子核外各层电子数相等的元素一定是金属元素
D.最外层只有4个电子的元素一定是金属元素
√
解析 核电荷数为1~18的元素中,最外层只有6个电子的元素有氧和硫,氧无最高正价,A项错误;
核电荷数是7的元素为氮元素,它容易获得3个电子而达到稳定结构,B项错误;
最外层有4个电子的元素有碳和硅,它们均是非金属元素,D项错误;
原子核外各层电子数相等的元素为铍元素,它是金属元素,C项正确。
1
2
3
4
5
6
7
8
9
10
7.下列结构示意图表示的原子中,易变为阳离子并能够与氯离子组成XY2型化合物的是
1
2
3
4
5
6
7
8
9
10
A. B. C. D.
√
解析 A是非金属元素氧的原子结构,其形成的离子是阴离子;
B是稀有气体氖的原子结构,其不易变为离子;
C是金属元素钠的原子结构,其形成的离子是Na+,Na+与Cl-组成的化合物是NaCl;
D是金属元素镁的原子结构,其形成的离子是Mg2+,Mg2+与Cl-组成的化合物是MgCl2。
解析 最外层电子数决定元素的化学性质,当最外层电子数大于或等于4且小于8时,易得到电子;当最外层电子数小于4时,易失去电子;当最外层电子数等于8时,处于稳定结构。当然解题时还要注意特例:稀有气体中的氦,最外层只有2个电子,但为稳定结构。
8.根据下列结构示意图判断,化学性质最稳定的是
1
2
3
4
5
6
7
8
9
10
A. B. C. D.
√
9.根据微粒结构示意图的共同特征,可把 、 、 三种
1
2
3
4
5
6
7
8
9
10
解析 题干中三种微粒分别表示Na+、K+、Ca2+,它们都属于阳离子;选项中四种微粒分别表示Ne、S2-、Mg2+、F-。显然,Mg2+与它们同属阳离子,故选C。
微粒归为一类,下列微粒可以归为此类的是
A. B. C. D.
√
10.根据给出的原子或离子结构示意图,回答下列问题(填字母):
1
2
3
4
5
6
7
8
9
10
(1)电子层排布相同的是____。
(2)属于同种元素的是____。
(3)属于金属元素的是___。
(4)属于稀有气体元素的是__,稀有气体一般不参与化学反应的原因是
_____________________________________________________________
____________。
BC
AB
D
C
原子的最外电子层已达到8(或2)电子的稳定结构,既不易失去电子也不易得到电子
(5)写出D参加化学反应后所得离子的结构示意图_______。
1
2
3
4
5
6
7
8
9
10
解析 电子层排布相同是指电子层数和各电子层上的电子数均相同;决定元素种类的是核内质子数,即核电荷数;金属元素原子的最外电子层上的电子数一般较少;稀有气体原子最外电子层上一般为8个电子,He最外层为2个电子。
1.下列结构示意图所代表的微粒中,最难发生化学反应的是
B组 综合强化练
1
2
3
4
5
6
7
8
9
A. B. C. D.
√
10
1~6题是单项选择题,7~8题是不定项选择题
2.下列关于Fe、Fe2+、Fe3+的说法中,正确的是
①它们的质子数不同 ②它们的核外电子排布不同 ③它们的最外层电子数不同 ④它们的相对原子质量相同 ⑤它们的化学性质相同 ⑥它们是同种元素
A.①③⑤⑥ B.②④⑤⑥
C.②③④⑥ D.①②③⑥
√
1
2
3
4
5
6
7
8
解析 Fe、Fe2+、Fe3+属于同种元素的不同粒子,因为核外电子排布不同,所以它们的化学性质不同。
9
10
3.(2019·河北唐山第一中学高一期末)X、Y-、Z+三种微粒的电子层结构相同,则一定不可能再相等的是
A.中子数 B.质量数
C.核电荷数 D.电子数
√
1
2
3
4
5
6
7
8
解析 X、Y-、Z+三种微粒的电子层结构相同,在原子中,核电荷数=核内质子数=核外电子数;在阳离子中,核电荷数=核内质子数=核外电子数+电荷数;在阴离子中,核电荷数=核内质子数=核外电子数-电荷数,则三种微粒中核电荷数一定不能相等。
9
10
4.(2019·湘潭高一检测)某元素X的气态氢化物极易溶于水,其水溶液能使酚酞溶液显红色,则X元素的原子结构示意图为
1
2
3
4
5
6
7
8
解析 由题意知X的气态氢化物的水溶液呈碱性,则该氢化物为NH3,X为氮元素。
9
A. B. C. D.
√
10
1
2
3
4
5
6
7
8
5.A、B、C三种元素的核电荷数依次为a、b、c,它们的离子An+、Bn-、Cm-具有相同的电子层结构,且n>m,则下列关系正确的是
A.a>b>c B.a>c>b
C.a=b+m+n D.a=c-n-m
解析 An+和Bn-具有相同的电子层结构,则a-n=b+n,a=b+2n,a>b。An+和Cm-具有相同的电子层结构,则a-n=c+m,a=c+m+n,a>c,Bn-和Cm-具有相同的电子层结构,且n>m,b+n=c+m,b-c=m-n<0,故c>b,所以a>c>b,B项正确。
√
9
10
6.某元素原子的最外层电子数与次外层电子数相同,且最外层电子数与次外层电子数之和小于8,该元素为
A.锂 B.铍 C.氦 D.钙
√
1
2
3
4
5
6
7
8
9
解析 符合题意的原子结构示意图为 ,x为4,为铍元素。
10
解析 A项为能量最低原理,正确;
K层离原子核最近,能量最低,B正确;
次外层电子数不超过18,C错误;
各电子层最多容纳电子数为2n2,D错误。
1
2
3
4
5
6
7
8
7.不符合原子核外电子排布基本规律的是
A.核外电子总是优先排在能量最低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为8
D.各电子层(n)最多可容纳的电子数为n2
√
9
10
√
1
2
3
4
5
6
7
8
8.下列微粒电子数相同的一组是
A.Na+和K+ B.CH4和
C. 和Cl- D.O2-和
9
解析 各微粒电子数分别为A中Na+:10,K+:18;
B中CH4:10, :10;
C中 :10,Cl-:18;
D中O2-:10, :8。
√
10
9.有A、B、C、D、E五种微粒。已知:
①当A微粒失去3个电子后,其电子层结构与氖原子相同;
②当B微粒得到1个电子后,其电子层结构与氩原子相同;
③C微粒带两个单位正电荷,核电荷数为12;
④D微粒有18个电子,当失去2个电子后显电中性;
⑤E微粒不带电,原子核中只有一个质子。
请回答:
(1)写出这五种微粒的化学符号:
A____,B____,C______,D_____,E_____。
1
2
3
4
5
6
7
8
9
Al
Cl
Mg2+
S2-
H
10
1
2
3
4
5
6
7
8
9
解析 氖原子核外有10个电子,故A的核外有13个电子,A为铝原子;
氩原子核外有18个电子,B微粒得到1个电子后核外有18个电子,故B为氯原子;
C为Mg2+;
D微粒有18个电子,失去2个电子后显中性,故D为S2-;
E原子核内只有一个质子,故E为H。
10
(2)B微粒的结构示意图为________,C微粒的结构示意图为______。
(3)A的单质与EB溶液反应的离子方程式为_________________________。
1
2
3
4
5
6
7
8
9
2Al+6H+===2Al3++3H2↑
10
10.(2019·厦门高一月考)(1)某元素原子的核电荷数是电子层数的5倍,其
1
2
3
4
5
6
7
8
9
质子数是最外层电子数的3倍,该元素的原子结构示意图是______。
解析 设:核电荷数=质子数=a,元素原子的电子层数为x,最外层电子数为y,依题意:a=5x,a=3y,则5x=3y,x= 。因原子的最外层电子数不超过8,即y为1~8的正整数,故仅当y=5,x=3时合理,该元素的核电荷数为15。
10
(2)已知某粒子的结构示意图为 。
试回答:
①当x-y=10时,该粒子为_____(填“原子”“阳离子”或“阴离子”)。
1
2
3
4
5
6
7
8
返回
9
解析 当x-y=10时,x=10+y,说明核电荷数等于核外电子数,所以该粒子应为原子。
原子
②当y=8时,粒子可能为________、________、________、________、____________________(填名称)。
氩原子
氯离子
硫离子
钾离子
钙离子(答案合理即可)
10
本课结束
1.了解原子核外电子运动特点。
2.掌握原子核外电子排布规律。
3.能用原子(离子)结构示意图表示常见原子(离子)的核外电子排布。
4.了解微观结构决定宏观性质的规律。
核心素养发展目标
一、核外电子排布
随堂演练 知识落实
课时对点练
二、原子结构与元素性质的关系
内
容
索
引
1.电子层与其电子的能量
一、核外电子排布
各电子层
(由内到外)
序号(n)
1
2
3
4
5
6
7
符号
__
__
__
N
O
P
Q
与原子核的距离
由___到___
能量
由___到___
K
L
M
近
远
低
高
2.原子核外电子排布的一般规律
能量最低
由内向外
能量较高
2n2
8
2
18
32
3.核外电子排布的表示方法——原子结构示意图
(1)钠原子的结构示意图如下,请注明其意义:
电子层
该电子层上的电子数
粒子符号
原子核
核电荷数
(2)离子结构示意图:Cl- ;Na+
(1)电子的能量越低,运动区域离核越远( )
(2)在多电子原子里,电子的能量不完全相同( )
判断正误
(3)钾原子的结构示意图为 ( )
(4)M层为最外层时,最多容纳18个电子( )
(5)原子的次外层电子数都为8( )
×
√
×
×
×
1.某元素原子的最外层电子数是次外层的a倍(a>1),则该原子的核内质子数是
A.2a+2 B.2a+10
C.a+2 D.2a
理解应用
解析 原子核外电子的排布规律是:最外层不超过8个,次外层不超过18个,某元素的最外层电子数是次外层的a倍(a>1),所以该元素的次外层只能是K层,2个电子,最外层是L层,电子数是2a,所以该元素的核外电子总数是2a+2,而原子的核内质子数=核外电子数。
√
返回
2.根据下列叙述,画出对应微粒的结构示意图。
(1)A元素原子的最外层电子数为电子层数的3倍:________。
(2)与Ar原子电子层结构相同的-1价阴离子:_________。
(3)质量数为23、中子数为12的原子:________。
二、原子结构与元素性质的关系
元素的性质与原子的核外电子排布密切相关,元素的化学性质主要取决于原子的 层电子排布,元素的化合价的数值也与原子的电子层结构特别是 层电子数有关。
1.金属元素原子最外层电子数一般 4,较易 电子,化合价常显__
价,且正化合价=失电子数=最外层电子数。
2.非金属元素原子最外层电子数一般 4,通常易 电子,在化合物中化合价常显 价,且负化合价=-(得电子数)=最外层电子数-8。
最外
最外
小于
失去
正
大于或等于
得到
负
3.稳定结构与不稳定结构
(1)稳定结构:原子最外层有8个电子(He为2)处于稳定状态,既不容易失去电子又不容易得到电子,化学性质稳定(如He、Ne、Ar)。
(2)不稳定结构:原子容易失去电子或得到电子转化为最外电子层上为8(有些为2)个电子的稳定结构(如易失电子的金属元素、易得电子的非金属元素)。
(1)最外层只有1个电子的元素一定是金属元素( )
(2)最外层电子数是次外层电子数2倍的元素的原子容易失去电子成为阳离子( )
(3)S原子的最外层电子数为6,故其最高正价为+6( )
(4)Mg2+、O2-、Ne电子层排布相同,故所含电子总数相等( )
判断正误
×
(5)Na+的结构示意图为 ,最外层达到8电子稳定结构,不易得失电子
( )
(6)元素性质是由最外层电子数决定的,稀有气体元素原子最外层电子都达到2或8个,所以稀有气体很稳定( )
×
√
√
√
√
(2019·陕西黄陵中学高一期末)观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:
理解应用
(1)属于离子结构示意图的是____、____(填字母,下同)。
B
E
解析 根据结构示意图可知A是氯原子,B是氧离子,C是氖原子,D是钠原子,E是镁离子。结构示意图中质子数与核外电子数不相等的是离子。
(2)性质最稳定的原子是____,最容易失去电子的原子是____,最容易得到电子的原子是____。
解析 稀有气体元素原子最外层已达到稳定结构,性质最稳定;金属元素的原子易失去电子,非金属元素的原子易得到电子。
C
D
A
解析 核外有10个电子的离子有氧离子、氟离子、钠离子、镁离子、铝离子。
(3)A、D两种元素形成的化合物在水溶液中的电离方程式:___________
_____。
解析 A、D两种元素形成的化合物为NaCl,NaCl在水溶液中电离出钠离子和氯离子,电离方程式为NaCl===Na++Cl-。
NaCl===Na+
+Cl-
(4)在核电荷数1~18的元素内,列举两个与B核外电子层排布相同的离子,写出离子的符号_____、______________。
Na+
Al3+(合理即可)
返回
1.原子核外每个电子层上均含有2n2个电子的元素是
A.Be B.C C.Ar D.Ne
√
1
2
3
5
随堂演练 知识落实
4
6
解析 n=1,该层电子数为2;n=2,该层电子数为8,即 ,则该元素为Ne。
A. B. C. D.
2.下列各原子结构示意图中所表示的核外电子排布正确的是
1
2
3
5
4
解析 解答此题时应注意:①电子排布遵循能量最低原理;②各电子层最多所能容纳的电子数目为2n2;③原子最外层电子数不能超过8(K层为最外层时不能超过2)。A项不符合能量最低原理,应该先排满K层再排L层,所以错误;
B项不符合各层最多排2n2个电子,K层最多排2个电子,所以错误;
D项不符合最外层最多只能排8个电子,所以错误。
√
6
3.某原子核外共有n个电子层(n>3),则n-1层最多容纳的电子数为
A.8个 B.18个
C.32个 D.2(n-1)2个
√
1
2
3
5
4
6
解析 某原子核外有n个电子层,则n-1层为次外层,最多容纳电子数为18个。
4.下列说法正确的是
A.某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子
B.最外层电子达到稳定结构的微粒只能是稀有气体的原子
C.F-、Na+、Mg2+、Al3+是与Ne原子具有相同电子层结构的离子
D.某元素原子的最外层只有2个电子,则该元素一定是金属元素
√
1
2
3
5
4
6
1
2
3
5
4
6
解析 电子排布为2、8、8结构的微粒还可能为S2-、Cl-等,A项错误;
O2-、F-、Cl-、Li+、Na+、Mg2+等微粒最外层电子数均达到了稳定结构,B项错误;
F-、Na+、Mg2+、Al3+核外电子排布均为2、8结构,与Ne原子的电子层结构相同,C项正确;
He原子的最外层只有2个电子,但He元素是稀有气体元素,D项错误。
5.今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍,A和B分别是
A.硅原子和钠原子 B.硼原子和氢原子
C.氯原子和碳原子 D.碳原子和铝原子
1
2
3
5
4
√
6
解析 设A原子L、M层电子数分别为x、y,依题意,A、B两原子的电子层结构为:
1
2
3
5
4
6
电子层
K
L
M
A原子
2
x
y
B原子
2
2x
y+3
B原子的M层至少有3个电子,因而其L层的电子数必然是8,求得x=4。对A原子来说,L层有4个电子时只能是最外层,即y=0,y+3=3。因此,这两个原子分别为碳原子和铝原子,故D项正确。
1
2
3
5
4
6.写出1~18号元素中符合下列条件的原子(或离子)的微粒符号,并画出其结构示意图。
(1)某元素原子L层上的电子数为K层的3倍:___________。
6
O:
(2)某元素原子L层上的电子数为K层的一半:____________。
Li:
(3)某元素原子得到2个电子后所形成的电子总数与氩原子的电子总数相同
S2-:
的离子:______________。
(4)某元素原子的最外层电子数等于次外层电子数的2倍:__________。
C:
返回
课时对点练
1
2
3
4
5
6
7
8
9
10
题组一 核外电子排布
1.下列说法中肯定错误的是
A.某原子K层上只有1个电子
B.某原子M层上电子数为L层电子数的4倍
C.某离子M层上和L层上的电子数均为K层的4倍
D.某离子的核电荷数与最外层电子数相等
√
A组 基础对点练
1
2
3
4
5
6
7
8
9
10
解析 K、L、M层上最多容纳的电子数分别为2、8、18,K层上可以有1~2个电子,A正确;
当M层上排有电子时,L层上一定排满电子,即L层上的电子数为8,由于18<8×4,故B错误;
当K、L层排满电子,即电子数分别是2、8时,M层上的电子数也可以是8,例如Cl-、K+均属于这种情况,C正确;
O2-的核电荷数与最外层电子数均为8,故D正确。
2.具有下列结构示意图的微粒,既可以是原子又可以是阴离子和阳离子的是
1
2
3
4
5
6
7
8
9
10
A. B. C. D.
√
解析 A项中x=13,为Al原子,错误;
B项中,只能为氮原子,x=7,错误;
C项中,若x=18,为Ar原子,若x=17,为Cl-,若x=19,为K+,正确;
D项中,只能为氯原子,x=17,错误。
3.某元素的原子核外有三个电子层,最外层电子数是4,该原子核内的质子数是
A.14 B.15 C.16 D.17
√
1
2
3
4
5
6
7
8
9
10
解析 核外有三层,最外层上有4个电子,则第一、第二层已排满,每层
电子数分别为2、8、4,则该原子结构示意图为 ,故选A。
4.下列离子中,所带电荷数与该离子的核外电子层数相等的是
A.Al3+ B.Mg2+ C.Be2+ D.H+
1
2
3
4
5
6
7
8
9
10
√
解析 四种离子的核外电子层数分别是2、2、1、0。
5.有A、B、C三种元素,核电荷数均小于18。已知A元素原子的核电荷数大于B元素原子的核电荷数,但两种元素的原子具有相同数目的电子层,A元素最外层电子数为B元素的两倍,A元素原子第三层电子数为第一层电子数的三倍,C元素原子的核电荷数是电子层数的4倍,其质子数为最外层电子数的6倍。请回答下列问题:
1
2
3
4
5
6
7
8
9
10
(1)A的原子结构示意图:_________;A元素的名称:____。
硫
(2)B的原子结构示意图:_________;B元素的名称:_____。
铝
(3)C的离子结构示意图:________;C元素的符号:______。
1
2
3
4
5
6
7
8
9
10
解析 因为最内层最多容纳2个电子,又已知A元素第三层电子数是第一层电子数的3倍,所以第三层电子数为2×3=6,则A为硫。B元素最外层的电子数为6÷2=3,则B为铝。已知C元素原子的核电荷数是电子层数的4倍,质子数为最外层电子数的6倍,4与6的最小公倍数为12,可见该元素原子的核内质子数应为12的倍数,又因为核电荷数小于18,故为Mg元素。
Mg
1
2
3
4
5
6
7
8
9
10
题组二 原子结构与元素性质的关系
6.(2019·丽水高一检测)核电荷数为1~18的元素中,下列叙述正确的是
A.最外层只有6个电子的元素最高正价为+6价
B.核电荷数是7的元素原子容易获得1个电子
C.原子核外各层电子数相等的元素一定是金属元素
D.最外层只有4个电子的元素一定是金属元素
√
解析 核电荷数为1~18的元素中,最外层只有6个电子的元素有氧和硫,氧无最高正价,A项错误;
核电荷数是7的元素为氮元素,它容易获得3个电子而达到稳定结构,B项错误;
最外层有4个电子的元素有碳和硅,它们均是非金属元素,D项错误;
原子核外各层电子数相等的元素为铍元素,它是金属元素,C项正确。
1
2
3
4
5
6
7
8
9
10
7.下列结构示意图表示的原子中,易变为阳离子并能够与氯离子组成XY2型化合物的是
1
2
3
4
5
6
7
8
9
10
A. B. C. D.
√
解析 A是非金属元素氧的原子结构,其形成的离子是阴离子;
B是稀有气体氖的原子结构,其不易变为离子;
C是金属元素钠的原子结构,其形成的离子是Na+,Na+与Cl-组成的化合物是NaCl;
D是金属元素镁的原子结构,其形成的离子是Mg2+,Mg2+与Cl-组成的化合物是MgCl2。
解析 最外层电子数决定元素的化学性质,当最外层电子数大于或等于4且小于8时,易得到电子;当最外层电子数小于4时,易失去电子;当最外层电子数等于8时,处于稳定结构。当然解题时还要注意特例:稀有气体中的氦,最外层只有2个电子,但为稳定结构。
8.根据下列结构示意图判断,化学性质最稳定的是
1
2
3
4
5
6
7
8
9
10
A. B. C. D.
√
9.根据微粒结构示意图的共同特征,可把 、 、 三种
1
2
3
4
5
6
7
8
9
10
解析 题干中三种微粒分别表示Na+、K+、Ca2+,它们都属于阳离子;选项中四种微粒分别表示Ne、S2-、Mg2+、F-。显然,Mg2+与它们同属阳离子,故选C。
微粒归为一类,下列微粒可以归为此类的是
A. B. C. D.
√
10.根据给出的原子或离子结构示意图,回答下列问题(填字母):
1
2
3
4
5
6
7
8
9
10
(1)电子层排布相同的是____。
(2)属于同种元素的是____。
(3)属于金属元素的是___。
(4)属于稀有气体元素的是__,稀有气体一般不参与化学反应的原因是
_____________________________________________________________
____________。
BC
AB
D
C
原子的最外电子层已达到8(或2)电子的稳定结构,既不易失去电子也不易得到电子
(5)写出D参加化学反应后所得离子的结构示意图_______。
1
2
3
4
5
6
7
8
9
10
解析 电子层排布相同是指电子层数和各电子层上的电子数均相同;决定元素种类的是核内质子数,即核电荷数;金属元素原子的最外电子层上的电子数一般较少;稀有气体原子最外电子层上一般为8个电子,He最外层为2个电子。
1.下列结构示意图所代表的微粒中,最难发生化学反应的是
B组 综合强化练
1
2
3
4
5
6
7
8
9
A. B. C. D.
√
10
1~6题是单项选择题,7~8题是不定项选择题
2.下列关于Fe、Fe2+、Fe3+的说法中,正确的是
①它们的质子数不同 ②它们的核外电子排布不同 ③它们的最外层电子数不同 ④它们的相对原子质量相同 ⑤它们的化学性质相同 ⑥它们是同种元素
A.①③⑤⑥ B.②④⑤⑥
C.②③④⑥ D.①②③⑥
√
1
2
3
4
5
6
7
8
解析 Fe、Fe2+、Fe3+属于同种元素的不同粒子,因为核外电子排布不同,所以它们的化学性质不同。
9
10
3.(2019·河北唐山第一中学高一期末)X、Y-、Z+三种微粒的电子层结构相同,则一定不可能再相等的是
A.中子数 B.质量数
C.核电荷数 D.电子数
√
1
2
3
4
5
6
7
8
解析 X、Y-、Z+三种微粒的电子层结构相同,在原子中,核电荷数=核内质子数=核外电子数;在阳离子中,核电荷数=核内质子数=核外电子数+电荷数;在阴离子中,核电荷数=核内质子数=核外电子数-电荷数,则三种微粒中核电荷数一定不能相等。
9
10
4.(2019·湘潭高一检测)某元素X的气态氢化物极易溶于水,其水溶液能使酚酞溶液显红色,则X元素的原子结构示意图为
1
2
3
4
5
6
7
8
解析 由题意知X的气态氢化物的水溶液呈碱性,则该氢化物为NH3,X为氮元素。
9
A. B. C. D.
√
10
1
2
3
4
5
6
7
8
5.A、B、C三种元素的核电荷数依次为a、b、c,它们的离子An+、Bn-、Cm-具有相同的电子层结构,且n>m,则下列关系正确的是
A.a>b>c B.a>c>b
C.a=b+m+n D.a=c-n-m
解析 An+和Bn-具有相同的电子层结构,则a-n=b+n,a=b+2n,a>b。An+和Cm-具有相同的电子层结构,则a-n=c+m,a=c+m+n,a>c,Bn-和Cm-具有相同的电子层结构,且n>m,b+n=c+m,b-c=m-n<0,故c>b,所以a>c>b,B项正确。
√
9
10
6.某元素原子的最外层电子数与次外层电子数相同,且最外层电子数与次外层电子数之和小于8,该元素为
A.锂 B.铍 C.氦 D.钙
√
1
2
3
4
5
6
7
8
9
解析 符合题意的原子结构示意图为 ,x为4,为铍元素。
10
解析 A项为能量最低原理,正确;
K层离原子核最近,能量最低,B正确;
次外层电子数不超过18,C错误;
各电子层最多容纳电子数为2n2,D错误。
1
2
3
4
5
6
7
8
7.不符合原子核外电子排布基本规律的是
A.核外电子总是优先排在能量最低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为8
D.各电子层(n)最多可容纳的电子数为n2
√
9
10
√
1
2
3
4
5
6
7
8
8.下列微粒电子数相同的一组是
A.Na+和K+ B.CH4和
C. 和Cl- D.O2-和
9
解析 各微粒电子数分别为A中Na+:10,K+:18;
B中CH4:10, :10;
C中 :10,Cl-:18;
D中O2-:10, :8。
√
10
9.有A、B、C、D、E五种微粒。已知:
①当A微粒失去3个电子后,其电子层结构与氖原子相同;
②当B微粒得到1个电子后,其电子层结构与氩原子相同;
③C微粒带两个单位正电荷,核电荷数为12;
④D微粒有18个电子,当失去2个电子后显电中性;
⑤E微粒不带电,原子核中只有一个质子。
请回答:
(1)写出这五种微粒的化学符号:
A____,B____,C______,D_____,E_____。
1
2
3
4
5
6
7
8
9
Al
Cl
Mg2+
S2-
H
10
1
2
3
4
5
6
7
8
9
解析 氖原子核外有10个电子,故A的核外有13个电子,A为铝原子;
氩原子核外有18个电子,B微粒得到1个电子后核外有18个电子,故B为氯原子;
C为Mg2+;
D微粒有18个电子,失去2个电子后显中性,故D为S2-;
E原子核内只有一个质子,故E为H。
10
(2)B微粒的结构示意图为________,C微粒的结构示意图为______。
(3)A的单质与EB溶液反应的离子方程式为_________________________。
1
2
3
4
5
6
7
8
9
2Al+6H+===2Al3++3H2↑
10
10.(2019·厦门高一月考)(1)某元素原子的核电荷数是电子层数的5倍,其
1
2
3
4
5
6
7
8
9
质子数是最外层电子数的3倍,该元素的原子结构示意图是______。
解析 设:核电荷数=质子数=a,元素原子的电子层数为x,最外层电子数为y,依题意:a=5x,a=3y,则5x=3y,x= 。因原子的最外层电子数不超过8,即y为1~8的正整数,故仅当y=5,x=3时合理,该元素的核电荷数为15。
10
(2)已知某粒子的结构示意图为 。
试回答:
①当x-y=10时,该粒子为_____(填“原子”“阳离子”或“阴离子”)。
1
2
3
4
5
6
7
8
返回
9
解析 当x-y=10时,x=10+y,说明核电荷数等于核外电子数,所以该粒子应为原子。
原子
②当y=8时,粒子可能为________、________、________、________、____________________(填名称)。
氩原子
氯离子
硫离子
钾离子
钙离子(答案合理即可)
10
本课结束
