高中化学苏教版(2019)必修第一册 专题2 第三单元 第1课时 人类认识原子结构的历程 原子核的构成(55张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)必修第一册 专题2 第三单元 第1课时 人类认识原子结构的历程 原子核的构成(55张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-16 17:47:01 | ||
图片预览











文档简介
第1课时 人类认识原子结构的历程
原子核的构成
1.了解原子结构模型的演变,培养探索未知崇尚真理的意识。
2.熟知原子的构成,会正确计算微粒的质量数、质子数、中子数。
3.知道元素、核素、同位素的概念,并了解它们之间的关系。
核心素养发展目标
一、人类认识原子结构的历程
随堂演练 知识落实
课时对点练
二、原子核的构成
内
容
索
引
1.古希腊哲学家德谟克利特——原子论。
2.19世纪初,英国科学家道尔顿—— 学说,他认为原子是实心球体。
3.1904年,英国物理学家汤姆生—— 原子模型,他在1897年发现了原子中存在 。
4.1911年,英国物理学家卢瑟福—— 模型或 模型。
他通过“α粒子散射实验”,推测原子中心存在 ,带 。电子带负电,在其周围 ,就像行星围绕太阳运转一样。
一、人类认识原子结构的历程
原子
葡萄干面包式
有核
行星
原子核
正电
高速运行
电子
5.1913年,丹麦物理学家玻尔——引入 观点。
他提出了新的原子结构模型:原子核外,电子在一系列稳定的 上运动,每个轨道都具有一个 的能量值;核外电子在这些稳定的轨道上运动时,既不 ,也不 。
6.20世纪末和21世纪初——新的飞速发展(量子力学模型)。
量子论
轨道
确定
放出能量
吸收能量
(1)从原子结构模型的发展历程可以看出,一些理论会随着人们知识的积累和方法与技术的积累而不断完善或改进( )
(2)英国物理学家汤姆生认为正、负电荷均匀地分布在原子中( )
(3)随着科学技术的发展,人们对微观世界的认识逐渐清晰和深化( )
判断正误
√
√
√
1.人类对原子结构的认识经历了漫长的历史阶段。下列实验事实与原子结构模型建立的关系正确的是
A.电子的发现:道尔顿的原子结构模型
B.α粒子散射:卢瑟福原子结构模型
C.α粒子散射:玻尔原子结构模型
D.氢原子光谱:卢瑟福原子结构模型
应用体验
√
解析 道尔顿的原子结构模型是道尔顿通过对大气的物理性质进行研究而提出的;卢瑟福原子结构模型是通过α粒子散射实验提出的;玻尔原子结构模型是玻尔在牛顿力学的基础上吸收了量子论和光子学说的思想建立起来的。
A.(1)(3)(2)(5)(4) B.(1)(2)(3)(4)(5)
C.(1)(5)(3)(2)(4) D.(1)(3)(5)(4)(2)
返回
2.如图所示的原子结构模型的演变图中,(1)为道尔顿实心球式原子模型,(2)为卢瑟福行星运转式原子模型,(3)为汤姆生葡萄干面包式原子模型,(4)为近代量子力学原子模型,(5)为玻尔轨道式原子模型。其中符合历史演变的顺序的一组为
√
二、原子核的构成
1.原子的组成
(1)原子
原子核
质子:带 个单位正电荷
中子:不带电
核外电子:带 个单位负电荷
1
1
(2)质量数:将原子核内所有的 和 的相对质量取整数加起来所得的数值,用 表示。
(3)构成原子的微粒间的两个关系
①质量数(A)=____________________
②质子数=核外电子数= =原子序数。
质子
中子
A
质子数(Z)+中子数(N)
核电荷数
(4)原子组成的表示方法
______
______
元素符号
质量数
质子数
如作为相对原子质量标准的 C表示质子数为 ,质量数为 的碳原子。
6
12
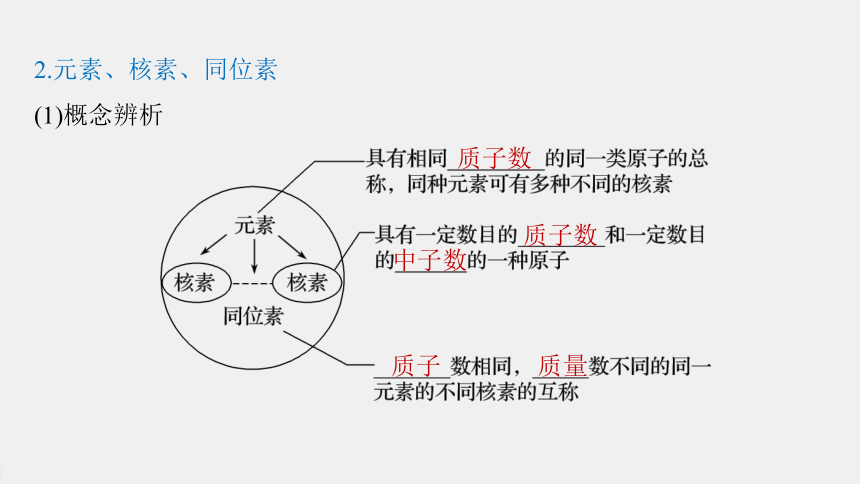
2.元素、核素、同位素
(1)概念辨析
质子数
质子数
中子数
质子
质量
?
(氕)
(氘)
(氚)
俗称
-
重氢
超重氢
符号
___
___
___
质子数
1
1
1
中子数
___
___
___
(2)氢元素的三种核素
H
D
T
0
1
2
(3)同位素的应用
①____在考古工作中用于测定文物的年代;
② U用于制造原子弹、核发电;
③_______用于制造氢弹;
④放射性同位素释放的射线可用于育种、治疗恶性肿瘤等。
14C
(1)原子呈电中性是因为中子不带电( )
(2)质子数和中子数决定原子的质量( )
(3)34S原子核内中子数为16( )
(4)2H+核外电子数为2( )
(5)13C和15N核内中子数相差1( )
(6)质量数就是元素的相对原子质量( )
(7)O2和O3、红磷和白磷均互称同位素( )
(8)一种单质中可能含有多种核素,如O2中可能含16O、17O、18O三种核素
( )
判断正误
×
√
×
×
√
×
×
√
填空
(1) 中的质子数是____,中子数是_____,核外电子数是_____,质量数是_____。
(2)微粒“AXn-”核外有18个电子,则它的核电荷数为______,核内中子数为__________。
(3)由1H216O与2H217O所代表的物质中,共有___种元素,___种原子,___种分子,互为同位素的原子有__________________。
理解应用
16
18
18
34
18-n
A-(18-n)
2
4
2
1H和2H、16O和17O
(1)一个信息丰富的符号解读
归纳总结
(2)粒子中的电性关系
①分子或原子:质子数=核电荷数=核外电子数
②阳离子Xn+:质子数=核电荷数=核外电子数+n
③阴离子Xn-:质子数=核电荷数=核外电子数-n
返回
1.(2020·杭州高一月考)19世纪初,某科学家提出原子学说,他认为物质由原子组成,原子不能被创造,也不能被毁灭,在化学反应中不能再分,这个科学家是
A.汤姆生 B.道尔顿 C.卢瑟福 D.玻尔
√
1
2
3
5
随堂演练 知识落实
4
6
氢元素中1H不含中子,C错误;
12C与13C质子数相同(均为6),中子数不同(前者为6,后者为7),互为同位素,D正确。
2.下列有关说法中,你认为不正确的是
1
2
3
5
4
解析 由于同位素的存在,所以原子种类大于元素种类,A正确;
√
电子质量只有质子质量的 ,B正确;
6
3.下列关于原子结构的说法正确的是
A.所有的原子都含有质子、中子和电子三种基本构成微粒,且个数都是
相等的
B.质子数决定元素的种类,中子数决定核素的种类
C.原子核对电子吸引作用的实质是原子核中的质子对核外电子的吸引
D.原子中的质子、中子和电子三种基本构成微粒不可能再进一步分成更
小的微粒
√
1
2
3
5
4
6
解析 氢原子 的原子核内没有中子,核素种类是由质子数和中子数共同决定的,A、B项错误;
原子核对核外电子的吸引作用就是质子对电子的吸引,C项正确;
以发展的观点分析,原子中的基本构成微粒有可能再进一步分成更小的微粒,如科学家研究发现了质子和中子里面还有更小的微粒——夸克,D项错误。
1
2
3
5
4
6
4.YBa2Cu8Ox(Y为钇元素)是磁悬浮列车中的重要超导材料,下列关于
的说法中不正确的是
A.质量数是89 B.中子数与质子数之差为50
C.核外电子数是39
√
1
2
3
5
4
6
5.某元素的阳离子Rn+,核外共有x个电子,原子的质量数为A,则该元素原子的中子数为
A.A-x-n B.A-x+n C.A+x-n D.A+x+n
1
2
3
5
4
解析 质量数=质子数+中子数,因此要求中子数必须先要知道质量数和质子数。阳离子Rn+中质子数等于阳离子的核外电子数加上阳离子所带的正电荷数,所以,该原子的中子数为A-(x+n)=A-x-n。
√
6
1
2
3
5
4
6.(2019·东营高一检测)现有下列基本微粒:
1H、2H、3H、1H+、234U、235U、238U、 、40K、40Ca、Cl2、14N、14C,请回答下列问题:
(1)在给出的微粒中,含有____种元素,属于氢元素的核素有____种,属于铀元素的核素有_____种,互为同位素的原子分别是_____________,_______________。
6
7
3
3
1H、2H、3H
234U、235U、238U
解析 共有7种元素,氢元素中有1H、2H、3H三种核素,铀元素有234U、235U、238U三种核素,上述三种氢原子、三种铀原子各自互为同位素。
1
2
3
5
4
(2)质量数相等的微粒为________、__________、________(可不填满,也可补充)。
6
解析 质量数相等的微粒有:1H与1H+、40K与40Ca、14N与14C。
1H与1H+
40K与40Ca
14N与14C
(3)氢的同位素1H、2H、3H与氧的同位素16O、17O、18O相互结合为水,可得水分子的种数为____,可得___种不同的相对分子质量。
18
7
解析 结合成水分子种数:①每2个相同氢原子核素分别与三个氧原子结合成9种;
②任意2个不同氢原子核素分别与三个氧原子结合成9种,共有18种;得到水分子的相对分子质量为18、19、20、21、22、23、24,共7种。
1
2
3
5
4
返回
(4)0.1 mol 中共含______mol中子,含_______个电子。
6
解析 每个 中含质子数为7×3=21,中子数为(14-7)×3=21,电子数为22,则0.1 mol 含2.1 mol中子,含2.2 NA个电子。
2.1
2.2NA
课时对点练
1
2
3
4
5
6
7
8
9
10
题组一 人类认识原子结构的历程
1.提出原子结构模型的科学家,从时间的先后顺序来看,下列排列正确的是
A.汤姆生、玻尔、卢瑟福、道尔顿
B.汤姆生、玻尔、道尔顿、卢瑟福
C.卢瑟福、道尔顿、汤姆生、玻尔
D.道尔顿、汤姆生、卢瑟福、玻尔
√
A组 基础对点练
1
2
3
4
5
6
7
8
9
10
解析 19世纪初,道尔顿提出了原子学说;1904年汤姆生提出了一个被称为“葡萄干面包式”的原子结构模型;1911年卢瑟福提出了带核的原子结构模型;1913年玻尔提出了新的原子结构模型。
2.提出“有核模型”的科学家是
A.汤姆生 B.卢瑟福
C.道尔顿 D.玻尔
√
1
2
3
4
5
6
7
8
9
10
题组二 原子核的构成
3.某元素B的核电荷数为Z。已知Bn-、Am+的核外具有相同的电子数,则A元素的质子数用Z、n、m来表示,应为
A.Z+n-m B.Z-n+m
C.Z-n-m D.Z+m+n
√
1
2
3
4
5
6
7
8
9
10
解析 设A元素的质子数为x,则有Z+n=x-m,x=Z+m+n。
4.已知R2+核内共有N个中子,R的质量数为A,确定m g R2+中含有电子的物质的量为
1
2
3
4
5
6
7
8
9
10
√
5.已知阳离子R2+核外有a个电子和b个中子。表示R原子符号正确的是
√
1
2
3
4
5
6
7
8
9
10
解析 阳离子R2+核外有a个电子,阳离子的质子数=核外电子数+离子所带电荷数=a+2,质量数=质子数+中子数=a+2+b,所以R原子可表示为 ,C正确。
1
2
3
4
5
6
7
8
9
10
6.13C-NMR(核磁共振)可用于含碳化合物的结构分析,15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下列有关13C、15N的叙述正确的是
A.13C与15N具有相同的中子数
B.13C与C60是同一种物质
C.15N与14N互为同位素
D.15N的核外电子数与中子数相同
√
解析 13C与15N的中子数分别是7和8,A不正确;
具有一定数目质子和一定数目中子的一种原子是核素,即13C是一种核素,而C60是一种单质,B不正确;
质子数相同、中子数不同的同一种元素的不同核素互称为同位素,C正确;
15N的核外电子数与中子数分别是7和8,D不正确。
1
2
3
4
5
6
7
8
9
10
7.下列各组中互为同位素的是
A. B.T2O与H2O
C. D.金刚石与石墨
√
1
2
3
4
5
6
7
8
9
10
解析 是不同种元素,因此不互为同位素,A错误;
T2O与H2O是由不同的H原子构成的水分子,物质的化学性质相同但是二者不是原子,因此不互为同位素,B错误;
属于同一种元素,质子数相同而中子数不同,因此二者互为同位素,C正确;
金刚石与石墨是由同种元素组成的结构不同的两种单质,D错误。
解析 氘(D)原子的质子数为1,核外有1个电子,A正确;
1H与D的质子数相同而中子数不同,互为同位素,B正确;
H2O与D2O的相对分子质量分别为18和20,不相同,C错误;
1H218O与D216O的相对分子质量相等,D正确。
8.重水(D2O)是重要的核工业原料,下列说法错误的是
A.氘(D)原子核外有1个电子
B.1H与D互为同位素
C.H2O与D2O相对分子质量相同
D.1H218O与D216O的相对分子质量相同
1
2
3
4
5
6
7
8
9
10
√
9.“玉兔”号月球车用 作为热源材料,下列关于 的说法正确的是
A. 与 互为同位素
B. 与 具有完全相同的物理性质
C. 与 具有完全相同的化学性质
D. 与 具有相同的最外层电子数
√
1
2
3
4
5
6
7
8
9
10
解析 质子数相同、中子数不同的同一元素的不同核素互为同位素,
与 的质子数不同,不互为同位素,故A错误;
与 的质子数不同,属于不同的元素,其化学性质不同,故C错误;
与 具有相同的质子数,所以其核外电子数相同,则具有相同的最外层电子数,故D正确。
10.据报道,某些花岗岩会产生氡( ),从而对人体产生伤害。请回答下列问题:
(1)该原子的质量数是_____,质子数是_____,中子数是______。
1
2
3
4
5
6
7
8
9
10
222
86
136
解析 的质量数是222,质子数是86,中子数是222-86=136。
1
2
3
4
5
6
7
8
9
10
(2)研究发现,镭能蜕变为 ,故将 称为镭射气;钍能蜕变为
,故将 称为钍射气;锕能蜕变为 ,故将 称为锕射气。
_____(填字母)。
A.属于同种元素 B.互为同位素
C.属于同种核素 D.属于同种原子
AB
解析 的质子数相同,属于同种元素但三者的中子数不同,故三者互为同位素。
(3)由(2)可知,_______决定元素种类,_______________决定核素种类。
解析 质子数决定元素种类;质子数和中子数共同决定核素种类。
质子数
质子数和中子数
1.(2019·镇江高一检测)下列叙述正确的是
A.40K和40Ca原子中质子数和中子数都不相等
B.金刚石和石墨的性质相同
C.H2和D2互为同位素
D.某物质只含一种元素,该物质一定是纯净物
√
B组 综合强化练
1
2
3
4
5
6
7
8
9
1~5题是单项选择题,6~7题是不定项选择题
解析 因为40K的质子数是19,40Ca的质子数是20,两者质量数相同,质子数不同,所以中子数也不相等,A正确;
金刚石和石墨都是由碳元素组成的,由于它们的晶体结构不同,性质上也存在差异,如硬度、导电性都不同,在化学性质上也不完全相同,金刚石相对稳定,B不正确;
H2和D2是单质分子,不符合同位素的概念,C不正确;
白磷和红磷混在一起,虽然体系中只有一种元素,却存在着结构完全不同的两种分子,所以不是纯净物,D不正确。
1
2
3
4
5
6
7
8
9
2.(2019·南宁高一检测)科学家发现两种微粒:第一种是由四个中子构成的微粒“四中子”;第二种是由四个氧原子构成的分子。下列关于这两种微粒的说法不正确的是
A.“四中子”不显电性
B.“四中子”的质量数为4
C.第二种微粒是氧元素的另一种同位素
D.第二种微粒的化学式为O4
√
1
2
3
4
5
6
7
8
解析 中子是不带电的微粒,所以“四中子”不显电性,A正确;
根据质量数与中子数、质子数的关系知“四中子”质量数为4,B正确;
四个氧原子构成的分子是一种氧单质,化学式为O4,C错误,D正确。
9
3.230Th和232Th是钍的两种同位素,232Th可以转化成233U。下列有关Th的说法正确的是
A.Th元素的质量数是232 B.Th元素的相对原子质量是231
C.232Th转换成233U是化学变化 D.230Th和232Th的化学性质相同
√
1
2
3
4
5
6
7
8
解析 232Th、230Th的质量数分别是232、230,A项错误;
元素的相对原子质量是由各种同位素的相对原子质量取得的平均值,B项错误;
同位素的物理性质可能不同,但化学性质几乎相同,D项正确;
化学变化是生成新物质的变化,原子不变,而C项的原子发生了变化,错误。
9
1
2
3
4
5
6
7
8
9
4.(2019·牡丹江高一检测)某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子构成HmX分子。在a g HmX中所含质子的物质的量是
√
1
2
3
4
5
6
7
8
9
解析
1
2
3
4
5
6
7
8
5.元素X、Y,已知X的质子数为a,X2+比Y2-核外少8个电子,若Y原子的质量数为b,则Y原子核内中子数为
A.b-a-4 B.b-a-8
C.b+a+8 D.b-a-12
解析 由题意可知Y的质子数为a-2+8-2=a+4,则Y原子核内中子数为b-a-4。
√
9
1
2
3
4
5
6
7
8
9
6.(2019·成都高一检测)1919年,科学家第一次实现了人类多年的梦想——人工转变元素,这个反应如下: ,下列叙述正确的是
A. 原子核内有8个质子
B. 原子核内有1个中子
C.O2和O3互为同位素
D.通常情况下,He和N2化学性质都很稳定
√
解析 原子核内质子数是8,A正确;
原子核内中子数是1-1=0,B错误;
通常情况下,He和N2化学性质都很稳定,D正确。
√
解析 本题考查同位素的概念。互为同位素的原子质子数相同,中子数和质量数都不同,所以A错误、B正确;
质子数相同,但质量数不同,不是同一种核素,C错误;
核外电子数等于质子数,二者互为同位素,D错误。
1
2
3
4
5
6
7
8
7.金属钛对人体体液无毒且有惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关 和 的说法中正确的是
A. 和 的质量数相同,互称为同位素
B. 和 的质子数相同,互称为同位素
C. 和 的质子数相同,是同一种核素
D. 与 核外电子数相同,中子数不同,不能互称为同位素
√
9
1
2
3
4
5
6
7
8
8.用 表示原子:
(1)中性原子的中子数N=_____。
A-Z
解析 根据“质子数+中子数=质量数”的关系,N=A-Z。
(2)AXn+共有x个电子,则该阳离子的中子数N=_________。
A-x-n
解析 AXn+共有x个电子,中性原子X的电子数为x+n,则N=A-x-n。
(3)AXn-共有x个电子,则该阴离子的中子数 N=________。
A-x+n
解析 AXn-共有x个电子,中性原子X的电子数为x-n,则N=A-x+n。
9
1
2
3
4
5
6
7
8
(4)12C 16O2分子中的中子数N=____。
22
解析 12C 16O2分子中的中子数为6+8+8=22。
(5)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的
量为_______________。
解析 A2-所含电子数为m-x+2,则n g A2-所含电子的物质的量为
mol。
9
9.近年来,科学家通过粒子加速器进行了一周的实验,获得了6个非常罕见的 原子,接着,科学家又使用特制的测量仪器观测到,这6个原子中有4个发生了衰变,这一实验证实了曾经预言的双质子衰变方式,即有一个原子同时放出两个质子的衰变方式。回答下列问题:
(1) 原子的核内中子数为___,该原子的核外电子数为____。
1
2
3
4
5
6
7
8
9
19
26
解析 的中子数=质量数-质子数=45-26=19,电子数=质子数=26。
(2)以下关于 的叙述正确的是_____(填字母)。
A. 与 是两种核素
B.科学家获得了一种新元素
C. 的衰变不是化学变化
D.这种铁原子衰变放出两个质子后变成
1
2
3
4
5
6
7
8
9
解析 与 的质子数相同,属同一元素Fe元素,但中子数不同,是两种不同的核素;Fe元素不是一种新元素; 衰变后变为质子数为24的新原子,原子核发生了变化,不是化学变化,因为化学的范畴是在原子、分子水平上研究物质的。
AC
(3)某同学认为 在一定条件下也可与氧气反应,他的判断依据是_____
_____________________________________________。
1
2
3
4
5
6
7
8
返回
9
本课结束
原子核的构成
1.了解原子结构模型的演变,培养探索未知崇尚真理的意识。
2.熟知原子的构成,会正确计算微粒的质量数、质子数、中子数。
3.知道元素、核素、同位素的概念,并了解它们之间的关系。
核心素养发展目标
一、人类认识原子结构的历程
随堂演练 知识落实
课时对点练
二、原子核的构成
内
容
索
引
1.古希腊哲学家德谟克利特——原子论。
2.19世纪初,英国科学家道尔顿—— 学说,他认为原子是实心球体。
3.1904年,英国物理学家汤姆生—— 原子模型,他在1897年发现了原子中存在 。
4.1911年,英国物理学家卢瑟福—— 模型或 模型。
他通过“α粒子散射实验”,推测原子中心存在 ,带 。电子带负电,在其周围 ,就像行星围绕太阳运转一样。
一、人类认识原子结构的历程
原子
葡萄干面包式
有核
行星
原子核
正电
高速运行
电子
5.1913年,丹麦物理学家玻尔——引入 观点。
他提出了新的原子结构模型:原子核外,电子在一系列稳定的 上运动,每个轨道都具有一个 的能量值;核外电子在这些稳定的轨道上运动时,既不 ,也不 。
6.20世纪末和21世纪初——新的飞速发展(量子力学模型)。
量子论
轨道
确定
放出能量
吸收能量
(1)从原子结构模型的发展历程可以看出,一些理论会随着人们知识的积累和方法与技术的积累而不断完善或改进( )
(2)英国物理学家汤姆生认为正、负电荷均匀地分布在原子中( )
(3)随着科学技术的发展,人们对微观世界的认识逐渐清晰和深化( )
判断正误
√
√
√
1.人类对原子结构的认识经历了漫长的历史阶段。下列实验事实与原子结构模型建立的关系正确的是
A.电子的发现:道尔顿的原子结构模型
B.α粒子散射:卢瑟福原子结构模型
C.α粒子散射:玻尔原子结构模型
D.氢原子光谱:卢瑟福原子结构模型
应用体验
√
解析 道尔顿的原子结构模型是道尔顿通过对大气的物理性质进行研究而提出的;卢瑟福原子结构模型是通过α粒子散射实验提出的;玻尔原子结构模型是玻尔在牛顿力学的基础上吸收了量子论和光子学说的思想建立起来的。
A.(1)(3)(2)(5)(4) B.(1)(2)(3)(4)(5)
C.(1)(5)(3)(2)(4) D.(1)(3)(5)(4)(2)
返回
2.如图所示的原子结构模型的演变图中,(1)为道尔顿实心球式原子模型,(2)为卢瑟福行星运转式原子模型,(3)为汤姆生葡萄干面包式原子模型,(4)为近代量子力学原子模型,(5)为玻尔轨道式原子模型。其中符合历史演变的顺序的一组为
√
二、原子核的构成
1.原子的组成
(1)原子
原子核
质子:带 个单位正电荷
中子:不带电
核外电子:带 个单位负电荷
1
1
(2)质量数:将原子核内所有的 和 的相对质量取整数加起来所得的数值,用 表示。
(3)构成原子的微粒间的两个关系
①质量数(A)=____________________
②质子数=核外电子数= =原子序数。
质子
中子
A
质子数(Z)+中子数(N)
核电荷数
(4)原子组成的表示方法
______
______
元素符号
质量数
质子数
如作为相对原子质量标准的 C表示质子数为 ,质量数为 的碳原子。
6
12
2.元素、核素、同位素
(1)概念辨析
质子数
质子数
中子数
质子
质量
?
(氕)
(氘)
(氚)
俗称
-
重氢
超重氢
符号
___
___
___
质子数
1
1
1
中子数
___
___
___
(2)氢元素的三种核素
H
D
T
0
1
2
(3)同位素的应用
①____在考古工作中用于测定文物的年代;
② U用于制造原子弹、核发电;
③_______用于制造氢弹;
④放射性同位素释放的射线可用于育种、治疗恶性肿瘤等。
14C
(1)原子呈电中性是因为中子不带电( )
(2)质子数和中子数决定原子的质量( )
(3)34S原子核内中子数为16( )
(4)2H+核外电子数为2( )
(5)13C和15N核内中子数相差1( )
(6)质量数就是元素的相对原子质量( )
(7)O2和O3、红磷和白磷均互称同位素( )
(8)一种单质中可能含有多种核素,如O2中可能含16O、17O、18O三种核素
( )
判断正误
×
√
×
×
√
×
×
√
填空
(1) 中的质子数是____,中子数是_____,核外电子数是_____,质量数是_____。
(2)微粒“AXn-”核外有18个电子,则它的核电荷数为______,核内中子数为__________。
(3)由1H216O与2H217O所代表的物质中,共有___种元素,___种原子,___种分子,互为同位素的原子有__________________。
理解应用
16
18
18
34
18-n
A-(18-n)
2
4
2
1H和2H、16O和17O
(1)一个信息丰富的符号解读
归纳总结
(2)粒子中的电性关系
①分子或原子:质子数=核电荷数=核外电子数
②阳离子Xn+:质子数=核电荷数=核外电子数+n
③阴离子Xn-:质子数=核电荷数=核外电子数-n
返回
1.(2020·杭州高一月考)19世纪初,某科学家提出原子学说,他认为物质由原子组成,原子不能被创造,也不能被毁灭,在化学反应中不能再分,这个科学家是
A.汤姆生 B.道尔顿 C.卢瑟福 D.玻尔
√
1
2
3
5
随堂演练 知识落实
4
6
氢元素中1H不含中子,C错误;
12C与13C质子数相同(均为6),中子数不同(前者为6,后者为7),互为同位素,D正确。
2.下列有关说法中,你认为不正确的是
1
2
3
5
4
解析 由于同位素的存在,所以原子种类大于元素种类,A正确;
√
电子质量只有质子质量的 ,B正确;
6
3.下列关于原子结构的说法正确的是
A.所有的原子都含有质子、中子和电子三种基本构成微粒,且个数都是
相等的
B.质子数决定元素的种类,中子数决定核素的种类
C.原子核对电子吸引作用的实质是原子核中的质子对核外电子的吸引
D.原子中的质子、中子和电子三种基本构成微粒不可能再进一步分成更
小的微粒
√
1
2
3
5
4
6
解析 氢原子 的原子核内没有中子,核素种类是由质子数和中子数共同决定的,A、B项错误;
原子核对核外电子的吸引作用就是质子对电子的吸引,C项正确;
以发展的观点分析,原子中的基本构成微粒有可能再进一步分成更小的微粒,如科学家研究发现了质子和中子里面还有更小的微粒——夸克,D项错误。
1
2
3
5
4
6
4.YBa2Cu8Ox(Y为钇元素)是磁悬浮列车中的重要超导材料,下列关于
的说法中不正确的是
A.质量数是89 B.中子数与质子数之差为50
C.核外电子数是39
√
1
2
3
5
4
6
5.某元素的阳离子Rn+,核外共有x个电子,原子的质量数为A,则该元素原子的中子数为
A.A-x-n B.A-x+n C.A+x-n D.A+x+n
1
2
3
5
4
解析 质量数=质子数+中子数,因此要求中子数必须先要知道质量数和质子数。阳离子Rn+中质子数等于阳离子的核外电子数加上阳离子所带的正电荷数,所以,该原子的中子数为A-(x+n)=A-x-n。
√
6
1
2
3
5
4
6.(2019·东营高一检测)现有下列基本微粒:
1H、2H、3H、1H+、234U、235U、238U、 、40K、40Ca、Cl2、14N、14C,请回答下列问题:
(1)在给出的微粒中,含有____种元素,属于氢元素的核素有____种,属于铀元素的核素有_____种,互为同位素的原子分别是_____________,_______________。
6
7
3
3
1H、2H、3H
234U、235U、238U
解析 共有7种元素,氢元素中有1H、2H、3H三种核素,铀元素有234U、235U、238U三种核素,上述三种氢原子、三种铀原子各自互为同位素。
1
2
3
5
4
(2)质量数相等的微粒为________、__________、________(可不填满,也可补充)。
6
解析 质量数相等的微粒有:1H与1H+、40K与40Ca、14N与14C。
1H与1H+
40K与40Ca
14N与14C
(3)氢的同位素1H、2H、3H与氧的同位素16O、17O、18O相互结合为水,可得水分子的种数为____,可得___种不同的相对分子质量。
18
7
解析 结合成水分子种数:①每2个相同氢原子核素分别与三个氧原子结合成9种;
②任意2个不同氢原子核素分别与三个氧原子结合成9种,共有18种;得到水分子的相对分子质量为18、19、20、21、22、23、24,共7种。
1
2
3
5
4
返回
(4)0.1 mol 中共含______mol中子,含_______个电子。
6
解析 每个 中含质子数为7×3=21,中子数为(14-7)×3=21,电子数为22,则0.1 mol 含2.1 mol中子,含2.2 NA个电子。
2.1
2.2NA
课时对点练
1
2
3
4
5
6
7
8
9
10
题组一 人类认识原子结构的历程
1.提出原子结构模型的科学家,从时间的先后顺序来看,下列排列正确的是
A.汤姆生、玻尔、卢瑟福、道尔顿
B.汤姆生、玻尔、道尔顿、卢瑟福
C.卢瑟福、道尔顿、汤姆生、玻尔
D.道尔顿、汤姆生、卢瑟福、玻尔
√
A组 基础对点练
1
2
3
4
5
6
7
8
9
10
解析 19世纪初,道尔顿提出了原子学说;1904年汤姆生提出了一个被称为“葡萄干面包式”的原子结构模型;1911年卢瑟福提出了带核的原子结构模型;1913年玻尔提出了新的原子结构模型。
2.提出“有核模型”的科学家是
A.汤姆生 B.卢瑟福
C.道尔顿 D.玻尔
√
1
2
3
4
5
6
7
8
9
10
题组二 原子核的构成
3.某元素B的核电荷数为Z。已知Bn-、Am+的核外具有相同的电子数,则A元素的质子数用Z、n、m来表示,应为
A.Z+n-m B.Z-n+m
C.Z-n-m D.Z+m+n
√
1
2
3
4
5
6
7
8
9
10
解析 设A元素的质子数为x,则有Z+n=x-m,x=Z+m+n。
4.已知R2+核内共有N个中子,R的质量数为A,确定m g R2+中含有电子的物质的量为
1
2
3
4
5
6
7
8
9
10
√
5.已知阳离子R2+核外有a个电子和b个中子。表示R原子符号正确的是
√
1
2
3
4
5
6
7
8
9
10
解析 阳离子R2+核外有a个电子,阳离子的质子数=核外电子数+离子所带电荷数=a+2,质量数=质子数+中子数=a+2+b,所以R原子可表示为 ,C正确。
1
2
3
4
5
6
7
8
9
10
6.13C-NMR(核磁共振)可用于含碳化合物的结构分析,15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下列有关13C、15N的叙述正确的是
A.13C与15N具有相同的中子数
B.13C与C60是同一种物质
C.15N与14N互为同位素
D.15N的核外电子数与中子数相同
√
解析 13C与15N的中子数分别是7和8,A不正确;
具有一定数目质子和一定数目中子的一种原子是核素,即13C是一种核素,而C60是一种单质,B不正确;
质子数相同、中子数不同的同一种元素的不同核素互称为同位素,C正确;
15N的核外电子数与中子数分别是7和8,D不正确。
1
2
3
4
5
6
7
8
9
10
7.下列各组中互为同位素的是
A. B.T2O与H2O
C. D.金刚石与石墨
√
1
2
3
4
5
6
7
8
9
10
解析 是不同种元素,因此不互为同位素,A错误;
T2O与H2O是由不同的H原子构成的水分子,物质的化学性质相同但是二者不是原子,因此不互为同位素,B错误;
属于同一种元素,质子数相同而中子数不同,因此二者互为同位素,C正确;
金刚石与石墨是由同种元素组成的结构不同的两种单质,D错误。
解析 氘(D)原子的质子数为1,核外有1个电子,A正确;
1H与D的质子数相同而中子数不同,互为同位素,B正确;
H2O与D2O的相对分子质量分别为18和20,不相同,C错误;
1H218O与D216O的相对分子质量相等,D正确。
8.重水(D2O)是重要的核工业原料,下列说法错误的是
A.氘(D)原子核外有1个电子
B.1H与D互为同位素
C.H2O与D2O相对分子质量相同
D.1H218O与D216O的相对分子质量相同
1
2
3
4
5
6
7
8
9
10
√
9.“玉兔”号月球车用 作为热源材料,下列关于 的说法正确的是
A. 与 互为同位素
B. 与 具有完全相同的物理性质
C. 与 具有完全相同的化学性质
D. 与 具有相同的最外层电子数
√
1
2
3
4
5
6
7
8
9
10
解析 质子数相同、中子数不同的同一元素的不同核素互为同位素,
与 的质子数不同,不互为同位素,故A错误;
与 的质子数不同,属于不同的元素,其化学性质不同,故C错误;
与 具有相同的质子数,所以其核外电子数相同,则具有相同的最外层电子数,故D正确。
10.据报道,某些花岗岩会产生氡( ),从而对人体产生伤害。请回答下列问题:
(1)该原子的质量数是_____,质子数是_____,中子数是______。
1
2
3
4
5
6
7
8
9
10
222
86
136
解析 的质量数是222,质子数是86,中子数是222-86=136。
1
2
3
4
5
6
7
8
9
10
(2)研究发现,镭能蜕变为 ,故将 称为镭射气;钍能蜕变为
,故将 称为钍射气;锕能蜕变为 ,故将 称为锕射气。
_____(填字母)。
A.属于同种元素 B.互为同位素
C.属于同种核素 D.属于同种原子
AB
解析 的质子数相同,属于同种元素但三者的中子数不同,故三者互为同位素。
(3)由(2)可知,_______决定元素种类,_______________决定核素种类。
解析 质子数决定元素种类;质子数和中子数共同决定核素种类。
质子数
质子数和中子数
1.(2019·镇江高一检测)下列叙述正确的是
A.40K和40Ca原子中质子数和中子数都不相等
B.金刚石和石墨的性质相同
C.H2和D2互为同位素
D.某物质只含一种元素,该物质一定是纯净物
√
B组 综合强化练
1
2
3
4
5
6
7
8
9
1~5题是单项选择题,6~7题是不定项选择题
解析 因为40K的质子数是19,40Ca的质子数是20,两者质量数相同,质子数不同,所以中子数也不相等,A正确;
金刚石和石墨都是由碳元素组成的,由于它们的晶体结构不同,性质上也存在差异,如硬度、导电性都不同,在化学性质上也不完全相同,金刚石相对稳定,B不正确;
H2和D2是单质分子,不符合同位素的概念,C不正确;
白磷和红磷混在一起,虽然体系中只有一种元素,却存在着结构完全不同的两种分子,所以不是纯净物,D不正确。
1
2
3
4
5
6
7
8
9
2.(2019·南宁高一检测)科学家发现两种微粒:第一种是由四个中子构成的微粒“四中子”;第二种是由四个氧原子构成的分子。下列关于这两种微粒的说法不正确的是
A.“四中子”不显电性
B.“四中子”的质量数为4
C.第二种微粒是氧元素的另一种同位素
D.第二种微粒的化学式为O4
√
1
2
3
4
5
6
7
8
解析 中子是不带电的微粒,所以“四中子”不显电性,A正确;
根据质量数与中子数、质子数的关系知“四中子”质量数为4,B正确;
四个氧原子构成的分子是一种氧单质,化学式为O4,C错误,D正确。
9
3.230Th和232Th是钍的两种同位素,232Th可以转化成233U。下列有关Th的说法正确的是
A.Th元素的质量数是232 B.Th元素的相对原子质量是231
C.232Th转换成233U是化学变化 D.230Th和232Th的化学性质相同
√
1
2
3
4
5
6
7
8
解析 232Th、230Th的质量数分别是232、230,A项错误;
元素的相对原子质量是由各种同位素的相对原子质量取得的平均值,B项错误;
同位素的物理性质可能不同,但化学性质几乎相同,D项正确;
化学变化是生成新物质的变化,原子不变,而C项的原子发生了变化,错误。
9
1
2
3
4
5
6
7
8
9
4.(2019·牡丹江高一检测)某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子构成HmX分子。在a g HmX中所含质子的物质的量是
√
1
2
3
4
5
6
7
8
9
解析
1
2
3
4
5
6
7
8
5.元素X、Y,已知X的质子数为a,X2+比Y2-核外少8个电子,若Y原子的质量数为b,则Y原子核内中子数为
A.b-a-4 B.b-a-8
C.b+a+8 D.b-a-12
解析 由题意可知Y的质子数为a-2+8-2=a+4,则Y原子核内中子数为b-a-4。
√
9
1
2
3
4
5
6
7
8
9
6.(2019·成都高一检测)1919年,科学家第一次实现了人类多年的梦想——人工转变元素,这个反应如下: ,下列叙述正确的是
A. 原子核内有8个质子
B. 原子核内有1个中子
C.O2和O3互为同位素
D.通常情况下,He和N2化学性质都很稳定
√
解析 原子核内质子数是8,A正确;
原子核内中子数是1-1=0,B错误;
通常情况下,He和N2化学性质都很稳定,D正确。
√
解析 本题考查同位素的概念。互为同位素的原子质子数相同,中子数和质量数都不同,所以A错误、B正确;
质子数相同,但质量数不同,不是同一种核素,C错误;
核外电子数等于质子数,二者互为同位素,D错误。
1
2
3
4
5
6
7
8
7.金属钛对人体体液无毒且有惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关 和 的说法中正确的是
A. 和 的质量数相同,互称为同位素
B. 和 的质子数相同,互称为同位素
C. 和 的质子数相同,是同一种核素
D. 与 核外电子数相同,中子数不同,不能互称为同位素
√
9
1
2
3
4
5
6
7
8
8.用 表示原子:
(1)中性原子的中子数N=_____。
A-Z
解析 根据“质子数+中子数=质量数”的关系,N=A-Z。
(2)AXn+共有x个电子,则该阳离子的中子数N=_________。
A-x-n
解析 AXn+共有x个电子,中性原子X的电子数为x+n,则N=A-x-n。
(3)AXn-共有x个电子,则该阴离子的中子数 N=________。
A-x+n
解析 AXn-共有x个电子,中性原子X的电子数为x-n,则N=A-x+n。
9
1
2
3
4
5
6
7
8
(4)12C 16O2分子中的中子数N=____。
22
解析 12C 16O2分子中的中子数为6+8+8=22。
(5)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的
量为_______________。
解析 A2-所含电子数为m-x+2,则n g A2-所含电子的物质的量为
mol。
9
9.近年来,科学家通过粒子加速器进行了一周的实验,获得了6个非常罕见的 原子,接着,科学家又使用特制的测量仪器观测到,这6个原子中有4个发生了衰变,这一实验证实了曾经预言的双质子衰变方式,即有一个原子同时放出两个质子的衰变方式。回答下列问题:
(1) 原子的核内中子数为___,该原子的核外电子数为____。
1
2
3
4
5
6
7
8
9
19
26
解析 的中子数=质量数-质子数=45-26=19,电子数=质子数=26。
(2)以下关于 的叙述正确的是_____(填字母)。
A. 与 是两种核素
B.科学家获得了一种新元素
C. 的衰变不是化学变化
D.这种铁原子衰变放出两个质子后变成
1
2
3
4
5
6
7
8
9
解析 与 的质子数相同,属同一元素Fe元素,但中子数不同,是两种不同的核素;Fe元素不是一种新元素; 衰变后变为质子数为24的新原子,原子核发生了变化,不是化学变化,因为化学的范畴是在原子、分子水平上研究物质的。
AC
(3)某同学认为 在一定条件下也可与氧气反应,他的判断依据是_____
_____________________________________________。
1
2
3
4
5
6
7
8
返回
9
本课结束
