核外电子排布和周期律复习
图片预览









文档简介
(共56张PPT)
一、核外电子排布
1.原子核外电子的分层排布
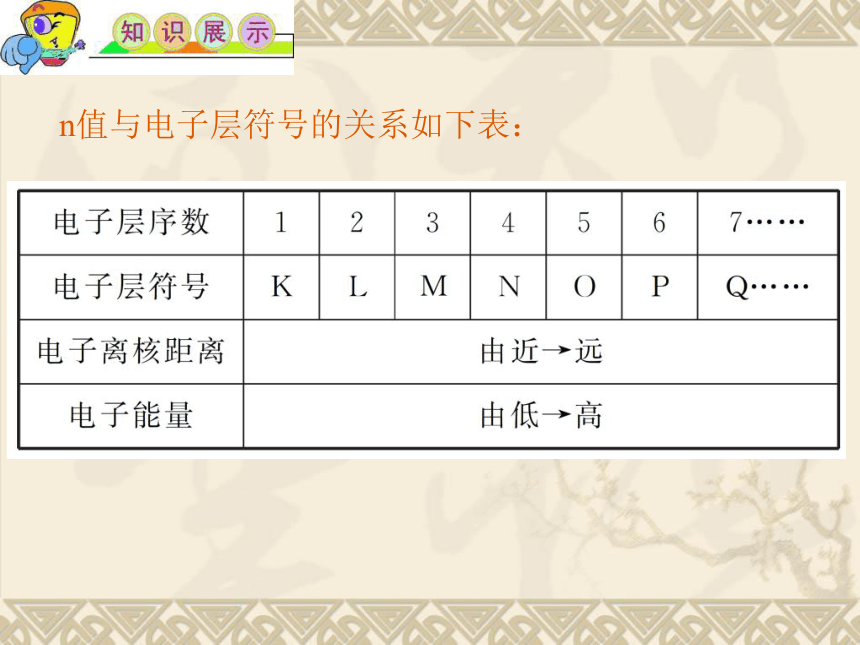
在含有多个电子的原子里,电子分别在能量不同的区域内运动,我们把不同的区域简化为不连续的壳层,也称作 电子层 。
在不同区域运动的电子具有不同的 能量 ,能量低的电子在离核 近 的区域运动,能量高的电子在离核 远 的区域运动。
常用n表示电子层的序数,n值越大,表示离核距离越远,能量越 高 。
n值与电子层符号的关系如下表:
2.核外电子分层排布的规律
核外电子的分层运动,又叫核外电子的分层排布,其主要规律有:
(1)原子核外电子总是先排能量最低的电子层,然后由里向外,依次排布在能量逐步升高的电子层(能量最低原理)。即排满了K层才排L层,排满了L层才排M层。
(2)原子核外每个电子层最多容纳 2n2 个电子。
(3)原子最外层电子数不超过 8 个电子(K层为最外层不能超过2个电子)。
(4)原子次外层电子数不超过 18 个电子(K层为次外层不能超过2个电子)。
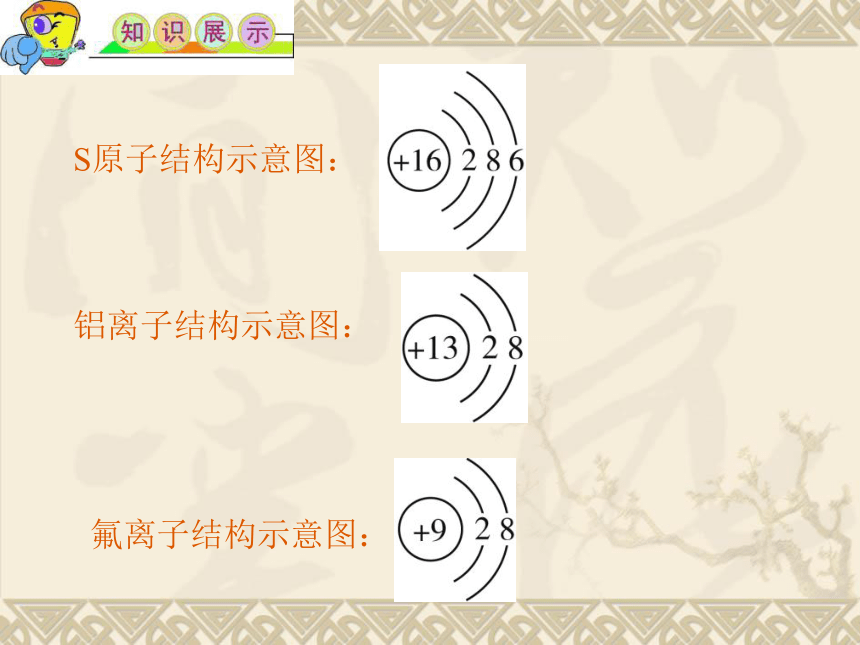
3.核外电子排布的表示方法:原子或离子结构示意图
圆圈表示原子核,圆圈内标示出核电荷数,用弧线表示电子层,弧线上的数字表示该电子层的电子数。要注意无论是阳离子还是阴离子,圆圈内的核电荷数是不变的,变化的是最外层电子数。
S原子结构示意图:
铝离子结构示意图:
氟离子结构示意图:
元素的性质与元素的原子核外电子排布的关系
(1)稀有气体的不活泼性:稀有气体元素的原子最外层有8个电子(氦是2个电子),处于稳定结构,因此化学性质稳定,一般不跟其他物质发生化学反应。
(2)非金属性与金属性(一般规律):
二、元素周期律
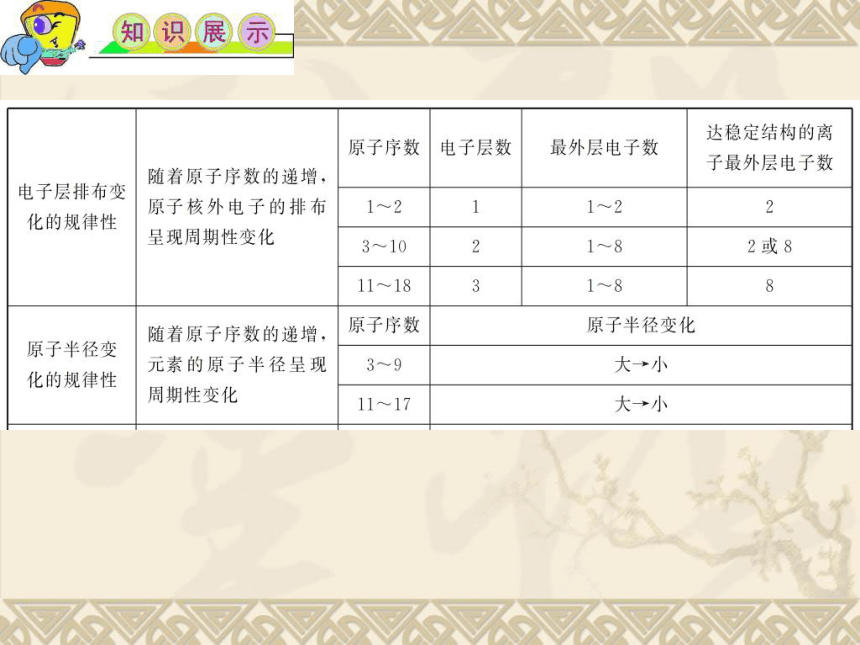
1.元素周期律
元素的 性质 随着原子序数的递增而呈 周期性 的变化,这个规律叫元素周期律。
2.元素周期律的基本内容
以1~18号元素为例
3.元素周期表中主族元素性质的递变规律
内容 同周期(从左到右) 同主族(从上到下)
原子半径 逐渐减小(稀有气体除外) 逐渐增大
电子层结构 电子层数相同
最外层电子数渐多 电子层数递增
最外层电子数相同
得电子能力
失电子能力 逐渐增强
逐渐减弱 逐渐减弱
逐渐增强
金属性非金属性 逐渐减弱
逐渐增强 逐渐增强
逐渐减弱
内容 同周期(从左到右) 同主族(从上到下)
主要化合价 最高正价:主族
序数(O、F除外)
最低负价:族序
数-8 最高正价数=族序数
(O、F除外)
最高价氧化
物对应水化
物的酸碱性 酸性逐渐增强
碱性逐渐减弱 酸性逐渐减弱
碱性逐渐增强
非金属元素
气态氢化物
的形成及稳
定性 气态氢化物的形
成逐渐容易气态
氢化物稳定性逐
渐增强 气态氢化物形成逐渐
困难气态氢化物稳定
性逐渐减弱
元素的原子半径,离子半径大小比较
1.核电荷数相同的微粒,电子数越多,则半径越大,即同种元素:
阳离子半径<原子半径<阴离子半径,如:
H+Fe2+>Fe3+;Na+2.电子数相同的微粒,核电荷数越多则半径越小
(1)与He电子层结构相同的微粒:H->Li+>Be2+。
(2)与Ne电子层结构相同的微粒:
O2->F->Na+>Mg2+>Al3+。
(3)与Ar电子层结构相同的微粒:S2->Cl->K+>Ca2+。
3.电子数和核电荷数都不同的微粒:
(1)同主族的元素,无论是金属还是非金属,无论是原子半径还是离子半径从上到下递增。
(2)同周期:原子半径从左到右递减,如Na>Cl。
(3)同周期元素的离子半径比较时要把阴阳离子分开。同周期非金属元素形成的阴离子半径大于金属元素形成的阳离子半径,如Na+推断题的“题眼”:
①原子半径最小的原子:H原子(最轻);
②非金属性最强的元素:F;金属性最强的元素:Cs(不考虑Fr);
③最高价氧化物对应水化物酸性最强的酸:HClO4(中学阶段);最高价氧化物对应水化物碱性最强的碱:CsOH;
④形成化合物最多的元素:C元素;含H质量分数最高的气态氢化物:CH4;
⑤地壳中含量最高的元素:O元素,其次是Si元素;地壳中含量最高的金属元素:Al元素,其次是Fe元素;
⑥常温下为液态的非金属单质Br2,金属单质Hg;
⑦原子最外层电子排布是1~8个电子,但第一周期是1~2个电子;
⑧同一周期元素主要化合价由+1价到+7价,但O、F一般没有正价;
⑨原子核中含有质子和中子,但是1H原子中没有中子;
⑩碱金属是ⅠA族,不包括H元素,ⅠA族包括H元素。
三、元素周期表和元素周期表的应用
世界上第一张元素周期表是在1869年,由俄国化学家 门捷列夫 绘制完成的,随着科学的不断发展,已逐步演变为现在的常用形式。
原子序数:按照元素在周期表中的顺序给元素编号,得到原子序数。原子序数=核电荷数= 质子 数= 核外电子 数。
1.结构
编排原则:
周期:把电子层数相同的元素按原子序数递增的顺序从左至右排成的横行。
族:把最外层电子数相等的元素,按原子序数由小到大的顺序,由上而下排成的纵行。
2.元素周期表的应用
如下图:元素周期表中元素的分区——金属元素区域和非金属元素区域
非金属元素 位于元素周期表的右上角区域, 金属元素 位于元素周期表的左下角区域,金属与非金属之间有一条分界线;非金属性最强的元素是 F ,金属性最强的元素是 Cs ,位于分界线附近的元素既能表现出一定的 金属性 ,又能表现出一定的 非金属性 。
元素周期表中位置接近的元素性质相似,人们可以借助元素周期表研究合成有特定性质的新物质。例如在金属与非金属元素分界线两侧寻找制造半导体材料的元素;在过渡元素中寻找各种优良的催化剂和耐高温、耐腐蚀的合金材料。
要熟悉周期表的结构,记住各周期的元素种数,记住各族的排列顺序,能分析常见元素在周期表的位置,能根据周期律分析元素的可能性质。
四、元素的“位、构、性”关系
1.化合价与原子结构、周期表位置的关系
元素的化合价与原子的电子层结构,特别是与最外电子层中电子的数目有密切关系,因此,元素原子的最外电子层中的电子,也叫做价电子。有些元素的化合价与它们原子的次外层或倒数第三层的部分电子有关,这部分电子也叫价电子。总之,价电子就是指那些与化合价关系密切的电子。
2.元素的“位、构、性”关系
主族元素的最高正化合价= 主族序数=价电子数=最外层电子数 (F、O除外)。
主族元素的最低负化合价= 最高正化合价-8 ,即主族元素的最高正化合价和其负化合
3.“位、构、性”关系图示
比较元素金属性强弱的依据有
①单质与水或酸反应置换出氢的难易程度(或反应的剧烈程度)。越易者,元素的金属性越强。
②最高价氧化物对应的水化物的碱性强弱。碱性越强者,其金属性越强。
③金属间的置换反应。一般活泼金属可从不活泼金属的盐溶液中将不活泼金属置换出来。
④金属阳离子氧化性强弱。一般阳离子的氧化性越强,对应金属的金属性越弱。
比较元素非金属性强弱的依据有
①单质与氢气化合的难易程度及生成气态氢化物的稳定性。一般与氢气化合越易,生成的氢化物越稳定,说明非金属性就越强。
②最高价氧化物对应的水化物的酸性强弱。酸性越强,说明其非金属性越强。
③非金属单质的置换反应。一般活泼非金属可以置换出不活泼的非金属。
④元素的原子对应阴离子的还原性强弱。阴离子的还原性越强,对应非金属的非金属性就越弱。
【典例】两种元素原子的核外电子层数之比与它们的最外层电子数之比相等,在核电荷数为1~10的元素中,满足上述关系的元素共有( )
A.1对 B.2对
C.3对 D.4对
【解析】核电荷数为1~10的元素,核外电子层数只有1、2两种可能,因此核外电子层数之比只能是1∶2,最外层电子数,对于K层也只有两种,即H 1个、He 2个。因此符合题设要求的,最外层电子数是它们两倍的,只能是2个(Be)、4个(C)。故符合题设条件的只有H和Be、He和C两对,选项B正确。
【参考答案】 B
【点拨】根据核外电子的排布情况可以推测元素的种类及元素可能性质。
前18号元素的原子结构的特殊性
①原子核中无中子的原子 。
②最外层有1个电子的元素:H、Li、Na。
③最外层有2个电子的元素:Be、Mg、He。
④最外层电子数等于次外层电子数的元素:Be、Ar。
⑤最外层电子数是次外层电子数2倍的元素:C;是次外层电子数3倍的元素:O;是次外层电子数4倍的元素:Ne。
⑥电子层数与最外层电子数相等的元素:H、Be、Al。
⑦电子总数为最外层电子数2倍的元素:Be。
⑧次外层电子数是最外层电子数2倍的元素:Si。
⑨内层电子数是最外层电子数2倍的元素:Li、P。
【迁移训练1】(2011·泰州中学调研)下列说法正确的是( )
A.ⅠA族元素的金属性一定比ⅡA族元素的金属性强
B.ⅥA族元素中氢化物最稳定的其沸点一定最高
C.非金属元素只能形成共价化合物
D.短周期中,同周期元素的离子半径从左到右逐渐减小
【解析】A选项中,同周期中ⅠA族元素的金属性一定比ⅡA族元素的金属性强;
B选项中,ⅥA族元素中氢化物最稳定的是H2O,由于分子间存在氢键,其沸点也最高;
C选项中,铵盐中可以只含非金属元素;
D选项中,短周期中,同周期元素的原子半径从左到右逐渐减小(稀有气体除外),而离子半径则不是,如半径Na+<Cl-。
【参考答案】B
【典例2】根据下列短周期元素性质的数据判断,下列说法正确的是( )
A.元素①⑧形成的化合物具有两性
B.元素⑦位于第二周期Ⅴ族
C.元素④⑤形成的化合物是离子化合物
D.元素③的最高价氧化物对应水化物碱性最强
【解析】先根据原子半径大小和化合价确定元素在周期表中的位置,确定元素的种类。
经分析A选项元素①⑧形成的化合物是氧化铝,具有两性,正确;元素⑦位于第二周期ⅤA族,主族符号A不能少;
C选项元素④⑤形成的化合物是共价化合物;
D选项元素⑥比③的最高价氧化物对应水化物碱性强。
【参考答案】A
【点拨】根据化合价确定元素的主族位置,根据原子半径的相对大小确定上下位置,要注意上下调整。
【迁移训练2】(2010·南通四中模拟)下表是元素周期表的一部分。X、Y、Z、W均为短周期元素,X、W的质子数之和为23。下列说法正确的是( )
A.X元素最多可形成五种氧化物
B.W元素的非金属性比Z元素非金属性弱
C.Z和X能以共价键结合形成一种无机非金属材料
D.Y元素的最高价氧化物的水化物是含氧酸中酸性最强的
【解析】设X的原子序数为a,则W的原子序数为a+9,由题意得:a+a+9=23,a=7,所以X为N,Y为F,Z为Si,W为S。X的氧化物有:N2O、NO、N2O3、NO2、N2O4、N2O5六种;W元素的非金属性比Z元素非金属性强;Y为F,无最高价氧化物的水化物。
【参考答案】C
【典例3】有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是( )
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
【解析】根据题意,X、Y位于同主族,且Y在X的下一个周期,则Y的金属性强于X,非金属性弱于X。
【参考答案】A
【点拨】同一周期随原子序数增大,金属性逐渐减弱,非金属性逐渐增强;同一主族由上到下,金属性逐渐增强,非金属性逐渐减弱。
同一周期随原子序数增大,单质的氧化性逐渐增强,还原性逐渐减弱;同一主族由上到下,氧化性逐渐减弱,还原性逐渐增强。
最高价氧化物的水化物的酸碱性,同一周期随原子序数增大,酸性逐渐增强,碱性逐渐减弱;同一主族由上到下,酸性逐渐减弱,碱性逐渐增强。
同一周期随原子序数增大,气态氢化物的稳定性逐渐增强,还原性逐渐减弱,酸性逐渐增强;同一主族由上到下,气态氢化物的稳定性逐渐减弱,还原性逐渐增强,酸性逐渐增强。
【迁移训练3】(2010·南京模拟)某矿石由前20号元素中的4种组成,其化学式为WYZX。X、Y、Z、W分布在三个周期,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同周期,Z单质是一种良好的半导体。下列说法正确的是( )
A.原子半径:W>Y>Z>X
B.气态氢化物的稳定性:XC.最高价氧化物对应水化物的碱性:Y>W
D.Y、Z的氧化物都有两性
【解析】根据所给信息,X为O,Z为Si,W能与冷水剧烈反应,W为第ⅠA元素,X、W原子的最外层电子数之和为7,所以Y的最外层电子数为3,Y、Z位于同周期,所以Y为Al,又因为X、Y、Z、W分布在三个周期,所以W为钾。气态氢化物的稳定性:X>Z,最高价氧化物对应水化物的碱性:W>Y,Y的氧化物(Al2O3)有两性,Z的氧化物(SiO2)为酸性氧化物。
【参考答案】A
【典例4】已知短周期元素的离子:aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径:A>B>C>D
B.原子序数:d>c>b>a
C.离子半径:C3->D->B+>A2+
D.单质的还原性:A>B>D>C
【解析】 aA2+、bB+、cC3-、dD-具有相同的电子层结构,说明A与B同周期,C与D同周期,且A、B处于C、D的下一周期,所以,原子半径是B>A>C>D,原子序数是a>b>d>c,离子半径是C3->D->B+>A2+,单质的还原性是B>A>C>D。
【参考答案】C
【点拨】1.原子半径:电子层数相同时,随原子序数递增,原子半径减小,如
r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl);
最外层电子数相同时,随电子层数递增原子半径增大,如r(Li)2.离子半径
①同种元素的离子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子,例:r(Cl-)>r(Cl),r(Fe)>r(Fe2+)>r(Fe3+);
②电子层结构相同的离子,核电荷数越大,半径越小,如
r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+);
③带相同电荷的离子,电子层越多,半径越大,如
r(Li+)r(O2-)④带电荷、电子层均不同的离子可选一种离子参照比较,如比较r(K+)与r(Mg2+)可选r(Na+)为参照可知r(K+)>r(Na+)>r(Mg2+)。
【迁移训练4】(2010·盐城中学模拟)X、Y、Z、W、R是周期表前20号元素,它们的原子序数依次增大,X与R,Y与W分别同主族,Z原子最外电子数是W原子最外层电子数的一半,X与Y可形成X2Y和X2Y2两种液态化合物。下列说法不正确的是( )
A.原子半径:R>Z>W>Y>X
B.离子半径:X、Z、Y、W、R依次增大
C.热稳定性:X2Y>X2W
D.由X、Y、Z、W、R五种元素组成的一种化合物可作净水剂
【解析】
由X与Y可形成X2Y和X2Y2两种液态化合物,可判断X为H,Y为O,再由题意可推出:Z为Al,W为S,R为K。B选项中,离子半径大小顺序为:W>R> Y > Z >X。
【参考答案】 B
【典例5】用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子八种微粒(离子或分子)。请回答:(以下用元素符号表示)
(1)A元素是______、B元素是______、C元素是______。
(2)D是由两种元素组成的双原子分子,其分子式是______。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是________。
(4)F是由两种元素组成的三原子分子,其分子式是________。
(5)G分子中含有4个原子,其分子式是________。
(6)H分子中含有8个原子,其分子式是________
【解析】熟悉常见的18个电子的离子或分子。
S
K
Cl
HCl
H2S
H2O2或PH3
F2
C2H6
【点拨】等电子体微粒结构相似,性质相似。平时要注意总结等电子体,练习书写等电子体的方法。
【迁移训练5】通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:
A:_____B:______C:_______D:_________。
(2)写出A、B、E三种微粒反应的离子方程式:
_____________________________________
_______________________________________ 。
H2O
NH3
NH4+
OH-
Al3++3NH3+3H2O===Al(OH)3↓+3 NH4+ 、
Mg2++2NH3+2H2O===Mg(OH)2↓+2 NH4+
【解析】熟悉常见的10个电子的离子或分子。
【典例6】(2010·金陵中学)短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A和C同主族,B原子的最外层电子数等于A原子次外层电子数。下列叙述中正确的是( )
A.原子半径:AB.C的氢化物稳定性大于A的氢化物的稳定性
C.三种元素的最高价氧化物对应的水化物均可由化合反应得到
D.高温下,A单质能置换出C单质
【解析】由于B原子的最外层电子数等于A原子次外层电子数,可基本确定是镁,结合短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A和C同主族,推出A为碳,C为硅。原子半径应该是B>C>A;A的氢化物稳定性大于C的氢化物的稳定性;三种元素的最高价氧化物对应的水化物中硅酸不能由化合反应得到;高温下,碳单质能置换出硅单质,所以D正确。
【点拨】先推出元素,给元素定位,然后根据位置、结构分析性质。
【参考答案】D
【迁移训练6】(2010·通州模拟)短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为32,且原子最外层电子数之和为10;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素。下列叙述正确的是( )
A.四种元素的原子半径:C>D>B>A
B.C元素处于元素周期表中第3周期第ⅡA族
C.最高价氧化物对应的水化物的酸性:B>D
D.B、D的最高价氧化物中,B、D与氧原子之间均为单键
【参考答案】AC
【解析】
根据题意可推出:A为H,B为C,C为Na,D为Si。C元素处于元素周期表中第3周期第ⅠA族,B的最高价氧化物为CO2,C和O之间为双键。
一、核外电子排布
1.原子核外电子的分层排布
在含有多个电子的原子里,电子分别在能量不同的区域内运动,我们把不同的区域简化为不连续的壳层,也称作 电子层 。
在不同区域运动的电子具有不同的 能量 ,能量低的电子在离核 近 的区域运动,能量高的电子在离核 远 的区域运动。
常用n表示电子层的序数,n值越大,表示离核距离越远,能量越 高 。
n值与电子层符号的关系如下表:
2.核外电子分层排布的规律
核外电子的分层运动,又叫核外电子的分层排布,其主要规律有:
(1)原子核外电子总是先排能量最低的电子层,然后由里向外,依次排布在能量逐步升高的电子层(能量最低原理)。即排满了K层才排L层,排满了L层才排M层。
(2)原子核外每个电子层最多容纳 2n2 个电子。
(3)原子最外层电子数不超过 8 个电子(K层为最外层不能超过2个电子)。
(4)原子次外层电子数不超过 18 个电子(K层为次外层不能超过2个电子)。
3.核外电子排布的表示方法:原子或离子结构示意图
圆圈表示原子核,圆圈内标示出核电荷数,用弧线表示电子层,弧线上的数字表示该电子层的电子数。要注意无论是阳离子还是阴离子,圆圈内的核电荷数是不变的,变化的是最外层电子数。
S原子结构示意图:
铝离子结构示意图:
氟离子结构示意图:
元素的性质与元素的原子核外电子排布的关系
(1)稀有气体的不活泼性:稀有气体元素的原子最外层有8个电子(氦是2个电子),处于稳定结构,因此化学性质稳定,一般不跟其他物质发生化学反应。
(2)非金属性与金属性(一般规律):
二、元素周期律
1.元素周期律
元素的 性质 随着原子序数的递增而呈 周期性 的变化,这个规律叫元素周期律。
2.元素周期律的基本内容
以1~18号元素为例
3.元素周期表中主族元素性质的递变规律
内容 同周期(从左到右) 同主族(从上到下)
原子半径 逐渐减小(稀有气体除外) 逐渐增大
电子层结构 电子层数相同
最外层电子数渐多 电子层数递增
最外层电子数相同
得电子能力
失电子能力 逐渐增强
逐渐减弱 逐渐减弱
逐渐增强
金属性非金属性 逐渐减弱
逐渐增强 逐渐增强
逐渐减弱
内容 同周期(从左到右) 同主族(从上到下)
主要化合价 最高正价:主族
序数(O、F除外)
最低负价:族序
数-8 最高正价数=族序数
(O、F除外)
最高价氧化
物对应水化
物的酸碱性 酸性逐渐增强
碱性逐渐减弱 酸性逐渐减弱
碱性逐渐增强
非金属元素
气态氢化物
的形成及稳
定性 气态氢化物的形
成逐渐容易气态
氢化物稳定性逐
渐增强 气态氢化物形成逐渐
困难气态氢化物稳定
性逐渐减弱
元素的原子半径,离子半径大小比较
1.核电荷数相同的微粒,电子数越多,则半径越大,即同种元素:
阳离子半径<原子半径<阴离子半径,如:
H+
(1)与He电子层结构相同的微粒:H->Li+>Be2+。
(2)与Ne电子层结构相同的微粒:
O2->F->Na+>Mg2+>Al3+。
(3)与Ar电子层结构相同的微粒:S2->Cl->K+>Ca2+。
3.电子数和核电荷数都不同的微粒:
(1)同主族的元素,无论是金属还是非金属,无论是原子半径还是离子半径从上到下递增。
(2)同周期:原子半径从左到右递减,如Na>Cl。
(3)同周期元素的离子半径比较时要把阴阳离子分开。同周期非金属元素形成的阴离子半径大于金属元素形成的阳离子半径,如Na+
①原子半径最小的原子:H原子(最轻);
②非金属性最强的元素:F;金属性最强的元素:Cs(不考虑Fr);
③最高价氧化物对应水化物酸性最强的酸:HClO4(中学阶段);最高价氧化物对应水化物碱性最强的碱:CsOH;
④形成化合物最多的元素:C元素;含H质量分数最高的气态氢化物:CH4;
⑤地壳中含量最高的元素:O元素,其次是Si元素;地壳中含量最高的金属元素:Al元素,其次是Fe元素;
⑥常温下为液态的非金属单质Br2,金属单质Hg;
⑦原子最外层电子排布是1~8个电子,但第一周期是1~2个电子;
⑧同一周期元素主要化合价由+1价到+7价,但O、F一般没有正价;
⑨原子核中含有质子和中子,但是1H原子中没有中子;
⑩碱金属是ⅠA族,不包括H元素,ⅠA族包括H元素。
三、元素周期表和元素周期表的应用
世界上第一张元素周期表是在1869年,由俄国化学家 门捷列夫 绘制完成的,随着科学的不断发展,已逐步演变为现在的常用形式。
原子序数:按照元素在周期表中的顺序给元素编号,得到原子序数。原子序数=核电荷数= 质子 数= 核外电子 数。
1.结构
编排原则:
周期:把电子层数相同的元素按原子序数递增的顺序从左至右排成的横行。
族:把最外层电子数相等的元素,按原子序数由小到大的顺序,由上而下排成的纵行。
2.元素周期表的应用
如下图:元素周期表中元素的分区——金属元素区域和非金属元素区域
非金属元素 位于元素周期表的右上角区域, 金属元素 位于元素周期表的左下角区域,金属与非金属之间有一条分界线;非金属性最强的元素是 F ,金属性最强的元素是 Cs ,位于分界线附近的元素既能表现出一定的 金属性 ,又能表现出一定的 非金属性 。
元素周期表中位置接近的元素性质相似,人们可以借助元素周期表研究合成有特定性质的新物质。例如在金属与非金属元素分界线两侧寻找制造半导体材料的元素;在过渡元素中寻找各种优良的催化剂和耐高温、耐腐蚀的合金材料。
要熟悉周期表的结构,记住各周期的元素种数,记住各族的排列顺序,能分析常见元素在周期表的位置,能根据周期律分析元素的可能性质。
四、元素的“位、构、性”关系
1.化合价与原子结构、周期表位置的关系
元素的化合价与原子的电子层结构,特别是与最外电子层中电子的数目有密切关系,因此,元素原子的最外电子层中的电子,也叫做价电子。有些元素的化合价与它们原子的次外层或倒数第三层的部分电子有关,这部分电子也叫价电子。总之,价电子就是指那些与化合价关系密切的电子。
2.元素的“位、构、性”关系
主族元素的最高正化合价= 主族序数=价电子数=最外层电子数 (F、O除外)。
主族元素的最低负化合价= 最高正化合价-8 ,即主族元素的最高正化合价和其负化合
3.“位、构、性”关系图示
比较元素金属性强弱的依据有
①单质与水或酸反应置换出氢的难易程度(或反应的剧烈程度)。越易者,元素的金属性越强。
②最高价氧化物对应的水化物的碱性强弱。碱性越强者,其金属性越强。
③金属间的置换反应。一般活泼金属可从不活泼金属的盐溶液中将不活泼金属置换出来。
④金属阳离子氧化性强弱。一般阳离子的氧化性越强,对应金属的金属性越弱。
比较元素非金属性强弱的依据有
①单质与氢气化合的难易程度及生成气态氢化物的稳定性。一般与氢气化合越易,生成的氢化物越稳定,说明非金属性就越强。
②最高价氧化物对应的水化物的酸性强弱。酸性越强,说明其非金属性越强。
③非金属单质的置换反应。一般活泼非金属可以置换出不活泼的非金属。
④元素的原子对应阴离子的还原性强弱。阴离子的还原性越强,对应非金属的非金属性就越弱。
【典例】两种元素原子的核外电子层数之比与它们的最外层电子数之比相等,在核电荷数为1~10的元素中,满足上述关系的元素共有( )
A.1对 B.2对
C.3对 D.4对
【解析】核电荷数为1~10的元素,核外电子层数只有1、2两种可能,因此核外电子层数之比只能是1∶2,最外层电子数,对于K层也只有两种,即H 1个、He 2个。因此符合题设要求的,最外层电子数是它们两倍的,只能是2个(Be)、4个(C)。故符合题设条件的只有H和Be、He和C两对,选项B正确。
【参考答案】 B
【点拨】根据核外电子的排布情况可以推测元素的种类及元素可能性质。
前18号元素的原子结构的特殊性
①原子核中无中子的原子 。
②最外层有1个电子的元素:H、Li、Na。
③最外层有2个电子的元素:Be、Mg、He。
④最外层电子数等于次外层电子数的元素:Be、Ar。
⑤最外层电子数是次外层电子数2倍的元素:C;是次外层电子数3倍的元素:O;是次外层电子数4倍的元素:Ne。
⑥电子层数与最外层电子数相等的元素:H、Be、Al。
⑦电子总数为最外层电子数2倍的元素:Be。
⑧次外层电子数是最外层电子数2倍的元素:Si。
⑨内层电子数是最外层电子数2倍的元素:Li、P。
【迁移训练1】(2011·泰州中学调研)下列说法正确的是( )
A.ⅠA族元素的金属性一定比ⅡA族元素的金属性强
B.ⅥA族元素中氢化物最稳定的其沸点一定最高
C.非金属元素只能形成共价化合物
D.短周期中,同周期元素的离子半径从左到右逐渐减小
【解析】A选项中,同周期中ⅠA族元素的金属性一定比ⅡA族元素的金属性强;
B选项中,ⅥA族元素中氢化物最稳定的是H2O,由于分子间存在氢键,其沸点也最高;
C选项中,铵盐中可以只含非金属元素;
D选项中,短周期中,同周期元素的原子半径从左到右逐渐减小(稀有气体除外),而离子半径则不是,如半径Na+<Cl-。
【参考答案】B
【典例2】根据下列短周期元素性质的数据判断,下列说法正确的是( )
A.元素①⑧形成的化合物具有两性
B.元素⑦位于第二周期Ⅴ族
C.元素④⑤形成的化合物是离子化合物
D.元素③的最高价氧化物对应水化物碱性最强
【解析】先根据原子半径大小和化合价确定元素在周期表中的位置,确定元素的种类。
经分析A选项元素①⑧形成的化合物是氧化铝,具有两性,正确;元素⑦位于第二周期ⅤA族,主族符号A不能少;
C选项元素④⑤形成的化合物是共价化合物;
D选项元素⑥比③的最高价氧化物对应水化物碱性强。
【参考答案】A
【点拨】根据化合价确定元素的主族位置,根据原子半径的相对大小确定上下位置,要注意上下调整。
【迁移训练2】(2010·南通四中模拟)下表是元素周期表的一部分。X、Y、Z、W均为短周期元素,X、W的质子数之和为23。下列说法正确的是( )
A.X元素最多可形成五种氧化物
B.W元素的非金属性比Z元素非金属性弱
C.Z和X能以共价键结合形成一种无机非金属材料
D.Y元素的最高价氧化物的水化物是含氧酸中酸性最强的
【解析】设X的原子序数为a,则W的原子序数为a+9,由题意得:a+a+9=23,a=7,所以X为N,Y为F,Z为Si,W为S。X的氧化物有:N2O、NO、N2O3、NO2、N2O4、N2O5六种;W元素的非金属性比Z元素非金属性强;Y为F,无最高价氧化物的水化物。
【参考答案】C
【典例3】有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是( )
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
【解析】根据题意,X、Y位于同主族,且Y在X的下一个周期,则Y的金属性强于X,非金属性弱于X。
【参考答案】A
【点拨】同一周期随原子序数增大,金属性逐渐减弱,非金属性逐渐增强;同一主族由上到下,金属性逐渐增强,非金属性逐渐减弱。
同一周期随原子序数增大,单质的氧化性逐渐增强,还原性逐渐减弱;同一主族由上到下,氧化性逐渐减弱,还原性逐渐增强。
最高价氧化物的水化物的酸碱性,同一周期随原子序数增大,酸性逐渐增强,碱性逐渐减弱;同一主族由上到下,酸性逐渐减弱,碱性逐渐增强。
同一周期随原子序数增大,气态氢化物的稳定性逐渐增强,还原性逐渐减弱,酸性逐渐增强;同一主族由上到下,气态氢化物的稳定性逐渐减弱,还原性逐渐增强,酸性逐渐增强。
【迁移训练3】(2010·南京模拟)某矿石由前20号元素中的4种组成,其化学式为WYZX。X、Y、Z、W分布在三个周期,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同周期,Z单质是一种良好的半导体。下列说法正确的是( )
A.原子半径:W>Y>Z>X
B.气态氢化物的稳定性:X
D.Y、Z的氧化物都有两性
【解析】根据所给信息,X为O,Z为Si,W能与冷水剧烈反应,W为第ⅠA元素,X、W原子的最外层电子数之和为7,所以Y的最外层电子数为3,Y、Z位于同周期,所以Y为Al,又因为X、Y、Z、W分布在三个周期,所以W为钾。气态氢化物的稳定性:X>Z,最高价氧化物对应水化物的碱性:W>Y,Y的氧化物(Al2O3)有两性,Z的氧化物(SiO2)为酸性氧化物。
【参考答案】A
【典例4】已知短周期元素的离子:aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径:A>B>C>D
B.原子序数:d>c>b>a
C.离子半径:C3->D->B+>A2+
D.单质的还原性:A>B>D>C
【解析】 aA2+、bB+、cC3-、dD-具有相同的电子层结构,说明A与B同周期,C与D同周期,且A、B处于C、D的下一周期,所以,原子半径是B>A>C>D,原子序数是a>b>d>c,离子半径是C3->D->B+>A2+,单质的还原性是B>A>C>D。
【参考答案】C
【点拨】1.原子半径:电子层数相同时,随原子序数递增,原子半径减小,如
r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl);
最外层电子数相同时,随电子层数递增原子半径增大,如r(Li)
①同种元素的离子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子,例:r(Cl-)>r(Cl),r(Fe)>r(Fe2+)>r(Fe3+);
②电子层结构相同的离子,核电荷数越大,半径越小,如
r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+);
③带相同电荷的离子,电子层越多,半径越大,如
r(Li+)
【迁移训练4】(2010·盐城中学模拟)X、Y、Z、W、R是周期表前20号元素,它们的原子序数依次增大,X与R,Y与W分别同主族,Z原子最外电子数是W原子最外层电子数的一半,X与Y可形成X2Y和X2Y2两种液态化合物。下列说法不正确的是( )
A.原子半径:R>Z>W>Y>X
B.离子半径:X、Z、Y、W、R依次增大
C.热稳定性:X2Y>X2W
D.由X、Y、Z、W、R五种元素组成的一种化合物可作净水剂
【解析】
由X与Y可形成X2Y和X2Y2两种液态化合物,可判断X为H,Y为O,再由题意可推出:Z为Al,W为S,R为K。B选项中,离子半径大小顺序为:W>R> Y > Z >X。
【参考答案】 B
【典例5】用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子八种微粒(离子或分子)。请回答:(以下用元素符号表示)
(1)A元素是______、B元素是______、C元素是______。
(2)D是由两种元素组成的双原子分子,其分子式是______。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是________。
(4)F是由两种元素组成的三原子分子,其分子式是________。
(5)G分子中含有4个原子,其分子式是________。
(6)H分子中含有8个原子,其分子式是________
【解析】熟悉常见的18个电子的离子或分子。
S
K
Cl
HCl
H2S
H2O2或PH3
F2
C2H6
【点拨】等电子体微粒结构相似,性质相似。平时要注意总结等电子体,练习书写等电子体的方法。
【迁移训练5】通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:
A:_____B:______C:_______D:_________。
(2)写出A、B、E三种微粒反应的离子方程式:
_____________________________________
_______________________________________ 。
H2O
NH3
NH4+
OH-
Al3++3NH3+3H2O===Al(OH)3↓+3 NH4+ 、
Mg2++2NH3+2H2O===Mg(OH)2↓+2 NH4+
【解析】熟悉常见的10个电子的离子或分子。
【典例6】(2010·金陵中学)短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A和C同主族,B原子的最外层电子数等于A原子次外层电子数。下列叙述中正确的是( )
A.原子半径:A
C.三种元素的最高价氧化物对应的水化物均可由化合反应得到
D.高温下,A单质能置换出C单质
【解析】由于B原子的最外层电子数等于A原子次外层电子数,可基本确定是镁,结合短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A和C同主族,推出A为碳,C为硅。原子半径应该是B>C>A;A的氢化物稳定性大于C的氢化物的稳定性;三种元素的最高价氧化物对应的水化物中硅酸不能由化合反应得到;高温下,碳单质能置换出硅单质,所以D正确。
【点拨】先推出元素,给元素定位,然后根据位置、结构分析性质。
【参考答案】D
【迁移训练6】(2010·通州模拟)短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为32,且原子最外层电子数之和为10;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素。下列叙述正确的是( )
A.四种元素的原子半径:C>D>B>A
B.C元素处于元素周期表中第3周期第ⅡA族
C.最高价氧化物对应的水化物的酸性:B>D
D.B、D的最高价氧化物中,B、D与氧原子之间均为单键
【参考答案】AC
【解析】
根据题意可推出:A为H,B为C,C为Na,D为Si。C元素处于元素周期表中第3周期第ⅠA族,B的最高价氧化物为CO2,C和O之间为双键。
