广东省惠州市2020-2021学年高一下学期期末考试化学试题 Word版含答案
文档属性
| 名称 | 广东省惠州市2020-2021学年高一下学期期末考试化学试题 Word版含答案 |

|
|
| 格式 | docx | ||
| 文件大小 | 475.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-18 00:00:00 | ||
图片预览




文档简介
惠州市2020-2021学年第二学期高一化学期末考试
化学试题
本试卷共20道必做题,考试时间75分钟,满分100分
可能用到的相对原子质量:H
1
C
12
N
14
O
16
Na
23
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学品的正确使用,关乎人体健康与环境保护。下列叙述正确的是
A.凡是有添加剂的食品均对人体健康不利
B.汽油是大宗化学品,属纯净物
C.化肥的超量使用不仅造成浪费,还可能污染环境
D.处方类药品是可不经医生直接购买服用
2.下列广东“南海1号”南宋沉船打捞的文物中,主要成分是有机高分子材料的是
A.陶瓷器
B.铜铁器
C.钱币
D.漆木器
3.
蒸发结晶操作中需要用到的仪器是
A.
B.
C.
D.
4.下列气体中,既可用浓H2SO4干燥,也可用碱石灰干燥的是
A.NO2
B.H2
C.Cl2
D.NH3
5.
食品检验是保证食品安全的重要措施,下列不属于食品安全检测指标的是
A.淀粉的含量
B.二氧化硫的含量
C.亚硝酸盐的含量
D.甲醛的含量
6.下列物品或设施,使用了硅酸盐材料的是
A.门窗玻璃
B.有机玻璃
C.光导纤维
D.计算机芯片
7.下列关于右图所示的装置的叙述,错误的是
A.铜是正极,其质量不变
B.电子从锌极沿导线流向铜极
C.铜极上发生氧化反应
D.铜极的电极反应式为2H++2e-=H2↑
8.下列措施中,不能增大反应速率达到实验目的的是
A.铁和稀盐酸反应制氢气时,用铁粉代替铁片
B.常温下用浓硫酸代替稀硫酸与铝反应制氢气
C.乙酸和乙醇进行酯化反应时采取加热措施
D.H2O2分解制O2时加入少量MnO2
9.
硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注,下列说法不正确的是
A.
汽车尾气中的含有NO、CO等多种大气污染物
B.
CO2
、NO2和SO2是形成酸雨的主要成因
C.
雷雨天气有少量HNO3降落地面,可促进植物生长
D.
工业废气中的SO2可采用石灰法进行脱除
10.
下列事实与括号中物质的性质对应关系正确的是
A.浓硝酸敞口放置于空气中密度减小(硝酸有强氧化性)
B.NO暴露于空气中变红棕色(NO有氧化性)
C.氢硫酸久置时变浑浊(H2S有还原性)
D.光照甲烷与氯气混合气体时,气体颜色变浅(甲烷有可燃性)
11.
若NA为阿伏伽德罗常数,下列说法正确的是
A.
28g
N2所占体积约为22.4
L
B.
标准状况下,22.4
LCCl4含有的分子数为NA
C.
100
mL
0.1
mol·L-1
HClO溶液中含H+数目为0.01NA
D.
标准状况下,11.2
L
N2和H2的混合气体所含分子数约为0.5NA
12.化学是以实验为基础的科学。下列实验操作或做法正确且能达到目的的是
选项
操作或做法
目的
A
将铜丝插入稀硝酸中
制备
NO2
B
实验室将生成的乙酸乙酯导入饱和的Na2CO3溶液中
可使产品更加纯净
C
实验室加热NH4Cl固体
制备NH3
D
向硝酸酸化的A溶液中滴加BaCl2溶液
检验A溶液中含有SO42-
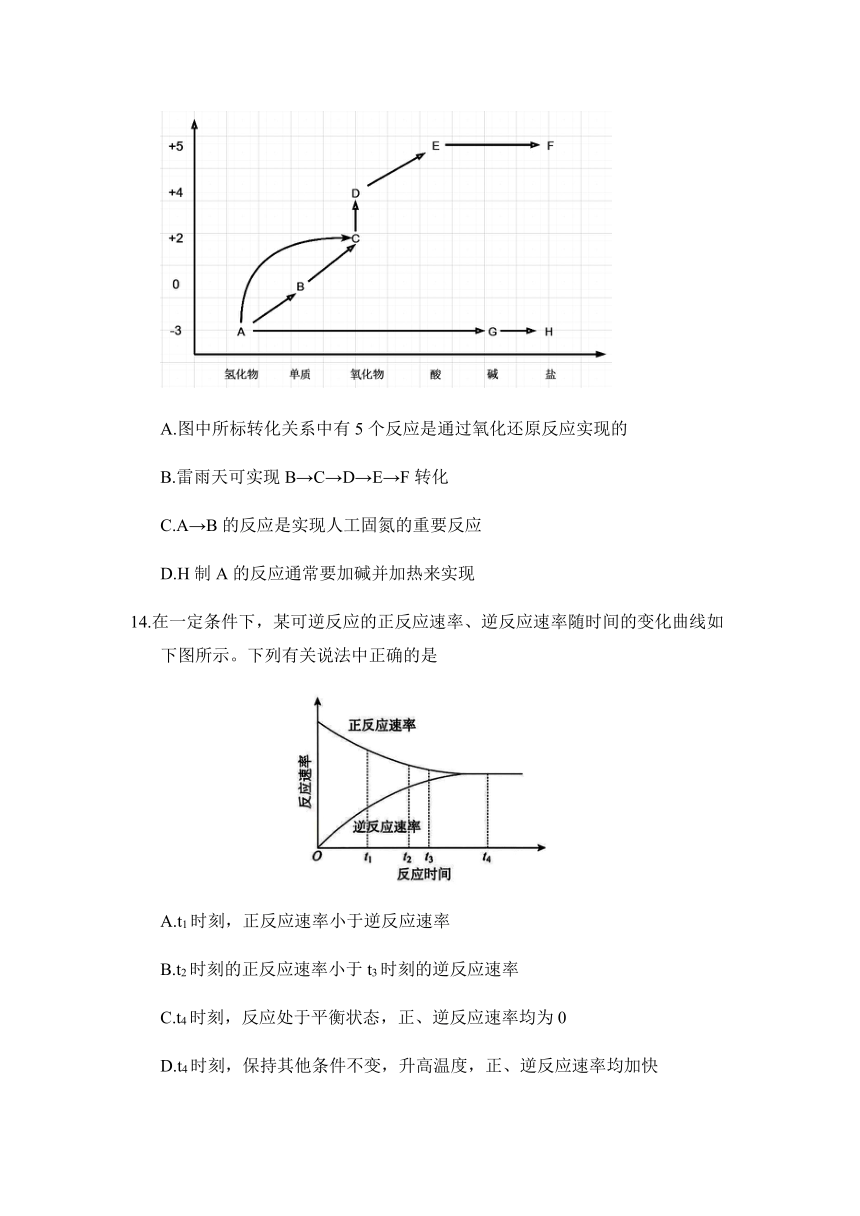
13.部分含氮物质的“价—类二维图”如下图所示。下列推断不合理的是
A.图中所标转化关系中有5个反应是通过氧化还原反应实现的
B.雷雨天可实现B→C→D→E→F转化
C.A→B的反应是实现人工固氮的重要反应
D.H制A的反应通常要加碱并加热来实现
14.在一定条件下,某可逆反应的正反应速率、逆反应速率随时间的变化曲线如下图所示。下列有关说法中正确的是
A.t1时刻,正反应速率小于逆反应速率
B.t2时刻的正反应速率小于t3时刻的逆反应速率
C.t4时刻,反应处于平衡状态,正、逆反应速率均为0
D.t4时刻,保持其他条件不变,升高温度,正、逆反应速率均加快
15.一定条件下的恒容密闭容器中,发生可逆反应H2(g)+I2(g)2HI(g)。下列情况能说明该反应一定达到平衡状态的是
A.1mol氢氢键断裂同时生成2mol氢碘键
B.H2的百分含量保持不变
C.混合气体的密度保持不变
D.H2、I2和HI的物质的量之比为1:1:2
16.柳树皮中的水杨酸可与乙酸酐发生下列反应生成乙酰水杨酸(阿司匹林):
以下说法中不正确的是
A.
水杨酸和乙酰水杨酸均有两种含氧官能团
B.
该反应的类型为加成反应
C.一定条件下,乙酰水杨酸既能发生酯化反应也能发生水解反应
D.反应式中有三种物质可直接与小苏打水溶液反应产生CO2
二、非选择题:共56分。
17.(14分)浓硫酸与木炭在加热条件下可发生化学反应,为检验反应的产物,某同学设计了如下图所示的实验。请据此回答下列问题
(1)连接好装置后(未加试剂),检验该装置的气密性的操作是:
①
关闭___________,在D
装置的导管口连接玻璃导管并插入盛水的水槽中;用酒精灯微热烧瓶,玻璃导管口___________;
②
停止加热时_________________。结合步骤上述实验现象,可以判断该装置气密性良好。
(2)实验过程中:
①
圆底烧瓶内发生反应的化学方程式为___________________________。
②
A装置现象是______,证明产物中_______生成(填写化学式,下同);
③
B装置证明产物中有_______生成,现象是_______________;
④
D装置证明产物中有_______生成,现象是_______________;
⑤
C装置的作用是____________,发生反应的离子方程式是__________。
18.(16分)氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意:
(1)合成塔中,反应开始进行时需要加热,加热的目的主要是_____________;反应开始后停止加热,发现反应更加剧烈,由此可知该反应是_____(填“放热”或“吸热”)反应。
(2)从合成气中分离出氨,主要利用了氨气________的性质;从氨分离器中分离出的另两种气体可回到________(填写装置名称)中再利用。
(3)请写出氧化炉内发生反应的化学方程式并用标出电子转移的方向和数目____________
______。
(4)向吸收塔中通入过量A是
,作用是___________。尾气处理装置中含有少量的NO2,可用NH3将其还原成不污染环境的气体,该反应方程式是___
_________。
(5)硝酸可氧化绝大多数金属,而工业上盛装大量浓硝酸可用铝制容器,原因是___________________________。
(6)①
可利用浓盐酸检验氨气管道是否泄漏,若泄漏,可观察到的现象_____
___
,该反应方程式是___
_________。
②
氯化铵是一种高效氮肥,但因_____
_____,必须放置阴凉处保存。硝酸铵也是一种高效氮肥,但__________,因此必须做改性处理后才能施用。
19.(12分)某温度时,在2
L容器中发生A、B两种气体间的转化反应,A、
B物质的量随时间变化的曲线如右图所示。请分析图中数据,回答下列问题。
【M点的坐标为(7,0.24)】
(1)该反应_____(填写“是”或“不是”)可逆反应,判断依据是__________。
(2)该化学方程式为___________________。
(3)反应从开始至4min时,用B的浓度变化来表示的反应速率为_____
_____。
(4)
比较M、N两点该反应的正反应速率的相对大小ⅴ(M)正______ⅴ(N)正(填写“>”、“<”或“=”)。判断依据是________________________________。
(5)运用图示数据计算该反应达到限度时A的转化率为__________%。
20.(14分)丙烯酸乙酯天然存在于菠萝等水果中,是一种食品用合成香料,可以用有机物A和石油化工产品C、E等为原料进行合成
已知:A是遇碘水显蓝色的有机物;
C是最简单的烯烃,其产量可以用来衡量一个国家石油化学工业的发展水平;E是C的同系物,其相对分子质量比C大14。回答下列问题
①
A的名称是______,A的分子式为____
__。
②
E的结构简式为____
__。
(2)C转化成D的化学方程式为_______________________。
(3)流程中C→D、D与F反应的反应类型分别是__________和__________。
(4)流程中,有机物B的结构简式为CH2OH-CHOH-CHOH-CHOH-CHOH-CHO,其所含官能团的名称是___________。
(5)写出丙烯酸乙酯自身发生加成聚合反应生成高聚物的化学方程式___
___。
(6)工业上用162t的A和足量的E为主要有机原料来生成丙烯酸乙酯,共得到100t产品,则该生产过程的产率为___________。
惠州市2020-2021学年第二学期高一化学期末考试
化学参考答案
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
C
D
C
B
A
A
C
B
B
C
D
B
C
D
B
B
二、非选择题:共56分
17.(共14分)
(1)
①
分液漏斗的旋塞(1分);有气泡冒出(1分);
②
液面沿导管口上升一段,最后形成稳定的水柱(1分)
(2)
①
C
+
2H2SO4(浓)CO2↑+SO2↑+2H2O(2分,没有配平扣1分)
②
固体由白色变蓝色(1分)
有水
(1分)
③
SO2(1分)
品红褪色(颜色变浅)
(1分)
④
CO2(1分)
澄清石灰水变浑浊
(1分)
⑤
吸收SO2,防止对CO2的检验产生干扰
(1分)
2MnO4-
+5SO2
+2H2O
=
2Mn2++5SO42-
+
4H+(2分,没有配平扣1分)
18.(共16分)
(1)促使反应发生,加快反应速率
(1分)
放热(1分)
(2)易液化(1分)
合成塔(1分)
(3)(2分,方程式正确1分,使用单线或双线桥表示都可以,电子转移1分)
(4)空气(氧气)(1分)
将NO氧化成NO2(1分)
8NH3
+6NO2
=
7N2
+12H2O(2分,没有配平扣1分)
(5)常温下,浓硝酸可使铝钝化(2分,没有说明常温扣1分)
(6)产生白烟(1分);
NH3+HCl=NH4Cl
(1分)
受热易分解(1分);受到撞击或遇热易爆炸(1分)
19.(共12分)
(1)
是
(1分)
从图可知,M点以后反应物和产物的浓度保持不变,即反应不能进行到底(
2分)
(2)
2A
B
(
2分)
(3)
0.025mol·L-1·
min-1
(
2分,单位1分)
(4)
<
(2分)
N点反应物A的浓度大于M点A的浓度
(1分)
(5)
70
(
2分,写70.0的不扣分)
(共14分)
(1)淀粉(1分)
(C6H10O5)n(1分)
CH2=CH-CH3
(2分,写C3H6不给分)
(2)CH2=CH2+H2OC2H5OH
(
2分
)
(3)加成反应
取代反应(或酯化反应)(1+1分)
(4)羟基、醛基(1+1分)
(5)(2分)
(6)50%(
2分,或50.0%)
化学试题
本试卷共20道必做题,考试时间75分钟,满分100分
可能用到的相对原子质量:H
1
C
12
N
14
O
16
Na
23
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学品的正确使用,关乎人体健康与环境保护。下列叙述正确的是
A.凡是有添加剂的食品均对人体健康不利
B.汽油是大宗化学品,属纯净物
C.化肥的超量使用不仅造成浪费,还可能污染环境
D.处方类药品是可不经医生直接购买服用
2.下列广东“南海1号”南宋沉船打捞的文物中,主要成分是有机高分子材料的是
A.陶瓷器
B.铜铁器
C.钱币
D.漆木器
3.
蒸发结晶操作中需要用到的仪器是
A.
B.
C.
D.
4.下列气体中,既可用浓H2SO4干燥,也可用碱石灰干燥的是
A.NO2
B.H2
C.Cl2
D.NH3
5.
食品检验是保证食品安全的重要措施,下列不属于食品安全检测指标的是
A.淀粉的含量
B.二氧化硫的含量
C.亚硝酸盐的含量
D.甲醛的含量
6.下列物品或设施,使用了硅酸盐材料的是
A.门窗玻璃
B.有机玻璃
C.光导纤维
D.计算机芯片
7.下列关于右图所示的装置的叙述,错误的是
A.铜是正极,其质量不变
B.电子从锌极沿导线流向铜极
C.铜极上发生氧化反应
D.铜极的电极反应式为2H++2e-=H2↑
8.下列措施中,不能增大反应速率达到实验目的的是
A.铁和稀盐酸反应制氢气时,用铁粉代替铁片
B.常温下用浓硫酸代替稀硫酸与铝反应制氢气
C.乙酸和乙醇进行酯化反应时采取加热措施
D.H2O2分解制O2时加入少量MnO2
9.
硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注,下列说法不正确的是
A.
汽车尾气中的含有NO、CO等多种大气污染物
B.
CO2
、NO2和SO2是形成酸雨的主要成因
C.
雷雨天气有少量HNO3降落地面,可促进植物生长
D.
工业废气中的SO2可采用石灰法进行脱除
10.
下列事实与括号中物质的性质对应关系正确的是
A.浓硝酸敞口放置于空气中密度减小(硝酸有强氧化性)
B.NO暴露于空气中变红棕色(NO有氧化性)
C.氢硫酸久置时变浑浊(H2S有还原性)
D.光照甲烷与氯气混合气体时,气体颜色变浅(甲烷有可燃性)
11.
若NA为阿伏伽德罗常数,下列说法正确的是
A.
28g
N2所占体积约为22.4
L
B.
标准状况下,22.4
LCCl4含有的分子数为NA
C.
100
mL
0.1
mol·L-1
HClO溶液中含H+数目为0.01NA
D.
标准状况下,11.2
L
N2和H2的混合气体所含分子数约为0.5NA
12.化学是以实验为基础的科学。下列实验操作或做法正确且能达到目的的是
选项
操作或做法
目的
A
将铜丝插入稀硝酸中
制备
NO2
B
实验室将生成的乙酸乙酯导入饱和的Na2CO3溶液中
可使产品更加纯净
C
实验室加热NH4Cl固体
制备NH3
D
向硝酸酸化的A溶液中滴加BaCl2溶液
检验A溶液中含有SO42-
13.部分含氮物质的“价—类二维图”如下图所示。下列推断不合理的是
A.图中所标转化关系中有5个反应是通过氧化还原反应实现的
B.雷雨天可实现B→C→D→E→F转化
C.A→B的反应是实现人工固氮的重要反应
D.H制A的反应通常要加碱并加热来实现
14.在一定条件下,某可逆反应的正反应速率、逆反应速率随时间的变化曲线如下图所示。下列有关说法中正确的是
A.t1时刻,正反应速率小于逆反应速率
B.t2时刻的正反应速率小于t3时刻的逆反应速率
C.t4时刻,反应处于平衡状态,正、逆反应速率均为0
D.t4时刻,保持其他条件不变,升高温度,正、逆反应速率均加快
15.一定条件下的恒容密闭容器中,发生可逆反应H2(g)+I2(g)2HI(g)。下列情况能说明该反应一定达到平衡状态的是
A.1mol氢氢键断裂同时生成2mol氢碘键
B.H2的百分含量保持不变
C.混合气体的密度保持不变
D.H2、I2和HI的物质的量之比为1:1:2
16.柳树皮中的水杨酸可与乙酸酐发生下列反应生成乙酰水杨酸(阿司匹林):
以下说法中不正确的是
A.
水杨酸和乙酰水杨酸均有两种含氧官能团
B.
该反应的类型为加成反应
C.一定条件下,乙酰水杨酸既能发生酯化反应也能发生水解反应
D.反应式中有三种物质可直接与小苏打水溶液反应产生CO2
二、非选择题:共56分。
17.(14分)浓硫酸与木炭在加热条件下可发生化学反应,为检验反应的产物,某同学设计了如下图所示的实验。请据此回答下列问题
(1)连接好装置后(未加试剂),检验该装置的气密性的操作是:
①
关闭___________,在D
装置的导管口连接玻璃导管并插入盛水的水槽中;用酒精灯微热烧瓶,玻璃导管口___________;
②
停止加热时_________________。结合步骤上述实验现象,可以判断该装置气密性良好。
(2)实验过程中:
①
圆底烧瓶内发生反应的化学方程式为___________________________。
②
A装置现象是______,证明产物中_______生成(填写化学式,下同);
③
B装置证明产物中有_______生成,现象是_______________;
④
D装置证明产物中有_______生成,现象是_______________;
⑤
C装置的作用是____________,发生反应的离子方程式是__________。
18.(16分)氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意:
(1)合成塔中,反应开始进行时需要加热,加热的目的主要是_____________;反应开始后停止加热,发现反应更加剧烈,由此可知该反应是_____(填“放热”或“吸热”)反应。
(2)从合成气中分离出氨,主要利用了氨气________的性质;从氨分离器中分离出的另两种气体可回到________(填写装置名称)中再利用。
(3)请写出氧化炉内发生反应的化学方程式并用标出电子转移的方向和数目____________
______。
(4)向吸收塔中通入过量A是
,作用是___________。尾气处理装置中含有少量的NO2,可用NH3将其还原成不污染环境的气体,该反应方程式是___
_________。
(5)硝酸可氧化绝大多数金属,而工业上盛装大量浓硝酸可用铝制容器,原因是___________________________。
(6)①
可利用浓盐酸检验氨气管道是否泄漏,若泄漏,可观察到的现象_____
___
,该反应方程式是___
_________。
②
氯化铵是一种高效氮肥,但因_____
_____,必须放置阴凉处保存。硝酸铵也是一种高效氮肥,但__________,因此必须做改性处理后才能施用。
19.(12分)某温度时,在2
L容器中发生A、B两种气体间的转化反应,A、
B物质的量随时间变化的曲线如右图所示。请分析图中数据,回答下列问题。
【M点的坐标为(7,0.24)】
(1)该反应_____(填写“是”或“不是”)可逆反应,判断依据是__________。
(2)该化学方程式为___________________。
(3)反应从开始至4min时,用B的浓度变化来表示的反应速率为_____
_____。
(4)
比较M、N两点该反应的正反应速率的相对大小ⅴ(M)正______ⅴ(N)正(填写“>”、“<”或“=”)。判断依据是________________________________。
(5)运用图示数据计算该反应达到限度时A的转化率为__________%。
20.(14分)丙烯酸乙酯天然存在于菠萝等水果中,是一种食品用合成香料,可以用有机物A和石油化工产品C、E等为原料进行合成
已知:A是遇碘水显蓝色的有机物;
C是最简单的烯烃,其产量可以用来衡量一个国家石油化学工业的发展水平;E是C的同系物,其相对分子质量比C大14。回答下列问题
①
A的名称是______,A的分子式为____
__。
②
E的结构简式为____
__。
(2)C转化成D的化学方程式为_______________________。
(3)流程中C→D、D与F反应的反应类型分别是__________和__________。
(4)流程中,有机物B的结构简式为CH2OH-CHOH-CHOH-CHOH-CHOH-CHO,其所含官能团的名称是___________。
(5)写出丙烯酸乙酯自身发生加成聚合反应生成高聚物的化学方程式___
___。
(6)工业上用162t的A和足量的E为主要有机原料来生成丙烯酸乙酯,共得到100t产品,则该生产过程的产率为___________。
惠州市2020-2021学年第二学期高一化学期末考试
化学参考答案
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
C
D
C
B
A
A
C
B
B
C
D
B
C
D
B
B
二、非选择题:共56分
17.(共14分)
(1)
①
分液漏斗的旋塞(1分);有气泡冒出(1分);
②
液面沿导管口上升一段,最后形成稳定的水柱(1分)
(2)
①
C
+
2H2SO4(浓)CO2↑+SO2↑+2H2O(2分,没有配平扣1分)
②
固体由白色变蓝色(1分)
有水
(1分)
③
SO2(1分)
品红褪色(颜色变浅)
(1分)
④
CO2(1分)
澄清石灰水变浑浊
(1分)
⑤
吸收SO2,防止对CO2的检验产生干扰
(1分)
2MnO4-
+5SO2
+2H2O
=
2Mn2++5SO42-
+
4H+(2分,没有配平扣1分)
18.(共16分)
(1)促使反应发生,加快反应速率
(1分)
放热(1分)
(2)易液化(1分)
合成塔(1分)
(3)(2分,方程式正确1分,使用单线或双线桥表示都可以,电子转移1分)
(4)空气(氧气)(1分)
将NO氧化成NO2(1分)
8NH3
+6NO2
=
7N2
+12H2O(2分,没有配平扣1分)
(5)常温下,浓硝酸可使铝钝化(2分,没有说明常温扣1分)
(6)产生白烟(1分);
NH3+HCl=NH4Cl
(1分)
受热易分解(1分);受到撞击或遇热易爆炸(1分)
19.(共12分)
(1)
是
(1分)
从图可知,M点以后反应物和产物的浓度保持不变,即反应不能进行到底(
2分)
(2)
2A
B
(
2分)
(3)
0.025mol·L-1·
min-1
(
2分,单位1分)
(4)
<
(2分)
N点反应物A的浓度大于M点A的浓度
(1分)
(5)
70
(
2分,写70.0的不扣分)
(共14分)
(1)淀粉(1分)
(C6H10O5)n(1分)
CH2=CH-CH3
(2分,写C3H6不给分)
(2)CH2=CH2+H2OC2H5OH
(
2分
)
(3)加成反应
取代反应(或酯化反应)(1+1分)
(4)羟基、醛基(1+1分)
(5)(2分)
(6)50%(
2分,或50.0%)
同课章节目录
