1.0《化学反应与能量》PPT课件(新人教版-选修4)
文档属性
| 名称 | 1.0《化学反应与能量》PPT课件(新人教版-选修4) |  | |
| 格式 | zip | ||
| 文件大小 | 682.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-05 15:15:11 | ||
图片预览










文档简介
(共57张PPT)
新课标人教版课件系列
《高中化学》
选修4
第一章
《化学反应与能量》
教学目标
1.了解化学反应中能量转化的原因和常见的能量转化形式。
2.认识化学反应过程中同时存在着物质和能量的变化,而且能量的释放或吸收是以发生变化的物质为基础的,能量的多少取决于反应物和生成物的质量。
3.了解反应热和焓变的涵义。
4.认识热化学方程式的意义并能正确书写热化学方程式。
5、理解燃烧热的概念,认识能源是人类生存和发展的重要基础,了解化学在解决能源危机中的重要作用。
6、知道节约能源、提高能量利用效率的实际意义。
7、理解盖斯定律的意义,能用盖斯定律和热化学方程式进行有关反应热的简单计算。
第一章 化学反应与能量
第一节
《化学反应与能量的变化》
一、反应热 焓变
问题:
化学反应过程中为什么会有能量的
变化?(用学过的知识回答)
化学反应的实质就是反应物分子中化学键
断裂,形成新的化学键,从新组合成生成
物的分子的过程。旧键断裂需要吸收能量,
新键形成需要放出能量。而一般化学反应
中,旧键的断裂所吸收的总能量与新键形
成所放出的总能量是不相等的,而这个差
值就是反应中能量的变化。所以化学反应
过程中会有能量的变化。
例子
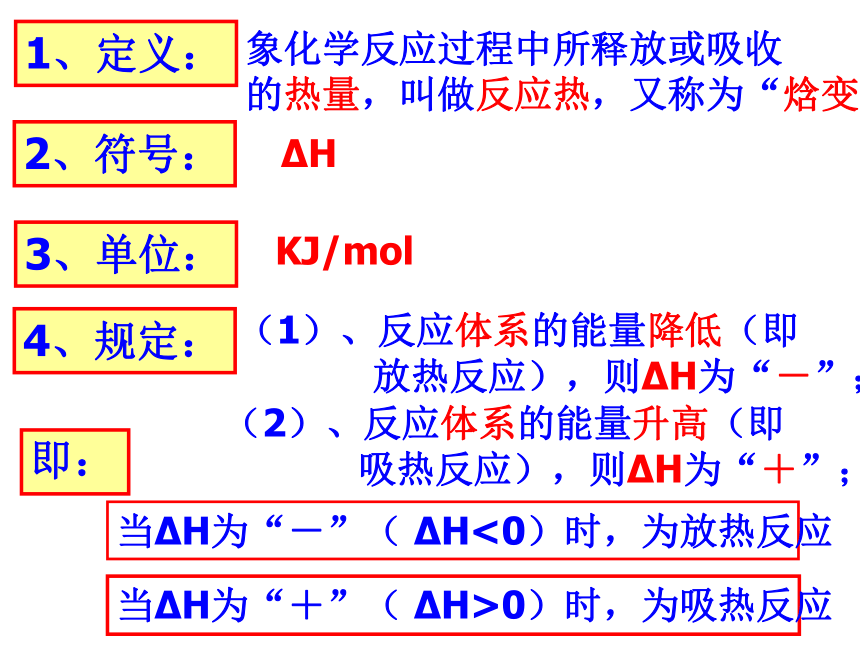
1、定义:
象化学反应过程中所释放或吸收
的热量,叫做反应热,又称为“焓变”
2、符号:
H
3、单位:
KJ/mol
4、规定:
(1)、反应体系的能量降低(即
放热反应),则 H为“-”;
(2)、反应体系的能量升高(即
吸热反应),则 H为“+”;
即:
当 H为“-”( H<0)时,为放热反应
当 H为“+”( H>0)时,为吸热反应
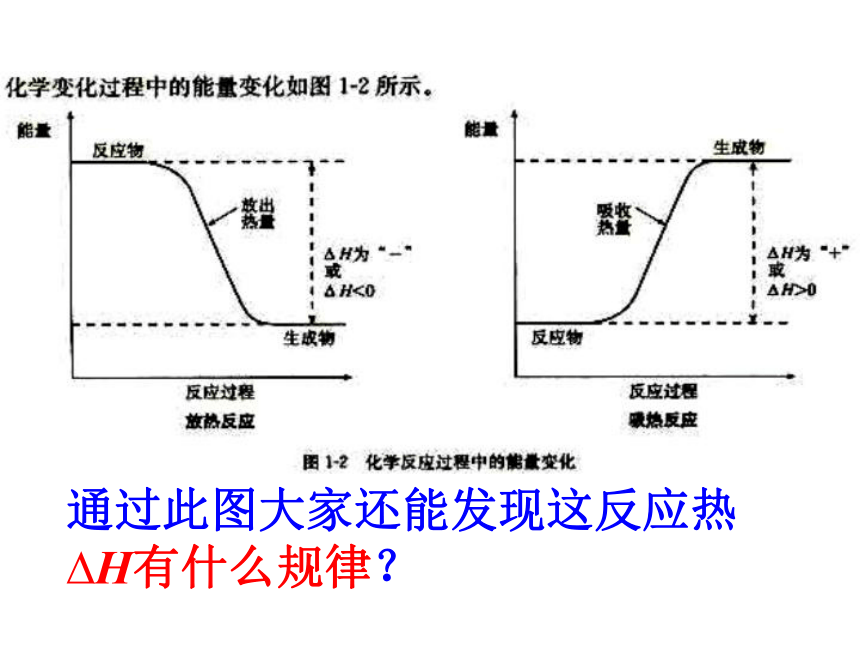
通过此图大家还能发现这反应热
H有什么规律?
我们可以发现:其实
H=
E(生成物的总能量)- E(反应物的总能量)
H=
E(生成物分子化学键形成时所吸收的总能量)- E(反应物分子化学键断裂时所释放的总能量)
我们认识了反应热,那么怎样书写
表示化学反应热的化学方程式?
例 1:1molC与1molH2O(g)反应失成lmol CO(g)和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H= kJ/mol。
例 2:拆开 lmol H—H键、lmol N-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946kj,则1mol N2生成NH3的反应热为 ,1mol H2生成NH3的反应热为 。
+131.5
-92KJ/mol
-30.6KJ/mol
练 习
二、学会热化学方程式的书写
什么是热化学方程式?
表示参加反应物质的量和反应热的
关系的化学方程式,叫做热化学方
程式。
请看以下两个例子,再思考!
问题:
通过以上两个例子,说明一下热化学方程式
与一般的化学方程式的书写有什么不同?
(1)、书写热化学方程式要注明反应的温度和
压强,(为什么?)而常温、常压可以不注明,
即不注明则是常温、常压。
(2)、标出了反应物与生成物的状态,
(为什么要标出?)
(3)、写出了反应热,还注明了“+”,“-”
(4)、方程式中的计量系数可以是整数也可以
是分数。
问题:
反应物和生成物前的系数它代表了什么?
在方程式中 H它表示了什么意义? H
它的值与什么有关系?
热化学方程式中各物质前的化学计量数不
表示分子个数,表示对应物质的物质的量。
H(KJ/mol)它表示每摩尔反应所放出的
热量, H它的值与方程式中的计量系数
有关,即对于相同的反应,当化学计量数
不同时,其 H不同。
例 题
1、当1mol气态H2与1mol气态Cl2反应
生成2mol气态HCl,放出184.6KJ的热
量,请写出该反应的热化学方程式。
H2(g) + Cl2(g) =2HCl(g) H =-184.6KJ/mol
而这些书写也是对的
写出下列反应的热化学方程式
课堂练习
1、1molN2(g)与适量O2(g)反应生成NO (g),需吸收68kJ的热量;
2、2molCu(s)与适量O2(g)反应生成CuO(s),放出314kJ热量;
3、 1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式。
4、 4g CO在氧气中燃烧生成CO2,放出 9. 6kJ热量,写出CO燃烧的热化学方程式。
5、在一定条件下,氢气和甲烷燃烧的化学方程式为:
2H2(g) + O2 (g) = 2H2O (l); H= – 572 kJ /mol
CH4(g) +2O2 (g) = CO2(g)+2H2O (l); H= – 890 kJ/mol由1mol 氢气和2mol甲烷组成的混合气体在上述条件下完全燃烧时放出的热量为多少。
2066KJ
6、在一定条件下,氢气和丙烷燃烧的化学方程式为:
2H2(g) + O2 (g) = 2H2O (l); H= – 572 kJ/mol
C3H8(g) +5O2(g)= 3CO2 (g) +4H2O (l); H= – 2220 kJ/mol
5mol 氢气和丙烷的混合气完全燃烧时放热
3847kJ,则氢气和甲烷的体积比为
(A) 1:3 (B) 3:1 (C) 1:4 (D) 1:1
B
第一章 化学反应与能量
第二节
《燃烧热 能源》
首先回顾上一节课小结、练习与思考。
反应热
化学反应中的能量变化
热化学方程式
(练习与巩固)依据事实,写出下列反应的热化学方程式∶
(1)1mol碳完全燃烧放出393.5KJ的热量;
(2)1克甲醇燃烧生成二氧化碳和水(液态)时放热22.68KJ;
(3)1mol氯气和水蒸气通过灼热的炭层反应,生成氯化氢和二氧化碳放出145KJ的热量。
参考答案∶
(1)C(s)+O2(g)=CO2(g) △H=-393.5KJ/mol
(2)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.8KJ/mol
(3)2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO 2 (g)
△H=-290KJ/mol
一、燃烧热
燃烧热∶25oC、101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热。单位为KJ/mol。如常温常压下,1mol甲烷完全燃烧放出890.31KJ的热量,就是甲烷的燃烧热∶
CH4(g)+2O2(g)=CO2(g)+2H2O(g)
△H=-890.31KJ/mol
阅读表1-1
思考与交流∶我们应根据什么标准看来选择燃料?试举例说明。
从物质的燃烧热、燃料的储量、开采、运输、储存的条件、价格、对生态环境的影响等各方面综合考虑。
二、能源
能源就是能提供能量的自然资源,它包括化石燃料、阳光、风力、流水、潮汐及柴草等等。我国目前使用的主要能源是化石燃料。
阅读资料∶“我国能源状况”
思考怎样利用、科学控制、寻找能源?
科学视野∶太阳能,氢能,地热能,风能等。
实践活动∶查阅资料(可以课后进行)
相关思考题∶
[问题]1.什么是化石燃料 目前使用最多的燃料是什么
2.燃料充分燃烧的条件是什么
3.燃料燃烧时,若空气过量或不足,会造成什么后果
4.为什么固体燃料要粉碎后使用
5.导致酸雨形成的主要原因是什么
1.人类当前所需能源的主要来源是化石燃料――煤、石油、天然气。
2.人类应当树立节能意识:
(1)化石燃烧无法再生;
(2)提高燃烧效率,节约能源。
3.使燃料充分燃烧的措施:
(1)通入充足且适量的空气;
(2)固体燃料粉碎、液体燃料喷雾以增大燃料与空气的接触面。
4.煤炭的气化和液化,既防止污染,又提高燃烧效率。
12g石墨与O2反应生成CO2放出393.51KJ热量; 12g金刚石与O2反应生成CO2放出395.41KJ热量,试比较,石墨与金刚石哪个稳定?
比较相同状态、相同数量的金刚石和石墨,与O2完全反应,生成相同状态、相同数量的CO2,金刚石释放出的热量更多,说明金刚石具有的总能量高,不稳定
思考
1. 下列反应既属于氧化还原反应,又是吸热反应的是( )
A.铝片与稀盐酸的反应.
B.Ba(OH)2·8H2O与NH4Cl的反应.
C.灼热的碳与CO2的反应
D.甲烷在氧气中的燃烧反应
2. 下列燃料中,不属于化石燃料的是( )
A.煤 B.石油 C.天然气 D.水煤气
[练习]
C
D
3. 酸雨危害可包括( )
①对人体的直接危害,引起肺部疾病而使人致死,②引起河流,湖泊的水体酸化,严重影响水生动杆物的生长,③破坏土壤,植被,森林 ④腐蚀金属,油漆,皮革,纺织品及建筑材料等,⑤渗入地下,可能引起地下水酸化.
A.①③⑤ B.①②③④
C.①③④⑤ D.①②③④⑤
C
下面请大家看看燃烧对环境的污染及侵害
(第二次作业∶P9EX5、EX6;预习化学反应热的计算。)
观看图片∶
第一章 化学反应与能量
第三节
《化学反应热的计算》
H2(g)+1/2O2(g)==H2O(g) △H1=-241.8kJ/mol
那么,H2的燃烧热△H究竟是多少?如何计算?
已知: H2O(g)==H2O(l) △H2=-44kJ/mol
H2(g)+1/2O2(g)==H2O(l) △H=△H1+△H2=-285.8kJ/mol
下列数据△H1表示燃烧热吗?why
小组讨论汇报
如何测出这个反应的反应热:
(1)C(s)+1/2O2(g)==CO(g) ΔH1=
①C(s)+1/2O2(g)==CO(g) ΔH1=
②CO(g)+1/2O2(g)== CO2(g) ΔH2=-283.0kJ/mol
③C(s)+O2(g)==CO2(g) ΔH3=-393.5kJ/mol
① + ② = ③ ,
则 ΔH1 + ΔH2 =ΔH3
所以, ΔH1 =ΔH3- ΔH2 =-393.5kJ/mol+ 283.0kJ/mol=-110.5kJ/mol
应用了什么规律?
不管化学反应是分一步完成或分几步完成,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
如何理解盖斯定律?
ΔH、ΔH1、ΔH2
之间有何关系?
ΔH=ΔH1+ΔH2
B
ΔH
A
C
ΔH1
ΔH2
例1:写出石墨变成金刚石的热化学方程式 (25℃,101kPa时)
说明: (1)可以在书中查找需要的数据
(2)并告诉大家你设计的理由。
先思考,之后小组讨论汇报
查燃烧热表知:
①C(石墨,s)+O2(g)==CO2(g) △H1=-393.5kJ/mol
②C(金刚石,s)+O2(g)==CO2(g) △H2=-395.0kJ/mol
所以, ①- ②得:
C(石墨,s)= C(金刚石,s) △H=+1.5kJ/mol
观察该热化学方程式,回答:金刚石能自动变成石墨吗?需要什么条件?
若金刚石、石墨共1mol混合在氧气中燃烧,产热QKJ,则两者的物质的量之比为:
你知道神六的火箭燃料是什么吗?
例2:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2 N2H4(g)+ 2NO2(g)== 3N2(g)+4H2O(l) △H=-1135.2kJ/mol
1、请用自己的话描述一下盖斯定律。
2、盖斯定律有哪些用途?
盖斯定律:不管化学反应是一步完成或分几步完成,其反应热是相同.换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关.
因为有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难.此时如果应用盖斯定律,就可以间接地把它们的反应热计算出来.
例1:已知298K时,合成氨反应N2(g) +3H2(g) =2NH3(g
) △H1=-92.0kJ/mol ,将此温度下的0.1molN2和0.3molH2放在密闭容器中反应,测得反应放出的热为:
A一定小于92.0kJ B一定大于92.0kJ
C一定等于92.0kJ D无法确定
例2充分燃烧一定量的丁烷,放出热为Q.完全吸收它生成CO2生成正盐,需5mol/L的KOH溶液100mL,则丁烷的燃烧热为:
例3已知CH4 (g) + 2O2(g)=CO2 (g) +
2H2 O (l)△ H= -Q1 KJ/mol
2H2(g)+O2(g) =2H2 O (g)
△ H= -Q2 KJ/mol
2H2(g)+O2(g) =2H2 O (l)
△ H=- Q3 KJ/mol,
常温下,取体积比4:1的甲烷和氢气的混合气体11.2L(标况),经完全燃烧恢复常温,放出的热为:
例4已知: Zn ( s ) +1/2O2 ( g ) = ZnO ( s ) ΔH = -351.1 kJ/mol
Hg ( l) +1/2O2 ( g ) = Hg O ( s ) ΔH = -90.7 kJ/mol
则可知: Zn ( s ) + Hg O ( s ) = ZnO ( s ) + Hg ( l)
ΔH 3= kJ/mol。则 为ΔH 3为多少?
例5已知:2C(s) + O2 ( g ) =2CO ( g ) ΔH = -221 kJ/mol
2H2 ( g ) + O2 ( g ) = 2H2O ( g ) ΔH = -483.6 kJ/mol
则C(s) + H2O ( g ) =CO ( g ) + H2( g )的ΔH为多少
CH4 ( g )+1/2O2 ( g ) = CO ( g ) + 2H2 g )
ΔH = -36 kJ/mol
CH4 ( g )+ H2O ( g ) = CO ( g ) + 3 H2 ( g )
ΔH = +216 kJ/mol由以上反应推出总反应热为零的总反应式子.
例7某人浸泡在盛有60mL水的浴盆中,在1h内,人体
所散发的热量使水温从30℃升到31.5 ℃,该人一天可释放多少热量 1g脂肪燃烧放出39.7KJ的热量,如果该人一天所需的热量以摄入脂肪来计算.则他一天至少需要摄入多少克脂肪 已知水的比热容为4.2KJ.(Kg. ℃)
例8强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)
△ H= -57.3 KJ/mol 分别向NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应的热效应分别为△H1 △H2 △H3则三者的大小关系为:
例9. 0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,其热化学方程式为:
已知H2O(l)=H2O (g) △ H=44kJ/mol,则11.2L(标况)乙硼烷完全燃烧生成气态水时放出的热量为多少
例10反应热是:
A燃烧热的集中表现
B中和热的集中表现
C溶解热的集中表现
D键能变化的集中表现
例11下列变化属于吸热反应的是:
a液态水汽化 b将胆矾加热变为白色粉未c浓硫酸稀释d氯酸钾分解得氧气e生石灰跟水反应生成熟石灰
例12下列反应既是氧化还原反应,又是放热反应是
A铝片与稀硫酸BBa(OH)2.8H2O和NH4Cl的反应
C灼热的碳与二氧化碳反应D氢氧化钠与盐酸反应
例13已知:H2O ( g ) = H2O ( l ) ΔH = Q1 kJ/mol
则C2H5OH(g) = C2H5OH(l) ΔH = Q2kJ/mol
C2H5OH(g) +3O2 (g) = 3H2O ( g ) + 2CO2 ( g ) ΔH =Q3kJ/mol
若使23g液体酒精完全燃烧,最后恢复到室温,则放出的热量为: KJ
例14我们把拆开1mol共价键所吸收的能量或生成1mol共价键所放出的能量叫键能,已知Cl-Cl键的键能为247 kJ/mol.下列有关键能的说法正确的是:
A要拆开1mol Cl-Cl键需要吸收247 kJ能量
B要形成1mol Cl-Cl键需要吸收247 kJ能量
C要拆开1mol Cl-Cl键需要放出247 kJ能量
A要形成1mol Cl-Cl键需要放出247 kJ能量
新课标人教版课件系列
《高中化学》
选修4
第一章
《化学反应与能量》
教学目标
1.了解化学反应中能量转化的原因和常见的能量转化形式。
2.认识化学反应过程中同时存在着物质和能量的变化,而且能量的释放或吸收是以发生变化的物质为基础的,能量的多少取决于反应物和生成物的质量。
3.了解反应热和焓变的涵义。
4.认识热化学方程式的意义并能正确书写热化学方程式。
5、理解燃烧热的概念,认识能源是人类生存和发展的重要基础,了解化学在解决能源危机中的重要作用。
6、知道节约能源、提高能量利用效率的实际意义。
7、理解盖斯定律的意义,能用盖斯定律和热化学方程式进行有关反应热的简单计算。
第一章 化学反应与能量
第一节
《化学反应与能量的变化》
一、反应热 焓变
问题:
化学反应过程中为什么会有能量的
变化?(用学过的知识回答)
化学反应的实质就是反应物分子中化学键
断裂,形成新的化学键,从新组合成生成
物的分子的过程。旧键断裂需要吸收能量,
新键形成需要放出能量。而一般化学反应
中,旧键的断裂所吸收的总能量与新键形
成所放出的总能量是不相等的,而这个差
值就是反应中能量的变化。所以化学反应
过程中会有能量的变化。
例子
1、定义:
象化学反应过程中所释放或吸收
的热量,叫做反应热,又称为“焓变”
2、符号:
H
3、单位:
KJ/mol
4、规定:
(1)、反应体系的能量降低(即
放热反应),则 H为“-”;
(2)、反应体系的能量升高(即
吸热反应),则 H为“+”;
即:
当 H为“-”( H<0)时,为放热反应
当 H为“+”( H>0)时,为吸热反应
通过此图大家还能发现这反应热
H有什么规律?
我们可以发现:其实
H=
E(生成物的总能量)- E(反应物的总能量)
H=
E(生成物分子化学键形成时所吸收的总能量)- E(反应物分子化学键断裂时所释放的总能量)
我们认识了反应热,那么怎样书写
表示化学反应热的化学方程式?
例 1:1molC与1molH2O(g)反应失成lmol CO(g)和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H= kJ/mol。
例 2:拆开 lmol H—H键、lmol N-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946kj,则1mol N2生成NH3的反应热为 ,1mol H2生成NH3的反应热为 。
+131.5
-92KJ/mol
-30.6KJ/mol
练 习
二、学会热化学方程式的书写
什么是热化学方程式?
表示参加反应物质的量和反应热的
关系的化学方程式,叫做热化学方
程式。
请看以下两个例子,再思考!
问题:
通过以上两个例子,说明一下热化学方程式
与一般的化学方程式的书写有什么不同?
(1)、书写热化学方程式要注明反应的温度和
压强,(为什么?)而常温、常压可以不注明,
即不注明则是常温、常压。
(2)、标出了反应物与生成物的状态,
(为什么要标出?)
(3)、写出了反应热,还注明了“+”,“-”
(4)、方程式中的计量系数可以是整数也可以
是分数。
问题:
反应物和生成物前的系数它代表了什么?
在方程式中 H它表示了什么意义? H
它的值与什么有关系?
热化学方程式中各物质前的化学计量数不
表示分子个数,表示对应物质的物质的量。
H(KJ/mol)它表示每摩尔反应所放出的
热量, H它的值与方程式中的计量系数
有关,即对于相同的反应,当化学计量数
不同时,其 H不同。
例 题
1、当1mol气态H2与1mol气态Cl2反应
生成2mol气态HCl,放出184.6KJ的热
量,请写出该反应的热化学方程式。
H2(g) + Cl2(g) =2HCl(g) H =-184.6KJ/mol
而这些书写也是对的
写出下列反应的热化学方程式
课堂练习
1、1molN2(g)与适量O2(g)反应生成NO (g),需吸收68kJ的热量;
2、2molCu(s)与适量O2(g)反应生成CuO(s),放出314kJ热量;
3、 1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式。
4、 4g CO在氧气中燃烧生成CO2,放出 9. 6kJ热量,写出CO燃烧的热化学方程式。
5、在一定条件下,氢气和甲烷燃烧的化学方程式为:
2H2(g) + O2 (g) = 2H2O (l); H= – 572 kJ /mol
CH4(g) +2O2 (g) = CO2(g)+2H2O (l); H= – 890 kJ/mol由1mol 氢气和2mol甲烷组成的混合气体在上述条件下完全燃烧时放出的热量为多少。
2066KJ
6、在一定条件下,氢气和丙烷燃烧的化学方程式为:
2H2(g) + O2 (g) = 2H2O (l); H= – 572 kJ/mol
C3H8(g) +5O2(g)= 3CO2 (g) +4H2O (l); H= – 2220 kJ/mol
5mol 氢气和丙烷的混合气完全燃烧时放热
3847kJ,则氢气和甲烷的体积比为
(A) 1:3 (B) 3:1 (C) 1:4 (D) 1:1
B
第一章 化学反应与能量
第二节
《燃烧热 能源》
首先回顾上一节课小结、练习与思考。
反应热
化学反应中的能量变化
热化学方程式
(练习与巩固)依据事实,写出下列反应的热化学方程式∶
(1)1mol碳完全燃烧放出393.5KJ的热量;
(2)1克甲醇燃烧生成二氧化碳和水(液态)时放热22.68KJ;
(3)1mol氯气和水蒸气通过灼热的炭层反应,生成氯化氢和二氧化碳放出145KJ的热量。
参考答案∶
(1)C(s)+O2(g)=CO2(g) △H=-393.5KJ/mol
(2)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.8KJ/mol
(3)2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO 2 (g)
△H=-290KJ/mol
一、燃烧热
燃烧热∶25oC、101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热。单位为KJ/mol。如常温常压下,1mol甲烷完全燃烧放出890.31KJ的热量,就是甲烷的燃烧热∶
CH4(g)+2O2(g)=CO2(g)+2H2O(g)
△H=-890.31KJ/mol
阅读表1-1
思考与交流∶我们应根据什么标准看来选择燃料?试举例说明。
从物质的燃烧热、燃料的储量、开采、运输、储存的条件、价格、对生态环境的影响等各方面综合考虑。
二、能源
能源就是能提供能量的自然资源,它包括化石燃料、阳光、风力、流水、潮汐及柴草等等。我国目前使用的主要能源是化石燃料。
阅读资料∶“我国能源状况”
思考怎样利用、科学控制、寻找能源?
科学视野∶太阳能,氢能,地热能,风能等。
实践活动∶查阅资料(可以课后进行)
相关思考题∶
[问题]1.什么是化石燃料 目前使用最多的燃料是什么
2.燃料充分燃烧的条件是什么
3.燃料燃烧时,若空气过量或不足,会造成什么后果
4.为什么固体燃料要粉碎后使用
5.导致酸雨形成的主要原因是什么
1.人类当前所需能源的主要来源是化石燃料――煤、石油、天然气。
2.人类应当树立节能意识:
(1)化石燃烧无法再生;
(2)提高燃烧效率,节约能源。
3.使燃料充分燃烧的措施:
(1)通入充足且适量的空气;
(2)固体燃料粉碎、液体燃料喷雾以增大燃料与空气的接触面。
4.煤炭的气化和液化,既防止污染,又提高燃烧效率。
12g石墨与O2反应生成CO2放出393.51KJ热量; 12g金刚石与O2反应生成CO2放出395.41KJ热量,试比较,石墨与金刚石哪个稳定?
比较相同状态、相同数量的金刚石和石墨,与O2完全反应,生成相同状态、相同数量的CO2,金刚石释放出的热量更多,说明金刚石具有的总能量高,不稳定
思考
1. 下列反应既属于氧化还原反应,又是吸热反应的是( )
A.铝片与稀盐酸的反应.
B.Ba(OH)2·8H2O与NH4Cl的反应.
C.灼热的碳与CO2的反应
D.甲烷在氧气中的燃烧反应
2. 下列燃料中,不属于化石燃料的是( )
A.煤 B.石油 C.天然气 D.水煤气
[练习]
C
D
3. 酸雨危害可包括( )
①对人体的直接危害,引起肺部疾病而使人致死,②引起河流,湖泊的水体酸化,严重影响水生动杆物的生长,③破坏土壤,植被,森林 ④腐蚀金属,油漆,皮革,纺织品及建筑材料等,⑤渗入地下,可能引起地下水酸化.
A.①③⑤ B.①②③④
C.①③④⑤ D.①②③④⑤
C
下面请大家看看燃烧对环境的污染及侵害
(第二次作业∶P9EX5、EX6;预习化学反应热的计算。)
观看图片∶
第一章 化学反应与能量
第三节
《化学反应热的计算》
H2(g)+1/2O2(g)==H2O(g) △H1=-241.8kJ/mol
那么,H2的燃烧热△H究竟是多少?如何计算?
已知: H2O(g)==H2O(l) △H2=-44kJ/mol
H2(g)+1/2O2(g)==H2O(l) △H=△H1+△H2=-285.8kJ/mol
下列数据△H1表示燃烧热吗?why
小组讨论汇报
如何测出这个反应的反应热:
(1)C(s)+1/2O2(g)==CO(g) ΔH1=
①C(s)+1/2O2(g)==CO(g) ΔH1=
②CO(g)+1/2O2(g)== CO2(g) ΔH2=-283.0kJ/mol
③C(s)+O2(g)==CO2(g) ΔH3=-393.5kJ/mol
① + ② = ③ ,
则 ΔH1 + ΔH2 =ΔH3
所以, ΔH1 =ΔH3- ΔH2 =-393.5kJ/mol+ 283.0kJ/mol=-110.5kJ/mol
应用了什么规律?
不管化学反应是分一步完成或分几步完成,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
如何理解盖斯定律?
ΔH、ΔH1、ΔH2
之间有何关系?
ΔH=ΔH1+ΔH2
B
ΔH
A
C
ΔH1
ΔH2
例1:写出石墨变成金刚石的热化学方程式 (25℃,101kPa时)
说明: (1)可以在书中查找需要的数据
(2)并告诉大家你设计的理由。
先思考,之后小组讨论汇报
查燃烧热表知:
①C(石墨,s)+O2(g)==CO2(g) △H1=-393.5kJ/mol
②C(金刚石,s)+O2(g)==CO2(g) △H2=-395.0kJ/mol
所以, ①- ②得:
C(石墨,s)= C(金刚石,s) △H=+1.5kJ/mol
观察该热化学方程式,回答:金刚石能自动变成石墨吗?需要什么条件?
若金刚石、石墨共1mol混合在氧气中燃烧,产热QKJ,则两者的物质的量之比为:
你知道神六的火箭燃料是什么吗?
例2:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2 N2H4(g)+ 2NO2(g)== 3N2(g)+4H2O(l) △H=-1135.2kJ/mol
1、请用自己的话描述一下盖斯定律。
2、盖斯定律有哪些用途?
盖斯定律:不管化学反应是一步完成或分几步完成,其反应热是相同.换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关.
因为有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难.此时如果应用盖斯定律,就可以间接地把它们的反应热计算出来.
例1:已知298K时,合成氨反应N2(g) +3H2(g) =2NH3(g
) △H1=-92.0kJ/mol ,将此温度下的0.1molN2和0.3molH2放在密闭容器中反应,测得反应放出的热为:
A一定小于92.0kJ B一定大于92.0kJ
C一定等于92.0kJ D无法确定
例2充分燃烧一定量的丁烷,放出热为Q.完全吸收它生成CO2生成正盐,需5mol/L的KOH溶液100mL,则丁烷的燃烧热为:
例3已知CH4 (g) + 2O2(g)=CO2 (g) +
2H2 O (l)△ H= -Q1 KJ/mol
2H2(g)+O2(g) =2H2 O (g)
△ H= -Q2 KJ/mol
2H2(g)+O2(g) =2H2 O (l)
△ H=- Q3 KJ/mol,
常温下,取体积比4:1的甲烷和氢气的混合气体11.2L(标况),经完全燃烧恢复常温,放出的热为:
例4已知: Zn ( s ) +1/2O2 ( g ) = ZnO ( s ) ΔH = -351.1 kJ/mol
Hg ( l) +1/2O2 ( g ) = Hg O ( s ) ΔH = -90.7 kJ/mol
则可知: Zn ( s ) + Hg O ( s ) = ZnO ( s ) + Hg ( l)
ΔH 3= kJ/mol。则 为ΔH 3为多少?
例5已知:2C(s) + O2 ( g ) =2CO ( g ) ΔH = -221 kJ/mol
2H2 ( g ) + O2 ( g ) = 2H2O ( g ) ΔH = -483.6 kJ/mol
则C(s) + H2O ( g ) =CO ( g ) + H2( g )的ΔH为多少
CH4 ( g )+1/2O2 ( g ) = CO ( g ) + 2H2 g )
ΔH = -36 kJ/mol
CH4 ( g )+ H2O ( g ) = CO ( g ) + 3 H2 ( g )
ΔH = +216 kJ/mol由以上反应推出总反应热为零的总反应式子.
例7某人浸泡在盛有60mL水的浴盆中,在1h内,人体
所散发的热量使水温从30℃升到31.5 ℃,该人一天可释放多少热量 1g脂肪燃烧放出39.7KJ的热量,如果该人一天所需的热量以摄入脂肪来计算.则他一天至少需要摄入多少克脂肪 已知水的比热容为4.2KJ.(Kg. ℃)
例8强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)
△ H= -57.3 KJ/mol 分别向NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应的热效应分别为△H1 △H2 △H3则三者的大小关系为:
例9. 0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,其热化学方程式为:
已知H2O(l)=H2O (g) △ H=44kJ/mol,则11.2L(标况)乙硼烷完全燃烧生成气态水时放出的热量为多少
例10反应热是:
A燃烧热的集中表现
B中和热的集中表现
C溶解热的集中表现
D键能变化的集中表现
例11下列变化属于吸热反应的是:
a液态水汽化 b将胆矾加热变为白色粉未c浓硫酸稀释d氯酸钾分解得氧气e生石灰跟水反应生成熟石灰
例12下列反应既是氧化还原反应,又是放热反应是
A铝片与稀硫酸BBa(OH)2.8H2O和NH4Cl的反应
C灼热的碳与二氧化碳反应D氢氧化钠与盐酸反应
例13已知:H2O ( g ) = H2O ( l ) ΔH = Q1 kJ/mol
则C2H5OH(g) = C2H5OH(l) ΔH = Q2kJ/mol
C2H5OH(g) +3O2 (g) = 3H2O ( g ) + 2CO2 ( g ) ΔH =Q3kJ/mol
若使23g液体酒精完全燃烧,最后恢复到室温,则放出的热量为: KJ
例14我们把拆开1mol共价键所吸收的能量或生成1mol共价键所放出的能量叫键能,已知Cl-Cl键的键能为247 kJ/mol.下列有关键能的说法正确的是:
A要拆开1mol Cl-Cl键需要吸收247 kJ能量
B要形成1mol Cl-Cl键需要吸收247 kJ能量
C要拆开1mol Cl-Cl键需要放出247 kJ能量
A要形成1mol Cl-Cl键需要放出247 kJ能量
