1.1《化学反应与能量的变化》PPT课件(新人教版-选修4)
文档属性
| 名称 | 1.1《化学反应与能量的变化》PPT课件(新人教版-选修4) |  | |
| 格式 | zip | ||
| 文件大小 | 93.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-05 15:16:58 | ||
图片预览








文档简介
(共22张PPT)
新课标人教版课件系列
《高中化学》
选修4
1.1《化学反应与
能量的变化》
教学目标
知识与技能:
1. 使学生了解化学反应中能量转化的原因和常见的能量转化形式;2. 认识化学反应过程的物质变化和能量变化;3. 了解反应热和焓变的涵义;4. 能正确认识、书写热化学方程式。
过程与方法:
1. 通过对学习资料的查找与交流,培养学生获取信息、理解信息并得出结论的能力以及语言表达能力;2. 通过从化学键的角度分析化学反应,引导学生分析引起反应热的本质。
情感态度与价值观:
培养学生从微观的角度理解化学问题。
教学重点、难点:
1. 化学反应中的能量变化及其微观原因
2. 正确认识、书写热化学方程式
问:
1.化学反应都有新物质产生,同时还伴随着能量变化,请列举学过的有热量变化的相关反应。
Mg、P、S、Fe、H2、C、煤、石油、天然气等燃烧;铝片与盐酸;氢氧化钡晶体与氯化铵晶体迅速搅拌下反应 。
2. 在这些反应中,哪些是我们日常生活中利用到的?
化学反应中所释放的能量——当今世界最重要的能源。
一.反应热 焓变
在化学反应过程中放出或吸收的热量,
通常叫做反应热。又称焓变。
1.符号:△H
2.单位:kJ/mol
注:单位中的每mol是与整个反应对应的,
即反应热表示每mol反应放出或吸收的热量。
5.放热反应:
放出热量的化学反应。(放热>吸热) △H 为“-”或△H <0
吸收热量的化学反应。(吸热>放热)△H 为“+”或△H >0
6.吸热反应:
3.测量条件:一定压强下,敞口
容器中发生的反应
4.产生原因:化学键断裂——吸热
化学键形成——放热
go
结论:
反应完成时,生成物释放的总能量(862 kJ/mol)比反应物吸收的总能量(679 kJ/mol)大,故为放热反应。
注:1、 对于放热反应,由于反应后放出热量而使反应本身的能量降低,反之成立。
2、规定:
放热反应:ΔH为“- ”或ΔH<0时
吸热反应:ΔH为“ + ”或ΔH>0时
(上述反应的反应热为:
ΔH=-184.6 kJ/mol)
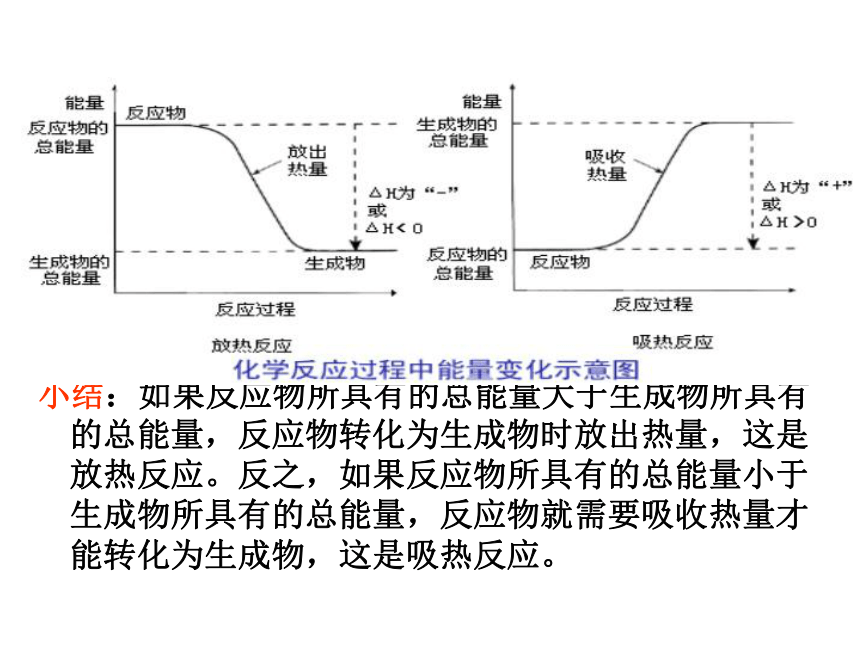
小结:如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时放出热量,这是放热反应。反之,如果反应物所具有的总能量小于生成物所具有的总能量,反应物就需要吸收热量才能转化为生成物,这是吸热反应。
二.热化学方程式
定义:表明反应所放出或吸收的热
量的化学方程式,叫做热化学方程式。
例如:
2H2(g)+O2(g)=2H2O(g),△H=-483.6kJ/mol
2H2(g)+O2(g)=2H2O(l),△H=-571.6kJ/mol
注:气体用g;液体用l;固体用s
2.书写要点:
C(s)+H2O(g)=CO(g)+H2(g),
①标聚集状态(s、l、g)
②右端标热量数值和符号,
△H:吸热用“+”,放热用:“-”。
③系数单位是“摩”,而不是“个”。
△H= + 131.3kJ/mol
④系数可用分数,但热量值要
相应变化。如:
2H2(g)+O2(g)=2H2O(l),△H=-571.6kJ/mol
H2(g)+1/2O2(g)=1H2O(l),△H=-285.8kJ/mol
⑤不注明条件,既指:
(250C , 1.01×105Pa)
[讨论] 1.为什么聚集状态不同,
热量值不同?
答:液态水变成水蒸气要吸收
热量
2.若反应物状态不同,而生成
物状态相同,那么热量值相
同吗?
答:不同
【例1】(2003年江苏高考题)已知在25℃,101kpa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,表示上述反应的热化学方程式正确的是 ( )
A.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g)
ΔH=-48.40 kJ·mol-1
B.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1)
ΔH=-5518 kJ·mol-1
C.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1)
ΔH=+5518 kJ·mol-1
D.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1)
ΔH=-48.40 kJ·mol-1
【解析】
反应放热显然C项错误,而A、D两项放热数值是错的。
【答案】B
【解题回顾】
热化学方程工的书写或判断正误注意:反应热与物质的状态有关,反应的热值应与方程式中的化学计量数相对应。
[练习1] 1克甲烷在空气中燃烧,
恢复常温下测得放出热量55.625
KJ,试写出热化学方程式。
[练习2]
同温、同压下,比较Q1与Q2的
大小:
S(g)+O2(g)==SO2(g); △H=- Q1 kJ/mol
S(s)+O2(g)==SO2(g); △H=- Q2 kJ/mol
Q1>Q2
[练习3] 已知:
C(s)+O2(g)==CO2(g); △H=- 393.5 kJ/mol
要获得1000千焦热量,需燃烧多
少克碳?
30.5克
[练习4] 已知:
S(s)+O2(g)=SO2(g); △H=- 290.6 kJ/mol
求1.6克硫燃烧成为SO2气体放
出多少热量?
14.53kJ
[小结1]
1.反应热
2.热化学方程式
(1)意义
(2)书写要规范
[自我检测]
3mol CH4燃烧时,生成液态水和CO2 同时
放出2670.9KJ的热。请写出热化学方程式。
2. 常温下14克CO在足量氧气中充分燃烧,放
出141.3KJ热量,写出该热化学方程式。
自我检测题答案:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ;
△H=- 890.3 kJ/mol
2. CO(g)+ O2(g)=CO2(g) ;
△H=- 282.6 kJ/mol
新课标人教版课件系列
《高中化学》
选修4
1.1《化学反应与
能量的变化》
教学目标
知识与技能:
1. 使学生了解化学反应中能量转化的原因和常见的能量转化形式;2. 认识化学反应过程的物质变化和能量变化;3. 了解反应热和焓变的涵义;4. 能正确认识、书写热化学方程式。
过程与方法:
1. 通过对学习资料的查找与交流,培养学生获取信息、理解信息并得出结论的能力以及语言表达能力;2. 通过从化学键的角度分析化学反应,引导学生分析引起反应热的本质。
情感态度与价值观:
培养学生从微观的角度理解化学问题。
教学重点、难点:
1. 化学反应中的能量变化及其微观原因
2. 正确认识、书写热化学方程式
问:
1.化学反应都有新物质产生,同时还伴随着能量变化,请列举学过的有热量变化的相关反应。
Mg、P、S、Fe、H2、C、煤、石油、天然气等燃烧;铝片与盐酸;氢氧化钡晶体与氯化铵晶体迅速搅拌下反应 。
2. 在这些反应中,哪些是我们日常生活中利用到的?
化学反应中所释放的能量——当今世界最重要的能源。
一.反应热 焓变
在化学反应过程中放出或吸收的热量,
通常叫做反应热。又称焓变。
1.符号:△H
2.单位:kJ/mol
注:单位中的每mol是与整个反应对应的,
即反应热表示每mol反应放出或吸收的热量。
5.放热反应:
放出热量的化学反应。(放热>吸热) △H 为“-”或△H <0
吸收热量的化学反应。(吸热>放热)△H 为“+”或△H >0
6.吸热反应:
3.测量条件:一定压强下,敞口
容器中发生的反应
4.产生原因:化学键断裂——吸热
化学键形成——放热
go
结论:
反应完成时,生成物释放的总能量(862 kJ/mol)比反应物吸收的总能量(679 kJ/mol)大,故为放热反应。
注:1、 对于放热反应,由于反应后放出热量而使反应本身的能量降低,反之成立。
2、规定:
放热反应:ΔH为“- ”或ΔH<0时
吸热反应:ΔH为“ + ”或ΔH>0时
(上述反应的反应热为:
ΔH=-184.6 kJ/mol)
小结:如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时放出热量,这是放热反应。反之,如果反应物所具有的总能量小于生成物所具有的总能量,反应物就需要吸收热量才能转化为生成物,这是吸热反应。
二.热化学方程式
定义:表明反应所放出或吸收的热
量的化学方程式,叫做热化学方程式。
例如:
2H2(g)+O2(g)=2H2O(g),△H=-483.6kJ/mol
2H2(g)+O2(g)=2H2O(l),△H=-571.6kJ/mol
注:气体用g;液体用l;固体用s
2.书写要点:
C(s)+H2O(g)=CO(g)+H2(g),
①标聚集状态(s、l、g)
②右端标热量数值和符号,
△H:吸热用“+”,放热用:“-”。
③系数单位是“摩”,而不是“个”。
△H= + 131.3kJ/mol
④系数可用分数,但热量值要
相应变化。如:
2H2(g)+O2(g)=2H2O(l),△H=-571.6kJ/mol
H2(g)+1/2O2(g)=1H2O(l),△H=-285.8kJ/mol
⑤不注明条件,既指:
(250C , 1.01×105Pa)
[讨论] 1.为什么聚集状态不同,
热量值不同?
答:液态水变成水蒸气要吸收
热量
2.若反应物状态不同,而生成
物状态相同,那么热量值相
同吗?
答:不同
【例1】(2003年江苏高考题)已知在25℃,101kpa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,表示上述反应的热化学方程式正确的是 ( )
A.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g)
ΔH=-48.40 kJ·mol-1
B.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1)
ΔH=-5518 kJ·mol-1
C.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1)
ΔH=+5518 kJ·mol-1
D.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1)
ΔH=-48.40 kJ·mol-1
【解析】
反应放热显然C项错误,而A、D两项放热数值是错的。
【答案】B
【解题回顾】
热化学方程工的书写或判断正误注意:反应热与物质的状态有关,反应的热值应与方程式中的化学计量数相对应。
[练习1] 1克甲烷在空气中燃烧,
恢复常温下测得放出热量55.625
KJ,试写出热化学方程式。
[练习2]
同温、同压下,比较Q1与Q2的
大小:
S(g)+O2(g)==SO2(g); △H=- Q1 kJ/mol
S(s)+O2(g)==SO2(g); △H=- Q2 kJ/mol
Q1>Q2
[练习3] 已知:
C(s)+O2(g)==CO2(g); △H=- 393.5 kJ/mol
要获得1000千焦热量,需燃烧多
少克碳?
30.5克
[练习4] 已知:
S(s)+O2(g)=SO2(g); △H=- 290.6 kJ/mol
求1.6克硫燃烧成为SO2气体放
出多少热量?
14.53kJ
[小结1]
1.反应热
2.热化学方程式
(1)意义
(2)书写要规范
[自我检测]
3mol CH4燃烧时,生成液态水和CO2 同时
放出2670.9KJ的热。请写出热化学方程式。
2. 常温下14克CO在足量氧气中充分燃烧,放
出141.3KJ热量,写出该热化学方程式。
自我检测题答案:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ;
△H=- 890.3 kJ/mol
2. CO(g)+ O2(g)=CO2(g) ;
△H=- 282.6 kJ/mol
