高中化学苏教版(2019)必修第一册 专题3 从海水中获得的化学物质 阶段重点突破练(三)(37张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)必修第一册 专题3 从海水中获得的化学物质 阶段重点突破练(三)(37张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 712.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-18 16:55:05 | ||
图片预览







文档简介
(共37张PPT)
阶段重点突破练(三)
一、氯气制取与性质的实验
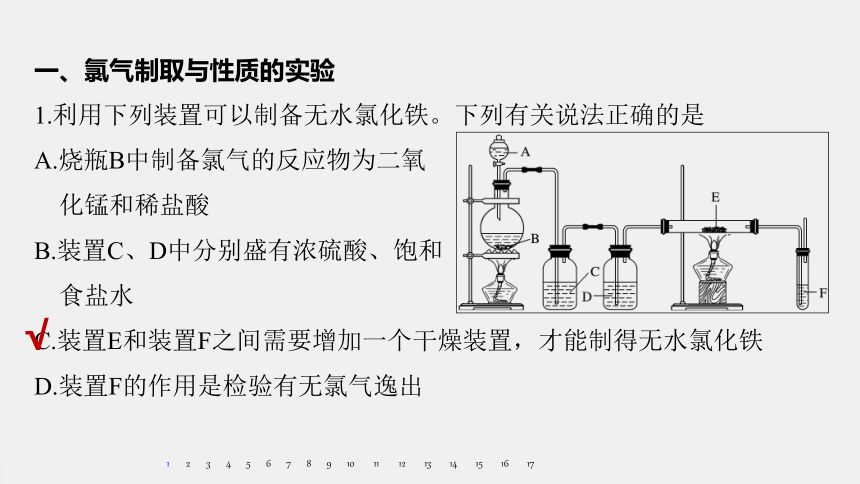
1.利用下列装置可以制备无水氯化铁。下列有关说法正确的是
A.烧瓶B中制备氯气的反应物为二氧
化锰和稀盐酸
B.装置C、D中分别盛有浓硫酸、饱和
食盐水
C.装置E和装置F之间需要增加一个干燥装置,才能制得无水氯化铁
D.装置F的作用是检验有无氯气逸出
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
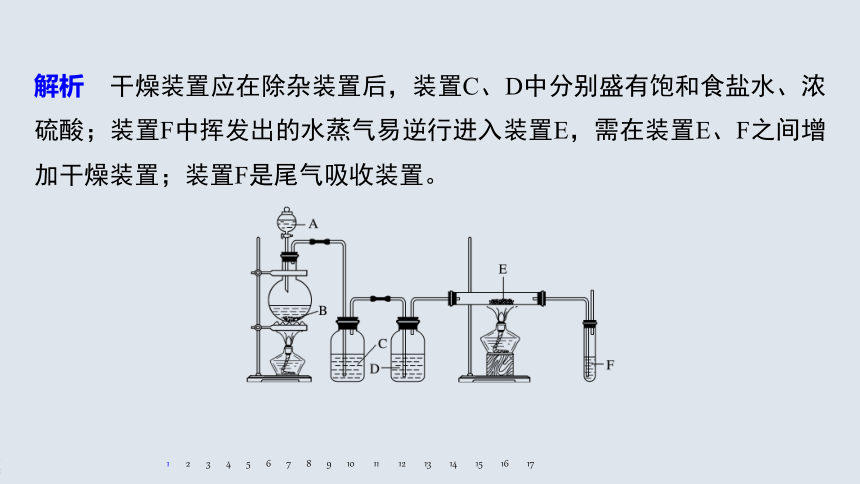
解析 干燥装置应在除杂装置后,装置C、D中分别盛有饱和食盐水、浓硫酸;装置F中挥发出的水蒸气易逆行进入装置E,需在装置E、F之间增加干燥装置;装置F是尾气吸收装置。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
2.(不定项)(2019·郑州一中月考)某化学教师为
“氯气与金属钠反应”设计了如图装置的实验。实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述中错误的是
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于
吸收过量的氯气
C.钠着火燃烧产生苍白色火焰
D.若在棉花球外沿滴一滴石蕊溶液,可根据其颜色变化判断氯气是否被
碱液完全吸收
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
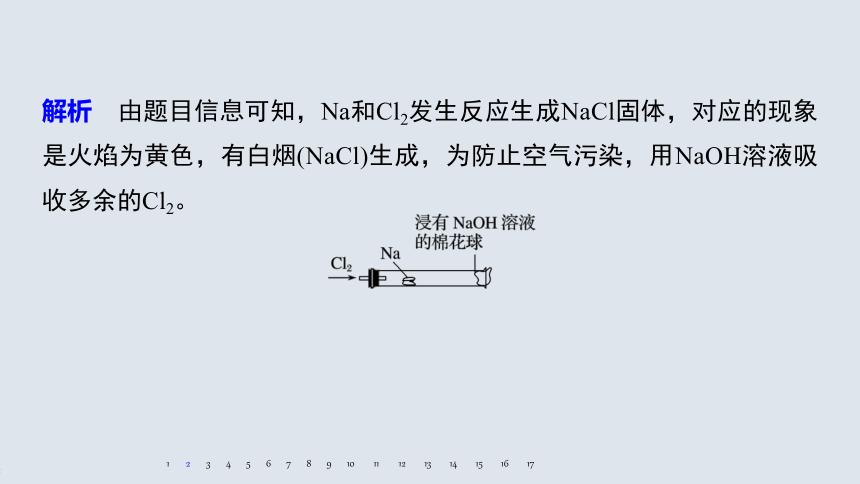
解析 由题目信息可知,Na和Cl2发生反应生成NaCl固体,对应的现象是火焰为黄色,有白烟(NaCl)生成,为防止空气污染,用NaOH溶液吸收多余的Cl2。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
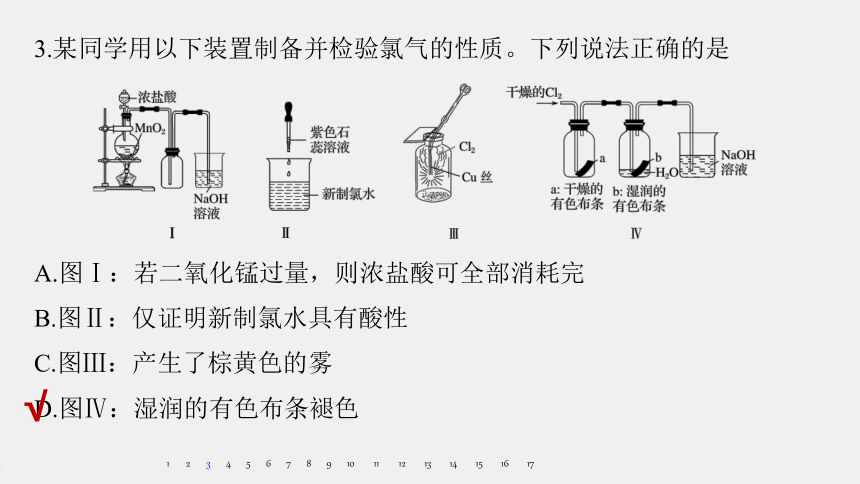
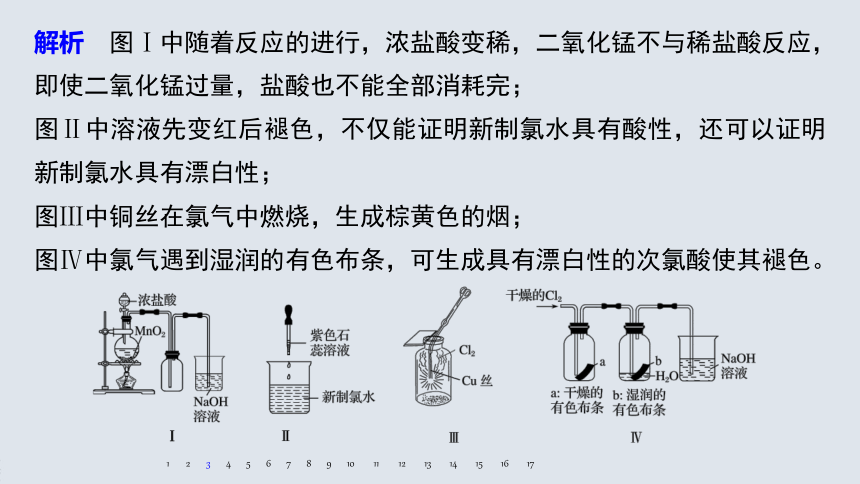
A.图Ⅰ:若二氧化锰过量,则浓盐酸可全部消耗完
B.图Ⅱ:仅证明新制氯水具有酸性
C.图Ⅲ:产生了棕黄色的雾
D.图Ⅳ:湿润的有色布条褪色
3.某同学用以下装置制备并检验氯气的性质。下列说法正确的是
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
解析 图Ⅰ中随着反应的进行,浓盐酸变稀,二氧化锰不与稀盐酸反应,即使二氧化锰过量,盐酸也不能全部消耗完;
图Ⅱ中溶液先变红后褪色,不仅能证明新制氯水具有酸性,还可以证明新制氯水具有漂白性;
图Ⅲ中铜丝在氯气中燃烧,生成棕黄色的烟;
图Ⅳ中氯气遇到湿润的有色布条,可生成具有漂白性的次氯酸使其褪色。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
二、氯及其化合物性质
4.(不定项)下列关于氯气及含氯化合物的叙述不正确的是
A.干燥的氯气和氯水均能使鲜花褪色
B.因为氯气有毒,所以可用于杀菌、消毒、漂白
C.漂白粉的主要成分是Ca(ClO)2
D.氯气和氯化氢通入AgNO3溶液中均能产生白色沉淀
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
√
解析 干燥的Cl2虽然不能使干燥的有色布条褪色,但可使鲜花褪色,因为鲜花中有充足的水分,A正确;
氯气可用于杀菌、消毒、漂白,不是由于氯气的毒性,而是因为Cl2与H2O反应生成的HClO有强氧化性,B错误;
漂白粉的主要成分是CaCl2和Ca(ClO)2,有效成分是Ca(ClO)2,C错误;
氯气通入AgNO3溶液中先与水发生反应,生成的HCl再与AgNO3反应,故有白色沉淀产生,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
解析 由该反应的化学方程式,可知H2CO3比HClO的酸性强;由NaClO+HCl===NaCl+HClO可知,加入少量盐酸可增强NaClO溶液的漂白性;由Cl2+H2O===HCl+HClO可知,通入少量Cl2可增强NaClO溶液的漂白性;“84”消毒液的有效成分为NaClO而不是Ca(ClO)2。
5.已知NaClO溶液与CO2能发生如下反应:NaClO+H2O+CO2===
NaHCO3+HClO,下列叙述错误的是
A.HClO比H2CO3的酸性弱
B.加入少量盐酸可增强NaClO溶液的漂白性
C.通入少量Cl2可增加NaClO溶液的漂白性
D.“84”消毒液的有效成分是Ca(ClO)2,可用于消毒
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
6.(2020·清华附中高一调研)下列物质中,与氯气、盐酸都能发生反应且生成不同氯化物的是
A.Fe
B.Al
C.Cu
D.Zn
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
7.(不定项)下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是
A.向新制氯水中滴加紫色石蕊溶液,溶液先变红色后褪色(H+、HClO)
B.新制氯水中滴加AgNO3溶液生成白色沉淀(Cl-)
C.镁粉加入新制氯水中,有无色气泡产生(H+)
D.将有色布条放入新制氯水中,有色布条褪色(HCl)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 新制氯水中含有Cl2、H2O、HClO、H+、Cl-、ClO-及少量OH-。A项,H+使紫色石蕊溶液变红色,HClO具有漂白性,使红色的石蕊溶液褪色,正确;
B项,Cl-与AgNO3溶液反应生成AgCl白色沉淀,正确;
C项,镁粉与H+反应放出氢气,正确;
D项,HClO具有漂白作用,能使有色布条褪色,HCl没有漂白作用,不能使有色布条褪色,错误。
17
8.(2020·清华附中高一调研)在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈黄绿色,说明有Cl2分子存在
C.向氯水中加入NaOH粉末,有气泡产生,说明氯水中含有HClO
D.加入AgNO3溶液,出现白色沉淀,说明有ClO-存在
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
解析 次氯酸具有漂白性,则加入有色布条后,有色布条褪色,说明有HClO分子存在,故A错误;
氯气为黄绿色气体,具有刺激性气味,则氯水呈黄绿色,说明有Cl2分子存在,故B正确;
向氯水中加入NaOH粉末,Cl2、HClO、H+都和NaOH反应,不会有气泡产生,现象是氯水浅黄绿色消失,故C错误;
加入AgNO3溶液,Cl2、Cl-都和AgNO3反应生成白色沉淀,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
9.从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。以下是氯元素形成物质的二维图的部分信息。
(1)根据图中信息,写出任意两种氯的氧化
物的化学式:_________________________
________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
Cl2O、Cl2O3、ClO2、Cl2O5、
Cl2O7(任意两种)
解析 根据图中信息可知氯元素的常见正化合价有+1、+3、+4、+5、+7等,因此氯的氧化物的化学式有Cl2O、Cl2O3、ClO2、Cl2O5、Cl2O7等。
(2)写出高氯酸(HClO4)与NaOH反应的化学方程式:__________________
______________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
NaClO4+H2O
HClO4+NaOH===
解析 高氯酸(HClO4)是一元强酸,与NaOH反应的化学方程式为HClO4+NaOH
===NaClO4+H2O。
(3)HCl既具有氧化性,又具有还原性。
①请任意写出一个体现HCl氧化性的离子
方程式:___________________________
__________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
Zn+2H+===Zn2++H2↑(或Fe+2H+===Fe2++H2↑等其他合理答案)
解析 金属与盐酸反应生成氢气体现氯化氢的氧化性,例如Zn+2H+===Zn2++H2↑、Fe+2H+===Fe2++H2↑等。
②浓盐酸可作为还原剂在加热条件下与MnO2发生反应制备Cl2,写出该反应的化学方程式:__________________________
______________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
+Cl2↑+2H2O
解析 浓盐酸可作为还原剂在加热条件下与MnO2发生反应制备Cl2,该反应的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O。
(4)Cl2既具有氧化性,又具有还原性。
①请结合如图说明原因:_______________
____________________________________________________________________________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
Cl2中Cl元素化合
价为0价,氯元素还有-1价以及+1价等价态,因此氯元素化合价可以升高,氯气体现还原性;氯元素化合价也可以降低,氯气体现氧化性
②潮湿的Cl2与Na2CO3混合制取少量Cl2O的反应中,Cl2既体现了氧化性,也体现了还原性。写出反应的化学方程式:_________________________
_______________________。
2Cl2+2Na2CO3+H2O===
2NaHCO3+2NaCl+Cl2O
选项
古诗词或谚语
包含的化学反应类型
A
熬胆矾铁釡,久之亦化为铜
复分解反应
B
千锤万凿出深山,烈火焚烧若等闲
分解反应
C
春蚕到死丝方尽,蜡炬成灰泪始干
化合反应
D
爆竹声中一岁除,春风送暖入屠苏
非氧化还原反应
三、氧化还原反应的概念
10.(2019·广东佛山一中高一第一次月考)我国古诗词或谚语中包含丰富的化学知识,下列解释正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
16
17
解析 熬胆矾铁釜,久之亦化铜,其原理为铁置换出铜,属于置换反应,A错误;
千锤万凿出深山,烈火焚烧若等闲,说的是石灰石的分解,B正确;
春蚕到死丝方尽,蜡炬成灰泪始干,说的是物质的燃烧,该过程不属于化合反应,C错误;
爆竹声中一岁除,春风送暖入屠苏,说的是炸药的爆炸,属于氧化还原反应,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
11.(2019·湖南民办学校联盟检测)化学实验中若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。在如图所示有编号的反应中,属于氧化还原反应的有
A.6个
B.5个
C.4个
D.3个
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
解析 由化合价变化可知,①中Cr元素化合价降低;②中Cr元素化合价没有变化;③中Cr(OH)3反应生成NaCrO2,反应中Cr元素化合价没有变化;④中Cr元素化合价升高;⑤中Cr元素化合价降低;⑥中Cr元素化合价没有变化。其中反应①④⑤中Cr元素化合价变化,属于氧化还原反应。
16
17
12.(2019·贵阳一中期末)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载。“银针验毒”的原理是4Ag+2H2S+O2===2X+2H2O。下列说法不正确的是
A.X的化学式为Ag2S
B.“银针验毒”时,空气中的氧气得到电子
C.反应中Ag和H2S均是还原剂
D.每生成1
mol
X,反应转移2
mol电子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
解析 根据原子守恒可知X的化学式为Ag2S,A项正确;
由化学方程式4Ag+2H2S+O2===2Ag2S+2H2O可知,Ag为还原剂,O2为氧化剂,B项正确;
反应中H2S起到酸的作用,C项错误;
生成1
mol
Ag2S时有2
mol
Ag参与反应,故转移2
mol电子,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
四、氧化还原反应的规律及应用
13.根据下列反应的方程式:
①O2+2H2S===2S↓+2H2O
②Na2S+I2===2NaI+S↓
③4NaI+O2+2H2SO4===2I2+2Na2SO4+2H2O
判断下列物质的氧化性强弱,正确的是
A.O2>I2>S
B.H2S>NaI>H2O
C.S>I2>O2
D.H2O>NaI>H2S
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
解析 由反应①可知氧化性:氧化剂O2>氧化产物S,由反应②可知氧化性:氧化剂I2>氧化产物S,由反应③可知氧化性:氧化剂O2>氧化产物I2,氧化性从强到弱的顺序为O2>I2>S。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
D.反应①②中生成等质量的I2时转移电子数之比为1∶5
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
14.(不定项)反应①和②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4===2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3===2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是
A.两个反应中均为硫元素被氧化
B.碘元素在反应①中被还原,在反应②中被氧化
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
15.(不定项)(2019·成都外国语学校检测)下列说法正确的是
A.KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O中氧化剂和还原剂的物质的
量之比为1∶5
B.3NO2+H2O===2HNO3+NO中,氧化产物和还原产物的物质的量之比
为1∶2
C.3S+6KOH===2K2S+K2SO3+3H2O中,被氧化和被还原的硫元素物
质的量之比为2∶1
D.Al2O3+N2+3C
2AlN+3CO中,氧化剂和还原剂物质的量之比
为1∶3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
√
解析 A项,KClO3为氧化剂,6
mol
HCl中只有5
mol
HCl被氧化,所以氧化剂和还原剂的物质的量之比为1∶5,正确;
B项,3
mol
NO2有2
mol
NO2失电子被氧化,2
mol
HNO3为氧化产物,1
mol
NO2得电子被还原,1
mol
NO为还原产物,所以氧化产物和还原产物之比为2∶1,错误;
C项,3
mol
S参加反应,其中有2
mol
S化合价降低被还原发生还原反应;其中1
mol
S化合价升高被氧化发生氧化反应,被氧化和被还原的硫元素的物质的量之比为1∶2,错误;
D项,N元素由0价降低到-3价,氮气是氧化剂,C元素由0价升高到+2价,碳是还原剂,所以氧化剂和还原剂的物质的量之比为1∶3,正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
16.(2019·贵州息烽县一中期中)实验室里将NaClO3和Na2SO3按质量之比为71∶42倒入烧瓶中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为
A.Cl2
B.Cl2O
C.ClO2
D.Cl2O3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
17.H2O2是在医疗、化工方面应用广泛的化学试剂。
(1)Na2O2、CaO2以及BaO2都可与酸反应生成过氧化氢,实验室通过上述某种过氧化物与适量稀硫酸反应,过滤后即可制得较纯净的H2O2溶液,则应选择的过氧化物是______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
BaO2
解析 实验室通过上述某种过氧化物与适量稀硫酸反应,过滤后即可制得较纯净的H2O2溶液,说明生成了硫酸钡沉淀,所以选用BaO2。
(2)实验室可用H2O2与次氯酸钠反应制氧气,其中还原剂是______,写出反应的化学方程式:_________________________________,生成0.5
mol氧气,转移电子_____mol。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
H2O2
解析 反应中因ClO-中的氯元素的化合价为+1价,次氯酸根具有氧化性,则H2O2具有还原性,反应的方程式:H2O2+NaClO===H2O+NaCl+O2↑,生成0.5
mol氧气,转移电子1
mol。
H2O2+NaClO===H2O+NaCl+O2↑
1
本课结束
阶段重点突破练(三)
一、氯气制取与性质的实验
1.利用下列装置可以制备无水氯化铁。下列有关说法正确的是
A.烧瓶B中制备氯气的反应物为二氧
化锰和稀盐酸
B.装置C、D中分别盛有浓硫酸、饱和
食盐水
C.装置E和装置F之间需要增加一个干燥装置,才能制得无水氯化铁
D.装置F的作用是检验有无氯气逸出
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
解析 干燥装置应在除杂装置后,装置C、D中分别盛有饱和食盐水、浓硫酸;装置F中挥发出的水蒸气易逆行进入装置E,需在装置E、F之间增加干燥装置;装置F是尾气吸收装置。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
2.(不定项)(2019·郑州一中月考)某化学教师为
“氯气与金属钠反应”设计了如图装置的实验。实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述中错误的是
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于
吸收过量的氯气
C.钠着火燃烧产生苍白色火焰
D.若在棉花球外沿滴一滴石蕊溶液,可根据其颜色变化判断氯气是否被
碱液完全吸收
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
解析 由题目信息可知,Na和Cl2发生反应生成NaCl固体,对应的现象是火焰为黄色,有白烟(NaCl)生成,为防止空气污染,用NaOH溶液吸收多余的Cl2。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
A.图Ⅰ:若二氧化锰过量,则浓盐酸可全部消耗完
B.图Ⅱ:仅证明新制氯水具有酸性
C.图Ⅲ:产生了棕黄色的雾
D.图Ⅳ:湿润的有色布条褪色
3.某同学用以下装置制备并检验氯气的性质。下列说法正确的是
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
解析 图Ⅰ中随着反应的进行,浓盐酸变稀,二氧化锰不与稀盐酸反应,即使二氧化锰过量,盐酸也不能全部消耗完;
图Ⅱ中溶液先变红后褪色,不仅能证明新制氯水具有酸性,还可以证明新制氯水具有漂白性;
图Ⅲ中铜丝在氯气中燃烧,生成棕黄色的烟;
图Ⅳ中氯气遇到湿润的有色布条,可生成具有漂白性的次氯酸使其褪色。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
二、氯及其化合物性质
4.(不定项)下列关于氯气及含氯化合物的叙述不正确的是
A.干燥的氯气和氯水均能使鲜花褪色
B.因为氯气有毒,所以可用于杀菌、消毒、漂白
C.漂白粉的主要成分是Ca(ClO)2
D.氯气和氯化氢通入AgNO3溶液中均能产生白色沉淀
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
√
解析 干燥的Cl2虽然不能使干燥的有色布条褪色,但可使鲜花褪色,因为鲜花中有充足的水分,A正确;
氯气可用于杀菌、消毒、漂白,不是由于氯气的毒性,而是因为Cl2与H2O反应生成的HClO有强氧化性,B错误;
漂白粉的主要成分是CaCl2和Ca(ClO)2,有效成分是Ca(ClO)2,C错误;
氯气通入AgNO3溶液中先与水发生反应,生成的HCl再与AgNO3反应,故有白色沉淀产生,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
解析 由该反应的化学方程式,可知H2CO3比HClO的酸性强;由NaClO+HCl===NaCl+HClO可知,加入少量盐酸可增强NaClO溶液的漂白性;由Cl2+H2O===HCl+HClO可知,通入少量Cl2可增强NaClO溶液的漂白性;“84”消毒液的有效成分为NaClO而不是Ca(ClO)2。
5.已知NaClO溶液与CO2能发生如下反应:NaClO+H2O+CO2===
NaHCO3+HClO,下列叙述错误的是
A.HClO比H2CO3的酸性弱
B.加入少量盐酸可增强NaClO溶液的漂白性
C.通入少量Cl2可增加NaClO溶液的漂白性
D.“84”消毒液的有效成分是Ca(ClO)2,可用于消毒
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
6.(2020·清华附中高一调研)下列物质中,与氯气、盐酸都能发生反应且生成不同氯化物的是
A.Fe
B.Al
C.Cu
D.Zn
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
7.(不定项)下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是
A.向新制氯水中滴加紫色石蕊溶液,溶液先变红色后褪色(H+、HClO)
B.新制氯水中滴加AgNO3溶液生成白色沉淀(Cl-)
C.镁粉加入新制氯水中,有无色气泡产生(H+)
D.将有色布条放入新制氯水中,有色布条褪色(HCl)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 新制氯水中含有Cl2、H2O、HClO、H+、Cl-、ClO-及少量OH-。A项,H+使紫色石蕊溶液变红色,HClO具有漂白性,使红色的石蕊溶液褪色,正确;
B项,Cl-与AgNO3溶液反应生成AgCl白色沉淀,正确;
C项,镁粉与H+反应放出氢气,正确;
D项,HClO具有漂白作用,能使有色布条褪色,HCl没有漂白作用,不能使有色布条褪色,错误。
17
8.(2020·清华附中高一调研)在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈黄绿色,说明有Cl2分子存在
C.向氯水中加入NaOH粉末,有气泡产生,说明氯水中含有HClO
D.加入AgNO3溶液,出现白色沉淀,说明有ClO-存在
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
解析 次氯酸具有漂白性,则加入有色布条后,有色布条褪色,说明有HClO分子存在,故A错误;
氯气为黄绿色气体,具有刺激性气味,则氯水呈黄绿色,说明有Cl2分子存在,故B正确;
向氯水中加入NaOH粉末,Cl2、HClO、H+都和NaOH反应,不会有气泡产生,现象是氯水浅黄绿色消失,故C错误;
加入AgNO3溶液,Cl2、Cl-都和AgNO3反应生成白色沉淀,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
9.从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。以下是氯元素形成物质的二维图的部分信息。
(1)根据图中信息,写出任意两种氯的氧化
物的化学式:_________________________
________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
Cl2O、Cl2O3、ClO2、Cl2O5、
Cl2O7(任意两种)
解析 根据图中信息可知氯元素的常见正化合价有+1、+3、+4、+5、+7等,因此氯的氧化物的化学式有Cl2O、Cl2O3、ClO2、Cl2O5、Cl2O7等。
(2)写出高氯酸(HClO4)与NaOH反应的化学方程式:__________________
______________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
NaClO4+H2O
HClO4+NaOH===
解析 高氯酸(HClO4)是一元强酸,与NaOH反应的化学方程式为HClO4+NaOH
===NaClO4+H2O。
(3)HCl既具有氧化性,又具有还原性。
①请任意写出一个体现HCl氧化性的离子
方程式:___________________________
__________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
Zn+2H+===Zn2++H2↑(或Fe+2H+===Fe2++H2↑等其他合理答案)
解析 金属与盐酸反应生成氢气体现氯化氢的氧化性,例如Zn+2H+===Zn2++H2↑、Fe+2H+===Fe2++H2↑等。
②浓盐酸可作为还原剂在加热条件下与MnO2发生反应制备Cl2,写出该反应的化学方程式:__________________________
______________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
+Cl2↑+2H2O
解析 浓盐酸可作为还原剂在加热条件下与MnO2发生反应制备Cl2,该反应的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O。
(4)Cl2既具有氧化性,又具有还原性。
①请结合如图说明原因:_______________
____________________________________________________________________________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
Cl2中Cl元素化合
价为0价,氯元素还有-1价以及+1价等价态,因此氯元素化合价可以升高,氯气体现还原性;氯元素化合价也可以降低,氯气体现氧化性
②潮湿的Cl2与Na2CO3混合制取少量Cl2O的反应中,Cl2既体现了氧化性,也体现了还原性。写出反应的化学方程式:_________________________
_______________________。
2Cl2+2Na2CO3+H2O===
2NaHCO3+2NaCl+Cl2O
选项
古诗词或谚语
包含的化学反应类型
A
熬胆矾铁釡,久之亦化为铜
复分解反应
B
千锤万凿出深山,烈火焚烧若等闲
分解反应
C
春蚕到死丝方尽,蜡炬成灰泪始干
化合反应
D
爆竹声中一岁除,春风送暖入屠苏
非氧化还原反应
三、氧化还原反应的概念
10.(2019·广东佛山一中高一第一次月考)我国古诗词或谚语中包含丰富的化学知识,下列解释正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
16
17
解析 熬胆矾铁釜,久之亦化铜,其原理为铁置换出铜,属于置换反应,A错误;
千锤万凿出深山,烈火焚烧若等闲,说的是石灰石的分解,B正确;
春蚕到死丝方尽,蜡炬成灰泪始干,说的是物质的燃烧,该过程不属于化合反应,C错误;
爆竹声中一岁除,春风送暖入屠苏,说的是炸药的爆炸,属于氧化还原反应,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
11.(2019·湖南民办学校联盟检测)化学实验中若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。在如图所示有编号的反应中,属于氧化还原反应的有
A.6个
B.5个
C.4个
D.3个
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
解析 由化合价变化可知,①中Cr元素化合价降低;②中Cr元素化合价没有变化;③中Cr(OH)3反应生成NaCrO2,反应中Cr元素化合价没有变化;④中Cr元素化合价升高;⑤中Cr元素化合价降低;⑥中Cr元素化合价没有变化。其中反应①④⑤中Cr元素化合价变化,属于氧化还原反应。
16
17
12.(2019·贵阳一中期末)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载。“银针验毒”的原理是4Ag+2H2S+O2===2X+2H2O。下列说法不正确的是
A.X的化学式为Ag2S
B.“银针验毒”时,空气中的氧气得到电子
C.反应中Ag和H2S均是还原剂
D.每生成1
mol
X,反应转移2
mol电子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
解析 根据原子守恒可知X的化学式为Ag2S,A项正确;
由化学方程式4Ag+2H2S+O2===2Ag2S+2H2O可知,Ag为还原剂,O2为氧化剂,B项正确;
反应中H2S起到酸的作用,C项错误;
生成1
mol
Ag2S时有2
mol
Ag参与反应,故转移2
mol电子,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
四、氧化还原反应的规律及应用
13.根据下列反应的方程式:
①O2+2H2S===2S↓+2H2O
②Na2S+I2===2NaI+S↓
③4NaI+O2+2H2SO4===2I2+2Na2SO4+2H2O
判断下列物质的氧化性强弱,正确的是
A.O2>I2>S
B.H2S>NaI>H2O
C.S>I2>O2
D.H2O>NaI>H2S
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
解析 由反应①可知氧化性:氧化剂O2>氧化产物S,由反应②可知氧化性:氧化剂I2>氧化产物S,由反应③可知氧化性:氧化剂O2>氧化产物I2,氧化性从强到弱的顺序为O2>I2>S。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
D.反应①②中生成等质量的I2时转移电子数之比为1∶5
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
14.(不定项)反应①和②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4===2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3===2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是
A.两个反应中均为硫元素被氧化
B.碘元素在反应①中被还原,在反应②中被氧化
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
15.(不定项)(2019·成都外国语学校检测)下列说法正确的是
A.KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O中氧化剂和还原剂的物质的
量之比为1∶5
B.3NO2+H2O===2HNO3+NO中,氧化产物和还原产物的物质的量之比
为1∶2
C.3S+6KOH===2K2S+K2SO3+3H2O中,被氧化和被还原的硫元素物
质的量之比为2∶1
D.Al2O3+N2+3C
2AlN+3CO中,氧化剂和还原剂物质的量之比
为1∶3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
√
解析 A项,KClO3为氧化剂,6
mol
HCl中只有5
mol
HCl被氧化,所以氧化剂和还原剂的物质的量之比为1∶5,正确;
B项,3
mol
NO2有2
mol
NO2失电子被氧化,2
mol
HNO3为氧化产物,1
mol
NO2得电子被还原,1
mol
NO为还原产物,所以氧化产物和还原产物之比为2∶1,错误;
C项,3
mol
S参加反应,其中有2
mol
S化合价降低被还原发生还原反应;其中1
mol
S化合价升高被氧化发生氧化反应,被氧化和被还原的硫元素的物质的量之比为1∶2,错误;
D项,N元素由0价降低到-3价,氮气是氧化剂,C元素由0价升高到+2价,碳是还原剂,所以氧化剂和还原剂的物质的量之比为1∶3,正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
16.(2019·贵州息烽县一中期中)实验室里将NaClO3和Na2SO3按质量之比为71∶42倒入烧瓶中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为
A.Cl2
B.Cl2O
C.ClO2
D.Cl2O3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
17.H2O2是在医疗、化工方面应用广泛的化学试剂。
(1)Na2O2、CaO2以及BaO2都可与酸反应生成过氧化氢,实验室通过上述某种过氧化物与适量稀硫酸反应,过滤后即可制得较纯净的H2O2溶液,则应选择的过氧化物是______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
BaO2
解析 实验室通过上述某种过氧化物与适量稀硫酸反应,过滤后即可制得较纯净的H2O2溶液,说明生成了硫酸钡沉淀,所以选用BaO2。
(2)实验室可用H2O2与次氯酸钠反应制氧气,其中还原剂是______,写出反应的化学方程式:_________________________________,生成0.5
mol氧气,转移电子_____mol。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
H2O2
解析 反应中因ClO-中的氯元素的化合价为+1价,次氯酸根具有氧化性,则H2O2具有还原性,反应的方程式:H2O2+NaClO===H2O+NaCl+O2↑,生成0.5
mol氧气,转移电子1
mol。
H2O2+NaClO===H2O+NaCl+O2↑
1
本课结束
