高中化学苏教版(2019)必修第一册 专题3 第三单元 第1课时 粗盐提纯 从海水中提取溴(51张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)必修第一册 专题3 第三单元 第1课时 粗盐提纯 从海水中提取溴(51张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-18 16:56:32 | ||
图片预览









文档简介
(共51张PPT)
第1课时 粗盐提纯 从海水中提取溴
1.掌握粗盐的提纯方法,学会利用离子反应进行物质的除杂与提纯。2.了解从海水中提取溴的原理和过程。
核心素养发展目标
一、粗盐提纯
随堂演练 知识落实
课时对点练
二、从海水中提取溴
内
容
索
引
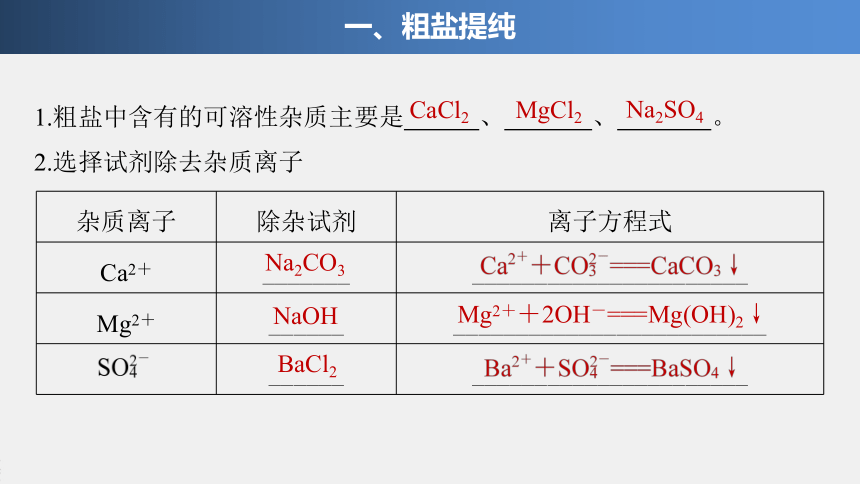
杂质离子
除杂试剂
离子方程式
Ca2+
_______
______________________
Mg2+
______
_________________________
______
______________________
1.粗盐中含有的可溶性杂质主要是
、
、
。
2.选择试剂除去杂质离子
一、粗盐提纯
CaCl2
MgCl2
Na2SO4
Na2CO3
NaOH
BaCl2
Mg2++2OH-===Mg(OH)2↓
3.物质除杂和分离的基本原则
(1)不增(不引入新的杂质)。
(2)不减(不减少被提纯的物质)。
(3)易分离(被提纯的物质与杂质易分离)。
(4)易复原(被提纯的物质易复原)。
4.物质除杂和分离注意的问题
(1)除杂试剂要过量。
(2)后续试剂应能除去过量的前一试剂。
(3)尽可能将杂质转化为所需物质。
(4)除去多种杂质时考虑加入试剂的合理顺序。
(1)除去NaCl溶液中的CaCl2杂质,可以加入过量的K2CO3溶液( )
(2)为保证原溶液纯净,加入的除杂试剂应越少越好( )
(3)只要选择好合适的除杂试剂,可以不考虑添加顺序( )
判断正误
×
×
×
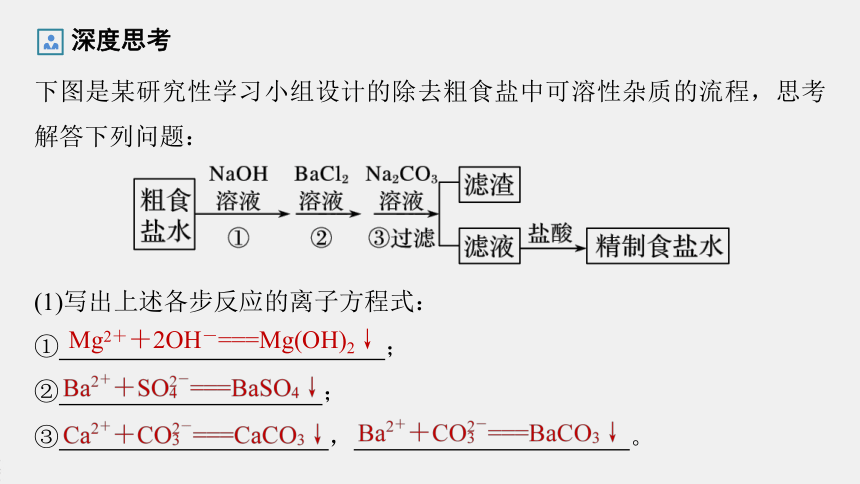
下图是某研究性学习小组设计的除去粗食盐中可溶性杂质的流程,思考解答下列问题:
深度思考
(1)写出上述各步反应的离子方程式:
①
;
②
;
③
,
。
Mg2++2OH-===Mg(OH)2↓
(2)Na2CO3溶液和BaCl2溶液的顺序是否可以颠倒?为什么?
提示 不可以。Na2CO3溶液的作用不但是除去溶液中的Ca2+,另一个作用是除去溶液中过量的Ba2+,因此Na2CO3溶液必须在加入BaCl2溶液之后加入。
(3)如何检验食盐水中杂质离子已除干净?
提示 ①取少许滤液于试管中,加入稀盐酸,再加BaCl2溶液,如无白色沉淀生成,证明
除净。
②取少许滤液于试管中,加入NaOH溶液,如无白色沉淀生成,证明Mg2+除净。
③取少许滤液于试管中,加入Na2CO3溶液,如无白色沉淀生成,证明Ca2+已除净。
返回
1.海水提溴的原料:苦卤(海水晒盐后得到的母液)是海水制盐工业的副产物,其中含有高浓度的K+、Mg2+、
和
等,是从海水中提取溴的主要原料。
2.海水提溴的三个步骤:
、
和
。
3.空气吹出法制溴
(1)流程:海水酸化→氯气氧化→空气或水蒸气吹出→SO2吸收使溴单质转化为HBr→氯气氧化。
(2)氯气氧化时发生的离子反应:
。
二、从海水中提取溴
Br-
浓缩
氧化
获取
Cl2+2Br-===2Cl-+Br2
(1)海水中含有Br2和游离态的Na、Mg、Cu( )
(2)提取溴单质时,应用了溴的挥发性( )
(3)从海水中提溴的过程,涉及多个氧化还原反应( )
(4)用SO2溶液吸收溴蒸气,是利用了SO2具有漂白性( )
判断正误
×
√
√
×
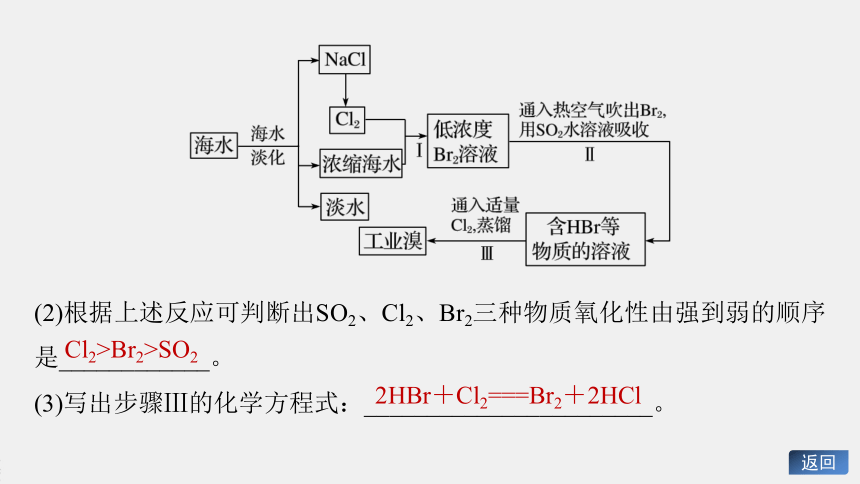
海水是巨大的资源宝库,可以进行综合利用。从海水中提取淡水、食盐和溴的过程如右:
深度思考
(1)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的,其反应的化学方程式为_______________________________。在该反应中,氧化剂是_____(填化学式);若反应中生成2
mol
HBr,则消耗___mol
SO2。
Br2+SO2+2H2O===H2SO4+2HBr
Br2
1
(2)根据上述反应可判断出SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是____________。
(3)写出步骤Ⅲ的化学方程式:_______________________。
Cl2>Br2>SO2
2HBr+Cl2===Br2+2HCl
返回
1.海水中水资源和化学资源的利用有非常广阔的前景。下列生产中,属于水资源利用的是
A.海水淡化
B.海水提盐
C.海水提溴
D.海水提镁
√
1
2
3
5
随堂演练 知识落实
4
2.下列有关海水综合利用的过程中属于物理变化的是
A.将海水中含有的钾元素转化得到钾单质
B.海水蒸发制海盐
C.从海水所得粗盐中制取精盐
D.从海带中提取碘单质
1
2
3
5
4
√
3.在粗食盐的提纯实验中,用蒸发皿蒸发滤液时,下列操作正确的是
A.把浑浊的滤液倒入蒸发皿里,进行加热
B.等到开始出现固体时,用玻璃棒不断搅拌液体
C.待滤液完全蒸干后,停止加热
D.等到出现大量固体时,停止加热
√
1
2
3
5
4
解析 海水提溴的三个步骤是:(1)先将浓缩海水中的Br-用氯气氧化:Cl2+2Br-===Br2+2Cl-。
(2)将溴吹入吸收塔,使溴蒸气和二氧化硫吸收剂发生作用转变成氢溴酸:Br2+SO2+2H2O===2Br-+ +4H+。
(3)用氯气将富集的溴离子氧化得到产品溴:Cl2+2Br-===Br2+2Cl-。
4.有关海水提溴的说法错误的是
A.海水晒盐后的卤水是提溴原料
B.可以利用氯气氧化溴离子
C.可用高温水蒸气将溴从溶液中吹出
D.吹出的溴蒸气冷凝后得到纯溴
√
1
2
3
5
4
5.(2019·西安期中)海盐经溶解、过滤后仍含有Ca2+、Mg2+、 可溶性杂质,为了得到纯净的NaCl,可向滤液中依次加入过量的下列溶液,其中不合理的是
A.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤→稀盐酸→蒸发结晶
B.Ba(OH)2溶液→Na2CO3溶液→过滤→稀盐酸→蒸发结晶
C.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤→稀盐酸→蒸发结晶
D.BaCl2溶液→Na2CO3溶液→NaOH溶液→过滤→稀盐酸→蒸发结晶
1
2
3
5
4
√
1
2
3
5
4
返回
课时对点练
1
2
3
4
5
6
7
8
9
10
题组一 海水提溴
1.目前从海水中提取的溴约占世界溴年产量的三分之一,从海水中提取溴的主要步骤可表示为
A.氧化→吸收→吹出→氧化
B.氧化→吹出→吸收→氧化
C.吹出→氧化→吸收→氧化
D.吹出→吸收→氧化
√
A组 基础对点练
2.用空气吹出法从海水中提取溴所涉及的化学反应可能有
①Cl2+2Br-===2Cl-+Br2
②Br2+SO2+2H2O===2HBr+H2SO4
③Br2+2I-===I2+2Br-
④2I-+H2O2+2H+===I2+2H2O
A.①②
B.②③
C.③④
D.①④
√
1
2
3
4
5
6
7
8
9
10
3.“空气吹出法”海水提溴的工艺流程如下:
下列说法中,不正确的是
A.实验室保存溴通常加少量水
B.海水提溴发生的反应均为氧化还原反应
C.经过吸收塔后,溴元素得到了富集
D.蒸馏塔中只发生了物理变化
√
1
2
3
4
5
6
7
8
9
10
解析 溴易挥发,加水液封可以减少挥发损失,A正确;
经过吸收塔后,所得溶液中的Br-浓度远大于进入吹出塔之前的海水中的Br-浓度,因此溴元素得到了富集,C正确;
蒸馏塔中发生的反应为:2Br-+Cl2===2Cl-+Br2,D错误。
1
2
3
4
5
6
7
8
9
10
4.除去海水提溴得到的液溴中溶有的少量氯气,应该采用的方法是
A.加入适量的KI溶液
B.通入溴蒸气
C.加氢氧化钠溶液
D.加入适量的溴化钠溶液
解析 A项,Cl2和Br2均与KI反应且引入了I2杂质;
B项,溴蒸气无法除去氯气;
C项,氯气和液溴均能与氢氧化钠反应;
D项,发生反应:Cl2+2NaBr===2NaCl+Br2,既除去了氯气,又不会引入新的杂质。
√
1
2
3
4
5
6
7
8
9
10
5.(2019·芜湖高一检测)在空气吹出法的工艺中,选用纯碱溶液作溴蒸气吸收剂的反应原理为3Na2CO3+3Br2===5NaBr+NaBrO3+3CO2,也有选用SO2作溴蒸气吸收剂的,下列有关说法正确的是
A.两种吸收过程中,Br2只作氧化剂
B.只有SO2吸收过程发生了氧化还原反应
C.用纯碱溶液作吸收剂时,纯碱既不是还原剂也不是氧化剂
D.用纯碱溶液作吸收剂只发生了复分解反应
√
1
2
3
4
5
6
7
8
9
10
解析 ①纯碱溶液作吸收剂的反应为3Na2CO3+3Br2===5NaBr+NaBrO3+3CO2;
②SO2作吸收剂的反应为SO2+Br2+2H2O===H2SO4+2HBr。
分析以上两个反应可知:①中Br2既作氧化剂,又作还原剂,Na2CO3既不是还原剂也不是氧化剂,②中Br2只作氧化剂,均属于氧化还原反应。
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
7
8
9
10
题组二 粗盐提纯
6.中国食盐产量居世界首位。下列实验室中的操作类似“海水晒盐”原理的是
A.蒸馏
B.蒸发
C.过滤
D.搅拌
√
7.(2019·石家庄高一期末)为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。正确的操作顺序是
A.①④②⑤③
B.④①②⑤③
C.⑤④①②③
D.⑤②④①③
解析 除去粗盐中的泥沙、CaCl2、MgCl2、Na2SO4得到NaCl,加NaOH除去MgCl2,加氯化钡除去Na2SO4,加碳酸钠除去CaCl2,碳酸钠一定在氯化钡之后加入,以便除去过量的氯化钡,过滤后加盐酸、蒸发得到
NaCl,则正确的操作顺序为⑤②④①③或②⑤④①③或⑤④②①③。
√
1
2
3
4
5
6
7
8
9
10
8.(2019·广东汕头金山中学月考)关于粗盐提纯的下列说法中正确的是
A.溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解
B.将制得的食盐晶体转移到新制过滤器中用大量水进行洗涤
C.当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干
D.为除去粗盐中的Ca2+、Mg2+、
可依次向溶液中加入足量的碳酸钠
溶液、氢氧化钠溶液、氯化钡溶液、稀盐酸
1
2
3
4
5
6
7
8
9
10
√
解析 溶解时不是越稀越好,如果溶液太稀,蒸发时就要消耗很长时间才能蒸干,A错误;
晶体应该用少量水洗涤,否则制得的晶体会有很多溶于水,B错误;
蒸发时,当有大量晶体析出时应停止加热,用余热蒸干剩余液体,以免晶体受热后飞溅出来,不仅造成损失,而且可能因此发生意外事故,C正确;
由于过量的钡离子需要用碳酸钠除去,则为除去粗盐中的Ca2+、Mg2+、
,可依次向溶液中加入足量的氢氧化钠溶液、氯化钡溶液、碳酸钠溶液,然后过滤,再向滤液中加入适量稀盐酸,D错误。
1
2
3
4
5
6
7
8
9
10
9.(2019·湖南长郡中学模块检测)实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示。下列分析正确的是
A.操作Ⅰ是过滤,将固体分离除去
B.操作Ⅱ是加热浓缩、趁热过滤,除去杂质氯化钠
C.操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分
离出来
D.操作Ⅰ~Ⅲ总共需两次过滤
√
1
2
3
4
5
6
7
8
9
10
解析 操作Ⅰ是在烧杯中加水溶解,故A项错误;
操作Ⅱ是蒸发浓缩,得到较高温度下的KNO3饱和溶液,故B项错误;
操作Ⅲ为冷却结晶,利用溶解度差异使KNO3结晶析出,过滤、洗涤、干燥即得KNO3晶体,故C项正确;
1
2
3
4
5
6
7
8
9
10
操作Ⅰ~Ⅲ只需一次过滤操作,只有操作Ⅲ为过滤,故D项错误。
10.(2019·黄石高一检测)海水开发利用的部分过程如图所示。下列说法错误的是
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
1
2
3
4
5
6
7
8
9
10
√
1
2
3
4
5
6
7
8
9
10
解析 苦卤中含有Br-,通入Cl2可将Br-氧化生成Br2,A正确;
粗盐中含有Ca2+、
等杂质离子,故先除杂得NaCl,而NaCl的溶解度随温度变化不大,故采用重结晶可以得到纯净的NaCl,B正确;
工业上沉淀海水中的Mg2+常采用Ca(OH)2,不用NaOH,因为NaOH的价格较高,C错误;
Br2易挥发,用水蒸气吹出后,用SO2吸收,生成H2SO4和HBr,富集后再用Cl2处理HBr生成Br2,D正确。
(1)在第⑦步蒸发过程中要用玻璃棒搅拌,目的是____________________
___________________。
1.通过海水晾晒可得粗盐,粗盐中除含有NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。制备精盐的各步操作流程如下:
B组 综合强化练
防止液体局部受热温度
过高,造成液体飞溅
解析 在第⑦步蒸发过程中要用玻璃棒搅拌,目的是防止液体局部受热温度过高,造成液体飞溅。
1
2
3
4
(2)第②、④步操作的目的分别是除去粗盐中的Na2SO4和CaCl2,需要加入的试剂依次是______________(填化学式)。
BaCl2、Na2CO3
解析 第②步操作的目的是除去粗盐中的硫酸钠,则需要加入过量BaCl2溶液,第④步操作是为了除去CaCl2及过量的BaCl2,则需要加入过量Na2CO3溶液。
1
2
3
4
(3)第⑥步操作中发生反应的化学方程式为__________________________
___________________________________。
NaOH+HCl===NaCl+H2O,
解析 第⑥步操作的目的是除去滤液中过量的氢氧化钠和碳酸钠,所以发生反应的化学方程式为NaOH+HCl===NaCl+H2O,Na2CO3+2HCl===2NaCl+H2O+CO2↑。
1
2
3
4
Na2CO3+2HCl===2NaCl+H2O+CO2↑
(4)在第③步操作中,选择的除杂试剂不能是KOH溶液,理由是________
__________。
会引入
解析 不能用KOH溶液代替NaOH溶液,理由是会引入新杂质K+。
1
2
3
4
新杂质K+
(5)第⑤步操作中,需要的玻璃仪器有_____、_____、_______。
解析 过滤操作所需玻璃仪器有漏斗、烧杯、玻璃棒。
漏斗
烧杯
玻璃棒
回答下列问题:
(1)操作A是_________(填实验基本操作名称)。要知道海水晒盐的过程中溶液里食盐含量在逐渐提高的简易方法是____(填字母)。
a.分析氯化钠含量
b.测定溶液密度
c.观察是否有沉淀析出
(2)图中虚线框内流程的主要目的是________。
2.海水是巨大的资源宝库,如图是从海水资源获取重要化工原料的流程示意图。
1
2
3
4
蒸发结晶
b
富集Br2
理论上,1
L苦卤最多可得到Mg(OH)2的质量为_____g。
(3)已知苦卤的主要成分如下:
1
2
3
4
离子
Na+
Mg2+
Cl-
浓度/(g·L-1)
63.7
28.8
144.6
46.4
解析 Mg2+~Mg(OH)2
24
58
28.8
g
m
69.6
3.(2019·湖北黄冈高一检测改编)为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某同学设计了如下实验方案:
(1)操作①为_________。
加水溶解
解析 沉淀反应必须在溶液中进行,以便充分反应,并使杂质完全沉淀,所以应先将固体配制成溶液。
1
2
3
4
(2)操作②~④加入的试剂依次为__________________________________
__________________________________________。
(3)判断
已除尽的方法是______________________________________
_________________________________。
Ba(NO3)2、K2CO3、KOH[或KOH、
1
2
3
4
Ba(NO3)2、K2CO3或Ba(NO3)2、KOH、K2CO3]
静置,取上层澄清溶液,加入少量Ba(NO3)2
解析 除去
、Mg2+的方法一般是使它们分别形成BaSO4和Mg(OH)2沉淀,所以需要加入稍过量的Ba(NO3)2和KOH溶液,过量的Ba2+可用K2CO3溶液除去,因此实验时必须先加入Ba(NO3)2溶液,后加入K2CO3溶液,不可用稀盐酸调节溶液的pH,否则会引入Cl-。
1
2
3
4
(4)实验过程中多次产生的沉淀_______(填“需要”或“不需要”)多次过滤,其理由是___________________________________________________
___________。
不需要
几个沉淀反应互不干扰,因此最后只过滤一次即可,可减
少操作程序
解析 几个沉淀分别为BaSO4、BaCO3、Mg(OH)2,这几个沉淀反应互不干扰,因此只过滤一次,可减少操作程序。
1
2
3
4
(5)该同学的实验设计方案是否严密?____(填“是”或“否”);请说明理由___________________________________________。
(6)写出上述提纯过程中可能涉及的反应的离子方程式:______________
_________________________________________________________________________________________________________。
否
加入盐酸调节溶液pH会引入Cl-,应加入稀硝酸
1
2
3
4
4.(2019·广东佛山第一中学段考)NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下:
1
2
3
4
(1)写出上述实验过程中所用试剂(写化学式):
试剂①______;试剂③_____。
BaCl2
HCl
解析 由分析可知试剂①为BaCl2,试剂③为HCl。
1
2
3
4
(2)判断试剂①已过量的方法是____________________________________
________________________________________。
静置,取上层清液加入少量氯化钡溶液,
没有白色沉淀产生,说明氯化钡溶液已过量
解析 由于硫酸钡是不溶于水也不溶于酸的白色沉淀,则判断试剂①已过量的方法是静置,取上层清液加入少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量。
1
2
3
4
(3)用离子方程式表示加入试剂②的作用:__________________________
______________________。
1
2
3
4
(4)操作①是利用半透膜进行分离提纯。
操作①的实验结果:淀粉______(填“能”或“不能”)透过半透膜;
____(填“能”或“不能”)透过半透膜。
不能
能
1
2
3
4
请用实验证明上述结果,完成下表(可不填满,也可增加)。限选试剂:
1
mol·L-1
AgNO3溶液、1
mol·L-1
BaCl2溶液、1
mol·L-1
Ba(NO3)2溶液、碘水、稀盐酸、稀硝酸
编号
实验操作
预期现象和结论
①
?
?
②
?
?
取半透膜外液体,加入少量碘水
液体没有变成蓝色,证明淀粉不能透过半透膜
另取一份半透膜外液体,加入足量稀盐酸和少量1
mol·
L-1
BaCl2溶液
产生不溶于盐酸的白色沉淀,证明
能够透过半透膜
1
2
3
4
返回
本课结束
第1课时 粗盐提纯 从海水中提取溴
1.掌握粗盐的提纯方法,学会利用离子反应进行物质的除杂与提纯。2.了解从海水中提取溴的原理和过程。
核心素养发展目标
一、粗盐提纯
随堂演练 知识落实
课时对点练
二、从海水中提取溴
内
容
索
引
杂质离子
除杂试剂
离子方程式
Ca2+
_______
______________________
Mg2+
______
_________________________
______
______________________
1.粗盐中含有的可溶性杂质主要是
、
、
。
2.选择试剂除去杂质离子
一、粗盐提纯
CaCl2
MgCl2
Na2SO4
Na2CO3
NaOH
BaCl2
Mg2++2OH-===Mg(OH)2↓
3.物质除杂和分离的基本原则
(1)不增(不引入新的杂质)。
(2)不减(不减少被提纯的物质)。
(3)易分离(被提纯的物质与杂质易分离)。
(4)易复原(被提纯的物质易复原)。
4.物质除杂和分离注意的问题
(1)除杂试剂要过量。
(2)后续试剂应能除去过量的前一试剂。
(3)尽可能将杂质转化为所需物质。
(4)除去多种杂质时考虑加入试剂的合理顺序。
(1)除去NaCl溶液中的CaCl2杂质,可以加入过量的K2CO3溶液( )
(2)为保证原溶液纯净,加入的除杂试剂应越少越好( )
(3)只要选择好合适的除杂试剂,可以不考虑添加顺序( )
判断正误
×
×
×
下图是某研究性学习小组设计的除去粗食盐中可溶性杂质的流程,思考解答下列问题:
深度思考
(1)写出上述各步反应的离子方程式:
①
;
②
;
③
,
。
Mg2++2OH-===Mg(OH)2↓
(2)Na2CO3溶液和BaCl2溶液的顺序是否可以颠倒?为什么?
提示 不可以。Na2CO3溶液的作用不但是除去溶液中的Ca2+,另一个作用是除去溶液中过量的Ba2+,因此Na2CO3溶液必须在加入BaCl2溶液之后加入。
(3)如何检验食盐水中杂质离子已除干净?
提示 ①取少许滤液于试管中,加入稀盐酸,再加BaCl2溶液,如无白色沉淀生成,证明
除净。
②取少许滤液于试管中,加入NaOH溶液,如无白色沉淀生成,证明Mg2+除净。
③取少许滤液于试管中,加入Na2CO3溶液,如无白色沉淀生成,证明Ca2+已除净。
返回
1.海水提溴的原料:苦卤(海水晒盐后得到的母液)是海水制盐工业的副产物,其中含有高浓度的K+、Mg2+、
和
等,是从海水中提取溴的主要原料。
2.海水提溴的三个步骤:
、
和
。
3.空气吹出法制溴
(1)流程:海水酸化→氯气氧化→空气或水蒸气吹出→SO2吸收使溴单质转化为HBr→氯气氧化。
(2)氯气氧化时发生的离子反应:
。
二、从海水中提取溴
Br-
浓缩
氧化
获取
Cl2+2Br-===2Cl-+Br2
(1)海水中含有Br2和游离态的Na、Mg、Cu( )
(2)提取溴单质时,应用了溴的挥发性( )
(3)从海水中提溴的过程,涉及多个氧化还原反应( )
(4)用SO2溶液吸收溴蒸气,是利用了SO2具有漂白性( )
判断正误
×
√
√
×
海水是巨大的资源宝库,可以进行综合利用。从海水中提取淡水、食盐和溴的过程如右:
深度思考
(1)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的,其反应的化学方程式为_______________________________。在该反应中,氧化剂是_____(填化学式);若反应中生成2
mol
HBr,则消耗___mol
SO2。
Br2+SO2+2H2O===H2SO4+2HBr
Br2
1
(2)根据上述反应可判断出SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是____________。
(3)写出步骤Ⅲ的化学方程式:_______________________。
Cl2>Br2>SO2
2HBr+Cl2===Br2+2HCl
返回
1.海水中水资源和化学资源的利用有非常广阔的前景。下列生产中,属于水资源利用的是
A.海水淡化
B.海水提盐
C.海水提溴
D.海水提镁
√
1
2
3
5
随堂演练 知识落实
4
2.下列有关海水综合利用的过程中属于物理变化的是
A.将海水中含有的钾元素转化得到钾单质
B.海水蒸发制海盐
C.从海水所得粗盐中制取精盐
D.从海带中提取碘单质
1
2
3
5
4
√
3.在粗食盐的提纯实验中,用蒸发皿蒸发滤液时,下列操作正确的是
A.把浑浊的滤液倒入蒸发皿里,进行加热
B.等到开始出现固体时,用玻璃棒不断搅拌液体
C.待滤液完全蒸干后,停止加热
D.等到出现大量固体时,停止加热
√
1
2
3
5
4
解析 海水提溴的三个步骤是:(1)先将浓缩海水中的Br-用氯气氧化:Cl2+2Br-===Br2+2Cl-。
(2)将溴吹入吸收塔,使溴蒸气和二氧化硫吸收剂发生作用转变成氢溴酸:Br2+SO2+2H2O===2Br-+ +4H+。
(3)用氯气将富集的溴离子氧化得到产品溴:Cl2+2Br-===Br2+2Cl-。
4.有关海水提溴的说法错误的是
A.海水晒盐后的卤水是提溴原料
B.可以利用氯气氧化溴离子
C.可用高温水蒸气将溴从溶液中吹出
D.吹出的溴蒸气冷凝后得到纯溴
√
1
2
3
5
4
5.(2019·西安期中)海盐经溶解、过滤后仍含有Ca2+、Mg2+、 可溶性杂质,为了得到纯净的NaCl,可向滤液中依次加入过量的下列溶液,其中不合理的是
A.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤→稀盐酸→蒸发结晶
B.Ba(OH)2溶液→Na2CO3溶液→过滤→稀盐酸→蒸发结晶
C.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤→稀盐酸→蒸发结晶
D.BaCl2溶液→Na2CO3溶液→NaOH溶液→过滤→稀盐酸→蒸发结晶
1
2
3
5
4
√
1
2
3
5
4
返回
课时对点练
1
2
3
4
5
6
7
8
9
10
题组一 海水提溴
1.目前从海水中提取的溴约占世界溴年产量的三分之一,从海水中提取溴的主要步骤可表示为
A.氧化→吸收→吹出→氧化
B.氧化→吹出→吸收→氧化
C.吹出→氧化→吸收→氧化
D.吹出→吸收→氧化
√
A组 基础对点练
2.用空气吹出法从海水中提取溴所涉及的化学反应可能有
①Cl2+2Br-===2Cl-+Br2
②Br2+SO2+2H2O===2HBr+H2SO4
③Br2+2I-===I2+2Br-
④2I-+H2O2+2H+===I2+2H2O
A.①②
B.②③
C.③④
D.①④
√
1
2
3
4
5
6
7
8
9
10
3.“空气吹出法”海水提溴的工艺流程如下:
下列说法中,不正确的是
A.实验室保存溴通常加少量水
B.海水提溴发生的反应均为氧化还原反应
C.经过吸收塔后,溴元素得到了富集
D.蒸馏塔中只发生了物理变化
√
1
2
3
4
5
6
7
8
9
10
解析 溴易挥发,加水液封可以减少挥发损失,A正确;
经过吸收塔后,所得溶液中的Br-浓度远大于进入吹出塔之前的海水中的Br-浓度,因此溴元素得到了富集,C正确;
蒸馏塔中发生的反应为:2Br-+Cl2===2Cl-+Br2,D错误。
1
2
3
4
5
6
7
8
9
10
4.除去海水提溴得到的液溴中溶有的少量氯气,应该采用的方法是
A.加入适量的KI溶液
B.通入溴蒸气
C.加氢氧化钠溶液
D.加入适量的溴化钠溶液
解析 A项,Cl2和Br2均与KI反应且引入了I2杂质;
B项,溴蒸气无法除去氯气;
C项,氯气和液溴均能与氢氧化钠反应;
D项,发生反应:Cl2+2NaBr===2NaCl+Br2,既除去了氯气,又不会引入新的杂质。
√
1
2
3
4
5
6
7
8
9
10
5.(2019·芜湖高一检测)在空气吹出法的工艺中,选用纯碱溶液作溴蒸气吸收剂的反应原理为3Na2CO3+3Br2===5NaBr+NaBrO3+3CO2,也有选用SO2作溴蒸气吸收剂的,下列有关说法正确的是
A.两种吸收过程中,Br2只作氧化剂
B.只有SO2吸收过程发生了氧化还原反应
C.用纯碱溶液作吸收剂时,纯碱既不是还原剂也不是氧化剂
D.用纯碱溶液作吸收剂只发生了复分解反应
√
1
2
3
4
5
6
7
8
9
10
解析 ①纯碱溶液作吸收剂的反应为3Na2CO3+3Br2===5NaBr+NaBrO3+3CO2;
②SO2作吸收剂的反应为SO2+Br2+2H2O===H2SO4+2HBr。
分析以上两个反应可知:①中Br2既作氧化剂,又作还原剂,Na2CO3既不是还原剂也不是氧化剂,②中Br2只作氧化剂,均属于氧化还原反应。
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
7
8
9
10
题组二 粗盐提纯
6.中国食盐产量居世界首位。下列实验室中的操作类似“海水晒盐”原理的是
A.蒸馏
B.蒸发
C.过滤
D.搅拌
√
7.(2019·石家庄高一期末)为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。正确的操作顺序是
A.①④②⑤③
B.④①②⑤③
C.⑤④①②③
D.⑤②④①③
解析 除去粗盐中的泥沙、CaCl2、MgCl2、Na2SO4得到NaCl,加NaOH除去MgCl2,加氯化钡除去Na2SO4,加碳酸钠除去CaCl2,碳酸钠一定在氯化钡之后加入,以便除去过量的氯化钡,过滤后加盐酸、蒸发得到
NaCl,则正确的操作顺序为⑤②④①③或②⑤④①③或⑤④②①③。
√
1
2
3
4
5
6
7
8
9
10
8.(2019·广东汕头金山中学月考)关于粗盐提纯的下列说法中正确的是
A.溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解
B.将制得的食盐晶体转移到新制过滤器中用大量水进行洗涤
C.当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干
D.为除去粗盐中的Ca2+、Mg2+、
可依次向溶液中加入足量的碳酸钠
溶液、氢氧化钠溶液、氯化钡溶液、稀盐酸
1
2
3
4
5
6
7
8
9
10
√
解析 溶解时不是越稀越好,如果溶液太稀,蒸发时就要消耗很长时间才能蒸干,A错误;
晶体应该用少量水洗涤,否则制得的晶体会有很多溶于水,B错误;
蒸发时,当有大量晶体析出时应停止加热,用余热蒸干剩余液体,以免晶体受热后飞溅出来,不仅造成损失,而且可能因此发生意外事故,C正确;
由于过量的钡离子需要用碳酸钠除去,则为除去粗盐中的Ca2+、Mg2+、
,可依次向溶液中加入足量的氢氧化钠溶液、氯化钡溶液、碳酸钠溶液,然后过滤,再向滤液中加入适量稀盐酸,D错误。
1
2
3
4
5
6
7
8
9
10
9.(2019·湖南长郡中学模块检测)实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示。下列分析正确的是
A.操作Ⅰ是过滤,将固体分离除去
B.操作Ⅱ是加热浓缩、趁热过滤,除去杂质氯化钠
C.操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分
离出来
D.操作Ⅰ~Ⅲ总共需两次过滤
√
1
2
3
4
5
6
7
8
9
10
解析 操作Ⅰ是在烧杯中加水溶解,故A项错误;
操作Ⅱ是蒸发浓缩,得到较高温度下的KNO3饱和溶液,故B项错误;
操作Ⅲ为冷却结晶,利用溶解度差异使KNO3结晶析出,过滤、洗涤、干燥即得KNO3晶体,故C项正确;
1
2
3
4
5
6
7
8
9
10
操作Ⅰ~Ⅲ只需一次过滤操作,只有操作Ⅲ为过滤,故D项错误。
10.(2019·黄石高一检测)海水开发利用的部分过程如图所示。下列说法错误的是
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
1
2
3
4
5
6
7
8
9
10
√
1
2
3
4
5
6
7
8
9
10
解析 苦卤中含有Br-,通入Cl2可将Br-氧化生成Br2,A正确;
粗盐中含有Ca2+、
等杂质离子,故先除杂得NaCl,而NaCl的溶解度随温度变化不大,故采用重结晶可以得到纯净的NaCl,B正确;
工业上沉淀海水中的Mg2+常采用Ca(OH)2,不用NaOH,因为NaOH的价格较高,C错误;
Br2易挥发,用水蒸气吹出后,用SO2吸收,生成H2SO4和HBr,富集后再用Cl2处理HBr生成Br2,D正确。
(1)在第⑦步蒸发过程中要用玻璃棒搅拌,目的是____________________
___________________。
1.通过海水晾晒可得粗盐,粗盐中除含有NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。制备精盐的各步操作流程如下:
B组 综合强化练
防止液体局部受热温度
过高,造成液体飞溅
解析 在第⑦步蒸发过程中要用玻璃棒搅拌,目的是防止液体局部受热温度过高,造成液体飞溅。
1
2
3
4
(2)第②、④步操作的目的分别是除去粗盐中的Na2SO4和CaCl2,需要加入的试剂依次是______________(填化学式)。
BaCl2、Na2CO3
解析 第②步操作的目的是除去粗盐中的硫酸钠,则需要加入过量BaCl2溶液,第④步操作是为了除去CaCl2及过量的BaCl2,则需要加入过量Na2CO3溶液。
1
2
3
4
(3)第⑥步操作中发生反应的化学方程式为__________________________
___________________________________。
NaOH+HCl===NaCl+H2O,
解析 第⑥步操作的目的是除去滤液中过量的氢氧化钠和碳酸钠,所以发生反应的化学方程式为NaOH+HCl===NaCl+H2O,Na2CO3+2HCl===2NaCl+H2O+CO2↑。
1
2
3
4
Na2CO3+2HCl===2NaCl+H2O+CO2↑
(4)在第③步操作中,选择的除杂试剂不能是KOH溶液,理由是________
__________。
会引入
解析 不能用KOH溶液代替NaOH溶液,理由是会引入新杂质K+。
1
2
3
4
新杂质K+
(5)第⑤步操作中,需要的玻璃仪器有_____、_____、_______。
解析 过滤操作所需玻璃仪器有漏斗、烧杯、玻璃棒。
漏斗
烧杯
玻璃棒
回答下列问题:
(1)操作A是_________(填实验基本操作名称)。要知道海水晒盐的过程中溶液里食盐含量在逐渐提高的简易方法是____(填字母)。
a.分析氯化钠含量
b.测定溶液密度
c.观察是否有沉淀析出
(2)图中虚线框内流程的主要目的是________。
2.海水是巨大的资源宝库,如图是从海水资源获取重要化工原料的流程示意图。
1
2
3
4
蒸发结晶
b
富集Br2
理论上,1
L苦卤最多可得到Mg(OH)2的质量为_____g。
(3)已知苦卤的主要成分如下:
1
2
3
4
离子
Na+
Mg2+
Cl-
浓度/(g·L-1)
63.7
28.8
144.6
46.4
解析 Mg2+~Mg(OH)2
24
58
28.8
g
m
69.6
3.(2019·湖北黄冈高一检测改编)为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某同学设计了如下实验方案:
(1)操作①为_________。
加水溶解
解析 沉淀反应必须在溶液中进行,以便充分反应,并使杂质完全沉淀,所以应先将固体配制成溶液。
1
2
3
4
(2)操作②~④加入的试剂依次为__________________________________
__________________________________________。
(3)判断
已除尽的方法是______________________________________
_________________________________。
Ba(NO3)2、K2CO3、KOH[或KOH、
1
2
3
4
Ba(NO3)2、K2CO3或Ba(NO3)2、KOH、K2CO3]
静置,取上层澄清溶液,加入少量Ba(NO3)2
解析 除去
、Mg2+的方法一般是使它们分别形成BaSO4和Mg(OH)2沉淀,所以需要加入稍过量的Ba(NO3)2和KOH溶液,过量的Ba2+可用K2CO3溶液除去,因此实验时必须先加入Ba(NO3)2溶液,后加入K2CO3溶液,不可用稀盐酸调节溶液的pH,否则会引入Cl-。
1
2
3
4
(4)实验过程中多次产生的沉淀_______(填“需要”或“不需要”)多次过滤,其理由是___________________________________________________
___________。
不需要
几个沉淀反应互不干扰,因此最后只过滤一次即可,可减
少操作程序
解析 几个沉淀分别为BaSO4、BaCO3、Mg(OH)2,这几个沉淀反应互不干扰,因此只过滤一次,可减少操作程序。
1
2
3
4
(5)该同学的实验设计方案是否严密?____(填“是”或“否”);请说明理由___________________________________________。
(6)写出上述提纯过程中可能涉及的反应的离子方程式:______________
_________________________________________________________________________________________________________。
否
加入盐酸调节溶液pH会引入Cl-,应加入稀硝酸
1
2
3
4
4.(2019·广东佛山第一中学段考)NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下:
1
2
3
4
(1)写出上述实验过程中所用试剂(写化学式):
试剂①______;试剂③_____。
BaCl2
HCl
解析 由分析可知试剂①为BaCl2,试剂③为HCl。
1
2
3
4
(2)判断试剂①已过量的方法是____________________________________
________________________________________。
静置,取上层清液加入少量氯化钡溶液,
没有白色沉淀产生,说明氯化钡溶液已过量
解析 由于硫酸钡是不溶于水也不溶于酸的白色沉淀,则判断试剂①已过量的方法是静置,取上层清液加入少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量。
1
2
3
4
(3)用离子方程式表示加入试剂②的作用:__________________________
______________________。
1
2
3
4
(4)操作①是利用半透膜进行分离提纯。
操作①的实验结果:淀粉______(填“能”或“不能”)透过半透膜;
____(填“能”或“不能”)透过半透膜。
不能
能
1
2
3
4
请用实验证明上述结果,完成下表(可不填满,也可增加)。限选试剂:
1
mol·L-1
AgNO3溶液、1
mol·L-1
BaCl2溶液、1
mol·L-1
Ba(NO3)2溶液、碘水、稀盐酸、稀硝酸
编号
实验操作
预期现象和结论
①
?
?
②
?
?
取半透膜外液体,加入少量碘水
液体没有变成蓝色,证明淀粉不能透过半透膜
另取一份半透膜外液体,加入足量稀盐酸和少量1
mol·
L-1
BaCl2溶液
产生不溶于盐酸的白色沉淀,证明
能够透过半透膜
1
2
3
4
返回
本课结束
