1.4《归纳与整理-全章知识复习》PPT课件(新人教版-选修4)
文档属性
| 名称 | 1.4《归纳与整理-全章知识复习》PPT课件(新人教版-选修4) |  | |
| 格式 | zip | ||
| 文件大小 | 66.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-05 16:49:38 | ||
图片预览






文档简介
(共18张PPT)
新课标人教版课件系列
《高中化学》
选修4
1.4《归纳与整理-
全章知识复习》
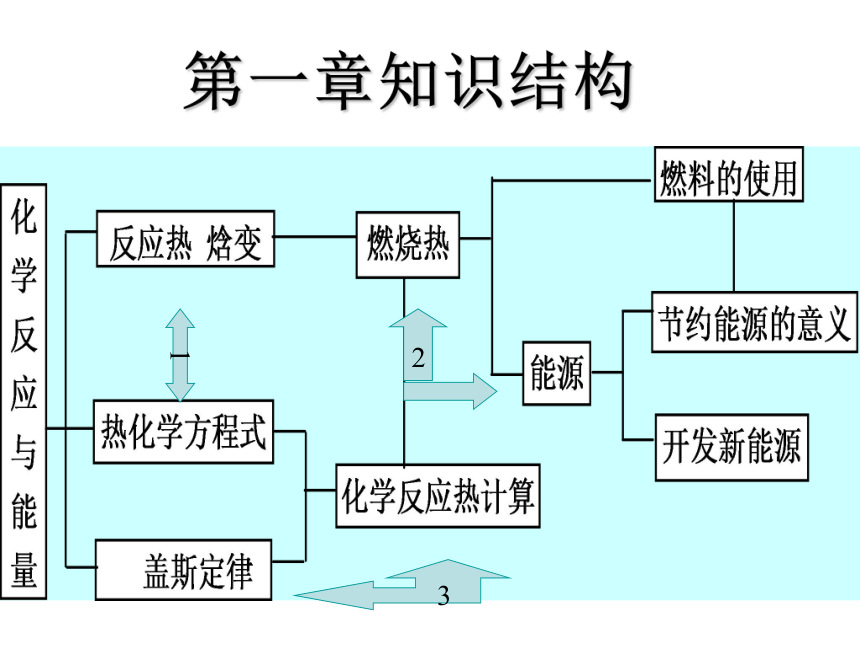
第一章知识结构
1
3
2
专题一 化学反应与能量变化参考答案:
1、A、2、A、3、D、4、C、5、A、6、A、7、D、8、B、9、A、10、C
11、吸收能量、放出能量、反应物与生成物的总能量大小、继键吸收能量大于成键放出能量。
12、2589.6 、
2C2H2(g)+ 5O2(g)= 4CO2 (g)+2H2O(l);
△H=-2589.6 kJ/mol
13、(1)反应活化能、活化分子变成生成物分子放出的能量、反应热(2)放热(3)<0
14、E(N-H)=391.5 kJ/mol
15、+14.55 kJ/mol
一、化学反应过程中同时存在物质和能量的变化,能量的释放或吸收是以发生变化的物质为基础的,而且是以物质为主。能量的多少则以反应物和产物的质量为基础。
二、反应热、焓变
★反应热∶化学过程中放出或吸收的热量,叫做反应热,也称为“焓变” ,符号用 △H表示,单位常采用KJ/mol。
注意问题∶
当△H为“-”或△H<O时,为放热反应;
当△H为“+”或△H>O时,为吸热反应。
要知道常见的放热反应和吸热反应
三、热化学方程式∶可以表述参加反应物质的量和反应热的关系的化学方程式,叫做热化学方程式。
▲书写热化学方程式应注意∶(必考)
1、需注明反应的温度和压强。如在多少度,多少千帕;如在常温(250c)、常压(101kpa)下,可不注明温度和压强的条件;
2、应注明反应物和生成物的状态;固体(s),液体(l),气体(g);不用↑和↓(因已注明状态)。
3、热化学方程式中各物质前的化学计量数不表示分子个数。化学计量数可以是整数,也可以是分数。对于相同的反应,当计量数不同时,其△H不同。
4、在方程式右端要注明△H为多少“+”或“一”kJ/mol。
5、热化学方程式具有加和性,化学式前面的计量数必须与△H相对应;反应逆向进行时,△H值不变,符号相反。
四、 ▲燃烧热∶25oC、101kPa时,
1mol纯物质完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热。单位为KJ/mol。如常温常压下,1mol甲烷完全燃烧放出890.31KJ的热量,就是甲烷的燃烧热∶
CH4(g)+2O2(g)=CO2(g)+2H2O(l);
△H=-890.31KJ/mol
能源就是能提供能量的自然资源,它包括化石燃料、阳光、风力、流水、潮汐及柴草等等。我国目前使用的主要能源是化石燃料(煤、石油、天然气等)。
新能源∶太阳能,氢能,地热能,风能、海洋能、核能、生物质能、反物质能、可燃冰等。
五、能源
6、▲盖斯定律∶化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
▲若一个化学方程式可由另外几个化学方程式相加减而得到,则该反应的焓变即为这几个化学反应焓变的代数和。
(经典练习回顾)
1、25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO(g);△H=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g);△H=+571.6 kJ/mol
C.CH4g)+2O2(g)=CO2(g)+2H2O(g);
△H=-890.3 kJ/mol
D.1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);
△H=-1 400 kJ/mol
D
2、下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)====CO2(g);△H1
C(s)+1/2O2(g)====CO(g);△H2
②S(s)+O2(g)====SO2(g);△H3
S(g)+O2(g)====SO2(g);△H4
③H2(g)+1/2O2(g)===H2O(l);△H5
2H2(g)+O2(g)====2H2O(l);△H6
④CaCO3(s)====CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)====Ca(OH)2(s);△H8
A① B④ C②③④ D①②③
C
3.下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解
B.乙醇燃烧
C.铝粉与氧化铁粉末反应
D.氧化钙溶于水
A
4、已知:(a)2H2(g)+O2=2H2O(g) △H = -Q1
(b)2H2(g)+O2=2H2O(1) △H = -Q2
(c)2CO(g)+O2(g)=2CO2(g) △H = -Q3
(1)Q1 (填>、=、<)Q2,因为 。
(2)CO和H2分别燃烧生成CO2和H2O(g),欲得到相同的热量,所需CO和H2的体积比是:
。
H2O(g)=H2O(l) △H<0
Q1/Q3
<
专题二 化学反应速率练习参考答案:
1、A、2、D、3、C、4、B、5、D、6、B、
7、C、8、C、9、D、10、B、11、AC、
12、D、13、C、14、CD、
15、反比、增大、加快、不变
16、0.0015 mol·L-1·S-1 0.003mol·L-1·S-1
17、C(H2)=2.1 mol·L-1
C(N2)=0.7 mol·L-1
C(NH3)=0.7 mol·L-1
18、b-2dt/3 mol·L-1
专题三 化 学 平 衡 参考答案:
1、A、2、C、3、A、4、B、5、BC、
6、AC、7、B、8、A、9、BC
10.⑴变小⑵不变⑶变小⑷①变小②变大
11. (1)0.05mol·L-1 (2) ③⑤;④
(3)4a + c = 2b 或(a+c/2)/(b+c/2)=1/2
12.⑴2;4 ⑵相等、60% ⑶8:5
新课标人教版课件系列
《高中化学》
选修4
1.4《归纳与整理-
全章知识复习》
第一章知识结构
1
3
2
专题一 化学反应与能量变化参考答案:
1、A、2、A、3、D、4、C、5、A、6、A、7、D、8、B、9、A、10、C
11、吸收能量、放出能量、反应物与生成物的总能量大小、继键吸收能量大于成键放出能量。
12、2589.6 、
2C2H2(g)+ 5O2(g)= 4CO2 (g)+2H2O(l);
△H=-2589.6 kJ/mol
13、(1)反应活化能、活化分子变成生成物分子放出的能量、反应热(2)放热(3)<0
14、E(N-H)=391.5 kJ/mol
15、+14.55 kJ/mol
一、化学反应过程中同时存在物质和能量的变化,能量的释放或吸收是以发生变化的物质为基础的,而且是以物质为主。能量的多少则以反应物和产物的质量为基础。
二、反应热、焓变
★反应热∶化学过程中放出或吸收的热量,叫做反应热,也称为“焓变” ,符号用 △H表示,单位常采用KJ/mol。
注意问题∶
当△H为“-”或△H<O时,为放热反应;
当△H为“+”或△H>O时,为吸热反应。
要知道常见的放热反应和吸热反应
三、热化学方程式∶可以表述参加反应物质的量和反应热的关系的化学方程式,叫做热化学方程式。
▲书写热化学方程式应注意∶(必考)
1、需注明反应的温度和压强。如在多少度,多少千帕;如在常温(250c)、常压(101kpa)下,可不注明温度和压强的条件;
2、应注明反应物和生成物的状态;固体(s),液体(l),气体(g);不用↑和↓(因已注明状态)。
3、热化学方程式中各物质前的化学计量数不表示分子个数。化学计量数可以是整数,也可以是分数。对于相同的反应,当计量数不同时,其△H不同。
4、在方程式右端要注明△H为多少“+”或“一”kJ/mol。
5、热化学方程式具有加和性,化学式前面的计量数必须与△H相对应;反应逆向进行时,△H值不变,符号相反。
四、 ▲燃烧热∶25oC、101kPa时,
1mol纯物质完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热。单位为KJ/mol。如常温常压下,1mol甲烷完全燃烧放出890.31KJ的热量,就是甲烷的燃烧热∶
CH4(g)+2O2(g)=CO2(g)+2H2O(l);
△H=-890.31KJ/mol
能源就是能提供能量的自然资源,它包括化石燃料、阳光、风力、流水、潮汐及柴草等等。我国目前使用的主要能源是化石燃料(煤、石油、天然气等)。
新能源∶太阳能,氢能,地热能,风能、海洋能、核能、生物质能、反物质能、可燃冰等。
五、能源
6、▲盖斯定律∶化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
▲若一个化学方程式可由另外几个化学方程式相加减而得到,则该反应的焓变即为这几个化学反应焓变的代数和。
(经典练习回顾)
1、25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO(g);△H=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g);△H=+571.6 kJ/mol
C.CH4g)+2O2(g)=CO2(g)+2H2O(g);
△H=-890.3 kJ/mol
D.1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);
△H=-1 400 kJ/mol
D
2、下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)====CO2(g);△H1
C(s)+1/2O2(g)====CO(g);△H2
②S(s)+O2(g)====SO2(g);△H3
S(g)+O2(g)====SO2(g);△H4
③H2(g)+1/2O2(g)===H2O(l);△H5
2H2(g)+O2(g)====2H2O(l);△H6
④CaCO3(s)====CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)====Ca(OH)2(s);△H8
A① B④ C②③④ D①②③
C
3.下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解
B.乙醇燃烧
C.铝粉与氧化铁粉末反应
D.氧化钙溶于水
A
4、已知:(a)2H2(g)+O2=2H2O(g) △H = -Q1
(b)2H2(g)+O2=2H2O(1) △H = -Q2
(c)2CO(g)+O2(g)=2CO2(g) △H = -Q3
(1)Q1 (填>、=、<)Q2,因为 。
(2)CO和H2分别燃烧生成CO2和H2O(g),欲得到相同的热量,所需CO和H2的体积比是:
。
H2O(g)=H2O(l) △H<0
Q1/Q3
<
专题二 化学反应速率练习参考答案:
1、A、2、D、3、C、4、B、5、D、6、B、
7、C、8、C、9、D、10、B、11、AC、
12、D、13、C、14、CD、
15、反比、增大、加快、不变
16、0.0015 mol·L-1·S-1 0.003mol·L-1·S-1
17、C(H2)=2.1 mol·L-1
C(N2)=0.7 mol·L-1
C(NH3)=0.7 mol·L-1
18、b-2dt/3 mol·L-1
专题三 化 学 平 衡 参考答案:
1、A、2、C、3、A、4、B、5、BC、
6、AC、7、B、8、A、9、BC
10.⑴变小⑵不变⑶变小⑷①变小②变大
11. (1)0.05mol·L-1 (2) ③⑤;④
(3)4a + c = 2b 或(a+c/2)/(b+c/2)=1/2
12.⑴2;4 ⑵相等、60% ⑶8:5
