3.3《盐类的水解》PPT课件(新人教版-选修4)
文档属性
| 名称 | 3.3《盐类的水解》PPT课件(新人教版-选修4) |

|
|
| 格式 | zip | ||
| 文件大小 | 970.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-05 00:00:00 | ||
图片预览








文档简介
(共35张PPT)
新课标人教版课件系列
《高中化学》
选修4
3.3《盐类的水解》
教学目标
知识与能力
1.使学生理解强碱弱酸盐和强酸弱碱盐的水解。
2.培养学生分析问题的能力,使学生会透过现象看本质。
3.培养学生的实验技能,对学生进行科学态度和科学方法教育。
【学习重点】
盐类水解的本质
【学习难点】
盐类水解方程式的书写和分析
【教学方法】
启发式、实验引导法、归纳法
1、pH>7的溶液呈碱性,pH=7的溶液呈中性,
pH<7的溶液呈酸性?
2、同属于盐类,为什么NaCl和C5H8NO4Na(谷氨酸一钠)可以用于调味,而Na2CO3和NaHCO3却被视为“碱”用于清洗油污和面食制作呢?
3、“酸溶液呈酸性,碱溶液呈碱性,盐溶液呈中性。”这种说法正确吗?
*
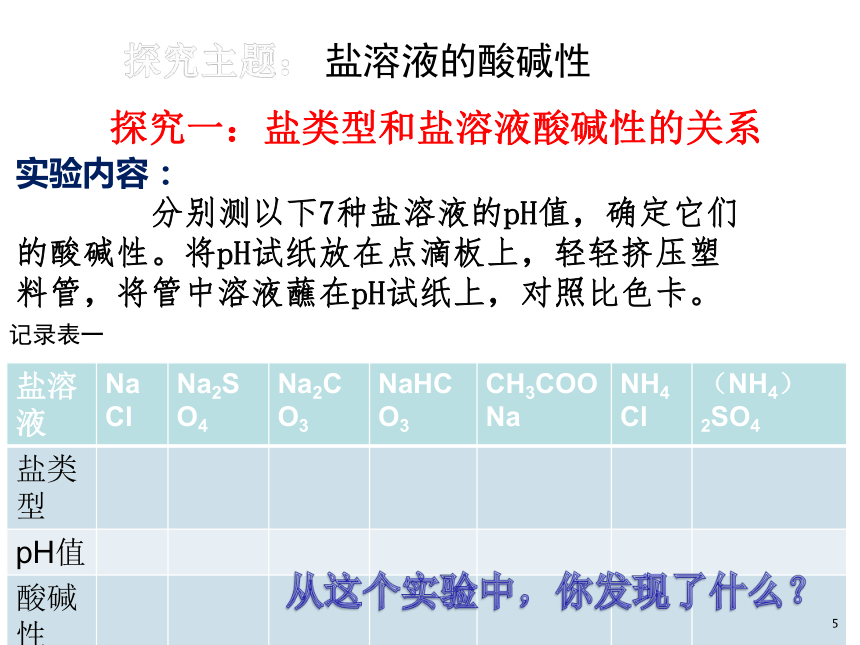
盐溶液的酸碱性
探究一:盐类型和盐溶液酸碱性的关系
记录表一
盐溶液 NaCl Na2SO4 Na2CO3 NaHCO3 CH3COONa NH4Cl (NH4)2SO4
盐类型
pH值
酸碱性
实验内容:
分别测以下7种盐溶液的pH值,确定它们的酸碱性。将pH试纸放在点滴板上,轻轻挤压塑料管,将管中溶液蘸在pH试纸上,对照比色卡。
*
*
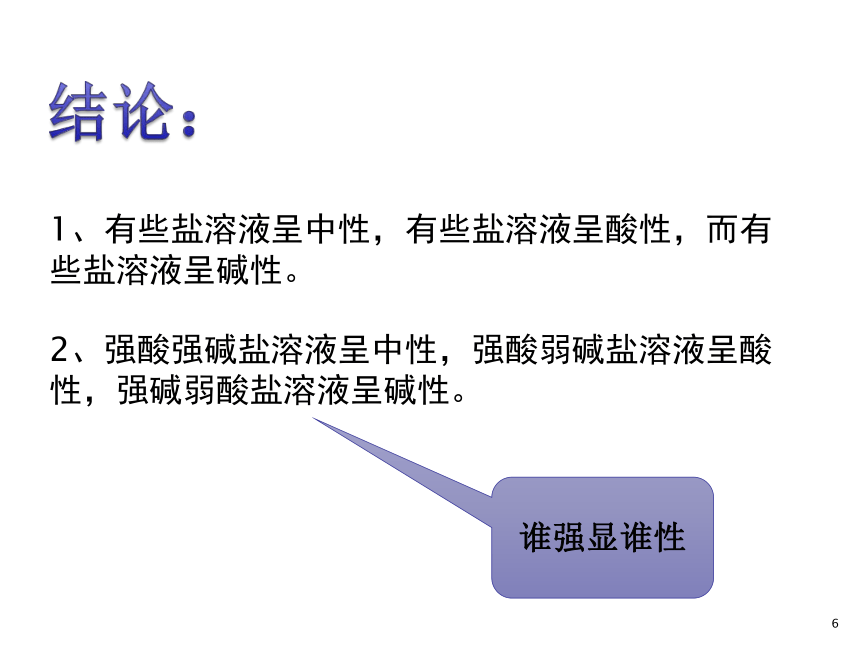
1、有些盐溶液呈中性,有些盐溶液呈酸性,而有些盐溶液呈碱性。
2、强酸强碱盐溶液呈中性,强酸弱碱盐溶液呈酸性,强碱弱酸盐溶液呈碱性。
谁强显谁性
*
探究二:不同类盐溶液呈现不同酸碱性的原因
记录表二
盐溶液 NaCl 溶液 NH4Cl 溶液 CH3COONa溶液
酸碱性
C(H+)和
C(OH—)相对大小
溶液中的离子
有无弱电解质生成
水的电离平衡是否移动
思考与交流:为什么不同类型的盐溶液会呈现不同的酸碱性?你能从离子浓度变化的角度来分析一下吗?
先独立思考并填好表格,再分小组进行讨论。
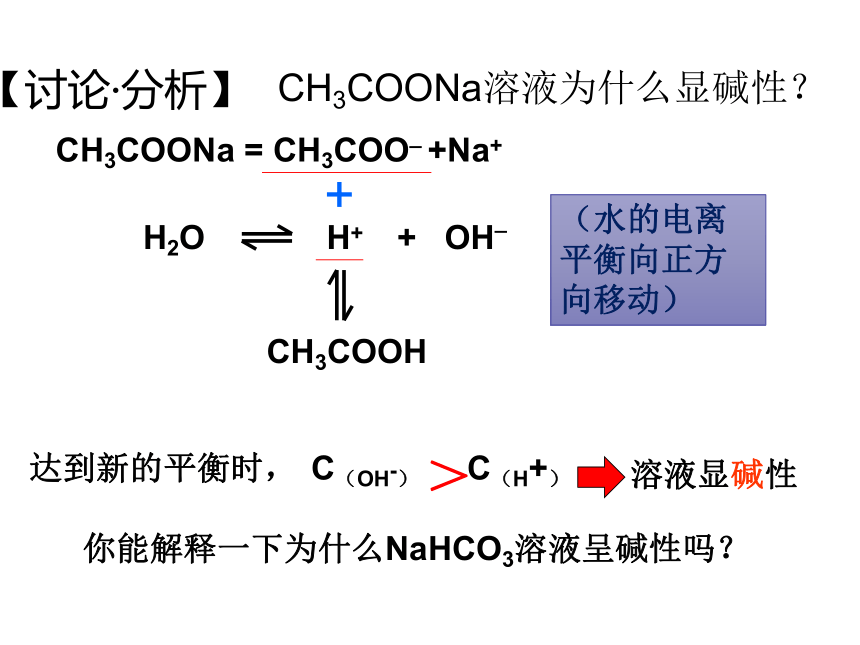
【讨论·分析】
CH3COONa溶液为什么显碱性?
H2O H+ + OH_
CH3COONa = CH3COO_ +Na+
CH3COOH
达到新的平衡时,
C(OH-) C(H+)
+
>
溶液显碱性
(水的电离平衡向正方向移动)
你能解释一下为什么NaHCO3溶液呈碱性吗?
思考:
1、0.1mol/L的CH3COONa溶液中CH3COO—浓度是否为 0.1mol/L?
2、 1mol/L的Na2S溶液中,C(Na+)=2C(S2-)吗?
*
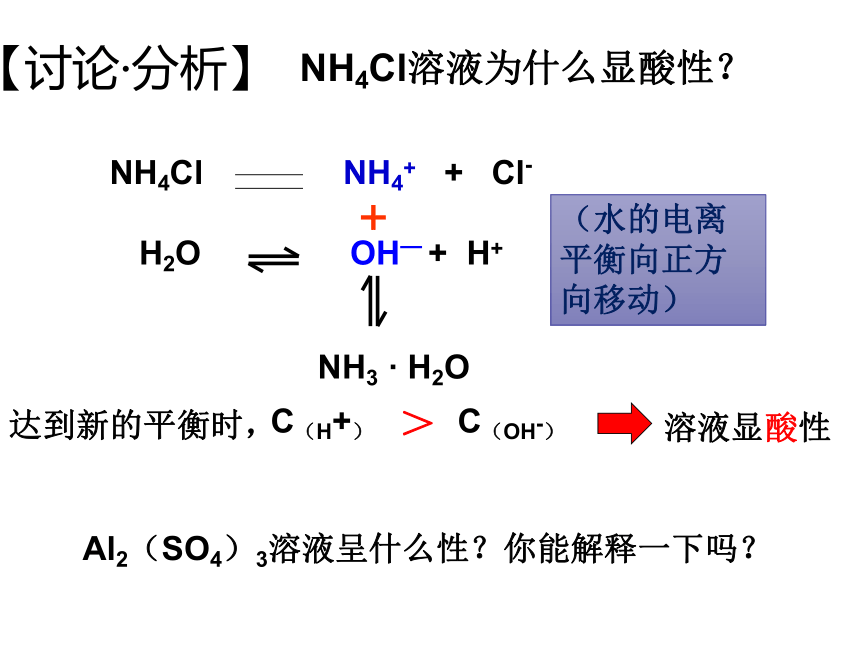
【讨论·分析】
NH4Cl溶液为什么显酸性?
NH4Cl NH4+ + Cl-
+
NH3 · H2O
H2O OH— + H+
达到新的平衡时,
C(H+) C(OH-)
>
溶液显酸性
(水的电离平衡向正方向移动)
Al2(SO4)3溶液呈什么性?你能解释一下吗?
通过以上的分析,你能总结出盐溶液呈酸碱性的实质吗?
在溶液中,盐电离出来的离子跟水所电离出来的H+ 或OH—结合生成弱电解质的反应,叫做盐类的水解。
思考:哪些盐能够发生水解呢?
水解的条件:生成弱电解质
*
有弱才水解,
无弱不水解。
谁弱谁水解,
谁强显谁性。
*
水解反应属于离子反应。
水解反应的程度是很小的。
水解的实质:促进了水的电离
水解反应与中和反应的关系:
酸+碱 盐+水
放热
中和
吸热
水解
(水解反应的逆反应是中和反应)
*
1、物质的量浓度相同的下列溶液中,符合按pH值由小到大顺序排列的是( )
A、Na2CO3、NaHCO3、NaCl、NH4Cl
B、Na2CO3、NaHCO3、NH4Cl、NaCl
C、(NH4)2SO4、NH4Cl、NaNO3、Na2S
D、NH4Cl、(NH4)2SO4、Na2S、NaNO3
C
2、 Na2S溶液中含有哪些粒子?
1、盐类水解的程度一般是很小的,通常用“ ”表示,同时无沉淀和气体产生。
2、多元弱酸的酸根离子水解是分步进行的,第一步水解程度比第二水解程度大,故相同物质的量浓度的Na2CO3和NaHCO3溶液,Na2CO3溶液碱性比NaHCO3强。
3、多元弱碱的阳离子水解过程较为复杂,通常写成一步完成。
4、多元弱酸的酸式酸根离子,水解和电离同步进行。
*
练习(做在作业本上):
写出 NH4Cl、Al2(SO4)3、NaF、 Na2CO3、Na2S、(NH4)2SO4的水解方程式。
盐类水解方程式的书写
水解平衡属于化学平衡(广义)中的一种,
所以,勒夏特列原理同样适用于水解平衡。
*
一、主要因素: 盐本身的性质(内因)。
盐与水生成弱电解质的倾向越大(弱电解质的电离常数越小),则水解的程度越大。
水解常数与弱酸/弱碱的电离常数的关系式:
Kh=
KW
Ka/Kb
*
“越弱越水解”
例:酸性:乙酸>碳酸>次氯酸
水解程度:乙酸钠<碳酸钠<次氯酸钠
溶液碱性: CH3COONa参考书本第58页《盐的水解常数》练习,书本59页第2题.
*
1、FeCl3溶液能否发生水解?如果可以,请写出水解方程式。
2、应用平衡移动原理,影响其水解的因素有哪些?
Fe3+ + 3H2O Fe(OH)3 +3H+
*
二、外界条件:温度,浓度,外加酸碱(外因)。
1、盐的浓度:
增大盐的浓度可使平衡向水解方向移动,水解程度增大;
盐溶液中加水稀释,也可使平衡向水解方向移动,盐的水解程度增大,但溶液酸性(或碱性)减小。
例:碳酸钠溶液加水稀释,水解程度 ,溶液的碱性 , pH 。
增大
减弱
变小
2、溶液的酸碱性
溶液的酸碱性可以抑制或促进盐的水解。
例:
加酸:H+与OH-反应生成水,降低了生成物浓度,平衡向水解方向移动。即促进了CH3COONa的水解。
加碱:增加了OH-浓度,使平衡向逆反应方向移动,即抑制了CH3COONa的水解。
CH3COO- + H2O CH3COOH + OH-
3、温度
盐类水解的逆反应是中和反应,则盐类的水解反应是 热反应。
升温,水解平衡向 反应方向移动。
问题:蒸干并灼烧AlCl3溶液,最后得到什么物质?
吸
正
(Al2O3)
1、判断盐溶液的酸碱性和比较盐溶液酸碱性的强弱时,通常需考虑盐的水解。
如:相同条件,相同物质的量浓度的下列七种溶液:Na2CO3、NaAc、Na2SO4、NaHCO3、NaOH 、(NH4)2SO4、NaHSO4等溶液,pH值由大到小的顺序为:
NaOH>Na2CO3>NaHCO3>NaAc>Na2SO4
>(NH4)2SO4>NaHSO4
2、比较盐溶液中各离子浓度的相对大小时,当盐中含有易水解的离子,需考虑盐的水解。
练:25℃时,在浓度均为1mo/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,若测得其中[NH4+]分别为a、b、c(单位为mol/L),则下列判断正确的是( )
A.a=b=c B.c>a>b
C.b>a>c D.a>c>b
B
3、判断溶液中离子能否大量共存
弱酸根离子与弱碱阳离子在水溶液中互相促进水解,水解程度增大。有些双促水解反应不能完全进行,这些离子能够共存;有些双促水解反应能完全进行则称为“双水解反应”。
如:完全双水解特例:
① Al3+与HCO3- 、CO32- 、ClO- 、S2- 、HS- 、AlO2-等发生完全双水解,生成沉淀或气体。
② Fe3+与HCO3- 、CO32- 、AlO2-等。
③ NH4+与SiO32-等发生完全双水解
不能在溶液中大量共存。
灭火器原理
玻璃筒里面放入的什么药品?
外筒(钢质)放入的是什么药品?
泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。
泡沫灭火器工作原理:
泡沫灭火器中的反应物分别是硫酸铝溶液和碳酸氢钠溶液,它们是如何产生二氧化碳的?
Al3+ + 3H2O Al(OH)3 + 3H+
HCO3- + H2O H2CO3 + OH-
混合时, H+ + OH- H2O
两个水解平衡相互促进, Al(OH)3形成沉淀, H2CO3 分解为CO2,总反应为:
Al3+ + 3HCO3- Al(OH)3 ↓+3CO2↑
4、某些易水解盐溶液的配制
例:配制FeCl3溶液,由于:
Fe3+ + 3H2O Fe(OH)3 +3H+
因生成难溶的Fe(OH)3而得不到澄清溶液,可加入少量盐酸以防止浑浊(加少量硫酸可以吗?)。
配制FeCl3、SnCl2等溶液时,先用少量浓盐酸溶解 ,再加水稀释到所需的浓度。
5、选择制备盐的途径时,需考虑盐的水解。如制备Al2S3时,因无法在溶液中制取,会完全水解,只能由干法直接反应制取。
加热蒸干AlCl3、MgCl2、FeCl3等溶液时,得不到AlCl3、MgCl2、FeCl3晶体,必须在蒸发过程中不断通入HCl气体,以抑制FeCl3的水解,才能得到其固体。
练习:要制得FeS沉淀,在FeCl2溶液中加入的试剂是( )
A.Na2S B.NaHS C.H2S D.(NH4)2S
A
6、化肥的合理使用,有时需考虑盐的水解。
如:铵态氮肥和草木灰不能混合施用,因草木灰(有效成分K2CO3)水解呈碱性。
7、某些试剂的实验室存放,需要考虑盐的水解。
如:Na2CO3、Na2SiO3等水解呈碱性,不能存放在磨口玻璃塞的试剂瓶中;NH4F不能存放在玻璃瓶中,因为NH4F水解应会产生HF,腐蚀玻璃 。
8、溶液中,某些离子的除杂,需考虑盐的水解。
练习:为了除去氯化镁酸性溶液中的Fe3+离子,可在加热搅拌下加入一种试剂,过滤后再加入适量盐酸。这种试剂是( )
A.氧化镁 B.氢氧化钠
C.碳酸钠 D. 碳酸镁
AD
9、明矾净水
KAl(SO4)·12H2O
氯化铁也能净水,原理与明矾一样。
请解释:
1、某些活泼金属(如镁)与强酸弱碱盐(如NH4Cl)溶液反应为什么能产生H2?
2、书后溶解性表中,为何在提到Al2(CO3)3和Fe2(CO3)3时显示的是“ — ”?
“三个守恒”:以Na2CO3溶液为例。
⒈电荷守恒:因溶液是电中性的,所以溶液中阳离子所带的正电荷总数与阴离子所带负电荷总数相等。
c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
⒉物料守恒:关键元素的原子数目之比守恒。
c(Na+)=2[c(CO32-)+ c(HCO3-)+c(H2CO3)](碳元素守恒)
⒊水的电离守恒:
c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
今晚作业:写出CH3COONa、Na2S溶液中的三个守恒关系。
“大小比较”
⒈ CH3COONa溶液
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
⒉Na2CO3溶液
c(Na+)>c(CO32-)> c(OH-)>c(HCO3-)> c(H+)
⒊NH4Cl溶液
c(Cl-)>c(NH4+)> c(H+)>c(OH-)
练习:已知等物质的量浓度醋酸与醋酸钠混合溶液呈酸性,写出混合溶液中各离子浓度大小关系。
1、0.1mol/l下列溶液PH值由大到小的顺序是 _________________
①H2SO4 ② NH3·H2O ③ NaOH ④NH4Cl ⑤NaCl ⑥CH3COONa ⑦ HCl ⑧ CH3COOH ⑨Ba(OH)2
2、将10 mL0.2 mol/L氨水和10 mL0.1 mol/L盐酸混合后, 溶液里各种离子物质的量浓度的关系是 ( )
A. c (Cl-) + c (OH-) = c(NH4+) + c (H+)
B. c (Cl-)> c(NH4+)> c (H+) > c (OH-)
C. c(NH4+) > c (Cl--)> c (OH-)> c (H+)
D. c (Cl-)> c (H+) > c (NH4+) > c (OH-)
AC
⑨>③>②>⑥>⑤>④>⑧>⑦>①
练习:
新课标人教版课件系列
《高中化学》
选修4
3.3《盐类的水解》
教学目标
知识与能力
1.使学生理解强碱弱酸盐和强酸弱碱盐的水解。
2.培养学生分析问题的能力,使学生会透过现象看本质。
3.培养学生的实验技能,对学生进行科学态度和科学方法教育。
【学习重点】
盐类水解的本质
【学习难点】
盐类水解方程式的书写和分析
【教学方法】
启发式、实验引导法、归纳法
1、pH>7的溶液呈碱性,pH=7的溶液呈中性,
pH<7的溶液呈酸性?
2、同属于盐类,为什么NaCl和C5H8NO4Na(谷氨酸一钠)可以用于调味,而Na2CO3和NaHCO3却被视为“碱”用于清洗油污和面食制作呢?
3、“酸溶液呈酸性,碱溶液呈碱性,盐溶液呈中性。”这种说法正确吗?
*
盐溶液的酸碱性
探究一:盐类型和盐溶液酸碱性的关系
记录表一
盐溶液 NaCl Na2SO4 Na2CO3 NaHCO3 CH3COONa NH4Cl (NH4)2SO4
盐类型
pH值
酸碱性
实验内容:
分别测以下7种盐溶液的pH值,确定它们的酸碱性。将pH试纸放在点滴板上,轻轻挤压塑料管,将管中溶液蘸在pH试纸上,对照比色卡。
*
*
1、有些盐溶液呈中性,有些盐溶液呈酸性,而有些盐溶液呈碱性。
2、强酸强碱盐溶液呈中性,强酸弱碱盐溶液呈酸性,强碱弱酸盐溶液呈碱性。
谁强显谁性
*
探究二:不同类盐溶液呈现不同酸碱性的原因
记录表二
盐溶液 NaCl 溶液 NH4Cl 溶液 CH3COONa溶液
酸碱性
C(H+)和
C(OH—)相对大小
溶液中的离子
有无弱电解质生成
水的电离平衡是否移动
思考与交流:为什么不同类型的盐溶液会呈现不同的酸碱性?你能从离子浓度变化的角度来分析一下吗?
先独立思考并填好表格,再分小组进行讨论。
【讨论·分析】
CH3COONa溶液为什么显碱性?
H2O H+ + OH_
CH3COONa = CH3COO_ +Na+
CH3COOH
达到新的平衡时,
C(OH-) C(H+)
+
>
溶液显碱性
(水的电离平衡向正方向移动)
你能解释一下为什么NaHCO3溶液呈碱性吗?
思考:
1、0.1mol/L的CH3COONa溶液中CH3COO—浓度是否为 0.1mol/L?
2、 1mol/L的Na2S溶液中,C(Na+)=2C(S2-)吗?
*
【讨论·分析】
NH4Cl溶液为什么显酸性?
NH4Cl NH4+ + Cl-
+
NH3 · H2O
H2O OH— + H+
达到新的平衡时,
C(H+) C(OH-)
>
溶液显酸性
(水的电离平衡向正方向移动)
Al2(SO4)3溶液呈什么性?你能解释一下吗?
通过以上的分析,你能总结出盐溶液呈酸碱性的实质吗?
在溶液中,盐电离出来的离子跟水所电离出来的H+ 或OH—结合生成弱电解质的反应,叫做盐类的水解。
思考:哪些盐能够发生水解呢?
水解的条件:生成弱电解质
*
有弱才水解,
无弱不水解。
谁弱谁水解,
谁强显谁性。
*
水解反应属于离子反应。
水解反应的程度是很小的。
水解的实质:促进了水的电离
水解反应与中和反应的关系:
酸+碱 盐+水
放热
中和
吸热
水解
(水解反应的逆反应是中和反应)
*
1、物质的量浓度相同的下列溶液中,符合按pH值由小到大顺序排列的是( )
A、Na2CO3、NaHCO3、NaCl、NH4Cl
B、Na2CO3、NaHCO3、NH4Cl、NaCl
C、(NH4)2SO4、NH4Cl、NaNO3、Na2S
D、NH4Cl、(NH4)2SO4、Na2S、NaNO3
C
2、 Na2S溶液中含有哪些粒子?
1、盐类水解的程度一般是很小的,通常用“ ”表示,同时无沉淀和气体产生。
2、多元弱酸的酸根离子水解是分步进行的,第一步水解程度比第二水解程度大,故相同物质的量浓度的Na2CO3和NaHCO3溶液,Na2CO3溶液碱性比NaHCO3强。
3、多元弱碱的阳离子水解过程较为复杂,通常写成一步完成。
4、多元弱酸的酸式酸根离子,水解和电离同步进行。
*
练习(做在作业本上):
写出 NH4Cl、Al2(SO4)3、NaF、 Na2CO3、Na2S、(NH4)2SO4的水解方程式。
盐类水解方程式的书写
水解平衡属于化学平衡(广义)中的一种,
所以,勒夏特列原理同样适用于水解平衡。
*
一、主要因素: 盐本身的性质(内因)。
盐与水生成弱电解质的倾向越大(弱电解质的电离常数越小),则水解的程度越大。
水解常数与弱酸/弱碱的电离常数的关系式:
Kh=
KW
Ka/Kb
*
“越弱越水解”
例:酸性:乙酸>碳酸>次氯酸
水解程度:乙酸钠<碳酸钠<次氯酸钠
溶液碱性: CH3COONa
*
1、FeCl3溶液能否发生水解?如果可以,请写出水解方程式。
2、应用平衡移动原理,影响其水解的因素有哪些?
Fe3+ + 3H2O Fe(OH)3 +3H+
*
二、外界条件:温度,浓度,外加酸碱(外因)。
1、盐的浓度:
增大盐的浓度可使平衡向水解方向移动,水解程度增大;
盐溶液中加水稀释,也可使平衡向水解方向移动,盐的水解程度增大,但溶液酸性(或碱性)减小。
例:碳酸钠溶液加水稀释,水解程度 ,溶液的碱性 , pH 。
增大
减弱
变小
2、溶液的酸碱性
溶液的酸碱性可以抑制或促进盐的水解。
例:
加酸:H+与OH-反应生成水,降低了生成物浓度,平衡向水解方向移动。即促进了CH3COONa的水解。
加碱:增加了OH-浓度,使平衡向逆反应方向移动,即抑制了CH3COONa的水解。
CH3COO- + H2O CH3COOH + OH-
3、温度
盐类水解的逆反应是中和反应,则盐类的水解反应是 热反应。
升温,水解平衡向 反应方向移动。
问题:蒸干并灼烧AlCl3溶液,最后得到什么物质?
吸
正
(Al2O3)
1、判断盐溶液的酸碱性和比较盐溶液酸碱性的强弱时,通常需考虑盐的水解。
如:相同条件,相同物质的量浓度的下列七种溶液:Na2CO3、NaAc、Na2SO4、NaHCO3、NaOH 、(NH4)2SO4、NaHSO4等溶液,pH值由大到小的顺序为:
NaOH>Na2CO3>NaHCO3>NaAc>Na2SO4
>(NH4)2SO4>NaHSO4
2、比较盐溶液中各离子浓度的相对大小时,当盐中含有易水解的离子,需考虑盐的水解。
练:25℃时,在浓度均为1mo/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,若测得其中[NH4+]分别为a、b、c(单位为mol/L),则下列判断正确的是( )
A.a=b=c B.c>a>b
C.b>a>c D.a>c>b
B
3、判断溶液中离子能否大量共存
弱酸根离子与弱碱阳离子在水溶液中互相促进水解,水解程度增大。有些双促水解反应不能完全进行,这些离子能够共存;有些双促水解反应能完全进行则称为“双水解反应”。
如:完全双水解特例:
① Al3+与HCO3- 、CO32- 、ClO- 、S2- 、HS- 、AlO2-等发生完全双水解,生成沉淀或气体。
② Fe3+与HCO3- 、CO32- 、AlO2-等。
③ NH4+与SiO32-等发生完全双水解
不能在溶液中大量共存。
灭火器原理
玻璃筒里面放入的什么药品?
外筒(钢质)放入的是什么药品?
泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。
泡沫灭火器工作原理:
泡沫灭火器中的反应物分别是硫酸铝溶液和碳酸氢钠溶液,它们是如何产生二氧化碳的?
Al3+ + 3H2O Al(OH)3 + 3H+
HCO3- + H2O H2CO3 + OH-
混合时, H+ + OH- H2O
两个水解平衡相互促进, Al(OH)3形成沉淀, H2CO3 分解为CO2,总反应为:
Al3+ + 3HCO3- Al(OH)3 ↓+3CO2↑
4、某些易水解盐溶液的配制
例:配制FeCl3溶液,由于:
Fe3+ + 3H2O Fe(OH)3 +3H+
因生成难溶的Fe(OH)3而得不到澄清溶液,可加入少量盐酸以防止浑浊(加少量硫酸可以吗?)。
配制FeCl3、SnCl2等溶液时,先用少量浓盐酸溶解 ,再加水稀释到所需的浓度。
5、选择制备盐的途径时,需考虑盐的水解。如制备Al2S3时,因无法在溶液中制取,会完全水解,只能由干法直接反应制取。
加热蒸干AlCl3、MgCl2、FeCl3等溶液时,得不到AlCl3、MgCl2、FeCl3晶体,必须在蒸发过程中不断通入HCl气体,以抑制FeCl3的水解,才能得到其固体。
练习:要制得FeS沉淀,在FeCl2溶液中加入的试剂是( )
A.Na2S B.NaHS C.H2S D.(NH4)2S
A
6、化肥的合理使用,有时需考虑盐的水解。
如:铵态氮肥和草木灰不能混合施用,因草木灰(有效成分K2CO3)水解呈碱性。
7、某些试剂的实验室存放,需要考虑盐的水解。
如:Na2CO3、Na2SiO3等水解呈碱性,不能存放在磨口玻璃塞的试剂瓶中;NH4F不能存放在玻璃瓶中,因为NH4F水解应会产生HF,腐蚀玻璃 。
8、溶液中,某些离子的除杂,需考虑盐的水解。
练习:为了除去氯化镁酸性溶液中的Fe3+离子,可在加热搅拌下加入一种试剂,过滤后再加入适量盐酸。这种试剂是( )
A.氧化镁 B.氢氧化钠
C.碳酸钠 D. 碳酸镁
AD
9、明矾净水
KAl(SO4)·12H2O
氯化铁也能净水,原理与明矾一样。
请解释:
1、某些活泼金属(如镁)与强酸弱碱盐(如NH4Cl)溶液反应为什么能产生H2?
2、书后溶解性表中,为何在提到Al2(CO3)3和Fe2(CO3)3时显示的是“ — ”?
“三个守恒”:以Na2CO3溶液为例。
⒈电荷守恒:因溶液是电中性的,所以溶液中阳离子所带的正电荷总数与阴离子所带负电荷总数相等。
c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
⒉物料守恒:关键元素的原子数目之比守恒。
c(Na+)=2[c(CO32-)+ c(HCO3-)+c(H2CO3)](碳元素守恒)
⒊水的电离守恒:
c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
今晚作业:写出CH3COONa、Na2S溶液中的三个守恒关系。
“大小比较”
⒈ CH3COONa溶液
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
⒉Na2CO3溶液
c(Na+)>c(CO32-)> c(OH-)>c(HCO3-)> c(H+)
⒊NH4Cl溶液
c(Cl-)>c(NH4+)> c(H+)>c(OH-)
练习:已知等物质的量浓度醋酸与醋酸钠混合溶液呈酸性,写出混合溶液中各离子浓度大小关系。
1、0.1mol/l下列溶液PH值由大到小的顺序是 _________________
①H2SO4 ② NH3·H2O ③ NaOH ④NH4Cl ⑤NaCl ⑥CH3COONa ⑦ HCl ⑧ CH3COOH ⑨Ba(OH)2
2、将10 mL0.2 mol/L氨水和10 mL0.1 mol/L盐酸混合后, 溶液里各种离子物质的量浓度的关系是 ( )
A. c (Cl-) + c (OH-) = c(NH4+) + c (H+)
B. c (Cl-)> c(NH4+)> c (H+) > c (OH-)
C. c(NH4+) > c (Cl--)> c (OH-)> c (H+)
D. c (Cl-)> c (H+) > c (NH4+) > c (OH-)
AC
⑨>③>②>⑥>⑤>④>⑧>⑦>①
练习:
