3.5《归纳与整理-全章知识复习》PPT课件(新人教版-选修4)
文档属性
| 名称 | 3.5《归纳与整理-全章知识复习》PPT课件(新人教版-选修4) |  | |
| 格式 | zip | ||
| 文件大小 | 94.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-05 16:49:38 | ||
图片预览









文档简介
(共59张PPT)
新课标人教版课件系列
《高中化学》
选修4
3.5《归纳与整理-
全章知识复习》
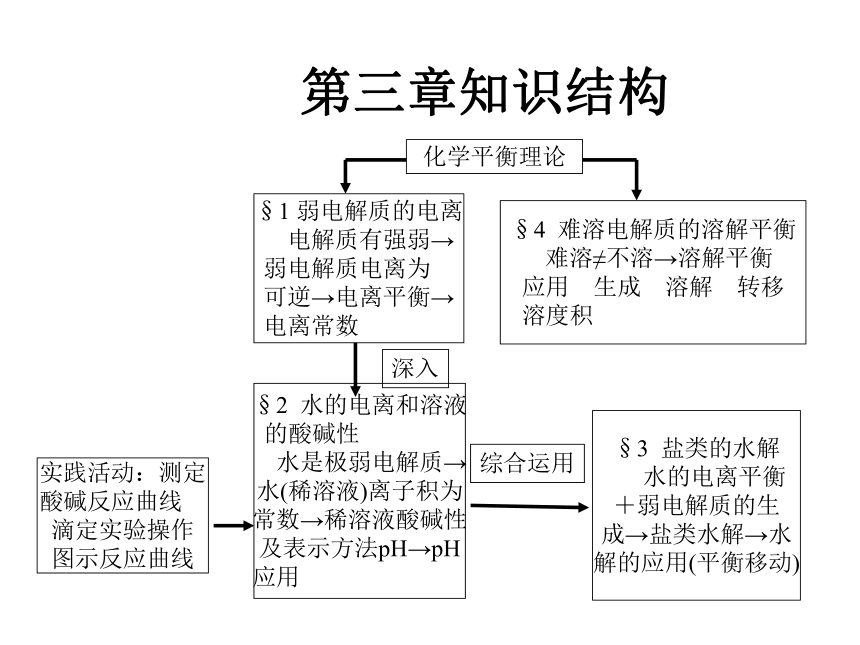
第三章知识结构
化学平衡理论
§1 弱电解质的电离
电解质有强弱→
弱电解质电离为
可逆→电离平衡→
电离常数
§4 难溶电解质的溶解平衡
难溶≠不溶→溶解平衡
应用 生成 溶解 转移
溶度积
§2 水的电离和溶液
的酸碱性
水是极弱电解质→
水(稀溶液)离子积为
常数→稀溶液酸碱性
及表示方法pH→pH
应用
§3 盐类的水解
水的电离平衡
+弱电解质的生
成→盐类水解→水
解的应用(平衡移动)
实践活动:测定
酸碱反应曲线
滴定实验操作
图示反应曲线
深入
综合运用
第三章重要知识点
第一节
1、强弱电解质的概念及其判断。
2、会写常见电解质的电离方程式
如: CH3COOH、H2S、Cu(OH)2
H2CO3、KHCO3、KHSO4、NH3.H2O
3、会分析导电性和强弱电解质的关系。
4、影响电离平衡的因素。
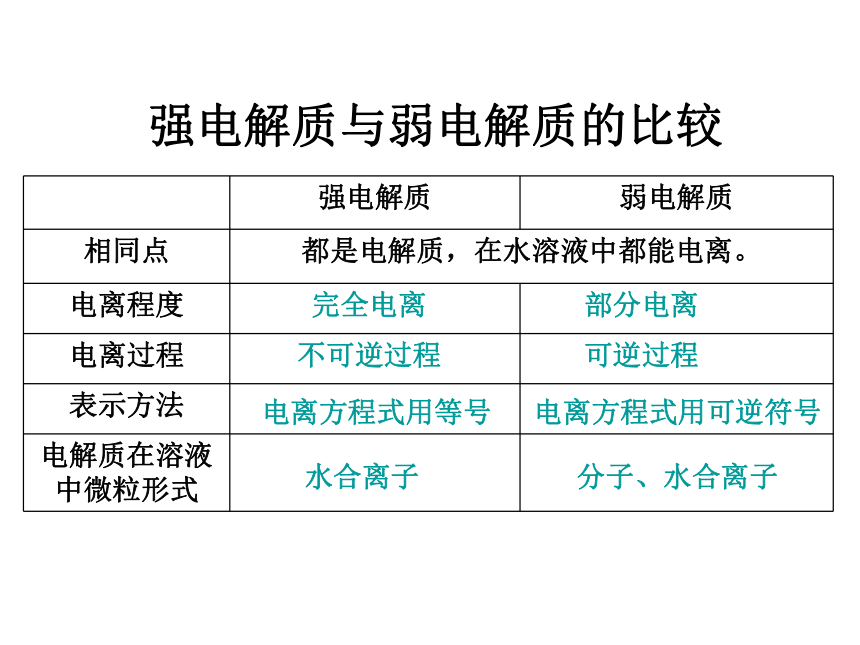
强电解质与弱电解质的比较
强电解质 弱电解质
相同点 都是电解质,在水溶液中都能电离。
电离程度
电离过程
表示方法
电解质在溶液中微粒形式
完全电离
部分电离
不可逆过程
可逆过程
电离方程式用等号
电离方程式用可逆符号
水合离子
分子、水合离子
把0.05molNaOH固体分别加入100mL下列液体中,溶液的导电性变化不大的是( ) A.自来水
B.0.5mol/LNH4Cl溶液
C.0.5mol/L 醋酸
D.0.5mol/L盐酸
BD
课堂练习
导电能力只和离子浓度及所带电荷有关
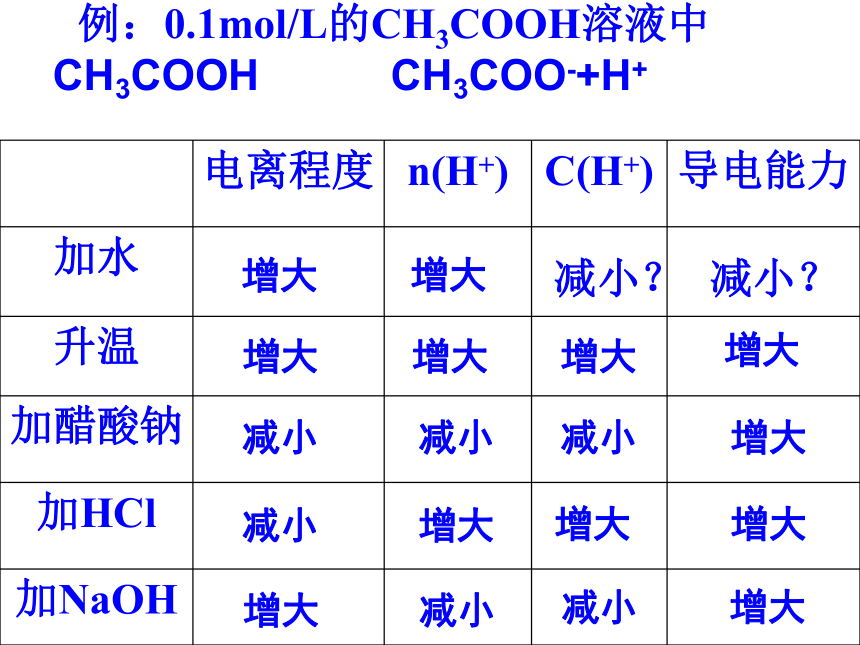
例:0.1mol/L的CH3COOH溶液中 CH3COOH CH3COO-+H+
电离程度 n(H+) C(H+) 导电能力
加水
升温
加醋酸钠
加HCl
加NaOH
增大
增大
增大
增大
增大
增大
增大
增大
增大
增大
增大
增大
减小?
减小?
减小
减小
减小
减小
减小
减小
验证醋酸是弱电解质的两种实验方案
方案一 配制某浓度的醋酸溶液,向其中滴入几滴甲基橙试液,然后再加入少量醋酸钠晶体,振荡。 现 象 溶液由红色逐渐变为橙色。 原 理 醋酸是弱电解质,其水溶液中存在着电离平衡:
CH3COOH == CH3COO-+H+
根据化学平衡移动原理,在醋酸溶液中加入醋酸钠晶体后,溶液中的醋酸根离子浓度增大,醋酸电离平衡向左移动,导致H+浓度减小,因此溶液由红色逐渐变为橙色。 。
方案二 配制某浓度的醋酸钠溶液,向其中加入几滴酚酞试液。 现 象 溶液由无色变为浅红色。 原 理 醋酸钠是强碱弱酸盐,溶于水后要发生水解,其水溶液中存在着水解平衡:CH3COO- + H2O === CH3COOH + OH- 。根据盐类水解理论,醋酸根离子与水电离出的氢离子结合生成弱电解质醋酸,破坏了水的电离平衡,导致氢氧根离子浓度大于氢离子浓度,使溶液显碱性。
下列物质能导电的是______,属于强电解质的是______,属于弱电解质的是________,属于非电解质的是_______.
a.铜丝 b.金刚石 c.石墨 d.NaCl e.盐酸
f.蔗糖 g.CO2 h.Na2O i.硬脂酸 j.醋酸
k.碳酸 l.碳酸氢铵 m.氢氧化铝 n.氯气
o. BaSO4
a.c.e.
d.h.l.o
i.j.k.m.
f.g.
课堂练习一
有浓度相同、体积相等的三种酸:
a、盐酸 b、硫酸 c、醋酸,同时加入足量的锌,则开始反应时速率______,反应完全后生成H2的质量_________。(用<、=、> 表示)
b > a=c
b>a > c
课堂练习二
有H+浓度相同、体积相等的三种酸:
a、盐酸 b、硫酸 c、醋酸,同时加入足量的锌,则开始反应时速率______,反应完全后生成H2的质量_________。(用<、=、> 表示)
a=b=c
a=b课堂练习三
知识扩展
强酸(HA)与弱酸(HB)的区别:
(1)溶液的物质的量浓度相同时,
pH(HA)<pH(HB)
(2)pH值相同时,溶液的浓度CHA<CHB
(3)pH相同时,加水稀释同等倍数后,
pHHA>pHHB
物质的量浓度相同的盐酸、硫酸和醋酸溶液,pH最小的是 ,pH最大的是 ;体积相同时分别与同种NaOH溶液反应,消耗NaOH溶液的体积大小关系为 。
pH相同的盐酸、硫酸和醋酸溶液,物质的量浓度最小的是 ,最大的是 ;体积相同时分别与同种NaOH溶液反应,消耗NaOH溶液的体积大小关系为 。
甲酸和乙酸都是弱酸,当它们的浓度均为0.10mol/L时,甲酸中的c(H+)为乙酸中c(H+)的3倍,欲使两溶液中c(H+)相等,则需将甲酸稀释至原来的 3倍(填“<”、“>”或“=”);试推测丙酸的酸性比乙酸强还是弱 。
一定量的盐酸跟过量的铁粉反应时,为减缓反应速率而不影响生成氢气的总量,可向盐酸中加入适量的 ( )
A.NaOH(固) B.H2O C.NH4Cl(固) D.CH3COONa (固)
BD
课堂练习四
错题再现
7、醋酸的下列性质中,可以证明它是弱电解的是 ( )
A、1mo/L醋酸溶液的PH值约为2
B、醋酸能与水任何比例互溶
C、溶液的导电能力比盐酸弱
D、溶液中存在着醋酸分子
AD
10.在0.01mol/L醋酸中加入少量硫酸后,其变化结果是 ( )
A.氢离子浓度变小
B.醋酸的浓度减小
C.酸性增强,PH变小
D.醋酸根离子浓度变小
错题再现
CD
11.在含有酚酞的0.1 mol·L-1氨水中加入少量的NH4Cl晶体,则溶液颜色
A.变蓝色
B.变深
C.变浅
D.不变
错题再现
C
15.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如左图所示,
⑴O点导电能力为0的理由是
⑵a、b、c三点溶液的c(H+)由小到大的顺序是
⑶a、b、c三点醋酸的电离程度最大的是
⑷要使c点c(Ac— )增大,c(H+)减少,可采取的措施是(至少写出三种方法)
① ②
③ ④ 。
错题再现
导电能力
加水体积
O
a
b
c
如图所示的试管中盛的是较浓的氨水,氨水中因加有酚酞而显浅红色
(1)对试管以热水浴的方式加热,观察试管中的溶液,结果是 (有现象就写明现象的内容,无现象就写明无现象的原因)。
(2)将加热后的试管放入约20℃的水中冷却,试管中的溶液里有明显的现象,它是 。
错题再现
链接高考
(06全国理综11)在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是:
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
B
链接高考
(06全国理综13)由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为:
A.0.15 mol·L-1 B.0.2 mol·L-1
C.0.3 mol·L-1 D.0.4 mol·L-1
第三章重要知识点
第二节
1、水的离子积常数Kw。
2、影响水的电离平衡的因素。
3、有关PH值的简单计算。
4、中和滴定。
课堂练习
试比较pH=3的HAc、pH=4的NH4Cl、pH=11的NaOH、pH=10Na2CO3四种溶液中水的电离程度从大到小的顺序是 。
注意:
①酸性溶液不一定是酸溶液
(可能是 溶液) ;
②pH<7 溶液不一定是酸性溶液
(只有温度为常温才对);
③碱性溶液不一定是碱溶液
(可能是 溶液)。
已知100℃时,水的KW=1×10-12,则该温度下
(1)NaCl的水溶液中[H+]= ,
pH = ,溶液呈 性。
(2)0.005mol/L的稀硫酸的pH= ; 0.01mol/L的NaOH溶液的pH=
课堂练习
用湿润的pH试纸测某稀溶液的pH,所测结果 (填“偏大”、“偏小”、“不变”或“不能确定”),
理由是 。
课堂练习
将pH=1的HCl和pH=10的NaOH溶液等体积混合,所得溶液的pH= ;
将pH=5的H2SO4和pH=12的NaOH溶液等体积混合,所得溶液的pH= ;20mLpH=5的盐酸中加入1滴(0.05mL)0.004mol/LBa(OH)2溶液后pH= 。
课堂练习
pH=3的HCl稀释100倍后溶液的pH变为 ;pH=3的HAc溶液稀释100倍后pH为 ,若使其pH变为5,应稀释的倍数应 (填不等号)100;pH=5的稀硫酸稀释1000倍后溶液中[H+] :[SO42-]= ; pH=10的NaOH溶液稀释100倍后溶液的pH变为 ;pH=10的NaAc溶液稀释10倍后溶液的pH为 。
课堂练习
一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸:①当其物质的量浓度相同时,C(H+)由大到小的顺序是 。
②同体积、同物质的量浓度的三种酸溶液,中和NaOH的能力由大到小的顺序是 ___________________
③当C(H+)相同时,物质的量浓度由大到小的是___
④当C(H+)相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的顺序是_______
⑤当C(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的氢气(相同状况)则开始时反应速率的大小关系是____,反应所需时间的长短关系是_____________
⑥将C(H+)相同的三种酸溶液均加水稀释至体积为原来的10倍后,C(H+)由大到小的顺序为______________
课堂练习
b a c
b a c
c a b
C>b=a
C>b=a
b=a>C
C>b=a
(1)100mLpH=3的H2SO4中加入10mL0.01mol/L氨水后溶液呈 性,原因是
( 2)pH=3的HCl与pH=11的氨水等体积混合后溶液呈 性,原因是 。
中和滴定实验
1)查漏(用自来水)
滴定管是否漏水、旋塞转动是否灵活
2)洗涤
滴定管:先用自来水冲洗→再用蒸馏水清洗2~3次→然后用待装液润洗
锥形瓶:自来水冲洗→蒸馏水清洗2~3次(不能用待盛液润洗)
3)装液[滴定管中加入液体的操作]
量取一定体积未知浓度待测液于锥形瓶操作:向滴定管中装液→挤气泡→调液面→记下起始读数→放液→记录终点读数→滴入指示剂
滴定管中装入标准液→挤气泡→调液面→记下起始读数
4)滴定
右手持锥形瓶颈部,向同一方向作圆周运动,而不是前后振动
. 左手控制活塞(或玻璃球)
滴加速度先快后慢
视线注视锥形瓶中颜色变化
.滴定终点达到后,半分钟颜色不变,再读数
.复滴2~3次
练5:用标准盐酸滴定待测烧碱,下列错误操作将对V(酸)和C(碱)有何影响?(偏大、偏小和无影响)
A、盛标准酸的滴定管尖嘴部分有气泡未排除就开始滴定 ,
B、振荡时液体飞溅出来 ,
C、开始读标准酸时用仰视 ,
D、终点读标准酸时用俯视 ,
E、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 。
偏大
偏小
偏小
偏小
无影响
查漏补缺
猜测必考
必考题型
一、实验题:
1、中和滴定(必考)
课堂练习:下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。
正确的操作顺序是 ( )
A.⑥③①②⑤④ B.⑤①②⑥④③
C.⑤④③②①⑥ D.③①②④⑤⑥
A
课堂练习:某学生用碱式滴定管量取0.1mol·L-1的NaOH溶液,开始时仰视液面读数为1.0mL, 取出部分溶液后,俯视液面,读数为11.0mL,该同学在操作中实际取出的液体体积为 ( )
A.大于10.0mL B.小于10.0mL
C.等于10.0mL D.等于11.0mL
课堂练习:有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是 ( )
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
A
C
课后请看第三章检测26题
第三章测试28题
二、计算题(可能以填空形式出现):
1、有关反应热的计算
第一章检测17、19,第一章测试18
2、有关化学反应速率
第二章检测16、19,第二章测试24
3、有关PH值的计算、有关平衡常数的计算
第三章测试29、30
必考题型
1、已知氢氧化钠和氢氧化钡混合溶液的pH = 14, 现取 100毫升该混合溶液, 缓缓通入CO2, 当通入的 CO2 气体体积为 0.56L时, 生成的沉淀已达最多(设CO2 被完全吸收, 气体的体积均为标准状况下测定, 溶液的体积变化忽略不计), 则:
1)原混合溶液中氢氧化钠和氢氧化钡的物质的量浓度为多少
2)当通入的CO2 总体积为 2.24L时, 溶液中各离子(除H+ 和 OH-且不考虑水解或电离)的物质的量的浓度为多少
(1)c(NaOH)=0.5mol/L c(Ba(OH)2)=0.25mol/L
(2)c(Na+)=0.5mol/L c(Ba2+)=0.25mol/L c(HCO3-)=1mol/L
栟茶中学期中试题
2、在一定温度下,10L密闭容器中加入5molSO2、3molO2,反应达平衡时有3molSO2发生了反应。试填写下列空格:
①生成SO3 mol;
②O2的转化率为 ;
③平衡时容器内气体总物质的量为 mol;
④平衡时体系中SO3的百 分含量(体积分数)为 ;
⑤平衡时s(SO2)= mol/L;c(O2)= mol/L; c(SO3)= mol/L;
⑥若反应前容器内压强为p1,则平衡时容器内的压强为 (用p1表示)
解题关键 三步骤法:明确各小问的意思
3
50%
6.5
46.15%
0.2
0.15
0.3
0.8125P1
参考答案
①3mol ②50% ③6.5mol
④46.15%
⑤c(SO2)=0.2mol/L; c(O2)=0.15mol/L c(SO3)=0.3mol/L; ⑥0.8125P1
栟茶中学期中试题
3、将0.05mol/L盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液滴定pH=3的某一元弱酸溶液20ml,达到终点时消耗NaOH溶液12.6ml,试求:
(1)NaOH溶液的物质的量浓度;
(2)此一元弱酸的物质的量浓度
(3)求此条件下的平衡常数
⑴ C(NaOH)=0.04mol/L ⑵C(弱酸)=0.0252mol/L
(3)K=4×10-5
(1)硫酸:0.05 mol/L,
盐酸: 0.2mol/L
(2) pH=1
4.硫酸和盐酸的混合溶液20ml,加入0.05mol/L的Ba(OH)2溶液时,生成BaSO4沉淀量及溶液pH发生变化如图所示
(1)开始时混合溶液中硫酸与盐酸的物质量浓度各是多少?
(2)在A点溶液的pH是多少?
已知:2H2 ( g ) + O2 ( g ) = 2H2O ( l ) △H = -571.6 kJ/mol
2H2 ( g ) + O2 ( g ) = 2H2O ( g )
△H = -483.6 kJ/mol
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ) △H = -890 kJ/mol
常温下,取甲烷和氢气的混合气体11.2 L(标准状况下)经完全燃烧后恢复到常温,则放出的热量为641.8kJ,试求混合气体中甲烷和氢气体积比。
水的电离平衡曲线如右图所示:
(1)若以A点表示25℃时水
电离平衡时的离子浓度,
B点表示100℃时水的电
离平衡状态,则此时水的
离子积从 增加到 。
(2)将pH=8的Ba(OH)2溶液
与pH=5的盐酸溶液混合,
并保持100℃,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 。
1×10-12
1×10-14
2︰9
25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va三、填空题:
1、等效平衡
2、化学平衡常数
3、影响电离平衡的因素
4、强弱酸的比较:
第三章第二节(2)11题
5、盐类水解的因素
6、离子浓度的比较
必考题型
四、选择题:
1、离子浓度的比较
2、离子共存
3、强弱电解质的比较
4、化学平衡的特征
5、化学平衡图像
6、化学反应速率
7、热化学方程式
8、盖斯定律
必考题型
溶液混合后离子浓度大小的比较
【例6】将0.1mol/L NaOH和0.1mol/LNH4Cl溶液等体积混合后,离子浓度大小正确的顺序是:
A.[Na+]>[Cl-]>[OH-]>[H+]
B.[Cl-]>[Na+]> [OH-]>[H+]
C.[Na+]= [Cl-]>[OH-]>[H+]
D.[Na+]= [Cl-]>[H+]>[OH-]
C
【例5】在常温下10mLpH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(设反应前后体积不变),则对反应后溶液的叙述正确的是
A、[A-] = [K+]
B、[H+] = [OH-]<[K+]<[A-]
C、V总≤20mL
D、V总≥20mL
AC
离子共存判断
在由水电离产生的c(H+)=1×10-14mol/L的溶液中,一定可以大量共存的离子组是
A)NH4+,Al3+,Br-,SO42-
B)Na+,Mg2+,Cl-,NO3-
C)K+,Ba2+,Cl-,NO3-
D)K+,Na+,SO32-,SO42-
C
溶液中微粒浓度的大小比较
1、基本原则:抓住溶液中微粒浓度必须满足的两种守恒关系:
①电荷守恒②物料守恒③质子守恒
2、同浓度的弱酸和其弱酸盐 、同浓度的弱碱和其弱碱盐的电离和水解强弱规律:
①中常化学常见的有三对
等浓度的HAc与NaAc的混合溶液:
弱酸的电离>其对应弱酸盐的水解,溶液呈酸性
等浓度的NH3·H2O与NH4Cl的混合液:
弱碱的电离>其对应弱碱盐的水解,溶液呈碱性
等浓度的HCN与NaCN的混合溶液:
弱酸的电离<其对应弱酸盐的水解,溶液呈碱性
②掌握其处理方法(即抓主要矛盾)
将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是:
A. [NH4+]>[Cl-]> [H+]>[OH-] B.[NH4+]>[Cl-] >[OH-]>[H+]
C.[Cl-] >[NH4+]>[H+] >[OH-] D.[Cl-]>[NH4+]>[OH-]>[H+]
B
一定温度下,向足量的石灰乳中加少量生石灰时,下列有关说法错误的是( )
A、溶液中Ca2+数不变
B、溶液的pH不变
C、溶液的密度不变
D、溶液中[Ca2+]不变
A
一定温度下,向足量Na2CO3饱和溶液中加入1.06g无水碳酸钠,析出Na2CO3·10H2O晶体,下列有关说法正确的是
A、析出晶体质量2.86g;
B、溶液的pH不变
C、溶液中Na+数增加
D、溶液质量减少
BD
一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸:①当其物质的量浓度相同时,C(H+)由大到小的顺序是 。
②同体积、同物质的量浓度的三种酸溶液,中和NaOH的能力由大到小的顺序是 ___________________
③当C(H+)相同时,物质的量浓度由大到小的是___
④当C(H+)相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的顺序是_______
⑤当C(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的氢气(相同状况)则开始时反应速率的大小关系是____,反应所需时间的长短关系是_____________
⑥将C(H+)相同的三种酸溶液均加水稀释至体积为原来的10倍后,C(H+)由大到小的顺序为______________
课堂练习
b a c
b a c
c a b
C>b=a
C>b=a
b=a>C
C>b=a
物质的量浓度相同的盐酸、硫酸和醋酸溶液,pH最小的是 ,pH最大的是 ;体积相同时分别与同种NaOH溶液反应,消耗NaOH溶液的体积大小关系为 。
pH相同的盐酸、硫酸和醋酸溶液,物质的量浓度最小的是 ,最大的是 ;体积相同时分别与同种NaOH溶液反应,消耗NaOH溶液的体积大小关系为 。
甲酸和乙酸都是弱酸,当它们的浓度均为0.10mol/L时,甲酸中的c(H+)为乙酸中c(H+)的3倍,欲使两溶液中c(H+)相等,则需将甲酸稀释至原来的 3倍(填“<”、“>”或“=”);试推测丙酸的酸性比乙酸强还是弱 。
新课标人教版课件系列
《高中化学》
选修4
3.5《归纳与整理-
全章知识复习》
第三章知识结构
化学平衡理论
§1 弱电解质的电离
电解质有强弱→
弱电解质电离为
可逆→电离平衡→
电离常数
§4 难溶电解质的溶解平衡
难溶≠不溶→溶解平衡
应用 生成 溶解 转移
溶度积
§2 水的电离和溶液
的酸碱性
水是极弱电解质→
水(稀溶液)离子积为
常数→稀溶液酸碱性
及表示方法pH→pH
应用
§3 盐类的水解
水的电离平衡
+弱电解质的生
成→盐类水解→水
解的应用(平衡移动)
实践活动:测定
酸碱反应曲线
滴定实验操作
图示反应曲线
深入
综合运用
第三章重要知识点
第一节
1、强弱电解质的概念及其判断。
2、会写常见电解质的电离方程式
如: CH3COOH、H2S、Cu(OH)2
H2CO3、KHCO3、KHSO4、NH3.H2O
3、会分析导电性和强弱电解质的关系。
4、影响电离平衡的因素。
强电解质与弱电解质的比较
强电解质 弱电解质
相同点 都是电解质,在水溶液中都能电离。
电离程度
电离过程
表示方法
电解质在溶液中微粒形式
完全电离
部分电离
不可逆过程
可逆过程
电离方程式用等号
电离方程式用可逆符号
水合离子
分子、水合离子
把0.05molNaOH固体分别加入100mL下列液体中,溶液的导电性变化不大的是( ) A.自来水
B.0.5mol/LNH4Cl溶液
C.0.5mol/L 醋酸
D.0.5mol/L盐酸
BD
课堂练习
导电能力只和离子浓度及所带电荷有关
例:0.1mol/L的CH3COOH溶液中 CH3COOH CH3COO-+H+
电离程度 n(H+) C(H+) 导电能力
加水
升温
加醋酸钠
加HCl
加NaOH
增大
增大
增大
增大
增大
增大
增大
增大
增大
增大
增大
增大
减小?
减小?
减小
减小
减小
减小
减小
减小
验证醋酸是弱电解质的两种实验方案
方案一 配制某浓度的醋酸溶液,向其中滴入几滴甲基橙试液,然后再加入少量醋酸钠晶体,振荡。 现 象 溶液由红色逐渐变为橙色。 原 理 醋酸是弱电解质,其水溶液中存在着电离平衡:
CH3COOH == CH3COO-+H+
根据化学平衡移动原理,在醋酸溶液中加入醋酸钠晶体后,溶液中的醋酸根离子浓度增大,醋酸电离平衡向左移动,导致H+浓度减小,因此溶液由红色逐渐变为橙色。 。
方案二 配制某浓度的醋酸钠溶液,向其中加入几滴酚酞试液。 现 象 溶液由无色变为浅红色。 原 理 醋酸钠是强碱弱酸盐,溶于水后要发生水解,其水溶液中存在着水解平衡:CH3COO- + H2O === CH3COOH + OH- 。根据盐类水解理论,醋酸根离子与水电离出的氢离子结合生成弱电解质醋酸,破坏了水的电离平衡,导致氢氧根离子浓度大于氢离子浓度,使溶液显碱性。
下列物质能导电的是______,属于强电解质的是______,属于弱电解质的是________,属于非电解质的是_______.
a.铜丝 b.金刚石 c.石墨 d.NaCl e.盐酸
f.蔗糖 g.CO2 h.Na2O i.硬脂酸 j.醋酸
k.碳酸 l.碳酸氢铵 m.氢氧化铝 n.氯气
o. BaSO4
a.c.e.
d.h.l.o
i.j.k.m.
f.g.
课堂练习一
有浓度相同、体积相等的三种酸:
a、盐酸 b、硫酸 c、醋酸,同时加入足量的锌,则开始反应时速率______,反应完全后生成H2的质量_________。(用<、=、> 表示)
b > a=c
b>a > c
课堂练习二
有H+浓度相同、体积相等的三种酸:
a、盐酸 b、硫酸 c、醋酸,同时加入足量的锌,则开始反应时速率______,反应完全后生成H2的质量_________。(用<、=、> 表示)
a=b=c
a=b
知识扩展
强酸(HA)与弱酸(HB)的区别:
(1)溶液的物质的量浓度相同时,
pH(HA)<pH(HB)
(2)pH值相同时,溶液的浓度CHA<CHB
(3)pH相同时,加水稀释同等倍数后,
pHHA>pHHB
物质的量浓度相同的盐酸、硫酸和醋酸溶液,pH最小的是 ,pH最大的是 ;体积相同时分别与同种NaOH溶液反应,消耗NaOH溶液的体积大小关系为 。
pH相同的盐酸、硫酸和醋酸溶液,物质的量浓度最小的是 ,最大的是 ;体积相同时分别与同种NaOH溶液反应,消耗NaOH溶液的体积大小关系为 。
甲酸和乙酸都是弱酸,当它们的浓度均为0.10mol/L时,甲酸中的c(H+)为乙酸中c(H+)的3倍,欲使两溶液中c(H+)相等,则需将甲酸稀释至原来的 3倍(填“<”、“>”或“=”);试推测丙酸的酸性比乙酸强还是弱 。
一定量的盐酸跟过量的铁粉反应时,为减缓反应速率而不影响生成氢气的总量,可向盐酸中加入适量的 ( )
A.NaOH(固) B.H2O C.NH4Cl(固) D.CH3COONa (固)
BD
课堂练习四
错题再现
7、醋酸的下列性质中,可以证明它是弱电解的是 ( )
A、1mo/L醋酸溶液的PH值约为2
B、醋酸能与水任何比例互溶
C、溶液的导电能力比盐酸弱
D、溶液中存在着醋酸分子
AD
10.在0.01mol/L醋酸中加入少量硫酸后,其变化结果是 ( )
A.氢离子浓度变小
B.醋酸的浓度减小
C.酸性增强,PH变小
D.醋酸根离子浓度变小
错题再现
CD
11.在含有酚酞的0.1 mol·L-1氨水中加入少量的NH4Cl晶体,则溶液颜色
A.变蓝色
B.变深
C.变浅
D.不变
错题再现
C
15.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如左图所示,
⑴O点导电能力为0的理由是
⑵a、b、c三点溶液的c(H+)由小到大的顺序是
⑶a、b、c三点醋酸的电离程度最大的是
⑷要使c点c(Ac— )增大,c(H+)减少,可采取的措施是(至少写出三种方法)
① ②
③ ④ 。
错题再现
导电能力
加水体积
O
a
b
c
如图所示的试管中盛的是较浓的氨水,氨水中因加有酚酞而显浅红色
(1)对试管以热水浴的方式加热,观察试管中的溶液,结果是 (有现象就写明现象的内容,无现象就写明无现象的原因)。
(2)将加热后的试管放入约20℃的水中冷却,试管中的溶液里有明显的现象,它是 。
错题再现
链接高考
(06全国理综11)在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是:
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
B
链接高考
(06全国理综13)由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为:
A.0.15 mol·L-1 B.0.2 mol·L-1
C.0.3 mol·L-1 D.0.4 mol·L-1
第三章重要知识点
第二节
1、水的离子积常数Kw。
2、影响水的电离平衡的因素。
3、有关PH值的简单计算。
4、中和滴定。
课堂练习
试比较pH=3的HAc、pH=4的NH4Cl、pH=11的NaOH、pH=10Na2CO3四种溶液中水的电离程度从大到小的顺序是 。
注意:
①酸性溶液不一定是酸溶液
(可能是 溶液) ;
②pH<7 溶液不一定是酸性溶液
(只有温度为常温才对);
③碱性溶液不一定是碱溶液
(可能是 溶液)。
已知100℃时,水的KW=1×10-12,则该温度下
(1)NaCl的水溶液中[H+]= ,
pH = ,溶液呈 性。
(2)0.005mol/L的稀硫酸的pH= ; 0.01mol/L的NaOH溶液的pH=
课堂练习
用湿润的pH试纸测某稀溶液的pH,所测结果 (填“偏大”、“偏小”、“不变”或“不能确定”),
理由是 。
课堂练习
将pH=1的HCl和pH=10的NaOH溶液等体积混合,所得溶液的pH= ;
将pH=5的H2SO4和pH=12的NaOH溶液等体积混合,所得溶液的pH= ;20mLpH=5的盐酸中加入1滴(0.05mL)0.004mol/LBa(OH)2溶液后pH= 。
课堂练习
pH=3的HCl稀释100倍后溶液的pH变为 ;pH=3的HAc溶液稀释100倍后pH为 ,若使其pH变为5,应稀释的倍数应 (填不等号)100;pH=5的稀硫酸稀释1000倍后溶液中[H+] :[SO42-]= ; pH=10的NaOH溶液稀释100倍后溶液的pH变为 ;pH=10的NaAc溶液稀释10倍后溶液的pH为 。
课堂练习
一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸:①当其物质的量浓度相同时,C(H+)由大到小的顺序是 。
②同体积、同物质的量浓度的三种酸溶液,中和NaOH的能力由大到小的顺序是 ___________________
③当C(H+)相同时,物质的量浓度由大到小的是___
④当C(H+)相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的顺序是_______
⑤当C(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的氢气(相同状况)则开始时反应速率的大小关系是____,反应所需时间的长短关系是_____________
⑥将C(H+)相同的三种酸溶液均加水稀释至体积为原来的10倍后,C(H+)由大到小的顺序为______________
课堂练习
b a c
b a c
c a b
C>b=a
C>b=a
b=a>C
C>b=a
(1)100mLpH=3的H2SO4中加入10mL0.01mol/L氨水后溶液呈 性,原因是
( 2)pH=3的HCl与pH=11的氨水等体积混合后溶液呈 性,原因是 。
中和滴定实验
1)查漏(用自来水)
滴定管是否漏水、旋塞转动是否灵活
2)洗涤
滴定管:先用自来水冲洗→再用蒸馏水清洗2~3次→然后用待装液润洗
锥形瓶:自来水冲洗→蒸馏水清洗2~3次(不能用待盛液润洗)
3)装液[滴定管中加入液体的操作]
量取一定体积未知浓度待测液于锥形瓶操作:向滴定管中装液→挤气泡→调液面→记下起始读数→放液→记录终点读数→滴入指示剂
滴定管中装入标准液→挤气泡→调液面→记下起始读数
4)滴定
右手持锥形瓶颈部,向同一方向作圆周运动,而不是前后振动
. 左手控制活塞(或玻璃球)
滴加速度先快后慢
视线注视锥形瓶中颜色变化
.滴定终点达到后,半分钟颜色不变,再读数
.复滴2~3次
练5:用标准盐酸滴定待测烧碱,下列错误操作将对V(酸)和C(碱)有何影响?(偏大、偏小和无影响)
A、盛标准酸的滴定管尖嘴部分有气泡未排除就开始滴定 ,
B、振荡时液体飞溅出来 ,
C、开始读标准酸时用仰视 ,
D、终点读标准酸时用俯视 ,
E、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 。
偏大
偏小
偏小
偏小
无影响
查漏补缺
猜测必考
必考题型
一、实验题:
1、中和滴定(必考)
课堂练习:下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。
正确的操作顺序是 ( )
A.⑥③①②⑤④ B.⑤①②⑥④③
C.⑤④③②①⑥ D.③①②④⑤⑥
A
课堂练习:某学生用碱式滴定管量取0.1mol·L-1的NaOH溶液,开始时仰视液面读数为1.0mL, 取出部分溶液后,俯视液面,读数为11.0mL,该同学在操作中实际取出的液体体积为 ( )
A.大于10.0mL B.小于10.0mL
C.等于10.0mL D.等于11.0mL
课堂练习:有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是 ( )
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
A
C
课后请看第三章检测26题
第三章测试28题
二、计算题(可能以填空形式出现):
1、有关反应热的计算
第一章检测17、19,第一章测试18
2、有关化学反应速率
第二章检测16、19,第二章测试24
3、有关PH值的计算、有关平衡常数的计算
第三章测试29、30
必考题型
1、已知氢氧化钠和氢氧化钡混合溶液的pH = 14, 现取 100毫升该混合溶液, 缓缓通入CO2, 当通入的 CO2 气体体积为 0.56L时, 生成的沉淀已达最多(设CO2 被完全吸收, 气体的体积均为标准状况下测定, 溶液的体积变化忽略不计), 则:
1)原混合溶液中氢氧化钠和氢氧化钡的物质的量浓度为多少
2)当通入的CO2 总体积为 2.24L时, 溶液中各离子(除H+ 和 OH-且不考虑水解或电离)的物质的量的浓度为多少
(1)c(NaOH)=0.5mol/L c(Ba(OH)2)=0.25mol/L
(2)c(Na+)=0.5mol/L c(Ba2+)=0.25mol/L c(HCO3-)=1mol/L
栟茶中学期中试题
2、在一定温度下,10L密闭容器中加入5molSO2、3molO2,反应达平衡时有3molSO2发生了反应。试填写下列空格:
①生成SO3 mol;
②O2的转化率为 ;
③平衡时容器内气体总物质的量为 mol;
④平衡时体系中SO3的百 分含量(体积分数)为 ;
⑤平衡时s(SO2)= mol/L;c(O2)= mol/L; c(SO3)= mol/L;
⑥若反应前容器内压强为p1,则平衡时容器内的压强为 (用p1表示)
解题关键 三步骤法:明确各小问的意思
3
50%
6.5
46.15%
0.2
0.15
0.3
0.8125P1
参考答案
①3mol ②50% ③6.5mol
④46.15%
⑤c(SO2)=0.2mol/L; c(O2)=0.15mol/L c(SO3)=0.3mol/L; ⑥0.8125P1
栟茶中学期中试题
3、将0.05mol/L盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液滴定pH=3的某一元弱酸溶液20ml,达到终点时消耗NaOH溶液12.6ml,试求:
(1)NaOH溶液的物质的量浓度;
(2)此一元弱酸的物质的量浓度
(3)求此条件下的平衡常数
⑴ C(NaOH)=0.04mol/L ⑵C(弱酸)=0.0252mol/L
(3)K=4×10-5
(1)硫酸:0.05 mol/L,
盐酸: 0.2mol/L
(2) pH=1
4.硫酸和盐酸的混合溶液20ml,加入0.05mol/L的Ba(OH)2溶液时,生成BaSO4沉淀量及溶液pH发生变化如图所示
(1)开始时混合溶液中硫酸与盐酸的物质量浓度各是多少?
(2)在A点溶液的pH是多少?
已知:2H2 ( g ) + O2 ( g ) = 2H2O ( l ) △H = -571.6 kJ/mol
2H2 ( g ) + O2 ( g ) = 2H2O ( g )
△H = -483.6 kJ/mol
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ) △H = -890 kJ/mol
常温下,取甲烷和氢气的混合气体11.2 L(标准状况下)经完全燃烧后恢复到常温,则放出的热量为641.8kJ,试求混合气体中甲烷和氢气体积比。
水的电离平衡曲线如右图所示:
(1)若以A点表示25℃时水
电离平衡时的离子浓度,
B点表示100℃时水的电
离平衡状态,则此时水的
离子积从 增加到 。
(2)将pH=8的Ba(OH)2溶液
与pH=5的盐酸溶液混合,
并保持100℃,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 。
1×10-12
1×10-14
2︰9
25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va
1、等效平衡
2、化学平衡常数
3、影响电离平衡的因素
4、强弱酸的比较:
第三章第二节(2)11题
5、盐类水解的因素
6、离子浓度的比较
必考题型
四、选择题:
1、离子浓度的比较
2、离子共存
3、强弱电解质的比较
4、化学平衡的特征
5、化学平衡图像
6、化学反应速率
7、热化学方程式
8、盖斯定律
必考题型
溶液混合后离子浓度大小的比较
【例6】将0.1mol/L NaOH和0.1mol/LNH4Cl溶液等体积混合后,离子浓度大小正确的顺序是:
A.[Na+]>[Cl-]>[OH-]>[H+]
B.[Cl-]>[Na+]> [OH-]>[H+]
C.[Na+]= [Cl-]>[OH-]>[H+]
D.[Na+]= [Cl-]>[H+]>[OH-]
C
【例5】在常温下10mLpH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(设反应前后体积不变),则对反应后溶液的叙述正确的是
A、[A-] = [K+]
B、[H+] = [OH-]<[K+]<[A-]
C、V总≤20mL
D、V总≥20mL
AC
离子共存判断
在由水电离产生的c(H+)=1×10-14mol/L的溶液中,一定可以大量共存的离子组是
A)NH4+,Al3+,Br-,SO42-
B)Na+,Mg2+,Cl-,NO3-
C)K+,Ba2+,Cl-,NO3-
D)K+,Na+,SO32-,SO42-
C
溶液中微粒浓度的大小比较
1、基本原则:抓住溶液中微粒浓度必须满足的两种守恒关系:
①电荷守恒②物料守恒③质子守恒
2、同浓度的弱酸和其弱酸盐 、同浓度的弱碱和其弱碱盐的电离和水解强弱规律:
①中常化学常见的有三对
等浓度的HAc与NaAc的混合溶液:
弱酸的电离>其对应弱酸盐的水解,溶液呈酸性
等浓度的NH3·H2O与NH4Cl的混合液:
弱碱的电离>其对应弱碱盐的水解,溶液呈碱性
等浓度的HCN与NaCN的混合溶液:
弱酸的电离<其对应弱酸盐的水解,溶液呈碱性
②掌握其处理方法(即抓主要矛盾)
将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是:
A. [NH4+]>[Cl-]> [H+]>[OH-] B.[NH4+]>[Cl-] >[OH-]>[H+]
C.[Cl-] >[NH4+]>[H+] >[OH-] D.[Cl-]>[NH4+]>[OH-]>[H+]
B
一定温度下,向足量的石灰乳中加少量生石灰时,下列有关说法错误的是( )
A、溶液中Ca2+数不变
B、溶液的pH不变
C、溶液的密度不变
D、溶液中[Ca2+]不变
A
一定温度下,向足量Na2CO3饱和溶液中加入1.06g无水碳酸钠,析出Na2CO3·10H2O晶体,下列有关说法正确的是
A、析出晶体质量2.86g;
B、溶液的pH不变
C、溶液中Na+数增加
D、溶液质量减少
BD
一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸:①当其物质的量浓度相同时,C(H+)由大到小的顺序是 。
②同体积、同物质的量浓度的三种酸溶液,中和NaOH的能力由大到小的顺序是 ___________________
③当C(H+)相同时,物质的量浓度由大到小的是___
④当C(H+)相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的顺序是_______
⑤当C(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的氢气(相同状况)则开始时反应速率的大小关系是____,反应所需时间的长短关系是_____________
⑥将C(H+)相同的三种酸溶液均加水稀释至体积为原来的10倍后,C(H+)由大到小的顺序为______________
课堂练习
b a c
b a c
c a b
C>b=a
C>b=a
b=a>C
C>b=a
物质的量浓度相同的盐酸、硫酸和醋酸溶液,pH最小的是 ,pH最大的是 ;体积相同时分别与同种NaOH溶液反应,消耗NaOH溶液的体积大小关系为 。
pH相同的盐酸、硫酸和醋酸溶液,物质的量浓度最小的是 ,最大的是 ;体积相同时分别与同种NaOH溶液反应,消耗NaOH溶液的体积大小关系为 。
甲酸和乙酸都是弱酸,当它们的浓度均为0.10mol/L时,甲酸中的c(H+)为乙酸中c(H+)的3倍,欲使两溶液中c(H+)相等,则需将甲酸稀释至原来的 3倍(填“<”、“>”或“=”);试推测丙酸的酸性比乙酸强还是弱 。
