4.5《归纳与整理-全章知识复习》PPT课件(新人教版-选修4)
文档属性
| 名称 | 4.5《归纳与整理-全章知识复习》PPT课件(新人教版-选修4) |

|
|
| 格式 | zip | ||
| 文件大小 | 180.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-05 00:00:00 | ||
图片预览




文档简介
(共26张PPT)
新课标人教版课件系列
《高中化学》
选修4
4.5《归纳与整理-
全章知识复习》
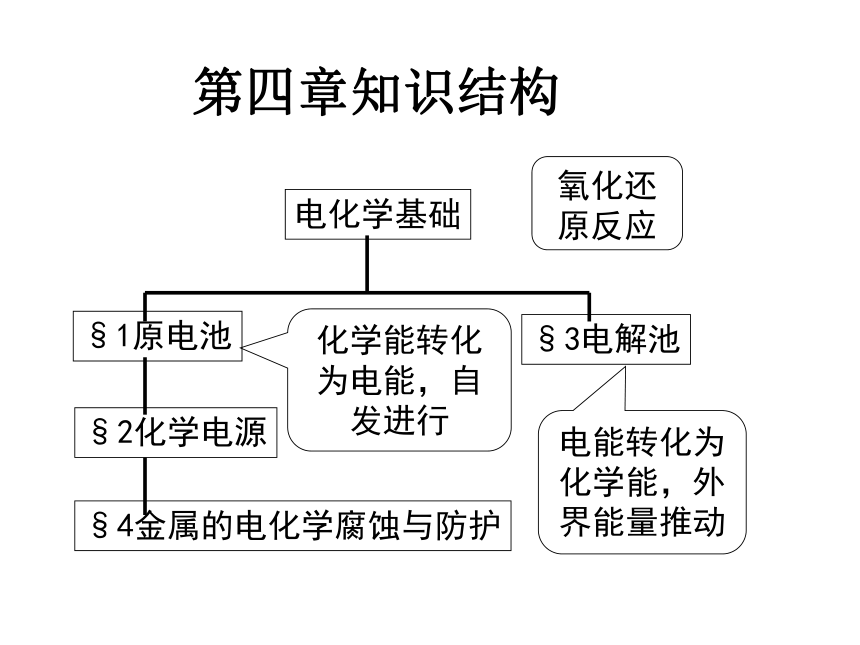
§1原电池
§2化学电源
§4金属的电化学腐蚀与防护
电化学基础
§3电解池
氧化还原反应
化学能转化为电能,自发进行
电能转化为化学能,外界能量推动
第四章知识结构
1、池型的判断
有外加电源一定为电解池,无外加电源一定为原电池;多池组合时,一般含活泼金属的池为原电池,其余都是在原电池带动下的电解池。
一、原电池与电解池的比较及判断:
3、电解池放电顺序的判断
阳极放电: 1)惰性电极:则溶液中阴离子放电。
2)非惰性电极:电极材料首先失电子。
阴极放电:电极材料受保护,溶液中阳离子放电。
2、电极的判断
原电池,看电极材料,电解池看电源的正负极。
4、判断溶液的pH变化:
先分析原溶液的酸碱性,再看电极产物。
(1)如果只产生氢气而没有氧气,只pH变大;
(2)如果只产生氧气而没有氢气,只pH变小;
(3)如果既产生氢气又产生氧气
①若原溶液呈酸性则pH减小;
②若原溶液呈碱性pH增大;
③若原溶液呈中性pH不变。
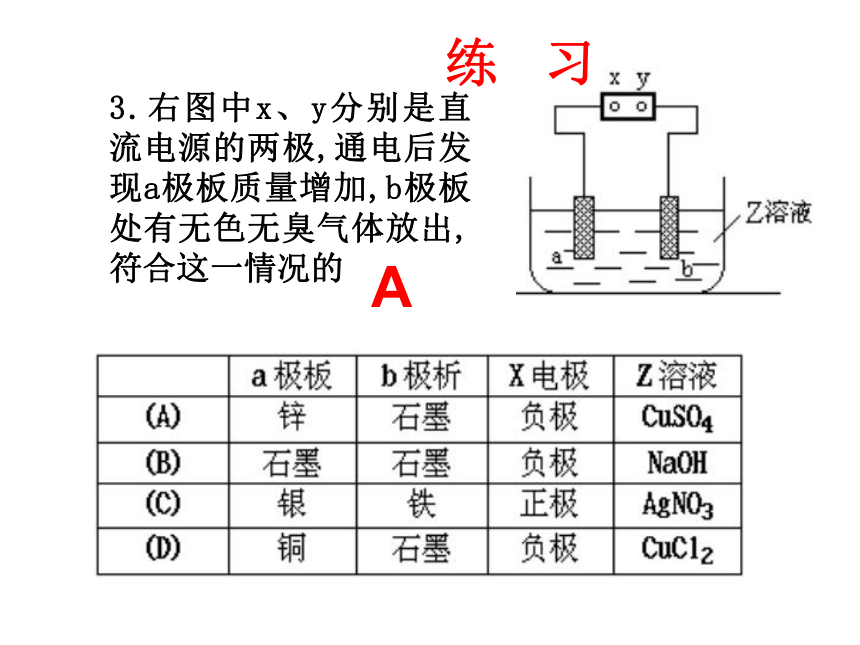
3.右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的
A
练 习
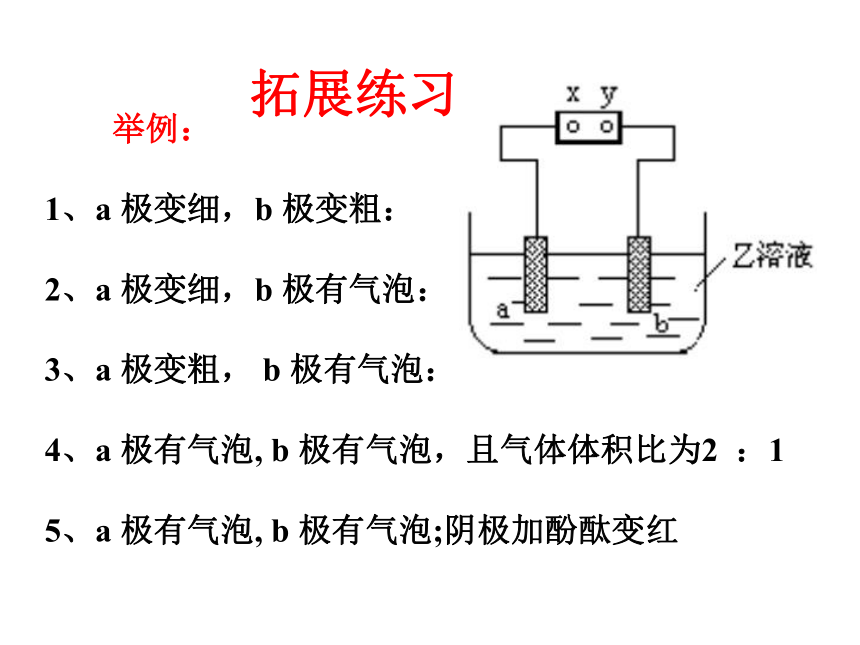
举例:
1、a 极变细,b 极变粗:
2、a 极变细,b 极有气泡:
3、a 极变粗, b 极有气泡:
4、a 极有气泡, b 极有气泡,且气体体积比为2 :1
5、a 极有气泡, b 极有气泡;阴极加酚酞变红
拓展练习
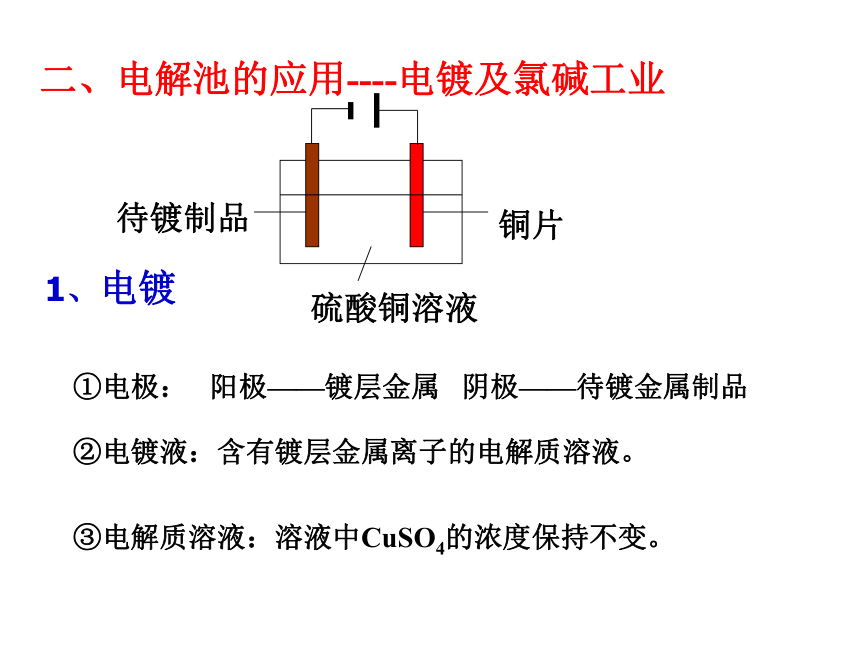
①电极: 阳极——镀层金属 阴极——待镀金属制品
二、电解池的应用----电镀及氯碱工业
待镀制品
铜片
硫酸铜溶液
②电镀液:含有镀层金属离子的电解质溶液。
③电解质溶液:溶液中CuSO4的浓度保持不变。
1、电镀
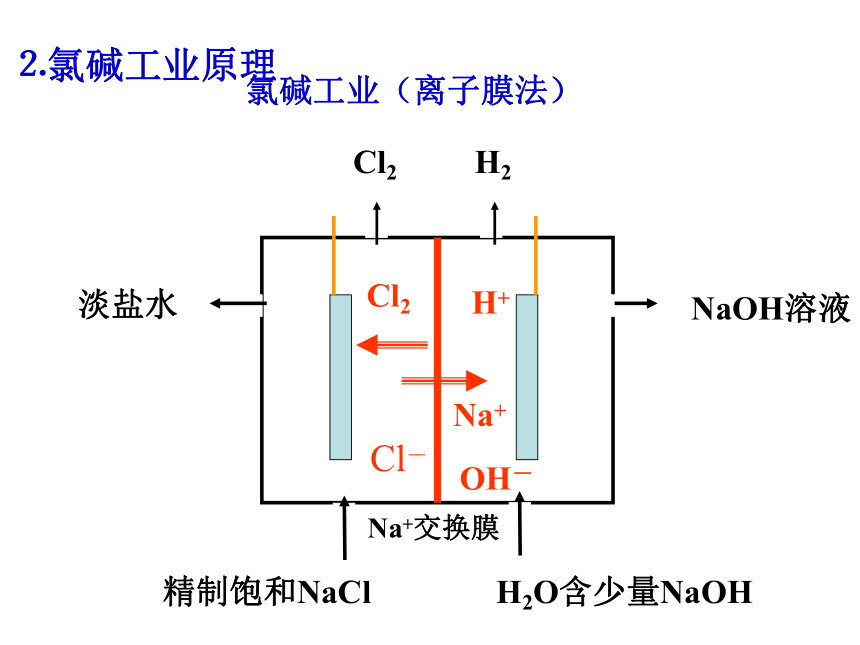
⒉氯碱工业原理
氯碱工业(离子膜法)
+
-
精制饱和NaCl
淡盐水
Cl2
H2
NaOH溶液
H2O含少量NaOH
Cl-
Cl2
H+
OH-
Na+
Na+交换膜
4、下列图一、图二是铁钉在水中被腐蚀的实验
数天后
数天后
图一
图二
(1)上述两装置中铁钉发生变化的共性是:
(2)图一说明原溶液呈 性,铁钉发生 腐蚀,
电极反应为:
(3)图二说明原溶液呈 性,铁钉发生 腐蚀,
电极反应为:
发生了原电池 反应
中性或弱碱
吸氧
负极:Fe -2e = Fe2+ ; 正极:2H2O +O2 +2e =4OH-
负极:Fe -2e = Fe2+ ;正极:2H+ +2e = H2↑
较强酸性
析氢
练 习
三、电解池及原电池的应用----金属的防护
1)金属腐蚀快慢的判断
①电解原理引起的腐蚀>原电池原理引起的腐蚀> 化学腐蚀> 有防腐蚀措施的腐蚀
②同一种金属的腐蚀:
强电解质>弱电解质>非电解质
2)金属的防护方法
①改变金属内部结构
②覆盖保护层
③电化学保护法
外加电源的阴极保护法
牺牲负极的正极保护法
5.下列装置暴露空气中一段时间,铁的腐蚀由快到慢
顺序 .
Fe
Fe
C
Fe
Zn
Fe
Zn
Fe
Sn
A(海水)
B(海水)
C(海水)
D(海水)
Fe
Sn
F(天然水)
E(海水)
D
E
F
A
C
B
拓展练习
6、汽车上用的铅蓄电池是以一组充满海绵状灰铅的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。总
反应式为:Pb+PbO2+2H2SO4 2PbSO4+2H2O
(1)试写出放电时的正、负极反应式
正极:______________________________________
负极:______________________________________
(2)试写出充电时的阳、阴极反应式
阳极:______________________________________
阴极:______________________________________
PbO2+4H++SO42- +2e- =PbSO4+2H2O
Pb+ SO42--2e- =PbSO4
练 习
PbSO4+2H2O-2e- =PbO2 + 4H++SO42-
PbSO4 +2e- =Pb + SO42-
小结:四、原电池电解池的应用----可充电电池
阴极:
正极:
还原反应极
→
得电子极→
电子流入极
放电:原电池
充电:电解池
负极:
阳极:
氧化反应极
→
电子流出极
失电子极
→
氧化反应极
失电子极→
电子流出极
→
还原反应极
得电子极
电子流入极
→
此电池放电时,负极发生反应的物质为
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
充电
放电
2Ag + Zn(OH)2
Ag2O + Zn + H2O
7.银锌电池广泛用于电子仪器的电源,它的充电和放电过程可表示为:
D
拓展练习
1.如上图所示,通电后A极上析出Ag,对该装置的有关叙述正确的是
A、P是电源的正极
B、F极上发生的反应为:4OH- - 4e-=2H2O+O2↑
C、电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参加了反应
D、通电后,甲池的PH减小,而乙、丙两池溶液的PH不变
B
巩
固
练
习
2.如图为一种钮扣微型电池,其电极分别为Ag2O和Zn电解质溶液是KOH溶液,俗称银锌电池,该电池的电极反应式为:Zn +Ag2O== ZnO+2Ag根据以上提供的资料,判断下列说法正确的是
A、锌为负极,Ag2O为 正极;
B、放电时正极附近溶液的PH值升高;
C、放电时负极附近溶液的PH值升高;
D、溶液中阴离子向正极方向移动,阳离子向负极方向移动。
AB
巩固练习
10.为下图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的PH值逐渐减小
D.CuSO4溶液的PH值不变
a
X Y
b
Pt
Cu
CuSO4溶液
NaCl和酚酞溶液
AC
练 习
11、下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
A.a电极是负极
B.b电极的电极反应为:4OH—-4e →2H2O+O2
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种只能将氧化剂和燃料全部储藏在电池内的发电装置
BD
12.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH==4K2CO3+10H2O,有关此电池的推断正确的是
A.负极反应为14H2O+7O2+28e-==28OH-
B.放电一段时间后,负极周围的pH减低
C.每消耗1molC2H6,则电路上转移的电子为14mol
D.放电过程中KOH的物质的量浓度不变
B C
练 习
Fe
Cu
氯化铜溶液
氯化铜溶液
Cu
C
氯化铜溶液
Cu
C
13、写出下列装置的极反应,并标明氧化反应、还原反应
A
B
D
C
Fe
Cu
氯化钠溶液
练 习
( A )
(B)
(C)
(D)
CuSO4
AgNO3
AgNO3
NaHSO4
Ag
Cu
Cu
C
Pt
Pt
Ag
Fe
14、写出下列装置的极反应,并判断A、B、C溶液PH值的变化。
练 习
难溶于水的电解质溶于某些盐溶液
如:Mg(OH)2溶于NH4Cl溶液
思考与交流
用平衡移动的原理分析Mg(OH)2溶于盐酸和NH4Cl溶液的原因
解释
在溶液中存在Mg(OH)2的溶解平衡:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
加入盐酸时,H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解
加入NH4Cl时,NH4+水解,产生的H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解
估题1
根据下式所表示的氧化还原反应设计一个原电池并画图:
Fe + 2 Fe3+ = 3Fe2+
要求:(1)用烧杯装液体和用盐桥连接。
(2)注明原电池的正极和负极并在外电路
用箭头标明电子的流向。
(3)写出两个电极上的电极反应式 :
正极:_________________________
负极:_________________________
_Fe3++e-=Fe2+_
_Fe-2e-=Fe2+_
新课标人教版课件系列
《高中化学》
选修4
4.5《归纳与整理-
全章知识复习》
§1原电池
§2化学电源
§4金属的电化学腐蚀与防护
电化学基础
§3电解池
氧化还原反应
化学能转化为电能,自发进行
电能转化为化学能,外界能量推动
第四章知识结构
1、池型的判断
有外加电源一定为电解池,无外加电源一定为原电池;多池组合时,一般含活泼金属的池为原电池,其余都是在原电池带动下的电解池。
一、原电池与电解池的比较及判断:
3、电解池放电顺序的判断
阳极放电: 1)惰性电极:则溶液中阴离子放电。
2)非惰性电极:电极材料首先失电子。
阴极放电:电极材料受保护,溶液中阳离子放电。
2、电极的判断
原电池,看电极材料,电解池看电源的正负极。
4、判断溶液的pH变化:
先分析原溶液的酸碱性,再看电极产物。
(1)如果只产生氢气而没有氧气,只pH变大;
(2)如果只产生氧气而没有氢气,只pH变小;
(3)如果既产生氢气又产生氧气
①若原溶液呈酸性则pH减小;
②若原溶液呈碱性pH增大;
③若原溶液呈中性pH不变。
3.右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的
A
练 习
举例:
1、a 极变细,b 极变粗:
2、a 极变细,b 极有气泡:
3、a 极变粗, b 极有气泡:
4、a 极有气泡, b 极有气泡,且气体体积比为2 :1
5、a 极有气泡, b 极有气泡;阴极加酚酞变红
拓展练习
①电极: 阳极——镀层金属 阴极——待镀金属制品
二、电解池的应用----电镀及氯碱工业
待镀制品
铜片
硫酸铜溶液
②电镀液:含有镀层金属离子的电解质溶液。
③电解质溶液:溶液中CuSO4的浓度保持不变。
1、电镀
⒉氯碱工业原理
氯碱工业(离子膜法)
+
-
精制饱和NaCl
淡盐水
Cl2
H2
NaOH溶液
H2O含少量NaOH
Cl-
Cl2
H+
OH-
Na+
Na+交换膜
4、下列图一、图二是铁钉在水中被腐蚀的实验
数天后
数天后
图一
图二
(1)上述两装置中铁钉发生变化的共性是:
(2)图一说明原溶液呈 性,铁钉发生 腐蚀,
电极反应为:
(3)图二说明原溶液呈 性,铁钉发生 腐蚀,
电极反应为:
发生了原电池 反应
中性或弱碱
吸氧
负极:Fe -2e = Fe2+ ; 正极:2H2O +O2 +2e =4OH-
负极:Fe -2e = Fe2+ ;正极:2H+ +2e = H2↑
较强酸性
析氢
练 习
三、电解池及原电池的应用----金属的防护
1)金属腐蚀快慢的判断
①电解原理引起的腐蚀>原电池原理引起的腐蚀> 化学腐蚀> 有防腐蚀措施的腐蚀
②同一种金属的腐蚀:
强电解质>弱电解质>非电解质
2)金属的防护方法
①改变金属内部结构
②覆盖保护层
③电化学保护法
外加电源的阴极保护法
牺牲负极的正极保护法
5.下列装置暴露空气中一段时间,铁的腐蚀由快到慢
顺序 .
Fe
Fe
C
Fe
Zn
Fe
Zn
Fe
Sn
A(海水)
B(海水)
C(海水)
D(海水)
Fe
Sn
F(天然水)
E(海水)
D
E
F
A
C
B
拓展练习
6、汽车上用的铅蓄电池是以一组充满海绵状灰铅的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。总
反应式为:Pb+PbO2+2H2SO4 2PbSO4+2H2O
(1)试写出放电时的正、负极反应式
正极:______________________________________
负极:______________________________________
(2)试写出充电时的阳、阴极反应式
阳极:______________________________________
阴极:______________________________________
PbO2+4H++SO42- +2e- =PbSO4+2H2O
Pb+ SO42--2e- =PbSO4
练 习
PbSO4+2H2O-2e- =PbO2 + 4H++SO42-
PbSO4 +2e- =Pb + SO42-
小结:四、原电池电解池的应用----可充电电池
阴极:
正极:
还原反应极
→
得电子极→
电子流入极
放电:原电池
充电:电解池
负极:
阳极:
氧化反应极
→
电子流出极
失电子极
→
氧化反应极
失电子极→
电子流出极
→
还原反应极
得电子极
电子流入极
→
此电池放电时,负极发生反应的物质为
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
充电
放电
2Ag + Zn(OH)2
Ag2O + Zn + H2O
7.银锌电池广泛用于电子仪器的电源,它的充电和放电过程可表示为:
D
拓展练习
1.如上图所示,通电后A极上析出Ag,对该装置的有关叙述正确的是
A、P是电源的正极
B、F极上发生的反应为:4OH- - 4e-=2H2O+O2↑
C、电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参加了反应
D、通电后,甲池的PH减小,而乙、丙两池溶液的PH不变
B
巩
固
练
习
2.如图为一种钮扣微型电池,其电极分别为Ag2O和Zn电解质溶液是KOH溶液,俗称银锌电池,该电池的电极反应式为:Zn +Ag2O== ZnO+2Ag根据以上提供的资料,判断下列说法正确的是
A、锌为负极,Ag2O为 正极;
B、放电时正极附近溶液的PH值升高;
C、放电时负极附近溶液的PH值升高;
D、溶液中阴离子向正极方向移动,阳离子向负极方向移动。
AB
巩固练习
10.为下图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的PH值逐渐减小
D.CuSO4溶液的PH值不变
a
X Y
b
Pt
Cu
CuSO4溶液
NaCl和酚酞溶液
AC
练 习
11、下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
A.a电极是负极
B.b电极的电极反应为:4OH—-4e →2H2O+O2
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种只能将氧化剂和燃料全部储藏在电池内的发电装置
BD
12.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH==4K2CO3+10H2O,有关此电池的推断正确的是
A.负极反应为14H2O+7O2+28e-==28OH-
B.放电一段时间后,负极周围的pH减低
C.每消耗1molC2H6,则电路上转移的电子为14mol
D.放电过程中KOH的物质的量浓度不变
B C
练 习
Fe
Cu
氯化铜溶液
氯化铜溶液
Cu
C
氯化铜溶液
Cu
C
13、写出下列装置的极反应,并标明氧化反应、还原反应
A
B
D
C
Fe
Cu
氯化钠溶液
练 习
( A )
(B)
(C)
(D)
CuSO4
AgNO3
AgNO3
NaHSO4
Ag
Cu
Cu
C
Pt
Pt
Ag
Fe
14、写出下列装置的极反应,并判断A、B、C溶液PH值的变化。
练 习
难溶于水的电解质溶于某些盐溶液
如:Mg(OH)2溶于NH4Cl溶液
思考与交流
用平衡移动的原理分析Mg(OH)2溶于盐酸和NH4Cl溶液的原因
解释
在溶液中存在Mg(OH)2的溶解平衡:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
加入盐酸时,H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解
加入NH4Cl时,NH4+水解,产生的H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解
估题1
根据下式所表示的氧化还原反应设计一个原电池并画图:
Fe + 2 Fe3+ = 3Fe2+
要求:(1)用烧杯装液体和用盐桥连接。
(2)注明原电池的正极和负极并在外电路
用箭头标明电子的流向。
(3)写出两个电极上的电极反应式 :
正极:_________________________
负极:_________________________
_Fe3++e-=Fe2+_
_Fe-2e-=Fe2+_
