第二单元第三节原子的构成习题精练-普通用卷(含解析)
文档属性
| 名称 | 第二单元第三节原子的构成习题精练-普通用卷(含解析) |
|
|
| 格式 | zip | ||
| 文件大小 | 336.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-19 09:37:26 | ||
图片预览




文档简介
第二单元第三节原子的构成习题精练
一、单选题
氚也是一种氢原子,氚原子含有1个质子和2个中子,如图示意图下列能正确表示氚原子结构的是
A.
B.
C.
D.
下列关于四种粒子的结构示意图说法正确的是
A.
、的化学性质相似
B.
所示的粒子符号为Na
C.
在化学反应中易失去电子
D.
中x可能为8
如图为小明制作的原子结构模型,外圈上的小球为电子,内圈为原子核,下列说法正确的是?
?
A.
该模型表示一种碳原子
B.
该原子的核电荷数为4
C.
该原子的相对原子质量为2
D.
该原子的原子核由2个质子和2个中子构成
钛被称为“航空金属”,国产C919大飞机的钛合金用量高达。已知一种钛原子核内有22个质子和26个中子,该原子的相对原子质量为?
?
A.
22
B.
26
C.
48
D.
4
人类探月的重要目的之一是勘察、获取地球上蕴藏量有限而月球上却极为丰富的核聚变燃料“”核电荷数为,以解决地球能源危机。已知“”是指原子核内含有6个质子和7个中子的碳原子,则“”所指的氦原子核内?
?
A.
含有3个质子,没有中子
B.
含有2个质子,1个中子
C.
含有1个质子,2个中子
D.
含有3个中子,没有质子
下列说法正确的是?
?
A.
分子是化学变化中的最小粒子
B.
原子核是由质子和电子构成
C.
NaCl由NaCl分子构成
D.
水蒸发过程中,水分子间的间隔变大
下面微粒结构示意图中属于阴离子的是?
?
A.
B.
C.
D.
根据下列各组原子结构示意图判断,其中化学性质相似的一组是?
?
A.
B.
C.
D.
如图为甲、乙两种粒子的结构示意图,下列关于这两种粒子的说法中,正确的是?
?
A.
粒子甲不显电性,粒子乙带正电荷
B.
甲、乙两种粒子是同一种原子形成的
C.
甲、乙两种粒子的化学性质均比较稳定
D.
粒子甲是阴离子,粒子乙是原子
质子数与中子数都是6的碳原子,其质量为ag,某元素的原子质量为bg,则该元素的相对原子质量为
A.
B.
C.
D.
作为相对原子质量标准的碳12原子的实际质量为,则实际质量为2mkg的一种原子的相对原子质量是
A.
24
B.
24g
C.
2
D.
2g
事物的宏观表象是由其微观性质决定的。下列事实及对这些事实的解释中,二者不相符的是
A.
成熟的菠萝会散发出浓浓的香味,说明分子在不断地运动
B.
水沸腾时能掀开壶盖,说明分子的大小随温度升高而增大
C.
50mL水和50mL酒精混合后总体积小于100mL,说明分子间有间隔
D.
湿衣服晾在太阳晒着的地方干得快,说明分子的运动速率与温度有关
炎热的夏天,路面会拱起开裂,小明通过查阅资料得知:这是由于受热膨胀引起的。物质具有热胀冷缩现象的主要原因是
A.
微粒的性质发生了改变
B.
微粒的大小发生了改变
C.
微粒的质量发生了改变
D.
微粒间的间隔发生了改变
下列有关分子、原子和离子的说法正确的是?
?
A.
分子是保持物质性质的一种粒子
B.
物体有热胀冷缩现象,主要是因为物体中的粒子大小随温度的改变而改变
C.
分子、原子、离子都可以直接构成物质
D.
在化学反应中,分子和原子都不能再分
二、填空题
如图中A、B、C、D是四种粒子的结构示意图,请回答下列问题。
中??????粒子的符号是??????。
由B粒子的结构示意图可知,B粒子的名称是??????。
以上四种结构示意图所表示的粒子中,表示离子的是??????填序号。
某原子的结构示意图为,该原子的核电荷数为??????,质子数为??????,核外有??????个电子层,第二层上有??????个电子,最外层上有??????个电子,在化学反应中该原子容易??????电子,形成相对稳定结构。从分类上看,该原子属于??????原子。
如图是氢气在氯气中燃烧生成氯化氢的微观模拟图,请回答下列问题。
在图乙中将相关微粒图形补充完整。
此变化前后发生改变的微粒是________。
从微观角度解释此反应为化合反应的原因是________。
请用“分子”“原子”和“离子”填空。
水由??????????构成,稀有气体由??????????构成,氯化钠由??????????构成。
三、实验题
在学习“运动的水分子”时,两位同学做了这样的实验:向盛有热水的小烧杯中加入少量品红后,静置,观察。请回答:
两位同学观察到的实验现象是?
?
?
?
?
?
?
?
?
?
?
?
?
?。
甲、乙两位同学分别画出如图所示的示意图,表示实验开始片刻后,品红分子在水中的分布水分子没有画出,根据你在实验中观察到的现象,判断?
?
?
?
?
??填“甲”或“乙”的示意图符合事实。
通过该实验,能得到的结论是?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
??。
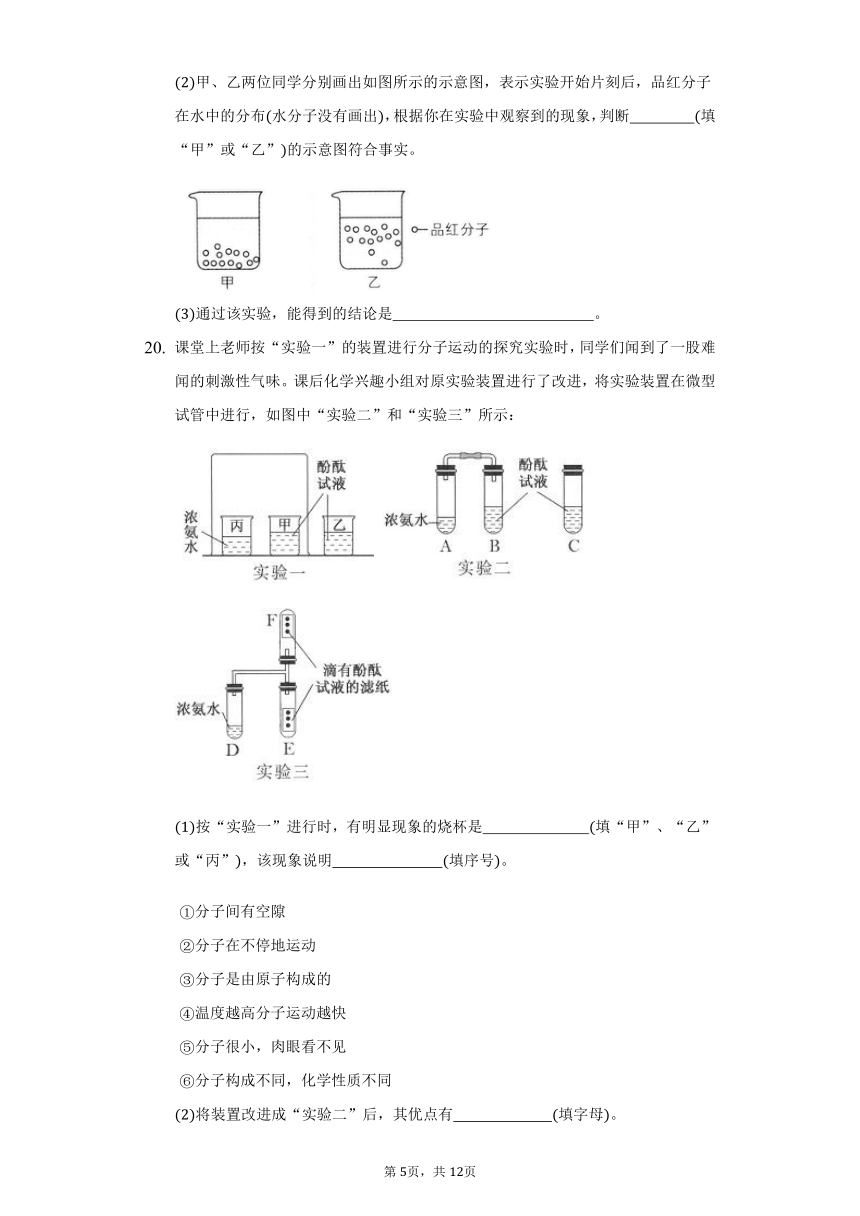
课堂上老师按“实验一”的装置进行分子运动的探究实验时,同学们闻到了一股难闻的刺激性气味。课后化学兴趣小组对原实验装置进行了改进,将实验装置在微型试管中进行,如图中“实验二”和“实验三”所示:
按“实验一”进行时,有明显现象的烧杯是?
?
?
?
?
?
?
?
?
?填“甲”、“乙”或“丙”,该现象说明?
?
?
?
?
?
?
?
?
??填序号。
分子间有空隙
分子在不停地运动
分子是由原子构成的
温度越高分子运动越快
分子很小,肉眼看不见
分子构成不同,化学性质不同
将装置改进成“实验二”后,其优点有?
?
?
?
?
?
?
?
??填字母。
A.减少空气污染
B.实验现象更明显
C.实验结论更准确
D.节约药品
“实验三”的装置比“实验一”和“实验二”的装置少了一部分,该部分装置在“实验一”和“实验二”中的作用是?
?
?
?
?
?
?
?
?
?
?
?
??。查询资料发现:浓氨水能够释放出氨气若气体分子的相对分子质量大于29,则该气体密度大于空气,反之则小于空气。实验过程中,?
?
?
?
?
?
?
?
?填“E”或“F”试管中滴有酚酞试液的滤纸条最先全部变红。
如图是通电分解水的简易装置。据图回答:
???
电解水实验:实验前加入少量的氢氧化钠溶液,目的是___________________________;与电源负极相连的试管内产生的气体是_______________,与电源正极相连的试管内产生的气体是____________,两种气体的体积比为___________。
???
检验电源正极产生的气体,可以用_______,然后观察现象。
???
由实验可知,化学变化中_______可以再分,__________不能再分。
???
电解水的文字表达式是________________________,属于________反应选填“化合”或“分解”。
四、计算题
1个过氧化氢分子的质量为,1个水分子的质量为,1个钠原子的质量为,若以1个氧原子质量的为基准,计算相对原子质量,则钠的相对原子质量是多少计算结果保留整数
请计算:若1个A原子的质量为bkg,1个碳12原子含有6个质子和6个中子的碳原子的质量为akg。则A原子的相对原子质量为_____________;碳12原子的相对原子质量为_____________。
与氩原子核外电子排布相同,R元素的相对原子质量为d,则R元素原子核内的中子数为________。
某阴离子的核外有18个电子,核内有18个中子,则X的相对原子质量为______。
原子的核电荷数为a,其阴离子的电子层结构与Y的阳离子的电子层结构相同,则Y原子的核电荷数为______用a、m、n表示。
镁的相对原于质量是24,铝的相对原子质量是27,则等质量的镁、铝两种金属中,镁原子、铝原子的个数比是______。
答案和解析
1.【答案】A
【解析】根据在原子中核内质子数核外电子数,其核内有一个质子和2个中子,可知,氚原子核外有1个电子,故A正确。
故选:A。??
2.【答案】D
【解析】A、因为微粒的化学性质和最外层电子数关系密切,所以最外层电子数相同则化学性质相似,的最外层电子数不同,故化学性质不会相似,故A错误;
B、由于微粒的质子数是11,带一个单位的正电荷,是钠离子,符号为:,故B错误;
C、的最外层电子数是6,大于4,在化学反应中得到电子,故C错误;
D、当为氯离子时,x为8,故D正确。
故选:D。??
3.【答案】D
【解析】由模型可知该原子核外有2个电子,核内有2个质子,故该模型表示的是氦原子,A错误;由模型可知该原子核内有2个质子,由于质子数核电荷数,故核电荷数为2,B错误;原子的质量主要集中在原子核上,原子的相对原子质量质子数中子数,C错误;由模型可知该原子核由2个质子和2个中子构成,故D正确。
4.【答案】C
【解析】钛原子的相对原子质量质子数中子数,C正确。
5.【答案】B
【解析】“”是指原子核内有6个质子和7个中子的碳原子,即“”中的“13”是指质子数与中子数的和。由此类比推理,“”是指原子核内有2个质子、1个中子的氦原子,B正确。
6.【答案】D
【解析】原子是化学变化中的最小粒子,A错误原子核是由质子和中子构成的,B错误氯化钠是由钠离子和氯离子构成的,C错误水蒸发的过程中,水分子间的间隔变大,
D正确。
7.【答案】B
【解析】解:A、质子数,核外电子数,质子数核外电子数,为阳离子,故选项错误.
B、质子数,核外电子数,质子数核外电子数,为阴离子,故选项正确.
C、质子数核外电子数,为原子,故选项错误.
D、质子数核外电子数,为原子,故选项错误.
故选:B。
8.【答案】A
【解析】A中两种原子的最外层均为6个电子,都易得2个电子而形成相对稳定结构,化学性质相似,正确中虽然两种原子的最外层电子数相同,但氢原子只有一个电子层,和钠原子化学性质不相似,错误中虽然两种原子的最外层电子数相同,但最外层电子数为2的氦原子的化学性质相对稳定,而最外层电子数为2的镁原子易失去最外层的2个电子形成相对稳定结构,错误中两种原子的最外层电子数分别为1和7,化学性质不相似,错误。
9.【答案】C
【解析】粒子甲中质子数,核外电子数,质子数核外电子数,为阴离子,带负电荷,粒子乙中质子数,核外电子数,质子数核外电子数,为阴离子,带负电荷,A、D错误;甲、乙两种粒子的质子数不同,不是由同种原子形成的,B错误;甲、乙两种粒子的最外层电子数都是8,属于相对稳定结构,故化学性质均比较稳定,C正确。
10.【答案】A
【解析】解:质子数与中子数都是6的碳原子,其质量为ag,某元素的原子质量为bg,则该元素原子的相对原子质量为。
故选A。??
11.【答案】A
【解析】解:实际质量为2m?kg的一种原子的相对原子质量;相对原子质量是有单位的,其单位为“1”;
故选:A。
12.【答案】B
【解析】A、成熟的菠萝会散发出浓浓的香味,是因为香味中含有的分子是在不断运动的,向四周扩散,使人们闻到菠萝的香味,故选项解释正确。
B、水沸腾时能掀起壶盖,是因为分子间的间隔而不是大小随温度变化而改变,故选项解释错误。
C、50mL水和50mL酒精混合后总体积小于100mL,是因为分子间有间隔的缘故,故选项解释正确。
D、湿衣服晾在太阳底下干得快,是因为温度升高,分子运动的速率加快,说明分子运动速率与温度有关,故选项解释正确。
故选:B。??
13.【答案】D
【解析】解:由物质的微粒性可知:物质都是由很小的微粒构成的,物质在受热膨胀时,微粒间的间隔变大了,没有生成其它物质。所以,微粒的大小、质量及性质没有改变。
故选:D。
通过本题的练习,能建立物质微粒性的观点,会用微观的知识来解释一些宏观的现象.
14.【答案】C
【解析】分子是保持物质化学性质的一种粒子,故A错误;物体有热胀冷缩现象,主要是因为构成物质的粒子之间的间隔发生了变化,粒子大小并没有变化,故B错误;构成物质的基本粒子有分子、原子、离子,它们都能直接构成物质,故C正确;在化学反应中,分子能分成原子,原子不能再分,故D错误。
15.【答案】2??铝原子?AD
【解析】当原子核外第一电子层排满时有2个电子,则;A粒子质子数,核外电子数,质子数核外电子数,故A粒子为带2个单位负电荷的硫离子,其符号为。
由B粒子的结构示意图可知,质子数核外电子数,故B粒子为铝原子。
图中四种结构示意图所表示的粒子中,A粒子为硫离子粒子为铝原子粒子质子数核外电子数,为原子粒子质子数,核外电子数,质子数核外电子数,为阴离子。
16.【答案】17?17?3?8?7?得到1个?非金属
17.【答案】
氯分子和参加反应的氢分子
两种分子反应生成另一种分子
【解析】由甲图可以看出:根据质量守恒定律,参加化学反应的氯气分子和氢气分子的个数比为,生成的氯化氢分子为2个,故补充的图形为;
化学变化前后发生改变的粒子是参加反应的氢分子和氯分子;
由图示中微粒的变化可以得出,此反应为化合反应的原因是:由不同种分子生成一种分子或由两种分子生成一种分子。??
18.【答案】分子?
原子
?离子
19.【答案】烧杯中的水逐渐变红
乙
分子在不断运动,分子间有间隔
【解析】因为品红逐渐向水中扩散,故观察到的实验现象是烧杯中的水逐渐变红。
把品红加入水中,由于分子扩散需要一定的时间,故实验开始片刻后品红还没有完全扩散,烧杯中的水只有上部变红。
通过该实验,能得到的结论是分子在不断运动,分子间有间隔。
20.【答案】甲;作对比实验;F
【解析】氨水能挥发出氨气,氨气运动到甲烧杯中形成氨水,能使酚酞试液变红,故有明显现象的烧杯是甲;该实验能够说明分子在不停地运动,且分子很小,肉眼不可见。
改进的“实验二”在密闭容器中进行,可以减少氨气向空气中扩散,即能减小空气污染,同时,在小试管中进行,可节约药品。
“实验三”减少了对比实验;根据氨气的相对分子质量为17可知,氨气的密度比空气小,则最先全部变为红色的部分是F。
21.【答案】增强导电性;氢气;氧气;2:1
带火星木条
分子;原子
水氢气氧气;分解
22.【答案】解:1个氧原子的质量为,钠的相对原子质量?。
答:钠的相对原子质量为23。
23.【答案】?;12
?
【解析】若1个A原子的质量为bkg,1个碳12原子含有6个质子和6个中子的碳原子的质量为akg。则A原子的相对原子质量为;相对原子质量质子数中子数,则碳12原子的相对原子质量为:;
与氩原子核外电子排布相同,则有18个电子,R原子有16个电子,由于原子中质子数电子数,则R原子中质子数为16;R元素的相对原子质量为d,相对原子质量质子数中子数,则R元素原子核内的中子数为:。??
24.【答案】34?
?
9:8
【解析】解:阴离子的核外有18个电子,该阴离子是X原子得到两个电子形成的,故X原子核外电子为16,在原子中质子数核外电子数,故X原子质子数为16,再根据相对原子质量质子数中子数可知,相对原子质量为;
设元素Y的核电荷数是b,则阳离子的核外电子数为,
因为X的核电荷数为a,它的阴离子核外电子数为,
因为阴离子与Y原子的阳离子的电子层结构相同,即核外电子数相同,
所以,即。
由于相对原子质量之比等于原子质量之比;相同质量的镁和铝两种金属中,含有镁原子和铝原子个数比为::8;
故答案为:;;:8.
根据该阴离子确定出原子的核外电子数,根据原子中,质子数核外电子数确定出质子数,再根据相对原子质量质子数中子数进行解答;
原子获得m个电子后变为,Y原子失去n个电子后变为,根据电子层结构相同,即核外电子数相同,设元素Y的核电荷数是b,列出等式求解即可;
根据原子的相对原子质量的概念,解答本题。
本题难度不是很大,解题的关键是掌握并灵活运用原子中核电荷数核内质子数核外电子数、相对原子质量质子数中子数。
第2页,共2页
第1页,共1页
一、单选题
氚也是一种氢原子,氚原子含有1个质子和2个中子,如图示意图下列能正确表示氚原子结构的是
A.
B.
C.
D.
下列关于四种粒子的结构示意图说法正确的是
A.
、的化学性质相似
B.
所示的粒子符号为Na
C.
在化学反应中易失去电子
D.
中x可能为8
如图为小明制作的原子结构模型,外圈上的小球为电子,内圈为原子核,下列说法正确的是?
?
A.
该模型表示一种碳原子
B.
该原子的核电荷数为4
C.
该原子的相对原子质量为2
D.
该原子的原子核由2个质子和2个中子构成
钛被称为“航空金属”,国产C919大飞机的钛合金用量高达。已知一种钛原子核内有22个质子和26个中子,该原子的相对原子质量为?
?
A.
22
B.
26
C.
48
D.
4
人类探月的重要目的之一是勘察、获取地球上蕴藏量有限而月球上却极为丰富的核聚变燃料“”核电荷数为,以解决地球能源危机。已知“”是指原子核内含有6个质子和7个中子的碳原子,则“”所指的氦原子核内?
?
A.
含有3个质子,没有中子
B.
含有2个质子,1个中子
C.
含有1个质子,2个中子
D.
含有3个中子,没有质子
下列说法正确的是?
?
A.
分子是化学变化中的最小粒子
B.
原子核是由质子和电子构成
C.
NaCl由NaCl分子构成
D.
水蒸发过程中,水分子间的间隔变大
下面微粒结构示意图中属于阴离子的是?
?
A.
B.
C.
D.
根据下列各组原子结构示意图判断,其中化学性质相似的一组是?
?
A.
B.
C.
D.
如图为甲、乙两种粒子的结构示意图,下列关于这两种粒子的说法中,正确的是?
?
A.
粒子甲不显电性,粒子乙带正电荷
B.
甲、乙两种粒子是同一种原子形成的
C.
甲、乙两种粒子的化学性质均比较稳定
D.
粒子甲是阴离子,粒子乙是原子
质子数与中子数都是6的碳原子,其质量为ag,某元素的原子质量为bg,则该元素的相对原子质量为
A.
B.
C.
D.
作为相对原子质量标准的碳12原子的实际质量为,则实际质量为2mkg的一种原子的相对原子质量是
A.
24
B.
24g
C.
2
D.
2g
事物的宏观表象是由其微观性质决定的。下列事实及对这些事实的解释中,二者不相符的是
A.
成熟的菠萝会散发出浓浓的香味,说明分子在不断地运动
B.
水沸腾时能掀开壶盖,说明分子的大小随温度升高而增大
C.
50mL水和50mL酒精混合后总体积小于100mL,说明分子间有间隔
D.
湿衣服晾在太阳晒着的地方干得快,说明分子的运动速率与温度有关
炎热的夏天,路面会拱起开裂,小明通过查阅资料得知:这是由于受热膨胀引起的。物质具有热胀冷缩现象的主要原因是
A.
微粒的性质发生了改变
B.
微粒的大小发生了改变
C.
微粒的质量发生了改变
D.
微粒间的间隔发生了改变
下列有关分子、原子和离子的说法正确的是?
?
A.
分子是保持物质性质的一种粒子
B.
物体有热胀冷缩现象,主要是因为物体中的粒子大小随温度的改变而改变
C.
分子、原子、离子都可以直接构成物质
D.
在化学反应中,分子和原子都不能再分
二、填空题
如图中A、B、C、D是四种粒子的结构示意图,请回答下列问题。
中??????粒子的符号是??????。
由B粒子的结构示意图可知,B粒子的名称是??????。
以上四种结构示意图所表示的粒子中,表示离子的是??????填序号。
某原子的结构示意图为,该原子的核电荷数为??????,质子数为??????,核外有??????个电子层,第二层上有??????个电子,最外层上有??????个电子,在化学反应中该原子容易??????电子,形成相对稳定结构。从分类上看,该原子属于??????原子。
如图是氢气在氯气中燃烧生成氯化氢的微观模拟图,请回答下列问题。
在图乙中将相关微粒图形补充完整。
此变化前后发生改变的微粒是________。
从微观角度解释此反应为化合反应的原因是________。
请用“分子”“原子”和“离子”填空。
水由??????????构成,稀有气体由??????????构成,氯化钠由??????????构成。
三、实验题
在学习“运动的水分子”时,两位同学做了这样的实验:向盛有热水的小烧杯中加入少量品红后,静置,观察。请回答:
两位同学观察到的实验现象是?
?
?
?
?
?
?
?
?
?
?
?
?
?。
甲、乙两位同学分别画出如图所示的示意图,表示实验开始片刻后,品红分子在水中的分布水分子没有画出,根据你在实验中观察到的现象,判断?
?
?
?
?
??填“甲”或“乙”的示意图符合事实。
通过该实验,能得到的结论是?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
??。
课堂上老师按“实验一”的装置进行分子运动的探究实验时,同学们闻到了一股难闻的刺激性气味。课后化学兴趣小组对原实验装置进行了改进,将实验装置在微型试管中进行,如图中“实验二”和“实验三”所示:
按“实验一”进行时,有明显现象的烧杯是?
?
?
?
?
?
?
?
?
?填“甲”、“乙”或“丙”,该现象说明?
?
?
?
?
?
?
?
?
??填序号。
分子间有空隙
分子在不停地运动
分子是由原子构成的
温度越高分子运动越快
分子很小,肉眼看不见
分子构成不同,化学性质不同
将装置改进成“实验二”后,其优点有?
?
?
?
?
?
?
?
??填字母。
A.减少空气污染
B.实验现象更明显
C.实验结论更准确
D.节约药品
“实验三”的装置比“实验一”和“实验二”的装置少了一部分,该部分装置在“实验一”和“实验二”中的作用是?
?
?
?
?
?
?
?
?
?
?
?
??。查询资料发现:浓氨水能够释放出氨气若气体分子的相对分子质量大于29,则该气体密度大于空气,反之则小于空气。实验过程中,?
?
?
?
?
?
?
?
?填“E”或“F”试管中滴有酚酞试液的滤纸条最先全部变红。
如图是通电分解水的简易装置。据图回答:
???
电解水实验:实验前加入少量的氢氧化钠溶液,目的是___________________________;与电源负极相连的试管内产生的气体是_______________,与电源正极相连的试管内产生的气体是____________,两种气体的体积比为___________。
???
检验电源正极产生的气体,可以用_______,然后观察现象。
???
由实验可知,化学变化中_______可以再分,__________不能再分。
???
电解水的文字表达式是________________________,属于________反应选填“化合”或“分解”。
四、计算题
1个过氧化氢分子的质量为,1个水分子的质量为,1个钠原子的质量为,若以1个氧原子质量的为基准,计算相对原子质量,则钠的相对原子质量是多少计算结果保留整数
请计算:若1个A原子的质量为bkg,1个碳12原子含有6个质子和6个中子的碳原子的质量为akg。则A原子的相对原子质量为_____________;碳12原子的相对原子质量为_____________。
与氩原子核外电子排布相同,R元素的相对原子质量为d,则R元素原子核内的中子数为________。
某阴离子的核外有18个电子,核内有18个中子,则X的相对原子质量为______。
原子的核电荷数为a,其阴离子的电子层结构与Y的阳离子的电子层结构相同,则Y原子的核电荷数为______用a、m、n表示。
镁的相对原于质量是24,铝的相对原子质量是27,则等质量的镁、铝两种金属中,镁原子、铝原子的个数比是______。
答案和解析
1.【答案】A
【解析】根据在原子中核内质子数核外电子数,其核内有一个质子和2个中子,可知,氚原子核外有1个电子,故A正确。
故选:A。??
2.【答案】D
【解析】A、因为微粒的化学性质和最外层电子数关系密切,所以最外层电子数相同则化学性质相似,的最外层电子数不同,故化学性质不会相似,故A错误;
B、由于微粒的质子数是11,带一个单位的正电荷,是钠离子,符号为:,故B错误;
C、的最外层电子数是6,大于4,在化学反应中得到电子,故C错误;
D、当为氯离子时,x为8,故D正确。
故选:D。??
3.【答案】D
【解析】由模型可知该原子核外有2个电子,核内有2个质子,故该模型表示的是氦原子,A错误;由模型可知该原子核内有2个质子,由于质子数核电荷数,故核电荷数为2,B错误;原子的质量主要集中在原子核上,原子的相对原子质量质子数中子数,C错误;由模型可知该原子核由2个质子和2个中子构成,故D正确。
4.【答案】C
【解析】钛原子的相对原子质量质子数中子数,C正确。
5.【答案】B
【解析】“”是指原子核内有6个质子和7个中子的碳原子,即“”中的“13”是指质子数与中子数的和。由此类比推理,“”是指原子核内有2个质子、1个中子的氦原子,B正确。
6.【答案】D
【解析】原子是化学变化中的最小粒子,A错误原子核是由质子和中子构成的,B错误氯化钠是由钠离子和氯离子构成的,C错误水蒸发的过程中,水分子间的间隔变大,
D正确。
7.【答案】B
【解析】解:A、质子数,核外电子数,质子数核外电子数,为阳离子,故选项错误.
B、质子数,核外电子数,质子数核外电子数,为阴离子,故选项正确.
C、质子数核外电子数,为原子,故选项错误.
D、质子数核外电子数,为原子,故选项错误.
故选:B。
8.【答案】A
【解析】A中两种原子的最外层均为6个电子,都易得2个电子而形成相对稳定结构,化学性质相似,正确中虽然两种原子的最外层电子数相同,但氢原子只有一个电子层,和钠原子化学性质不相似,错误中虽然两种原子的最外层电子数相同,但最外层电子数为2的氦原子的化学性质相对稳定,而最外层电子数为2的镁原子易失去最外层的2个电子形成相对稳定结构,错误中两种原子的最外层电子数分别为1和7,化学性质不相似,错误。
9.【答案】C
【解析】粒子甲中质子数,核外电子数,质子数核外电子数,为阴离子,带负电荷,粒子乙中质子数,核外电子数,质子数核外电子数,为阴离子,带负电荷,A、D错误;甲、乙两种粒子的质子数不同,不是由同种原子形成的,B错误;甲、乙两种粒子的最外层电子数都是8,属于相对稳定结构,故化学性质均比较稳定,C正确。
10.【答案】A
【解析】解:质子数与中子数都是6的碳原子,其质量为ag,某元素的原子质量为bg,则该元素原子的相对原子质量为。
故选A。??
11.【答案】A
【解析】解:实际质量为2m?kg的一种原子的相对原子质量;相对原子质量是有单位的,其单位为“1”;
故选:A。
12.【答案】B
【解析】A、成熟的菠萝会散发出浓浓的香味,是因为香味中含有的分子是在不断运动的,向四周扩散,使人们闻到菠萝的香味,故选项解释正确。
B、水沸腾时能掀起壶盖,是因为分子间的间隔而不是大小随温度变化而改变,故选项解释错误。
C、50mL水和50mL酒精混合后总体积小于100mL,是因为分子间有间隔的缘故,故选项解释正确。
D、湿衣服晾在太阳底下干得快,是因为温度升高,分子运动的速率加快,说明分子运动速率与温度有关,故选项解释正确。
故选:B。??
13.【答案】D
【解析】解:由物质的微粒性可知:物质都是由很小的微粒构成的,物质在受热膨胀时,微粒间的间隔变大了,没有生成其它物质。所以,微粒的大小、质量及性质没有改变。
故选:D。
通过本题的练习,能建立物质微粒性的观点,会用微观的知识来解释一些宏观的现象.
14.【答案】C
【解析】分子是保持物质化学性质的一种粒子,故A错误;物体有热胀冷缩现象,主要是因为构成物质的粒子之间的间隔发生了变化,粒子大小并没有变化,故B错误;构成物质的基本粒子有分子、原子、离子,它们都能直接构成物质,故C正确;在化学反应中,分子能分成原子,原子不能再分,故D错误。
15.【答案】2??铝原子?AD
【解析】当原子核外第一电子层排满时有2个电子,则;A粒子质子数,核外电子数,质子数核外电子数,故A粒子为带2个单位负电荷的硫离子,其符号为。
由B粒子的结构示意图可知,质子数核外电子数,故B粒子为铝原子。
图中四种结构示意图所表示的粒子中,A粒子为硫离子粒子为铝原子粒子质子数核外电子数,为原子粒子质子数,核外电子数,质子数核外电子数,为阴离子。
16.【答案】17?17?3?8?7?得到1个?非金属
17.【答案】
氯分子和参加反应的氢分子
两种分子反应生成另一种分子
【解析】由甲图可以看出:根据质量守恒定律,参加化学反应的氯气分子和氢气分子的个数比为,生成的氯化氢分子为2个,故补充的图形为;
化学变化前后发生改变的粒子是参加反应的氢分子和氯分子;
由图示中微粒的变化可以得出,此反应为化合反应的原因是:由不同种分子生成一种分子或由两种分子生成一种分子。??
18.【答案】分子?
原子
?离子
19.【答案】烧杯中的水逐渐变红
乙
分子在不断运动,分子间有间隔
【解析】因为品红逐渐向水中扩散,故观察到的实验现象是烧杯中的水逐渐变红。
把品红加入水中,由于分子扩散需要一定的时间,故实验开始片刻后品红还没有完全扩散,烧杯中的水只有上部变红。
通过该实验,能得到的结论是分子在不断运动,分子间有间隔。
20.【答案】甲;作对比实验;F
【解析】氨水能挥发出氨气,氨气运动到甲烧杯中形成氨水,能使酚酞试液变红,故有明显现象的烧杯是甲;该实验能够说明分子在不停地运动,且分子很小,肉眼不可见。
改进的“实验二”在密闭容器中进行,可以减少氨气向空气中扩散,即能减小空气污染,同时,在小试管中进行,可节约药品。
“实验三”减少了对比实验;根据氨气的相对分子质量为17可知,氨气的密度比空气小,则最先全部变为红色的部分是F。
21.【答案】增强导电性;氢气;氧气;2:1
带火星木条
分子;原子
水氢气氧气;分解
22.【答案】解:1个氧原子的质量为,钠的相对原子质量?。
答:钠的相对原子质量为23。
23.【答案】?;12
?
【解析】若1个A原子的质量为bkg,1个碳12原子含有6个质子和6个中子的碳原子的质量为akg。则A原子的相对原子质量为;相对原子质量质子数中子数,则碳12原子的相对原子质量为:;
与氩原子核外电子排布相同,则有18个电子,R原子有16个电子,由于原子中质子数电子数,则R原子中质子数为16;R元素的相对原子质量为d,相对原子质量质子数中子数,则R元素原子核内的中子数为:。??
24.【答案】34?
?
9:8
【解析】解:阴离子的核外有18个电子,该阴离子是X原子得到两个电子形成的,故X原子核外电子为16,在原子中质子数核外电子数,故X原子质子数为16,再根据相对原子质量质子数中子数可知,相对原子质量为;
设元素Y的核电荷数是b,则阳离子的核外电子数为,
因为X的核电荷数为a,它的阴离子核外电子数为,
因为阴离子与Y原子的阳离子的电子层结构相同,即核外电子数相同,
所以,即。
由于相对原子质量之比等于原子质量之比;相同质量的镁和铝两种金属中,含有镁原子和铝原子个数比为::8;
故答案为:;;:8.
根据该阴离子确定出原子的核外电子数,根据原子中,质子数核外电子数确定出质子数,再根据相对原子质量质子数中子数进行解答;
原子获得m个电子后变为,Y原子失去n个电子后变为,根据电子层结构相同,即核外电子数相同,设元素Y的核电荷数是b,列出等式求解即可;
根据原子的相对原子质量的概念,解答本题。
本题难度不是很大,解题的关键是掌握并灵活运用原子中核电荷数核内质子数核外电子数、相对原子质量质子数中子数。
第2页,共2页
第1页,共1页
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
