脂肪烃的性质
图片预览






文档简介
(共21张PPT)
脂肪烃的性质
专题三第一单元
一、烃的分类
烃
脂肪烃
饱和烃
不含苯环
含苯环
不含不饱和键
含不饱和键
C=C、 C≡C
不饱和烃
芳香烃
碳氢元素的化合物
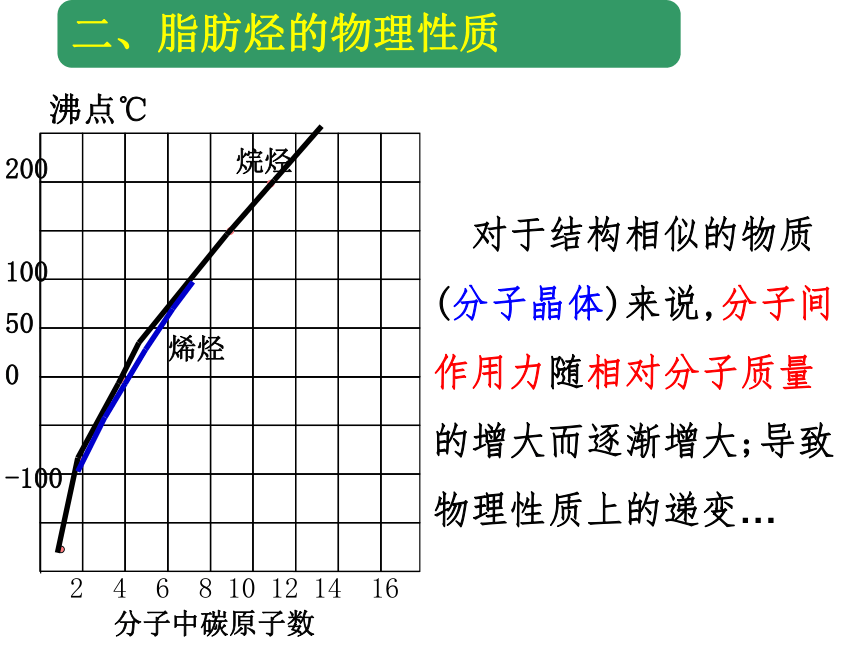
二、脂肪烃的物理性质
沸点℃
分子中碳原子数
2 4 6 8 10 12 14 16
200
100
50
0
-100
烷烃
烯烃
对于结构相似的物质
(分子晶体)来说,分子间
作用力随相对分子质量
的增大而逐渐增大;导致
物理性质上的递变…
2.下列液体混合物可以用分液的方法分离的是 ( )
A.苯和溴苯 B.汽油和辛烷
C.己烷和水 D.戊烷和庚烷
1.下列烷烃沸点最高的是( )
A.CH3CH2CH3 B.CH3CH2CH2CH3
C.CH3(CH2)3CH3 D.(CH3)2CHCH2CH3
练习:
C
C
三、脂肪烃的结构
烷烃CnH2n+2
烯烃CnH2n
炔烃CnH2n-2
空间取向四面体
双键碳上的所有原子共面,
叁键碳上的所有原子共线,
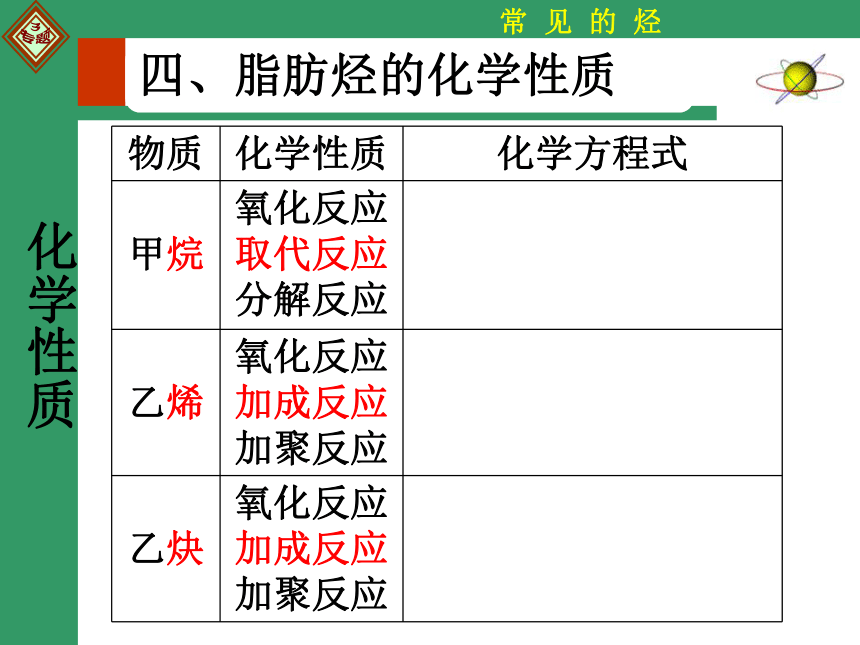
四、脂肪烃的化学性质
物质 化学性质 化学方程式
甲烷 氧化反应
取代反应
分解反应
乙烯 氧化反应
加成反应
加聚反应
乙炔 氧化反应
加成反应
加聚反应
化学性质
2 、氧化反应
燃烧: CH4 + 2O2 CO2 + 2H2O
燃烧
1、通常状况下,它们很稳定,跟酸、碱及氧化物都不发生反应,也难与其他物质化合。
3 、取代反应
C
H
4
C
H
3
C
l
C
H
2
C
l
2
C
H
C
l
3
C
C
l
4
C
l
2
C
l
2
C
l
2
C
l
2
烷 烃
卤代反应、酯化反应、
硝化反应、磺化反应
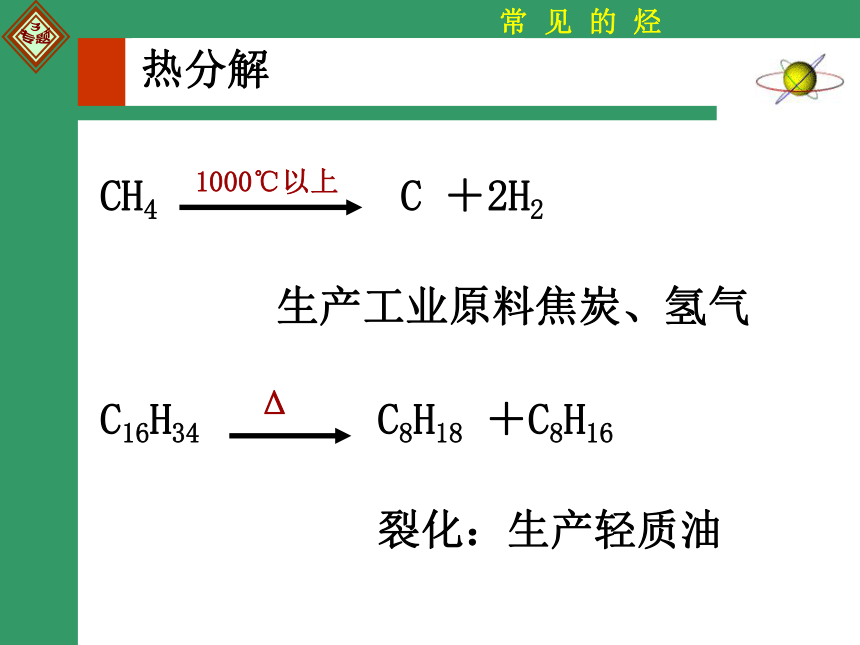
热分解
CH4 C +2H2
1000℃以上
生产工业原料焦炭、氢气
C16H34 C8H18 +C8H16
Δ
裂化:生产轻质油
C4H10 C2H4+C2H6
△
C4H10 CH4+C3H6
△
裂解:得到短链的不饱和烃
②催化氧化:
③与酸性KMnO4的作用:
2CH2==CH2 +O2 2CH3CHO
催化剂
加热加压
5CH2=CH2 + 12KMnO4 +18H2SO4
10CO2 ↑ + 12MnSO4 + 6K2SO4 + 28H2O
使KMnO4溶液褪色
(1)氧化反应:
①燃烧:
火焰明亮,冒黑烟。
烯 烃
(2)加成反应(与H2、Br2、HX、H2O等):
CH3-CH=CH2 + H2 CH3CH2CH3
催化剂
CH2==CH2+Br2 CH2BrCH2Br
使溴水褪色
写出下列反应的方程式: 乙烯与氢气、溴、水、氯化氢加成
丙烯与氯化氢
氧化反应
不能使酸性高锰酸钾溶液褪色,
能使酸性高锰酸钾溶液褪色,所以可以用酸性高锰酸钾溶液鉴别 和 。
除杂:CH4(C2H4)或 CH4(C2H2)
烷烃
饱和烃 和 不饱和烃
烯烃、炔烃
溴水
1.单体
2.链节
3.聚合度
4.聚合物
问题解决:P43
高聚物的结构
nCH2=CH2 [ CH2─CH2 ] n
CH2=CH2
─ CH2─CH2 ─
n
加聚反应:
练习:
找出下列高聚物的单体
2. [ CH2-CH=C-CH2 ] | Cl
n
1. [ CH2-CH ]
| C6H5
n
分别写出下列烯烃发生加聚反应
的化学方程式:
A、CH2=CHCH2CH3;
B、CH3CH=CHCH2CH3;
C、CH3C=CHCH3;
CH3
b.不对称加成
丙烯的加成
H2C=CH-CH3+HBr
H2C-CH-CH3
| |
H Br
H2C-CH-CH3
| |
Br H
马氏规则:不对称烯烃发生加成反应时,氢原子加到含氢多的不饱和碳原子上。
主要产物
四、脂肪烃的化学性质
c.1,3-丁二烯的加成反应(与Br2)
低温
H2C=CH-CH=CH2+Br2→
H2C-CH-CH=CH2
| |
Br Br
高温
H2C=CH-CH=CH2+Br2→
H2C-CH=CH-CH2
| |
Br Br
低温:1,2加成
高温:1,4加成
四、脂肪烃的化学性质
1.在分子:CH≡C─CH=CHC(CH3)3中在一条直线上的原子有 个,至少 个有碳原子共面,最多有 个碳原子共面。
[ CH2-CH=CH-CH2-CH2-CH ] | CN
n
2.找出下列高聚物的单体
4
5
6
练习:
脂肪烃的性质含碳量的变化
烷烃CnH2n+2
烯烃CnH2n
炔烃CnH2n-2
C%=12n/(14n+2); n增大C%增大
C%=6/7; n增大C%不变
C%=12n/(14n-2); n增大C%减小
练习:
1.等质量的乙烷、丙烯、丁炔完全燃烧,消耗氧气的物质的量由多到少的顺序为: 。
2.等物质的量的乙烷、丙烯、丁炔完全燃烧,消耗氧气的物质的量由多到少的顺序为: 。
乙烷>丙烯>丁炔
丁炔>丙烯>乙烷
规律:等质量的不同烃完全燃烧消耗氧气的量为含氢量越高消耗氧气越多
脂肪烃的性质
专题三第一单元
一、烃的分类
烃
脂肪烃
饱和烃
不含苯环
含苯环
不含不饱和键
含不饱和键
C=C、 C≡C
不饱和烃
芳香烃
碳氢元素的化合物
二、脂肪烃的物理性质
沸点℃
分子中碳原子数
2 4 6 8 10 12 14 16
200
100
50
0
-100
烷烃
烯烃
对于结构相似的物质
(分子晶体)来说,分子间
作用力随相对分子质量
的增大而逐渐增大;导致
物理性质上的递变…
2.下列液体混合物可以用分液的方法分离的是 ( )
A.苯和溴苯 B.汽油和辛烷
C.己烷和水 D.戊烷和庚烷
1.下列烷烃沸点最高的是( )
A.CH3CH2CH3 B.CH3CH2CH2CH3
C.CH3(CH2)3CH3 D.(CH3)2CHCH2CH3
练习:
C
C
三、脂肪烃的结构
烷烃CnH2n+2
烯烃CnH2n
炔烃CnH2n-2
空间取向四面体
双键碳上的所有原子共面,
叁键碳上的所有原子共线,
四、脂肪烃的化学性质
物质 化学性质 化学方程式
甲烷 氧化反应
取代反应
分解反应
乙烯 氧化反应
加成反应
加聚反应
乙炔 氧化反应
加成反应
加聚反应
化学性质
2 、氧化反应
燃烧: CH4 + 2O2 CO2 + 2H2O
燃烧
1、通常状况下,它们很稳定,跟酸、碱及氧化物都不发生反应,也难与其他物质化合。
3 、取代反应
C
H
4
C
H
3
C
l
C
H
2
C
l
2
C
H
C
l
3
C
C
l
4
C
l
2
C
l
2
C
l
2
C
l
2
烷 烃
卤代反应、酯化反应、
硝化反应、磺化反应
热分解
CH4 C +2H2
1000℃以上
生产工业原料焦炭、氢气
C16H34 C8H18 +C8H16
Δ
裂化:生产轻质油
C4H10 C2H4+C2H6
△
C4H10 CH4+C3H6
△
裂解:得到短链的不饱和烃
②催化氧化:
③与酸性KMnO4的作用:
2CH2==CH2 +O2 2CH3CHO
催化剂
加热加压
5CH2=CH2 + 12KMnO4 +18H2SO4
10CO2 ↑ + 12MnSO4 + 6K2SO4 + 28H2O
使KMnO4溶液褪色
(1)氧化反应:
①燃烧:
火焰明亮,冒黑烟。
烯 烃
(2)加成反应(与H2、Br2、HX、H2O等):
CH3-CH=CH2 + H2 CH3CH2CH3
催化剂
CH2==CH2+Br2 CH2BrCH2Br
使溴水褪色
写出下列反应的方程式: 乙烯与氢气、溴、水、氯化氢加成
丙烯与氯化氢
氧化反应
不能使酸性高锰酸钾溶液褪色,
能使酸性高锰酸钾溶液褪色,所以可以用酸性高锰酸钾溶液鉴别 和 。
除杂:CH4(C2H4)或 CH4(C2H2)
烷烃
饱和烃 和 不饱和烃
烯烃、炔烃
溴水
1.单体
2.链节
3.聚合度
4.聚合物
问题解决:P43
高聚物的结构
nCH2=CH2 [ CH2─CH2 ] n
CH2=CH2
─ CH2─CH2 ─
n
加聚反应:
练习:
找出下列高聚物的单体
2. [ CH2-CH=C-CH2 ] | Cl
n
1. [ CH2-CH ]
| C6H5
n
分别写出下列烯烃发生加聚反应
的化学方程式:
A、CH2=CHCH2CH3;
B、CH3CH=CHCH2CH3;
C、CH3C=CHCH3;
CH3
b.不对称加成
丙烯的加成
H2C=CH-CH3+HBr
H2C-CH-CH3
| |
H Br
H2C-CH-CH3
| |
Br H
马氏规则:不对称烯烃发生加成反应时,氢原子加到含氢多的不饱和碳原子上。
主要产物
四、脂肪烃的化学性质
c.1,3-丁二烯的加成反应(与Br2)
低温
H2C=CH-CH=CH2+Br2→
H2C-CH-CH=CH2
| |
Br Br
高温
H2C=CH-CH=CH2+Br2→
H2C-CH=CH-CH2
| |
Br Br
低温:1,2加成
高温:1,4加成
四、脂肪烃的化学性质
1.在分子:CH≡C─CH=CHC(CH3)3中在一条直线上的原子有 个,至少 个有碳原子共面,最多有 个碳原子共面。
[ CH2-CH=CH-CH2-CH2-CH ] | CN
n
2.找出下列高聚物的单体
4
5
6
练习:
脂肪烃的性质含碳量的变化
烷烃CnH2n+2
烯烃CnH2n
炔烃CnH2n-2
C%=12n/(14n+2); n增大C%增大
C%=6/7; n增大C%不变
C%=12n/(14n-2); n增大C%减小
练习:
1.等质量的乙烷、丙烯、丁炔完全燃烧,消耗氧气的物质的量由多到少的顺序为: 。
2.等物质的量的乙烷、丙烯、丁炔完全燃烧,消耗氧气的物质的量由多到少的顺序为: 。
乙烷>丙烯>丁炔
丁炔>丙烯>乙烷
规律:等质量的不同烃完全燃烧消耗氧气的量为含氢量越高消耗氧气越多
