第2节探索酸的性质(酸的个性)
图片预览





文档简介
(共13张PPT)
第2节 探索酸的性质
酸的个性
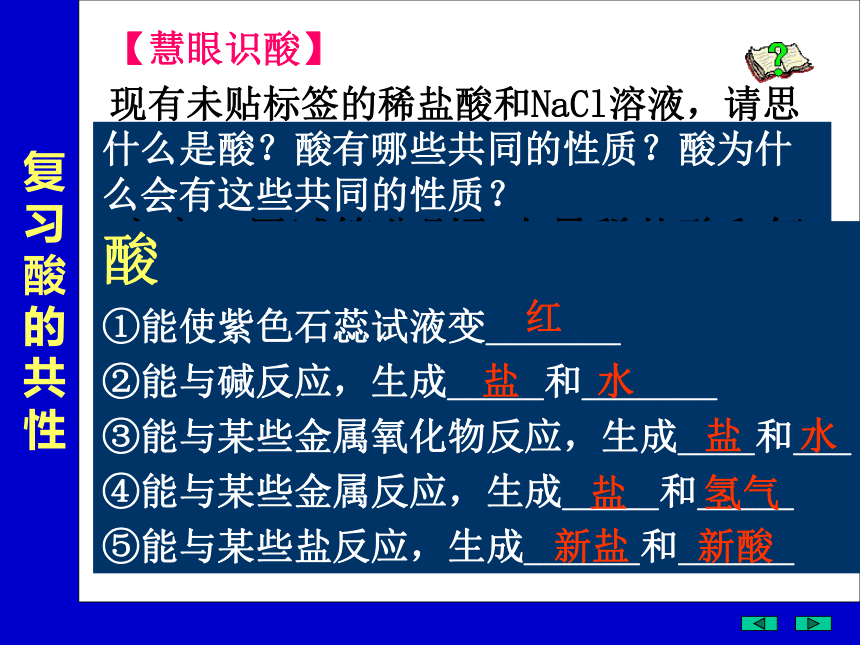
【慧眼识酸】
现有未贴标签的稀盐酸和NaCl溶液,请思考通过什么方法可以区分它们?说出方案。
复习酸的共性
什么是酸?酸有哪些共同的性质?酸为什么会有这些共同的性质?
方案:用试管分别取少量稀盐酸和氯化钠溶液,分别滴加紫色石蕊试液,能变红色的是稀盐酸,不变色的是氯化钠溶液。
酸
①能使紫色石蕊试液变_______
②能与碱反应,生成_____和_______
③能与某些金属氧化物反应,生成____和___
④能与某些金属反应,生成_____和_____
⑤能与某些盐反应,生成______和______
红
盐 水
盐 水
盐 氢气
新盐 新酸
工业三强酸:盐酸(HCl)、硝酸(HNO3)、硫酸(H2SO4)
浓盐酸的个性
一、盐酸(HCl)
盐酸试剂瓶标签上的内容:
1、物性:纯净的浓盐酸是无色的液体,有刺激性气味。工业品浓盐酸因含有杂质而带黄色。常用的浓盐酸中HCl的质量分数约为37%~38%,密度是1. 19g/㎝3 。
它们相同点是什么?不同点是什么?
你知道认识一种物质一般从哪些方面入手吗?
【猜一猜】
白雾是什么?怎样形成的?你猜想的依据是什么?
2、浓盐酸具有挥发性。从浓盐酸挥发出来的氯化氢气体跟空气里的水蒸气接触,形成盐酸小液滴,从而形成白雾。
一、
浓盐酸的个性
【结论】
P13观察3:瓶口出现白雾;盐酸具有刺激性气味。
闻气体气味的方法
雾是液滴悬浮在空气中的现象
【实验】
3、盐酸与硝酸银溶液的反应(化学方程式)
产生白色沉淀。
【现象】
【结论】
生成了不溶于水和酸的AgCl白色沉淀。
【应用】
用于检验盐酸或其他电离时能产生Cl- 的化合物
一、
盐酸的个性
联想:你还记得硫酸的检验方法吗?
4、浓盐酸有腐蚀性
1、物性:纯净的HNO3是一种无色的液体,具有刺激性气味。
2、硝酸具有挥发性。在空气里也能挥发出HNO3气体, HNO3气体与空气里的水蒸气结合形成硝酸小液滴,形成白雾。
3、硝酸具有很强的腐蚀性。
二、
硝酸的个性
二、硝酸(HNO3)
三、浓硫酸( H2SO4)
三、
浓硫酸的个性
2、浓硫酸具有强腐蚀性。
【拓展与迁移】如果稀硫酸沾到皮肤或衣服上,是否也要进行这样的处理?为什么?
【思考】如果浓硫酸不慎溅到皮肤上,应怎样处理?
1、物性:纯净的浓硫酸是无色、粘稠、油状的液体,不容易挥发。常用的浓硫酸中H2SO4的质量分数是98%,密度为1.84g/㎝3
三、
硫酸的个性
浓硫酸的稀释实验
【现象】
【结论】
烧杯外壁很热。
3、浓硫酸易溶于水,溶解时放出大量的热。
错误操作
稀释浓硫酸时,一定要把浓硫酸沿着器壁(或玻璃棒)慢慢地注入水里,并不断搅拌。
正确操作
不能把水倒入浓硫酸中
【分析】由于水的密度较小,水流进浓硫酸时浮在硫酸上面,硫酸溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅。导致事故发生。
【思考】为什么切不可把水倒入浓硫酸中稀释?
三、
硫酸的个性
【思维方法】水与浓硫酸的密度比较、浓硫酸稀释放热、水会发生什么现象?导致浓硫酸会发生什么现象?
结论:4、浓硫酸具有脱水性。能使木材、纸张脱水碳化
5、浓硫酸具有吸水性,可做干燥剂。
三、
硫酸的个性
怎样区分脱水性和吸水性?
P14实验3:浓硫酸点在纸上现象:纸变黑
能干燥哪些气体呢?
硫酸的用途:重要的化工原料,应用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油、金属除锈等,实验室常用作干燥剂。
干燥剂与被干燥的气体不能发生反应。
【三强酸的个性】
酸的个性
酸名称 个性
浓盐酸 挥发性
腐蚀性 瓶口形成白雾
浓硝酸 挥发性
腐蚀性 瓶口形成白雾
浓硫酸 腐蚀性
脱水性
吸水性 使用注意
稀释方法
干燥剂
【思考与讨论】
三强酸敝口放置,溶液质量增加的是_____,溶液质量减小的是_____,溶质的质量分数怎样变?放置一段时间后这些酸有无变质?
【讨论与交流】你还认识哪些酸?它们有哪些特性
巩固与拓展
磷酸H3PO4:纯品为无色透明粘稠状液体或斜方晶体,无臭,味很酸。性质相对稳定,挥发性小;酸性中等。
醋酸CH3COOH:无色的液体,酸味很浓, 容易与水相混和,是有机酸。
【小结 】
本节课今天我们学到了什么知识?掌握了什么学习方法?
知识类: 三强酸的个性
方法类:观察实验现象,类比方法学习、分析推理
归纳与小结
第2节 探索酸的性质
酸的个性
【慧眼识酸】
现有未贴标签的稀盐酸和NaCl溶液,请思考通过什么方法可以区分它们?说出方案。
复习酸的共性
什么是酸?酸有哪些共同的性质?酸为什么会有这些共同的性质?
方案:用试管分别取少量稀盐酸和氯化钠溶液,分别滴加紫色石蕊试液,能变红色的是稀盐酸,不变色的是氯化钠溶液。
酸
①能使紫色石蕊试液变_______
②能与碱反应,生成_____和_______
③能与某些金属氧化物反应,生成____和___
④能与某些金属反应,生成_____和_____
⑤能与某些盐反应,生成______和______
红
盐 水
盐 水
盐 氢气
新盐 新酸
工业三强酸:盐酸(HCl)、硝酸(HNO3)、硫酸(H2SO4)
浓盐酸的个性
一、盐酸(HCl)
盐酸试剂瓶标签上的内容:
1、物性:纯净的浓盐酸是无色的液体,有刺激性气味。工业品浓盐酸因含有杂质而带黄色。常用的浓盐酸中HCl的质量分数约为37%~38%,密度是1. 19g/㎝3 。
它们相同点是什么?不同点是什么?
你知道认识一种物质一般从哪些方面入手吗?
【猜一猜】
白雾是什么?怎样形成的?你猜想的依据是什么?
2、浓盐酸具有挥发性。从浓盐酸挥发出来的氯化氢气体跟空气里的水蒸气接触,形成盐酸小液滴,从而形成白雾。
一、
浓盐酸的个性
【结论】
P13观察3:瓶口出现白雾;盐酸具有刺激性气味。
闻气体气味的方法
雾是液滴悬浮在空气中的现象
【实验】
3、盐酸与硝酸银溶液的反应(化学方程式)
产生白色沉淀。
【现象】
【结论】
生成了不溶于水和酸的AgCl白色沉淀。
【应用】
用于检验盐酸或其他电离时能产生Cl- 的化合物
一、
盐酸的个性
联想:你还记得硫酸的检验方法吗?
4、浓盐酸有腐蚀性
1、物性:纯净的HNO3是一种无色的液体,具有刺激性气味。
2、硝酸具有挥发性。在空气里也能挥发出HNO3气体, HNO3气体与空气里的水蒸气结合形成硝酸小液滴,形成白雾。
3、硝酸具有很强的腐蚀性。
二、
硝酸的个性
二、硝酸(HNO3)
三、浓硫酸( H2SO4)
三、
浓硫酸的个性
2、浓硫酸具有强腐蚀性。
【拓展与迁移】如果稀硫酸沾到皮肤或衣服上,是否也要进行这样的处理?为什么?
【思考】如果浓硫酸不慎溅到皮肤上,应怎样处理?
1、物性:纯净的浓硫酸是无色、粘稠、油状的液体,不容易挥发。常用的浓硫酸中H2SO4的质量分数是98%,密度为1.84g/㎝3
三、
硫酸的个性
浓硫酸的稀释实验
【现象】
【结论】
烧杯外壁很热。
3、浓硫酸易溶于水,溶解时放出大量的热。
错误操作
稀释浓硫酸时,一定要把浓硫酸沿着器壁(或玻璃棒)慢慢地注入水里,并不断搅拌。
正确操作
不能把水倒入浓硫酸中
【分析】由于水的密度较小,水流进浓硫酸时浮在硫酸上面,硫酸溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅。导致事故发生。
【思考】为什么切不可把水倒入浓硫酸中稀释?
三、
硫酸的个性
【思维方法】水与浓硫酸的密度比较、浓硫酸稀释放热、水会发生什么现象?导致浓硫酸会发生什么现象?
结论:4、浓硫酸具有脱水性。能使木材、纸张脱水碳化
5、浓硫酸具有吸水性,可做干燥剂。
三、
硫酸的个性
怎样区分脱水性和吸水性?
P14实验3:浓硫酸点在纸上现象:纸变黑
能干燥哪些气体呢?
硫酸的用途:重要的化工原料,应用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油、金属除锈等,实验室常用作干燥剂。
干燥剂与被干燥的气体不能发生反应。
【三强酸的个性】
酸的个性
酸名称 个性
浓盐酸 挥发性
腐蚀性 瓶口形成白雾
浓硝酸 挥发性
腐蚀性 瓶口形成白雾
浓硫酸 腐蚀性
脱水性
吸水性 使用注意
稀释方法
干燥剂
【思考与讨论】
三强酸敝口放置,溶液质量增加的是_____,溶液质量减小的是_____,溶质的质量分数怎样变?放置一段时间后这些酸有无变质?
【讨论与交流】你还认识哪些酸?它们有哪些特性
巩固与拓展
磷酸H3PO4:纯品为无色透明粘稠状液体或斜方晶体,无臭,味很酸。性质相对稳定,挥发性小;酸性中等。
醋酸CH3COOH:无色的液体,酸味很浓, 容易与水相混和,是有机酸。
【小结 】
本节课今天我们学到了什么知识?掌握了什么学习方法?
知识类: 三强酸的个性
方法类:观察实验现象,类比方法学习、分析推理
归纳与小结
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
