5.1 质量守恒定律 培优同步训练— 2021-2022学年九年级化学人教版上册(含解析)
文档属性
| 名称 | 5.1 质量守恒定律 培优同步训练— 2021-2022学年九年级化学人教版上册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 119.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-20 09:18:03 | ||
图片预览




文档简介
2021-2022年九年级化学(上册)培优同步训练(人教版)
课题5.1
质量守恒定律
一、单选题。本大题共12小题。每小题只有一个选项符合题意
1.下列关于2CO+O22CO2的说法不正确的是( )
A.表示一氧化碳与氧气在点燃条件下反应生成二氧化碳
B.参加反应的一氧化碳与氧气的质量比为7:8
C.反应前后碳原子、氧原子的个数均保持不变
D.参加反应的一氧化碳与生成的二氧化碳的分子个数比为1:1
2.已知X+Y=M+N,如果40gX和1gY恰好完全反应,生成9gN,则同时生成M的质量为( )
A.41g
B.32g
C.39g
D.10g
3.下图表示某反应前后反应物与生成物分子及其数目的变化,其中,分别表示A、B、C三种不同的分子,该反应的化学方程式中A、B、C前的化学计量数之比为(
)
A.4:1:3
B.4:1:2
C.3:1:2
D.3:1:3
4.化学反应前后一定没有变化的是( )
①物质种类
②元素种类
③分子种类
④原子种类
⑤分子数目
⑥原子数目
⑦物质的总质量
A.①②⑤⑥⑦
B.②③④⑤⑥
C.②④⑥⑦
D.①②④⑤⑥⑦
5.实验小组在密闭容器中用CO2和湿度两种传感器探究乙醇燃烧的产物。测定结果如下图所示。下列说法不正确的是
A.图1曲线说明乙醇燃烧有水产生
B.根据图1,可推理得出乙醇中含有氢元素
C.图2曲线说明乙醇燃烧有CO2产生
D.根据图2,可推理得出乙醇中含有碳和氧元素
6.关于质量守恒定律,下列叙述中正确的是( )
A.煤燃烧化为灰烬,该反应不符合质量守恒定律
B.31g红磷在空气中完全燃烧生成71g五氧化二磷,实际消耗空气的质量为40g
C.一切化学反应都遵循质量守恒定律
D.在化学反应中反应物的分子数等于生成物的分子数
7.用如图所示装置验证质量守恒定律,能达到实验目的的物质组合是( )
A.过氧化氢溶液和二氧化锰
B.碳酸钠和稀盐酸
C.铁和硫酸铜溶液
D.蔗糖和水
8.下图是某反应前后分子种类变化的微观示意图。下列说法正确的是
A.反应前后分子个数不变
B.反应中涉及到2种氧化物
C.反应中甲、乙分子个数比为1:1
D.丙的相对分子质量为64g
9.工业上,煅烧石灰石(主要成分是CaCO3)可制得生石灰(CaO)和二氧化碳。现有氧化钙和碳酸钙的固体混合物156g,高温煅烧至完全反应,得到固体质量112g,则原固体混合物中钙元素的质量为
A.40g
B.60g
C.80g
D.56g
10.在某化学反应
2XY
+
Y2
=2Z中,Z物质的化学式符合(
)
A.XY2
B.X2Y
C.X2Y2
D.X3Y2
11.化学反应:3Cu+8HNO3═3Cu(NO3)2+2X+4H2O中,X的化学式为
A.CuO
B.NO2
C.N2O
D.NO
12.分别分解高锰酸钾、氯酸钾、过氧化氢三种物质,都可以制得氧气。这说明三种物质的组成中都含有
A.氧气
B.氧分子
C.氧化物
D.氧元素
二、填空题。本大题共6小题。
13.化学方程式表示的意义
(1)质的方面:表示______、______、______。
(2)量的方面:①宏观:表示反应物和生成物各物质之间的_____;
②微观:表示反应物和生成物各物质之间的粒子_____。
14.将A、B、C、D四种物质放在密闭容器中加热,化学反应前后四种物质的质量关系如下列所示:
A
B
C
D
反应前/g
16
4
4
111
反应后/g
20
X
89
0
则:
(1)该反应的反应物是___,生成物是____;
(2)表中“X”值为___;
(3)该反应属于___反应(填“化合”“分解”)。
15.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下反应,测得反应前后各物质质量如下表:
物质
甲
乙
丙
丁
反应前质量/g
3
5
20
4
反应后质量/g
待测
14
3
12
请分析该表后,回答下列问题:
(1)反应后甲的质量为_________g,反应中甲物质的作用可能是_________
。
(2)该反应中生成物的质量比为_________。
(3)写出符合该反应类型的一个文字表达式_______________________。
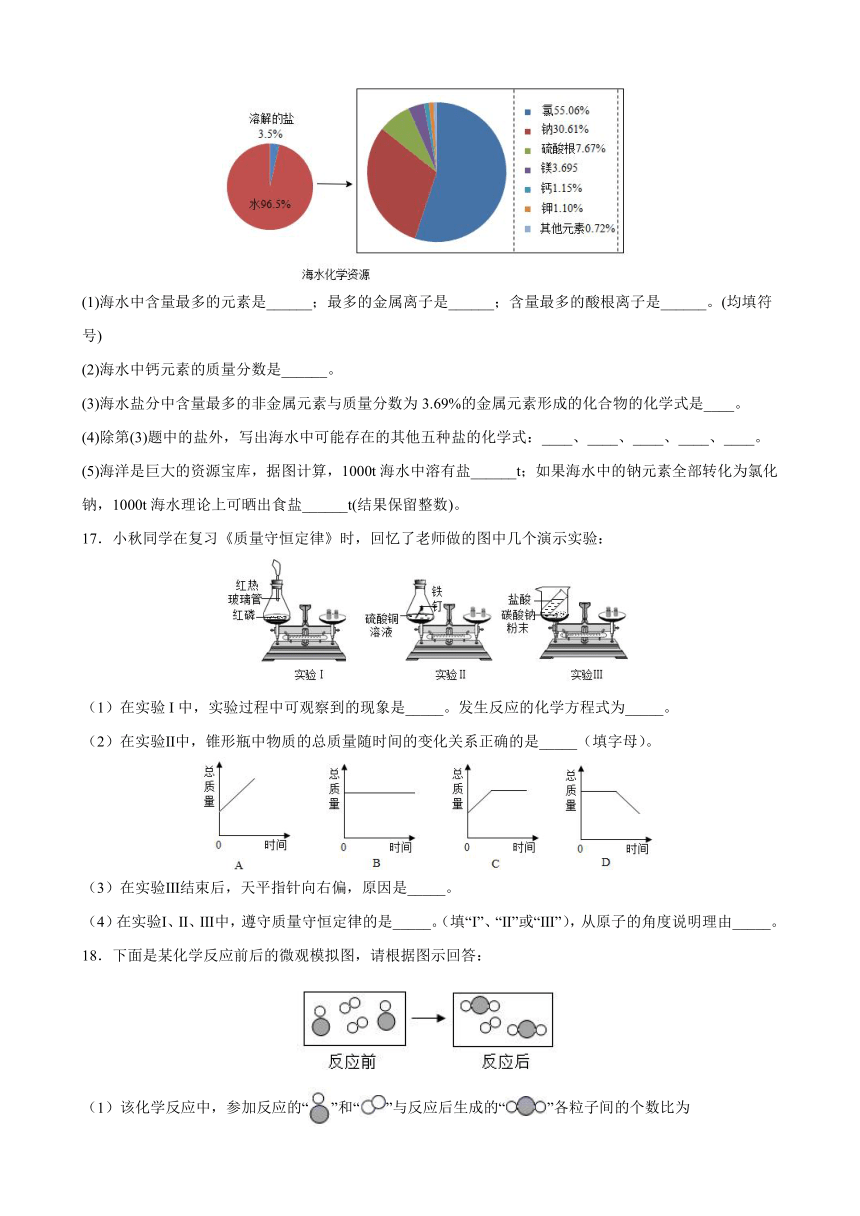
16.阅读下列“海水中的化学资源”图表,回答下列问题。
(1)海水中含量最多的元素是______;最多的金属离子是______;含量最多的酸根离子是______。(均填符号)
(2)海水中钙元素的质量分数是______。
(3)海水盐分中含量最多的非金属元素与质量分数为3.69%的金属元素形成的化合物的化学式是____。
(4)除第(3)题中的盐外,写出海水中可能存在的其他五种盐的化学式:____、____、____、____、____。
(5)海洋是巨大的资源宝库,据图计算,1000t海水中溶有盐______t;如果海水中的钠元素全部转化为氯化钠,1000t海水理论上可晒出食盐______t(结果保留整数)。
17.小秋同学在复习《质量守恒定律》时,回忆了老师做的图中几个演示实验:
(1)在实验I中,实验过程中可观察到的现象是_____。发生反应的化学方程式为_____。
(2)在实验Ⅱ中,锥形瓶中物质的总质量随时间的变化关系正确的是_____(填字母)。
(3)在实验Ⅲ结束后,天平指针向右偏,原因是_____。
(4)在实验Ⅰ、Ⅱ、Ⅲ中,遵守质量守恒定律的是_____。(填“Ⅰ”、“Ⅱ”或“Ⅲ”),从原子的角度说明理由_____。
18.下面是某化学反应前后的微观模拟图,请根据图示回答:
(1)该化学反应中,参加反应的“”和“”与反应后生成的“”各粒子间的个数比为______________。
(2)该反应的基本反应类型为______________。
(3)根据图所示,以具体物质为例,写出符合该反应的化学方程式______________。
参考答案
1.B
【解析】A、该反应可表示一氧化碳与氧气在点燃条件下反应生成二氧化碳,故选项说法正确;
B、参加反应的一氧化碳与氧气的质量比为(28×2):32=7:4,故选项说法错误;
C、化学反应前后碳原子、氧原子的个数均保持不变,故选项说法正确;
D、微观上,点燃条件下,每2个一氧化碳分子和1个氧分子反应生成2个二氧化碳分子,则参加反应的一氧化碳与生成的二氧化碳的分子个数比为2:2=1:1,故选项说法正确。
故选B。
2.B
【解析】已知X+Y=M+N,如果40gX和1gY恰好完全反应,生成9gN,由质量守恒定律,参加反应的X和Y的质量之和等于生成M和N的质量之和,则同时生成M的质量为40g+1g-9g=32g。故A、C、D均不符合题意,B符合题意。
故选B。
3.C
【解析】由反应的微观图可知,反应后仍含有1个A分子,说明反应前的4个A分子中有1个分子未参加反应,参加反应的A分子的数目为3、B分子的数目为1、生成的C分子的数目为2,故该反应的化学方程式中A、B、C的化学计量数之比为3:1:2;
故选C。
4.C
【解析】在化学反应前后,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和,这是宏观概念的解释,因此⑦符合题意;化学反应是生成新物质,因此物质种类一定发生变化,①不符合题意;化学反应前后,元素种类不发生变化,②符合题意;化学反应的实质时分子变为原子,原子重新组合形成新的分子,分子种类反应前后一定发生变化,但是分子数目不一定发生变化,③⑤不符合题意;原子在化学反应前后种类、数目一定不发生变化,这样才可以反应前后质量不变,④和⑥符合题意,因此可知②④⑥⑦符合题意,故选C。
5.D
【解析】A、由图1可知,随着反应的进行,相对湿度逐渐增大,说明乙醇燃烧有水产生,不符合题意;
B、由图1可知,乙醇燃烧生成水,水是由H、O两种元素组成,根据质量守恒定律,化学反应前后,元素的种类不变,可得乙醇中含氢元素,不符合题意;
C、由图2可知,随着反应的进行,二氧化碳的浓度逐渐增大,说明乙醇燃烧有二氧化碳产生,不符合题意;
D、由图2可知,乙醇燃烧生成二氧化碳,二氧化碳是由C、O两种元素组成,根据质量守恒定律,化学反应前后,元素的种类不变,可得乙醇中含有碳元素,氧元素可能来自于氧气,符合题意。
故选D。
6.C
【解析】A、煤燃烧化为灰烬,该反应是化学反应,符合质量守恒定律,选项A错误;
B、化学反应前后参加反应的各物质的质量总和与生成的各物质的质量总和相等,31g红磷在空气中完全燃烧生成71g五氧化二磷,实际消耗氧气的质量为71g﹣31g=40g,不是空气的质量,选项B错误;
C、一切化学反应都遵循质量守恒定律,选项C正确;
D、化学反应前后生成不同的物质,分子的个数可能改变,选项D错误;
故选:C。
7.C
【解析】A、过氧化氢在二氧化锰催化作用下分解生成水和氧气,氧气逸出装置,不能验证质量守恒定律,选项A不符合题意;
B、碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,二氧化碳逸出装置,不能验证质量守恒定律,选项B不符合题意;
C、铁和硫酸铜反应生成硫酸亚铁和铜,全部物质都在装置内,能够验证质量守恒定律,选项C符合题意;
D、蔗糖和水混合是溶解过程,没有新物质生成,属于物理变化,不发生化学反应,不能验证质量守恒定律,选项D不符合题意。故选C。
8.B
【解析】由微观粒子的反应过程可知,二氧化碳和氢气在一定条件下反应生成甲醇和水,反应的化学方程式为:。
A、由方程式可知,每5个分子变化成了4个分子,反应前后分子个数发生了变化,故A不符合题意;
B、由方程式可知,反应中涉及到二氧化硫和水两种氧化物,故B符合题意;
C、由方程式可知,反应中甲、乙分子个数比为2:3,故C不符合题意;
D、丙的相对分子质量为64,单位为1不是“g”,故D不符合题意;
9.C
【解析】完全反应后当固体质量不再变化时,为纯净物氧化钙的质量,此时氧化钙的质量为112g,则112g氧化钙中钙元素的质量为;故选C。
10.A
【解析】化学反应前后,元素的种类不变,原子的种类、总个数不变,由2XY+Y2=2Z可知,每个Z中含有1个X和2个Y,Z的化学式是XY2。
故选:A。
11.D
【解析】
试题分析:根据质量守恒定律化学反应前后原子的种类和数目不变,反应前Cu:3,H:8,N:8,O:24,反应后Cu:3,H:8,N:6,O:22,X前有化学计量数2,故X的化学式为NO
。故选D。
12.D
【解析】A、高锰酸钾、氯酸钾、过氧化氢三种物质都是纯净物,则三种物质的组成中不会有氧气这种物质,故A项错误;
B、纯净物中只有一种微粒构成,而氧气是由氧气分子构成的,则三种物质的组成中不会有氧分子,故B项错误;
C、物质的组成是用元素来描述的,而氧化物是一种物质的类别,高锰酸钾、氯酸钾都属于化合物,不属于氧化物,故C项错误;
D、物质是由元素组成的,三种物质都可以制得氧气,则三种物质中都含有氧元素,故D项正确;
答案:D。
13.反应物
生成物
反应条件
质量比
个数比
【解析】化学方程式的意义有:(1)从宏观上表示物质之间的变化和发生此变化的条件;(2)从微观上表示构成反应物和生成物的粒子之间的变化关系;(3)从量的变化上表示反应物与生成物各物质之间的质量关系。
14.D
ABC
26
分解
【解析】(1)反应后ABC质量增大,是生成物,D质量减小,是反应物;故填:D;ABC。
(2)根据质量守恒定律,X=16+4+4+111﹣20﹣89=26,表中“X”值为26;故填:26。
(3)该反应中反应物只有一种生成物有多种符合分解反应;故填:分解。
15.3
催化作用
9:8
过氧化氢水
+
氧气
【解析】(1)根据质量守恒定律,反应后甲的质量=(3+5+20+4)g-(14+3+12)g=3g;物质甲反应前后质量不变,可能为该反应的催化剂,在反应中起催化作用;
(2)物质乙、丁反应后质量变大,为反应的生成物,反应中乙、丁的质量比=(14-5)g:(12-4)g=9:8;
(3)物质丙在反应前后质量减小,为反应的反应物,该反应可表示为丙=乙+丁,且生成物质量比为9:8;过氧化氢在二氧化锰催化下分解生成水和氧气符合该反应的特点;文字表达式为:过氧化氢水+氧气(其余合理答案亦可给分)。
16.O
Na+
Cl-
0.04%
MgCl2
NaCl
KCl
CaCl2
Na2SO4
K2SO4
35
27
【解析】(1)在海水中含量最多的元素是氧元素,其符号为:O;最多的金属离子是:Na+;含量最多的酸根离子是氯离子,离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。故氯离子可表示为:Cl-;
(2)海水中溶解的盐的质量分数为3.5%,其中钙离子的含量为1.15%,故海水中钙元素的质量分数是:3.5%×1.15%=0.04%;
(3)海水盐分中含量最多的是氯化钠,其中非金属元素是氯元素,质量分数为3.69%的金属元素是镁元素,故氯元素与镁元素形成的化合物的化学式是:MgCl2;
(4)海水中可能存在的其他五种盐是氯化钠、氯化钾、氯化钙、硫酸钠、硫酸钾,其化学式为:NaCl、KCl、CaCl2、Na2SO4、K2SO4;
(5)
1000t海水中溶有盐的质量=1000t×3.5%=35t;如果海水中的钠元素全部转化为氯化钠,1000t海水理论上可晒出食盐的质量=35t×30.61%÷≈27t。
17.红磷燃烧生成大量白烟,放出热量,气球先膨胀后缩小,天平平衡
B
盐酸和碳酸钠反应生成的气体逸出装置
Ⅰ、Ⅱ、Ⅲ
反应前后,原子的种类数目和质量均不变
【解析】(1)红磷燃烧产生大量的白烟,气体受热膨胀先变大,当红磷燃烧完后锥形瓶的温度降到室温气球会因为装置中的氧气被消耗气压减小气球会变瘪甚至缩进玻璃管中;故填:红磷燃烧生成大量白烟,放出热量,气球先膨胀后缩小,天平平衡。对应化学方程式为。
(2)铁和硫酸铜反应生成硫酸亚铁和铜,没有气体生成,反应前后物质的总质量不发生改变,该装置中物质的总质量不发生改变,所以装置中物质的总质量不发生改变;故选B。
(3)碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,反应生成的二氧化碳逃逸,没有称量到它的质量,故天平指针向右偏;
(4)Ⅰ、Ⅱ、Ⅲ均发生化学变化,所有化学变化均遵循质量守恒定律。质量守恒定律的微观解释是反应前后,原子的种类数目和质量均不变。
18.2:1:2
化合反应
【解析】(1)根据微观模拟图,反应前有2个分子,反应后有1个分子,说明只有1个分子参加反应;则反应中、、三种分子个数比为2:1:2;因此反应中、、三种分子个数比为2:1:2;
(2)该反应为两种物质反应生成一种物质,符合化合反应“多变一”的特点,该反应属于化合反应;
(3)从微量,可推知,这2种元素能形成AB和AB2形式的化合物,如CO,CO2符合要求。且一氧化碳与氧气在点燃的条件下可转化为二氧化碳。符合图示要求。故可填(其他合理也可)。
课题5.1
质量守恒定律
一、单选题。本大题共12小题。每小题只有一个选项符合题意
1.下列关于2CO+O22CO2的说法不正确的是( )
A.表示一氧化碳与氧气在点燃条件下反应生成二氧化碳
B.参加反应的一氧化碳与氧气的质量比为7:8
C.反应前后碳原子、氧原子的个数均保持不变
D.参加反应的一氧化碳与生成的二氧化碳的分子个数比为1:1
2.已知X+Y=M+N,如果40gX和1gY恰好完全反应,生成9gN,则同时生成M的质量为( )
A.41g
B.32g
C.39g
D.10g
3.下图表示某反应前后反应物与生成物分子及其数目的变化,其中,分别表示A、B、C三种不同的分子,该反应的化学方程式中A、B、C前的化学计量数之比为(
)
A.4:1:3
B.4:1:2
C.3:1:2
D.3:1:3
4.化学反应前后一定没有变化的是( )
①物质种类
②元素种类
③分子种类
④原子种类
⑤分子数目
⑥原子数目
⑦物质的总质量
A.①②⑤⑥⑦
B.②③④⑤⑥
C.②④⑥⑦
D.①②④⑤⑥⑦
5.实验小组在密闭容器中用CO2和湿度两种传感器探究乙醇燃烧的产物。测定结果如下图所示。下列说法不正确的是
A.图1曲线说明乙醇燃烧有水产生
B.根据图1,可推理得出乙醇中含有氢元素
C.图2曲线说明乙醇燃烧有CO2产生
D.根据图2,可推理得出乙醇中含有碳和氧元素
6.关于质量守恒定律,下列叙述中正确的是( )
A.煤燃烧化为灰烬,该反应不符合质量守恒定律
B.31g红磷在空气中完全燃烧生成71g五氧化二磷,实际消耗空气的质量为40g
C.一切化学反应都遵循质量守恒定律
D.在化学反应中反应物的分子数等于生成物的分子数
7.用如图所示装置验证质量守恒定律,能达到实验目的的物质组合是( )
A.过氧化氢溶液和二氧化锰
B.碳酸钠和稀盐酸
C.铁和硫酸铜溶液
D.蔗糖和水
8.下图是某反应前后分子种类变化的微观示意图。下列说法正确的是
A.反应前后分子个数不变
B.反应中涉及到2种氧化物
C.反应中甲、乙分子个数比为1:1
D.丙的相对分子质量为64g
9.工业上,煅烧石灰石(主要成分是CaCO3)可制得生石灰(CaO)和二氧化碳。现有氧化钙和碳酸钙的固体混合物156g,高温煅烧至完全反应,得到固体质量112g,则原固体混合物中钙元素的质量为
A.40g
B.60g
C.80g
D.56g
10.在某化学反应
2XY
+
Y2
=2Z中,Z物质的化学式符合(
)
A.XY2
B.X2Y
C.X2Y2
D.X3Y2
11.化学反应:3Cu+8HNO3═3Cu(NO3)2+2X+4H2O中,X的化学式为
A.CuO
B.NO2
C.N2O
D.NO
12.分别分解高锰酸钾、氯酸钾、过氧化氢三种物质,都可以制得氧气。这说明三种物质的组成中都含有
A.氧气
B.氧分子
C.氧化物
D.氧元素
二、填空题。本大题共6小题。
13.化学方程式表示的意义
(1)质的方面:表示______、______、______。
(2)量的方面:①宏观:表示反应物和生成物各物质之间的_____;
②微观:表示反应物和生成物各物质之间的粒子_____。
14.将A、B、C、D四种物质放在密闭容器中加热,化学反应前后四种物质的质量关系如下列所示:
A
B
C
D
反应前/g
16
4
4
111
反应后/g
20
X
89
0
则:
(1)该反应的反应物是___,生成物是____;
(2)表中“X”值为___;
(3)该反应属于___反应(填“化合”“分解”)。
15.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下反应,测得反应前后各物质质量如下表:
物质
甲
乙
丙
丁
反应前质量/g
3
5
20
4
反应后质量/g
待测
14
3
12
请分析该表后,回答下列问题:
(1)反应后甲的质量为_________g,反应中甲物质的作用可能是_________
。
(2)该反应中生成物的质量比为_________。
(3)写出符合该反应类型的一个文字表达式_______________________。
16.阅读下列“海水中的化学资源”图表,回答下列问题。
(1)海水中含量最多的元素是______;最多的金属离子是______;含量最多的酸根离子是______。(均填符号)
(2)海水中钙元素的质量分数是______。
(3)海水盐分中含量最多的非金属元素与质量分数为3.69%的金属元素形成的化合物的化学式是____。
(4)除第(3)题中的盐外,写出海水中可能存在的其他五种盐的化学式:____、____、____、____、____。
(5)海洋是巨大的资源宝库,据图计算,1000t海水中溶有盐______t;如果海水中的钠元素全部转化为氯化钠,1000t海水理论上可晒出食盐______t(结果保留整数)。
17.小秋同学在复习《质量守恒定律》时,回忆了老师做的图中几个演示实验:
(1)在实验I中,实验过程中可观察到的现象是_____。发生反应的化学方程式为_____。
(2)在实验Ⅱ中,锥形瓶中物质的总质量随时间的变化关系正确的是_____(填字母)。
(3)在实验Ⅲ结束后,天平指针向右偏,原因是_____。
(4)在实验Ⅰ、Ⅱ、Ⅲ中,遵守质量守恒定律的是_____。(填“Ⅰ”、“Ⅱ”或“Ⅲ”),从原子的角度说明理由_____。
18.下面是某化学反应前后的微观模拟图,请根据图示回答:
(1)该化学反应中,参加反应的“”和“”与反应后生成的“”各粒子间的个数比为______________。
(2)该反应的基本反应类型为______________。
(3)根据图所示,以具体物质为例,写出符合该反应的化学方程式______________。
参考答案
1.B
【解析】A、该反应可表示一氧化碳与氧气在点燃条件下反应生成二氧化碳,故选项说法正确;
B、参加反应的一氧化碳与氧气的质量比为(28×2):32=7:4,故选项说法错误;
C、化学反应前后碳原子、氧原子的个数均保持不变,故选项说法正确;
D、微观上,点燃条件下,每2个一氧化碳分子和1个氧分子反应生成2个二氧化碳分子,则参加反应的一氧化碳与生成的二氧化碳的分子个数比为2:2=1:1,故选项说法正确。
故选B。
2.B
【解析】已知X+Y=M+N,如果40gX和1gY恰好完全反应,生成9gN,由质量守恒定律,参加反应的X和Y的质量之和等于生成M和N的质量之和,则同时生成M的质量为40g+1g-9g=32g。故A、C、D均不符合题意,B符合题意。
故选B。
3.C
【解析】由反应的微观图可知,反应后仍含有1个A分子,说明反应前的4个A分子中有1个分子未参加反应,参加反应的A分子的数目为3、B分子的数目为1、生成的C分子的数目为2,故该反应的化学方程式中A、B、C的化学计量数之比为3:1:2;
故选C。
4.C
【解析】在化学反应前后,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和,这是宏观概念的解释,因此⑦符合题意;化学反应是生成新物质,因此物质种类一定发生变化,①不符合题意;化学反应前后,元素种类不发生变化,②符合题意;化学反应的实质时分子变为原子,原子重新组合形成新的分子,分子种类反应前后一定发生变化,但是分子数目不一定发生变化,③⑤不符合题意;原子在化学反应前后种类、数目一定不发生变化,这样才可以反应前后质量不变,④和⑥符合题意,因此可知②④⑥⑦符合题意,故选C。
5.D
【解析】A、由图1可知,随着反应的进行,相对湿度逐渐增大,说明乙醇燃烧有水产生,不符合题意;
B、由图1可知,乙醇燃烧生成水,水是由H、O两种元素组成,根据质量守恒定律,化学反应前后,元素的种类不变,可得乙醇中含氢元素,不符合题意;
C、由图2可知,随着反应的进行,二氧化碳的浓度逐渐增大,说明乙醇燃烧有二氧化碳产生,不符合题意;
D、由图2可知,乙醇燃烧生成二氧化碳,二氧化碳是由C、O两种元素组成,根据质量守恒定律,化学反应前后,元素的种类不变,可得乙醇中含有碳元素,氧元素可能来自于氧气,符合题意。
故选D。
6.C
【解析】A、煤燃烧化为灰烬,该反应是化学反应,符合质量守恒定律,选项A错误;
B、化学反应前后参加反应的各物质的质量总和与生成的各物质的质量总和相等,31g红磷在空气中完全燃烧生成71g五氧化二磷,实际消耗氧气的质量为71g﹣31g=40g,不是空气的质量,选项B错误;
C、一切化学反应都遵循质量守恒定律,选项C正确;
D、化学反应前后生成不同的物质,分子的个数可能改变,选项D错误;
故选:C。
7.C
【解析】A、过氧化氢在二氧化锰催化作用下分解生成水和氧气,氧气逸出装置,不能验证质量守恒定律,选项A不符合题意;
B、碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,二氧化碳逸出装置,不能验证质量守恒定律,选项B不符合题意;
C、铁和硫酸铜反应生成硫酸亚铁和铜,全部物质都在装置内,能够验证质量守恒定律,选项C符合题意;
D、蔗糖和水混合是溶解过程,没有新物质生成,属于物理变化,不发生化学反应,不能验证质量守恒定律,选项D不符合题意。故选C。
8.B
【解析】由微观粒子的反应过程可知,二氧化碳和氢气在一定条件下反应生成甲醇和水,反应的化学方程式为:。
A、由方程式可知,每5个分子变化成了4个分子,反应前后分子个数发生了变化,故A不符合题意;
B、由方程式可知,反应中涉及到二氧化硫和水两种氧化物,故B符合题意;
C、由方程式可知,反应中甲、乙分子个数比为2:3,故C不符合题意;
D、丙的相对分子质量为64,单位为1不是“g”,故D不符合题意;
9.C
【解析】完全反应后当固体质量不再变化时,为纯净物氧化钙的质量,此时氧化钙的质量为112g,则112g氧化钙中钙元素的质量为;故选C。
10.A
【解析】化学反应前后,元素的种类不变,原子的种类、总个数不变,由2XY+Y2=2Z可知,每个Z中含有1个X和2个Y,Z的化学式是XY2。
故选:A。
11.D
【解析】
试题分析:根据质量守恒定律化学反应前后原子的种类和数目不变,反应前Cu:3,H:8,N:8,O:24,反应后Cu:3,H:8,N:6,O:22,X前有化学计量数2,故X的化学式为NO
。故选D。
12.D
【解析】A、高锰酸钾、氯酸钾、过氧化氢三种物质都是纯净物,则三种物质的组成中不会有氧气这种物质,故A项错误;
B、纯净物中只有一种微粒构成,而氧气是由氧气分子构成的,则三种物质的组成中不会有氧分子,故B项错误;
C、物质的组成是用元素来描述的,而氧化物是一种物质的类别,高锰酸钾、氯酸钾都属于化合物,不属于氧化物,故C项错误;
D、物质是由元素组成的,三种物质都可以制得氧气,则三种物质中都含有氧元素,故D项正确;
答案:D。
13.反应物
生成物
反应条件
质量比
个数比
【解析】化学方程式的意义有:(1)从宏观上表示物质之间的变化和发生此变化的条件;(2)从微观上表示构成反应物和生成物的粒子之间的变化关系;(3)从量的变化上表示反应物与生成物各物质之间的质量关系。
14.D
ABC
26
分解
【解析】(1)反应后ABC质量增大,是生成物,D质量减小,是反应物;故填:D;ABC。
(2)根据质量守恒定律,X=16+4+4+111﹣20﹣89=26,表中“X”值为26;故填:26。
(3)该反应中反应物只有一种生成物有多种符合分解反应;故填:分解。
15.3
催化作用
9:8
过氧化氢水
+
氧气
【解析】(1)根据质量守恒定律,反应后甲的质量=(3+5+20+4)g-(14+3+12)g=3g;物质甲反应前后质量不变,可能为该反应的催化剂,在反应中起催化作用;
(2)物质乙、丁反应后质量变大,为反应的生成物,反应中乙、丁的质量比=(14-5)g:(12-4)g=9:8;
(3)物质丙在反应前后质量减小,为反应的反应物,该反应可表示为丙=乙+丁,且生成物质量比为9:8;过氧化氢在二氧化锰催化下分解生成水和氧气符合该反应的特点;文字表达式为:过氧化氢水+氧气(其余合理答案亦可给分)。
16.O
Na+
Cl-
0.04%
MgCl2
NaCl
KCl
CaCl2
Na2SO4
K2SO4
35
27
【解析】(1)在海水中含量最多的元素是氧元素,其符号为:O;最多的金属离子是:Na+;含量最多的酸根离子是氯离子,离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。故氯离子可表示为:Cl-;
(2)海水中溶解的盐的质量分数为3.5%,其中钙离子的含量为1.15%,故海水中钙元素的质量分数是:3.5%×1.15%=0.04%;
(3)海水盐分中含量最多的是氯化钠,其中非金属元素是氯元素,质量分数为3.69%的金属元素是镁元素,故氯元素与镁元素形成的化合物的化学式是:MgCl2;
(4)海水中可能存在的其他五种盐是氯化钠、氯化钾、氯化钙、硫酸钠、硫酸钾,其化学式为:NaCl、KCl、CaCl2、Na2SO4、K2SO4;
(5)
1000t海水中溶有盐的质量=1000t×3.5%=35t;如果海水中的钠元素全部转化为氯化钠,1000t海水理论上可晒出食盐的质量=35t×30.61%÷≈27t。
17.红磷燃烧生成大量白烟,放出热量,气球先膨胀后缩小,天平平衡
B
盐酸和碳酸钠反应生成的气体逸出装置
Ⅰ、Ⅱ、Ⅲ
反应前后,原子的种类数目和质量均不变
【解析】(1)红磷燃烧产生大量的白烟,气体受热膨胀先变大,当红磷燃烧完后锥形瓶的温度降到室温气球会因为装置中的氧气被消耗气压减小气球会变瘪甚至缩进玻璃管中;故填:红磷燃烧生成大量白烟,放出热量,气球先膨胀后缩小,天平平衡。对应化学方程式为。
(2)铁和硫酸铜反应生成硫酸亚铁和铜,没有气体生成,反应前后物质的总质量不发生改变,该装置中物质的总质量不发生改变,所以装置中物质的总质量不发生改变;故选B。
(3)碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,反应生成的二氧化碳逃逸,没有称量到它的质量,故天平指针向右偏;
(4)Ⅰ、Ⅱ、Ⅲ均发生化学变化,所有化学变化均遵循质量守恒定律。质量守恒定律的微观解释是反应前后,原子的种类数目和质量均不变。
18.2:1:2
化合反应
【解析】(1)根据微观模拟图,反应前有2个分子,反应后有1个分子,说明只有1个分子参加反应;则反应中、、三种分子个数比为2:1:2;因此反应中、、三种分子个数比为2:1:2;
(2)该反应为两种物质反应生成一种物质,符合化合反应“多变一”的特点,该反应属于化合反应;
(3)从微量,可推知,这2种元素能形成AB和AB2形式的化合物,如CO,CO2符合要求。且一氧化碳与氧气在点燃的条件下可转化为二氧化碳。符合图示要求。故可填(其他合理也可)。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
