高中化学苏教版(2019)必修第一册 专题4 第三单元 防治二氧化硫对环境的污染(65张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)必修第一册 专题4 第三单元 防治二氧化硫对环境的污染(65张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-21 10:26:09 | ||
图片预览








文档简介
(共65张PPT)
第三单元 防治二氧化硫对环境的污染
1.了解自然界中硫元素的循环、酸雨的形成及治理方法。
2.了解空气质量评价和空气质量指数。
3.提高环保意识,使学生形成与自然友好、促进可持续发展的正确认识。
核心素养发展目标
一、自然界中的硫循环
随堂演练 知识落实
课时对点练
二、酸雨及其治理
内
容
索
引
三、空气质量评价
自然界中的硫循环
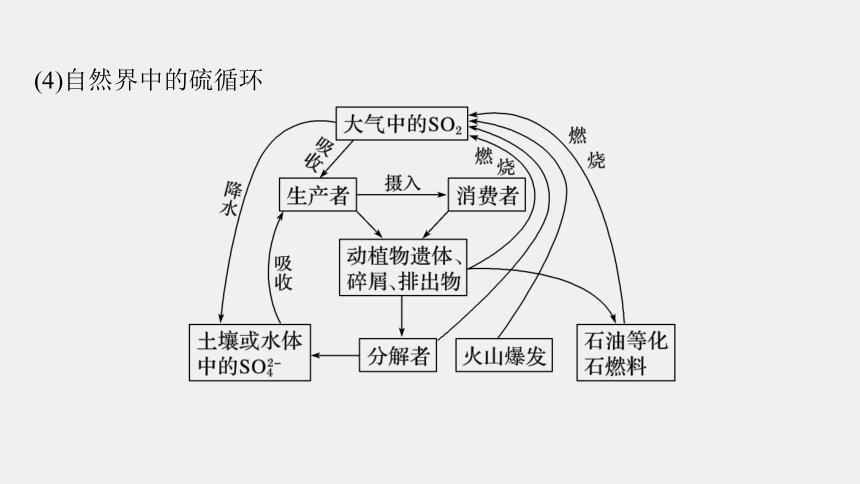
(1)SO2的来源:
、
、
等。
(2)自然界中的硫循环:地壳的岩石里、生物体内以及大气与水中都含有
元素。随着地壳运动、生命活动以及大气与水的流动,这些含硫物质不断地发生
和
,形成了硫在自然界中的
。
(3)地壳中的
、
和
等都含有硫元素,这些矿物通过风化分解、燃烧、火山爆发等方式释放出
、
等气体,这些气体有些进入大气,有些转化为
、
溶入河流或海洋,还有些则被土壤中的硫化细菌吸收。
一、自然界中的硫循环
含硫化石燃料燃烧
含硫金属矿石冶炼
硫酸生产
硫
转化
转移
循环
硫黄矿
硫铁矿
煤
SO2
H2S
亚硫酸盐
硫酸盐
(4)自然界中的硫循环
(5)自然界中含硫物质非常丰富
如H2S、S、SO2、SO3、H2SO3、H2SO4、Na2SO4、CaSO4等。
上述物质在“价—类”二维图中的相应位置如下:
(1)大气中的硫可以酸雨的形式进入土壤( )
(2)煤和石油中的硫燃烧生成二氧化硫进入大气( )
(3)化石燃料中的硫主要来自形成化石燃料的生物体( )
(4)自然界中硫只能以化合态存在( )
判断正误
√
×
√
√
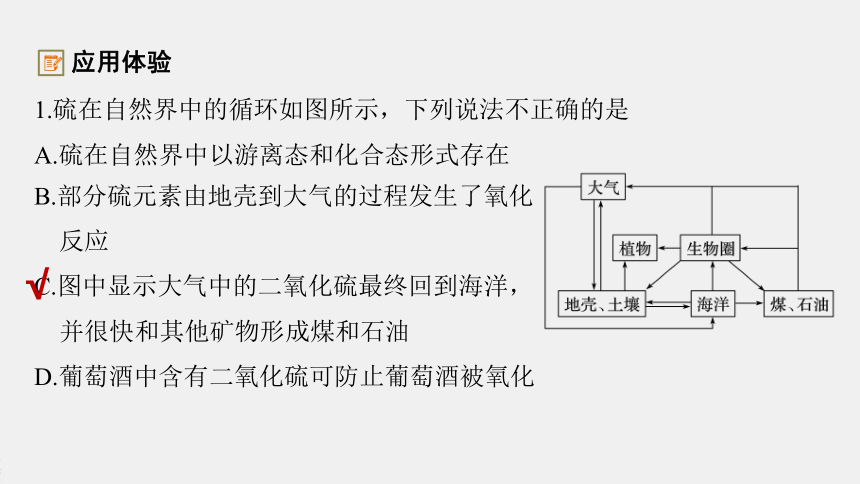
1.硫在自然界中的循环如图所示,下列说法不正确的是
A.硫在自然界中以游离态和化合态形式存在
B.部分硫元素由地壳到大气的过程发生了氧化
反应
C.图中显示大气中的二氧化硫最终回到海洋,
并很快和其他矿物形成煤和石油
D.葡萄酒中含有二氧化硫可防止葡萄酒被氧化
√
应用体验
解析 火山爆发时地壳中的硫和氧气反应生成二氧化硫,部分硫元素由地壳到大气的过程发生了氧化反应;形成煤和石油的过程是一个漫长过程;二氧化硫具有还原性,能被强氧化剂氧化,葡萄酒中含有二氧化硫被氧化,所以可防止葡萄酒被氧化。
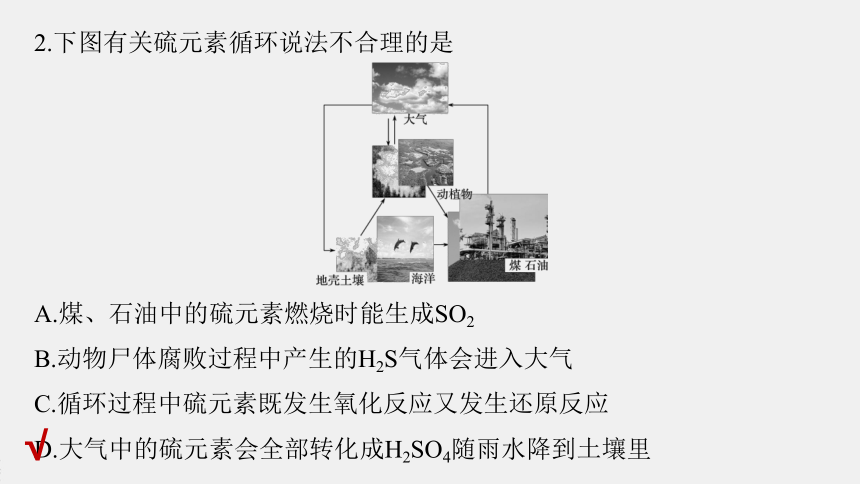
2.下图有关硫元素循环说法不合理的是
A.煤、石油中的硫元素燃烧时能生成SO2
B.动物尸体腐败过程中产生的H2S气体会进入大气
C.循环过程中硫元素既发生氧化反应又发生还原反应
D.大气中的硫元素会全部转化成H2SO4随雨水降到土壤里
√
解析 A项,煤、石油中的硫元素燃烧时能生成SO2,正确;
B项,动物尸体腐败过程中产生的H2S气体会进入大气,正确;
C项,循环过程中硫元素既发生氧化反应又发生还原反应,正确;
D项,大气中的硫元素部分转化成亚硫酸,进一步转化为H2SO4随雨水降到土壤里,错误。
返回
1.硫酸型酸雨的形成
(1)酸雨:pH<
的降水被称为酸雨。正常雨水pH约为
,这是溶解了
的缘故。
(2)形成:
的燃烧、含硫金属矿石的冶炼和
的生产等产生的废气中含有二氧化硫。
二、酸雨及其治理
5.6
5.6
CO2
硫酸
化石燃料
写出图中标号表示的化学方程式:
①_____________________。
②___________________。
③___________________。
④_____________________。
2SO2+O2
2SO3
SO2+H2O
H2SO3
SO3+H2O===H2SO4
2H2SO3+O2===2H2SO4
2.酸雨的危害
(1)
,危害水生生物。
(2)
,降低土壤肥力,影响作物生长。
(3)腐蚀建筑物。
酸化湖泊
酸化土壤
3.酸雨的防治
(1)消除
,研究开发
(如太阳能、核能、氢能等)。
(2)对含硫燃料进行
处理。
(3)对SO2废气进行处理或回收利用。
污染源
新能源
脱硫
注意:工业上选择处理SO2的方法,会考虑环保、成本、工艺流程是否简便易行等因素。
SO2+2NaOH===Na2SO3+H2O
SO2+Ca(OH)2===CaSO3+H2O
SO2+CaO===CaSO3
(1)pH<7的雨水均称为酸雨( )
(2)酸雨会使土壤、湖泊酸化( )
(3)酸雨形成过程中不涉及氧化还原反应( )
(4)燃煤中加入石灰石可防治酸雨( )
判断正误
×
×
√
√
理解应用
1.室内空气污染是人类健康的“隐形杀手”,越来越受到人们关注。下列不会造成室内空气污染的是
A.家用燃料燃烧产生的CO、CO2
B.家庭烹调产生的油烟
C.装饰材料散发出的甲醛、苯等
D.保持室内空气流通
√
解析 A项,家用燃料燃烧产生的CO有毒,属于室内空气污染物,CO2虽然无毒,但量大了对人体也有害;
B项,烹调产生的油烟含有使人致癌的成分,属于室内空气污染物;
C项,装饰材料的释放物中的有毒物质甲醛和苯,属于室内空气污染物;
D项,保持室内空气流通,可有效防止空气污染。
2.(1)我国酸雨危害十分严重,是世界三大酸雨地区之一,且主要为硫酸型酸雨。形成硫酸型酸雨主要是由于空气中____含量超标,主要反应的化学方程式为
途径一:_________________________________________;
途径二:_________________________________________。
SO2
SO2+H2O
H2SO3,2H2SO3+O2===2H2SO4
2SO2+O2
2SO3,SO3+H2O===H2SO4
解析 酸雨的形成首先是含硫燃料燃烧生成二氧化硫,二氧化硫与雨水反应生成亚硫酸,亚硫酸被空气中的氧气氧化成硫酸,形成酸雨。或空气中的二氧化硫气体在粉尘作催化剂的条件下生成三氧化硫,三氧化硫再与雨水形成酸雨。
(2)某校科技活动小组的同学采集酸雨样品,每隔一段时间测定样品的pH,得到下列数据:
时间
开始
8
h后
16
h后
24
h后
pH
5.0
4.8
4.5
4.3
请根据上述材料,回答下列有关问题:
酸雨放置时,pH发生变化的主要原因为___________________________
_____。
H2SO3被氧化成H2SO4,酸性
增强
解析 酸雨形成的主要原因是:大量燃烧化石燃料产生二氧化硫,随雨水降落形成酸雨,酸雨放置时,发生的反应为:2H2SO3+O2===2H2SO4,由弱酸生成强酸,酸性增强。
(3)你认为减少酸雨产生的途径可采取的措施是____(填字母)。
A.用煤作燃料
B.把工厂烟囱造高
C.燃料脱硫
D.开发新能源
CD
解析 少用煤作燃料、燃料脱硫、开发新的能源等措施可以减少二氧化硫气体的排放,从而减少酸雨的形成。
返回
三、空气质量评价
1.空气质量指数(AQI)
人们研究空气污染,可以通过
来获取空气质量状况的信息。
(1)定义
空气质量指数是根据空气中的
、
、
、
、
和
的浓度计算出来的数值。
(2)与空气质量的关系
空气质量指数
,空气质量越好,对人体健康的危害就越小。
空气质量指数AQI
细颗粒物(PM2.5)
可吸入颗粒物(PM10)
二氧化硫
二氧化氮
臭氧
一氧化碳
越小
2.空气质量指数(AQI)的确定
(1)确定方法
空气质量监测人员测出空气质量指数中这六大污染物的浓度,再换算成它们的
,其中指数
的污染物会被确定为首要污染物,____
的质量指数即为该地区的空气质量指数。
(2)与空气质量等级的关系
空气质量指数
,空气质量等级污染程度越
。
质量指数
最大
首要
越大
严重
污染物
3.雾霾
(1)定义:大量极细微的颗粒物均匀地悬浮在空中,这些颗粒物容易吸附空气中的水蒸气形成
,使空气水平能见度小于
,我们把这种空气混浊现象叫作雾霾。
(2)颗粒物分类依据是
。
(3)颗粒物分类
细颗粒物(PM2.5,直径小于2.5
μm)
可吸入颗粒物(PM10,直径小于10
μm)
(4)SO2的排放与雾霾形成的关系
空气中的SO2在一定条件下形成CaSO4,硫酸盐在PM2.5中所占比例较大。
雾滴
10
km
颗粒物直径的大小
4.大气污染的防治
(1)改变能源结构;
(2)控制SO2等有害气体的排放;
(3)提高污染排放标准。
(1)NO2、SO2、PM2.5、N2均属于空气污染物( )
(2)空气质量指数越高,空气质量越好( )
(3)大量化石燃料的燃烧是形成雾霾的一个重要原因( )
(4)改变能源结构有利于大气污染的防治( )
判断正误
×
×
√
√
1.雾霾、PM2.5已经成为公众耳熟能详的热词。“PM2.5”是指大气中直径小于2.5微米的细小颗粒物,也称为可入肺颗粒物。下列有关说法中错误的是
A.雾霾有可能产生丁达尔效应
B.雾霾的形成与工业排放的烟气和汽车尾气有关系
C.“PM2.5”分散在大气中形成气溶胶,性质稳定,没有必要纳入空气质
量评价指标
D.雾霾天气严重危害人体健康
√
应用体验
解析 A项,“PM2.5”是指大气中直径小于2.5微米的细小颗粒物,若直径在1~100
nm之间也能形成胶体,产生丁达尔效应,正确;
B项,工业排放的烟气是形成雾霾天气的最大元凶,正确;
C项,PM2.5主要来自于化石燃料的燃烧,化石燃料燃烧产生有害气体,能影响空气质量,要纳入空气质量评价指标,错误。
2.空气质量等级依次为:优、良、轻微污染、轻度污染、中度污染、中度重污染、重污染等。某地区空气污染物指数为SO2:78、NO2:43、可吸入颗粒物:163。则该地区的空气污染指数为____,该地区空气质量等级为________,首要污染物为_____________。
163
轻度污染
可吸入颗粒物
解析 其中最高的污染指数为163,故该地区的空气污染指数为163。空气污染指数在151~200之间,空气质量级别为Ⅲ(2)级,空气质量状况属于轻度污染。可吸入颗粒物的指数最高,为首要污染物。
返回
1.下列有关酸雨的说法中正确的是
A.雨水溶解二氧化碳的结果
B.pH<7的雨水
C.引起呼吸系统的疾病
D.空气中硫、氮的氧化物随雨水下降的结果
√
1
2
3
5
随堂演练 知识落实
4
解析 正常雨水显酸性,酸雨的pH小于5.6。
2.入冬以来,雾霾天气已经严重影响了我国多数人的正常出行和生活节奏。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是
A.加高工厂的烟囱,使烟尘和废气运离地表
B.推广使用燃煤脱硫技术,防止SO2污染
C.研制新型高效可充电电池,发展纯电动汽车
D.开发利用绿色能源(例如太阳能)替代化石燃料
1
2
3
5
4
√
解析 加高工厂的烟囱,使烟尘和废气远离地表,不能改变空气中污染物的含量,A错误。
3.煤炭燃烧时会排放二氧化硫等污染物,为了减少污染物的排放,许多地方都使用了洁净煤(如脱硫)技术。读煤炭脱硫效率图,完成下题。
1
2
3
5
4
关于洁净煤技术的影响,叙述正确的是
A.该技术脱硫效率达到100%
B.该技术可以减小pH和酸雨危害
C.该技术使煤炭资源得到了循环利用
D.该技术提高了煤炭资源利用的经济价值
√
1
2
3
5
4
解析 洁净煤技术脱硫效率没达到100%,A错误;
洁净煤技术可使煤炭燃烧时排放的酸性气体减少,酸雨危害减小,pH增大,B错误;
该技术没有体现煤炭资源的循环利用,但提高了煤炭资源利用的经济价值。
4.下列物质中,属于“城市空气质量日报”报道的污染物是
A.N2
B.SO2
C.CO2
D.SO3
√
1
2
3
5
4
5.2013年1月,我国中东部的大部分地区出现雾霾天气,许多城市的空气质量已经达到了严重污染。下列有关说法中,正确的是
A.雾霾天气仅影响出行能见度,对人体健康没有影响
B.减少化石燃料燃烧和汽车尾气排放,是减少雾霾发生的有效措施
C.当光束分别通过雾霾和豆浆时,仅豆浆可看到一条光亮的通路
D.气候环境报告中新增的“PM2.5”就是雾霾
1
2
3
5
4
√
解析 雾霾有毒,所以雾霾天气对人体健康有害,故A项错误;
化石燃料燃烧和汽车尾气中含有粉尘,能形成雾霾天气,故B项正确;
雾霾和豆浆都属于胶体,当光束通过时都会产生一条光亮的通路,故C项错误;
雾霾天气指原因不明的因大量烟、尘等微粒悬浮而形成的浑浊现象,PM2.5:指环境空气中空气动力学当量直径小于2.5
μm的颗粒物,也称细颗粒物,二者不完全相同。
1
2
3
5
4
返回
课时对点练
题组一 自然界中的硫循环
1.硫在自然界中的循环过程如下图所示,下列说法不正确的是
A组 基础对点练
A.石油和煤等化石燃料中含有硫元素
B.大气中的二氧化硫只来源于火山喷
发产生的气体
C.地壳中的硫元素常以硫化物和硫酸
盐的形式存在
1
2
3
4
5
6
7
8
9
D.动植物遗体被微生物分解后,可产生
和SO2
√
1
2
3
4
5
6
7
8
9
解析 大气中的二氧化硫主要来源于化石燃料的燃烧、火山喷发和微生物的分解。
2.下列关于硫的叙述中不正确的是
A.硫是一种难溶于水的黄色固体
B.硫的化合物常存在于火山喷出的气体中和矿泉水里
C.硫在自然界中只能以硫化物和硫酸盐的形态存在
D.硫的燃烧产物二氧化硫是大气污染物之一
√
1
2
3
4
5
6
7
8
9
解析 硫在自然界中既能以化合态(主要为硫化物和硫酸盐)又能以游离态(火山喷口附近或地壳岩层)的形式存在。硫俗称硫黄,是一种黄色固体,难溶于水,微溶于酒精,易溶于二硫化碳,常用二硫化碳除去试管内壁附着的硫单质。
题组二 酸雨及其治理、空气质量评价
3.酸雨形成的最主要原因是
A.森林遭乱砍滥伐,破坏了生态平衡
B.工业上大量燃烧含硫燃料
C.大气中二氧化碳的含量增多
D.汽车排出大量尾气
√
1
2
3
4
5
6
7
8
9
解析 空气中硫的氧化物和氮的氧化物随雨水降下就形成酸雨。酸雨的形成主要是由于空气中SO2和NOx的增多。在我国主要是SO2的增多。空气中SO2的主要来源是:①化石燃料(煤和石油产品)的燃烧;②含硫矿石的冶炼;③硫酸、磷肥、纸浆厂的工业废气。目前,由于汽车用的燃料汽油、柴油等都经过了脱硫处理,所以形成酸雨的最主要原因是工业上大量燃烧含硫燃料。
1
2
3
4
5
6
7
8
9
4.下列气体中,无色有毒、能污染大气,能用碱液吸收的是
A.一氧化碳
B.二氧化碳
C.二氧化硫
D.氯气
1
2
3
4
5
6
7
8
9
解析 一氧化碳、二氧化硫、氯气有毒,一氧化碳不能与碱液反应,氯气为黄绿色。
√
5.现有以下几种措施:①对燃烧煤时产生的尾气进行除硫处理;②少用原煤作燃料;③燃煤时鼓入足量空气;④开发清洁能源。其中能减少酸雨产生的措施是
A.①②③
B.②③④
C.①②④
D.①③④
√
1
2
3
4
5
6
7
8
9
解析 煤及其他化石燃料中含S元素,它们燃烧产生的SO2大量排放是形成酸雨的主要原因。对燃煤产生的尾气进行除硫,少用、不用原煤作燃料,开发清洁能源都可以减少SO2的排放,减少酸雨的产生。燃煤时鼓入足量空气只能提高煤的燃烧效率,不能减少SO2的排放。
1
2
3
4
5
6
7
8
9
6.2013年12月6日,上海遭遇重度雾霾,空气质量指数达六级重度污染。雾霾是雾和霾的混合物,其中雾是自然天气现象,霾的核心物质是悬浮在空气中的烟、灰尘等物质,其中霾属于悬浊液,雾所属的分散系是
A.溶液
B.悬浊液
C.乳浊液
D.胶体
√
解析 雾是小液滴,形成的分散系是胶体,答案选D。
7.空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防止扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的供应量
√
1
2
3
4
5
6
7
8
9
解析 A、B、C都是可采取的措施,
在D中,若加大不可再生资源石油、煤的开采速度,会造成资源缺乏,同时会使空气中的SO2、NOx含量增加。
8.形成酸雨的原理之一可简示为
1
2
3
4
5
6
7
8
9
回答下列问题:
(1)A物质的化学式为_____,B物质的化学式为____。
(2)洗涤含SO2的烟气,以下物质可作洗涤剂的是___
(填字母)
a.Ca(OH)2
b.Na2CO3
c.CaCl2
d.NaHSO3
SO2
SO3
ab
(3)利用钠碱循环法可脱除烟气中的SO2,在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是____
____________________。
(4)某有色金属冶炼厂排放的废气中含SO2,先用石灰浆吸收SO2,然后利用空气中的氧气将产物继续氧化成石膏(CaSO4·2H2O)。写出有关反应的两个化学方程式:______________________________________________
________________。
1
2
3
4
5
6
7
8
9
SO2
SO2+Ca(OH)2===CaSO3+H2O,2CaSO3+O2+2H2O
===2CaSO4·2H2O
9.SO2被称为“空中死神”,其对环境的危害常表现为________(填一种即可)。为了减少危害,人们进行了许多探索和研究,并且在实际应用中取得了一定的成果。
1
2
3
4
5
6
7
8
9
形成酸雨
解析 酸雨是人类大量使用煤、石油、天然气等化石燃料燃烧后产生的硫氧化物或氮氧化物在大气中经过复杂的化学反应后形成的,由于酸雨对生物有极大的危害,因此SO2被称为“空中死神”。
(1)工业上常用生石灰来处理煤炭中的SO2,这是利用了SO2属于_____氧化物的性质。
1
2
3
4
5
6
7
8
9
酸性
解析 二氧化硫是酸性氧化物,二氧化硫和CaO反应生成亚硫酸钙,亚硫酸钙不稳定,极易被空气中的氧气氧化生成硫酸钙,因此工业上常用生石灰来处理煤炭中的SO2。
1
2
3
4
5
6
7
8
9
①此种方法中,可以循环利用的物质是_________。
NaCl溶液
(2)近年来,有人提出了一种利用电解饱和氯化钠溶液(2NaCl+2H2O
2NaOH+Cl2↑+H2↑)循环治理含二氧化硫的废气并回收二氧化硫的方法。该方法的流程如下:
解析 根据流程图可知,电解氯化钠溶液得到NaOH溶液、氯气和氢气,亚硫酸氢钠和稀盐酸反应生成氯化钠溶液、SO2和水,所以能循环利用的物质是氯化钠溶液。
1
2
3
4
5
6
7
8
9
②写出反应Ⅰ的离子方程式:_______________________。
解析 亚硫酸氢钠和稀盐酸发生复分解反应的离子方程式为
+H+===H2O+SO2↑。
A.含硫杆菌及好氧/厌氧菌促进了硫
的循环
B.硫循环中硫的化合物均为无机物
C.上述硫循环中硫元素均被氧化
1.硫是生物必需的营养元素之一,下列关于如图所示的自然界中硫循环的说法正确的是
√
B组 综合强化练
1
2
3
4
5
D.烧煤时加石灰石,可减少酸雨及温室气体的排放
6
1
2
3
4
5
解析 硫酸盐、亚硫酸盐等在含硫杆菌及好氧/厌氧菌作用下缓慢转化成植物R1—S—R2,故含硫杆菌及好氧/厌氧菌促进了硫的循环,A项正确;
硫循环中硫的化合物有含硫的有机物,如煤、石油等,不全是无机物,B项错误;
含硫杆菌及好氧/厌氧菌将硫酸盐、亚硫酸盐中的硫还原成R1—S—R2,硫循环中硫元素有时被氧化,有时被还原,C项错误;
烧煤时加石灰石,可减少酸雨的排放,但生成二氧化碳,会增加温室气体的排放,D项错误。
6
2.(不定项)(2019·吉林榆树一中期末)某工厂的一个生产工艺流程如图所示,下列叙述正确的是
1
2
3
4
5
A.该工艺流程是用来制备H2SO4的
B.气体M是SO3
C.气体M参加的反应是化合反应
D.SO2参加反应时氧化剂和还原剂的物质的量之比是1∶1
√
6
√
1
2
3
4
5
解析 由工艺流程的箭头指向可知,该过程中硫酸亚铁和硫酸铁可循环使用,气体M和SO2为反应物,指向流程之外的箭头只有硫酸(部分硫酸又参与循环),即硫酸铁和二氧化硫作用生成硫酸和硫酸亚铁。气体M和硫酸、硫酸亚铁作用生成硫酸铁。根据上述分析知该工艺流程是用来制备硫酸的,A项正确;
根据反应关系知气体M、H2SO4和FeSO4作用生成Fe2(SO4)3,所以M是具有氧化性的气体,如O2等,B项错误;
6
1
2
3
4
5
气体M、FeSO4溶液和硫酸溶液作用生成Fe2(SO4)3,气体M参加的反应是氧化还原反应,C项错误;
SO2参加反应时的化学方程式为SO2+Fe2(SO4)3+2H2O===2FeSO4+2H2SO4,参加反应时氧化剂和还原剂的物质的量之比是1∶1,D项正确。
6
3.如图是某燃煤发电厂处理废气的装置示意图,装置内发生的主要反应中不含
A.化合反应
B.分解反应
C.置换反应
D.氧化还原反应
√
1
2
3
4
5
解析 根据图示可知,装置中发生的反应有:碳酸钙分解生成氧化钙和二氧化碳;二氧化硫与氧化钙化合生成亚硫酸钙;亚硫酸钙与氧气反应,既是化合反应,又是氧化还原反应。
6
解析 光化学烟雾主要是由汽车排出的氮氧化物、碳氢化合物等造成的;臭氧层空洞是由氟氯代烃等的排放引起的;温室效应主要是由大气中CO2含量的不断增加造成的。
4.下列污染现象主要与二氧化硫有关的是
A.酸雨
B.光化学烟雾
C.臭氧层空洞
D.温室效应
1
2
3
4
5
√
6
5.实验证明铜在低温下不能和氧气发生反应,也不能和稀硫酸共热发生反应。但工业上却是将废铜屑倒入热的稀硫酸中并不断地通入空气来制取硫酸铜溶液的。
(1)写出铜屑在上述状态下发生的一系列反应的化学方程式:___________
___________;___________________________。
(2)利用铜和浓硫酸在加热条件下也能制备硫酸铜溶液,其化学方程式为_______________________________________。
1
2
3
4
5
2Cu+O2
CuO+H2SO4===CuSO4+H2O
6
解析 第一种方法中,Cu与O2反应后的生成物迅速溶解在热的稀硫酸中生成CuSO4;第二种方法是在加热条件下使铜与浓硫酸反应,H2SO4会被还原为SO2,H2SO4的利用率低且生成的气体有毒。
(3)以上两种方法是前者好还是后者好:_______,原因是_____________
_________________________________________________________。
1
2
3
4
5
前者好
制得相同质量的产品,前者消耗的硫酸少,而且后者生成的SO2会造成大气污染
6
6.回答下列问题:
(1)下列气体容易形成酸雨的是____
(填字母)。
A.CO2
B.SO2
C.N2
D.NO2
1
2
3
4
5
BD
解析 SO2、NOx易形成酸雨。
6
(2)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
1
2
3
4
5
测试时间/h
0
1
2
3
4
雨水的pH
4.73
4.63
4.56
4.55
4.55
分析数据,回答下列问题:
①雨水样品的pH变化的原因是____________________________________
________(用化学方程式表示)。
SO2+H2O
H2SO3,2H2SO3+O2===
2H2SO4
解析 酸雨放置时pH变小,其原因是雨水中的H2SO3被空气中氧气氧化所致:SO2+H2O
H2SO3,2H2SO3+O2===2H2SO4。
6
1
2
3
4
5
测试时间/h
0
1
2
3
4
雨水的pH
4.73
4.63
4.56
4.55
4.55
②如果将刚取样的上述雨水和自来水相混合,pH将变___,原因是_____
______________________________________________________(用化学方程式表示)。
小
Cl2+
2H2O+SO2===H2SO4+2HCl或H2SO3+HClO===H2SO4+HCl
解析 雨水和自来水混合,应考虑SO2与Cl2(或H2SO3与HClO)的反应:SO2+2H2O+Cl2===H2SO4+2HCl(或H2SO3+HClO===H2SO4+HCl)。因此雨水与自来水混合后溶液pH将变小。
6
(3)下列措施中,可减少酸雨产生的途径的是___
(填字母)。
①少用煤做燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③
B.②③④⑤
C.①③⑤
D.①③④⑤
1
2
3
4
5
C
解析 减少酸雨的产生需减少SO2的排放,将煤转化为清洁能源(如煤的气化和液化),燃料脱硫、固硫,开发不含硫的新能源(如氢能、核能等),都是有力措施。因此①③⑤正确。
返回
6
本课结束
第三单元 防治二氧化硫对环境的污染
1.了解自然界中硫元素的循环、酸雨的形成及治理方法。
2.了解空气质量评价和空气质量指数。
3.提高环保意识,使学生形成与自然友好、促进可持续发展的正确认识。
核心素养发展目标
一、自然界中的硫循环
随堂演练 知识落实
课时对点练
二、酸雨及其治理
内
容
索
引
三、空气质量评价
自然界中的硫循环
(1)SO2的来源:
、
、
等。
(2)自然界中的硫循环:地壳的岩石里、生物体内以及大气与水中都含有
元素。随着地壳运动、生命活动以及大气与水的流动,这些含硫物质不断地发生
和
,形成了硫在自然界中的
。
(3)地壳中的
、
和
等都含有硫元素,这些矿物通过风化分解、燃烧、火山爆发等方式释放出
、
等气体,这些气体有些进入大气,有些转化为
、
溶入河流或海洋,还有些则被土壤中的硫化细菌吸收。
一、自然界中的硫循环
含硫化石燃料燃烧
含硫金属矿石冶炼
硫酸生产
硫
转化
转移
循环
硫黄矿
硫铁矿
煤
SO2
H2S
亚硫酸盐
硫酸盐
(4)自然界中的硫循环
(5)自然界中含硫物质非常丰富
如H2S、S、SO2、SO3、H2SO3、H2SO4、Na2SO4、CaSO4等。
上述物质在“价—类”二维图中的相应位置如下:
(1)大气中的硫可以酸雨的形式进入土壤( )
(2)煤和石油中的硫燃烧生成二氧化硫进入大气( )
(3)化石燃料中的硫主要来自形成化石燃料的生物体( )
(4)自然界中硫只能以化合态存在( )
判断正误
√
×
√
√
1.硫在自然界中的循环如图所示,下列说法不正确的是
A.硫在自然界中以游离态和化合态形式存在
B.部分硫元素由地壳到大气的过程发生了氧化
反应
C.图中显示大气中的二氧化硫最终回到海洋,
并很快和其他矿物形成煤和石油
D.葡萄酒中含有二氧化硫可防止葡萄酒被氧化
√
应用体验
解析 火山爆发时地壳中的硫和氧气反应生成二氧化硫,部分硫元素由地壳到大气的过程发生了氧化反应;形成煤和石油的过程是一个漫长过程;二氧化硫具有还原性,能被强氧化剂氧化,葡萄酒中含有二氧化硫被氧化,所以可防止葡萄酒被氧化。
2.下图有关硫元素循环说法不合理的是
A.煤、石油中的硫元素燃烧时能生成SO2
B.动物尸体腐败过程中产生的H2S气体会进入大气
C.循环过程中硫元素既发生氧化反应又发生还原反应
D.大气中的硫元素会全部转化成H2SO4随雨水降到土壤里
√
解析 A项,煤、石油中的硫元素燃烧时能生成SO2,正确;
B项,动物尸体腐败过程中产生的H2S气体会进入大气,正确;
C项,循环过程中硫元素既发生氧化反应又发生还原反应,正确;
D项,大气中的硫元素部分转化成亚硫酸,进一步转化为H2SO4随雨水降到土壤里,错误。
返回
1.硫酸型酸雨的形成
(1)酸雨:pH<
的降水被称为酸雨。正常雨水pH约为
,这是溶解了
的缘故。
(2)形成:
的燃烧、含硫金属矿石的冶炼和
的生产等产生的废气中含有二氧化硫。
二、酸雨及其治理
5.6
5.6
CO2
硫酸
化石燃料
写出图中标号表示的化学方程式:
①_____________________。
②___________________。
③___________________。
④_____________________。
2SO2+O2
2SO3
SO2+H2O
H2SO3
SO3+H2O===H2SO4
2H2SO3+O2===2H2SO4
2.酸雨的危害
(1)
,危害水生生物。
(2)
,降低土壤肥力,影响作物生长。
(3)腐蚀建筑物。
酸化湖泊
酸化土壤
3.酸雨的防治
(1)消除
,研究开发
(如太阳能、核能、氢能等)。
(2)对含硫燃料进行
处理。
(3)对SO2废气进行处理或回收利用。
污染源
新能源
脱硫
注意:工业上选择处理SO2的方法,会考虑环保、成本、工艺流程是否简便易行等因素。
SO2+2NaOH===Na2SO3+H2O
SO2+Ca(OH)2===CaSO3+H2O
SO2+CaO===CaSO3
(1)pH<7的雨水均称为酸雨( )
(2)酸雨会使土壤、湖泊酸化( )
(3)酸雨形成过程中不涉及氧化还原反应( )
(4)燃煤中加入石灰石可防治酸雨( )
判断正误
×
×
√
√
理解应用
1.室内空气污染是人类健康的“隐形杀手”,越来越受到人们关注。下列不会造成室内空气污染的是
A.家用燃料燃烧产生的CO、CO2
B.家庭烹调产生的油烟
C.装饰材料散发出的甲醛、苯等
D.保持室内空气流通
√
解析 A项,家用燃料燃烧产生的CO有毒,属于室内空气污染物,CO2虽然无毒,但量大了对人体也有害;
B项,烹调产生的油烟含有使人致癌的成分,属于室内空气污染物;
C项,装饰材料的释放物中的有毒物质甲醛和苯,属于室内空气污染物;
D项,保持室内空气流通,可有效防止空气污染。
2.(1)我国酸雨危害十分严重,是世界三大酸雨地区之一,且主要为硫酸型酸雨。形成硫酸型酸雨主要是由于空气中____含量超标,主要反应的化学方程式为
途径一:_________________________________________;
途径二:_________________________________________。
SO2
SO2+H2O
H2SO3,2H2SO3+O2===2H2SO4
2SO2+O2
2SO3,SO3+H2O===H2SO4
解析 酸雨的形成首先是含硫燃料燃烧生成二氧化硫,二氧化硫与雨水反应生成亚硫酸,亚硫酸被空气中的氧气氧化成硫酸,形成酸雨。或空气中的二氧化硫气体在粉尘作催化剂的条件下生成三氧化硫,三氧化硫再与雨水形成酸雨。
(2)某校科技活动小组的同学采集酸雨样品,每隔一段时间测定样品的pH,得到下列数据:
时间
开始
8
h后
16
h后
24
h后
pH
5.0
4.8
4.5
4.3
请根据上述材料,回答下列有关问题:
酸雨放置时,pH发生变化的主要原因为___________________________
_____。
H2SO3被氧化成H2SO4,酸性
增强
解析 酸雨形成的主要原因是:大量燃烧化石燃料产生二氧化硫,随雨水降落形成酸雨,酸雨放置时,发生的反应为:2H2SO3+O2===2H2SO4,由弱酸生成强酸,酸性增强。
(3)你认为减少酸雨产生的途径可采取的措施是____(填字母)。
A.用煤作燃料
B.把工厂烟囱造高
C.燃料脱硫
D.开发新能源
CD
解析 少用煤作燃料、燃料脱硫、开发新的能源等措施可以减少二氧化硫气体的排放,从而减少酸雨的形成。
返回
三、空气质量评价
1.空气质量指数(AQI)
人们研究空气污染,可以通过
来获取空气质量状况的信息。
(1)定义
空气质量指数是根据空气中的
、
、
、
、
和
的浓度计算出来的数值。
(2)与空气质量的关系
空气质量指数
,空气质量越好,对人体健康的危害就越小。
空气质量指数AQI
细颗粒物(PM2.5)
可吸入颗粒物(PM10)
二氧化硫
二氧化氮
臭氧
一氧化碳
越小
2.空气质量指数(AQI)的确定
(1)确定方法
空气质量监测人员测出空气质量指数中这六大污染物的浓度,再换算成它们的
,其中指数
的污染物会被确定为首要污染物,____
的质量指数即为该地区的空气质量指数。
(2)与空气质量等级的关系
空气质量指数
,空气质量等级污染程度越
。
质量指数
最大
首要
越大
严重
污染物
3.雾霾
(1)定义:大量极细微的颗粒物均匀地悬浮在空中,这些颗粒物容易吸附空气中的水蒸气形成
,使空气水平能见度小于
,我们把这种空气混浊现象叫作雾霾。
(2)颗粒物分类依据是
。
(3)颗粒物分类
细颗粒物(PM2.5,直径小于2.5
μm)
可吸入颗粒物(PM10,直径小于10
μm)
(4)SO2的排放与雾霾形成的关系
空气中的SO2在一定条件下形成CaSO4,硫酸盐在PM2.5中所占比例较大。
雾滴
10
km
颗粒物直径的大小
4.大气污染的防治
(1)改变能源结构;
(2)控制SO2等有害气体的排放;
(3)提高污染排放标准。
(1)NO2、SO2、PM2.5、N2均属于空气污染物( )
(2)空气质量指数越高,空气质量越好( )
(3)大量化石燃料的燃烧是形成雾霾的一个重要原因( )
(4)改变能源结构有利于大气污染的防治( )
判断正误
×
×
√
√
1.雾霾、PM2.5已经成为公众耳熟能详的热词。“PM2.5”是指大气中直径小于2.5微米的细小颗粒物,也称为可入肺颗粒物。下列有关说法中错误的是
A.雾霾有可能产生丁达尔效应
B.雾霾的形成与工业排放的烟气和汽车尾气有关系
C.“PM2.5”分散在大气中形成气溶胶,性质稳定,没有必要纳入空气质
量评价指标
D.雾霾天气严重危害人体健康
√
应用体验
解析 A项,“PM2.5”是指大气中直径小于2.5微米的细小颗粒物,若直径在1~100
nm之间也能形成胶体,产生丁达尔效应,正确;
B项,工业排放的烟气是形成雾霾天气的最大元凶,正确;
C项,PM2.5主要来自于化石燃料的燃烧,化石燃料燃烧产生有害气体,能影响空气质量,要纳入空气质量评价指标,错误。
2.空气质量等级依次为:优、良、轻微污染、轻度污染、中度污染、中度重污染、重污染等。某地区空气污染物指数为SO2:78、NO2:43、可吸入颗粒物:163。则该地区的空气污染指数为____,该地区空气质量等级为________,首要污染物为_____________。
163
轻度污染
可吸入颗粒物
解析 其中最高的污染指数为163,故该地区的空气污染指数为163。空气污染指数在151~200之间,空气质量级别为Ⅲ(2)级,空气质量状况属于轻度污染。可吸入颗粒物的指数最高,为首要污染物。
返回
1.下列有关酸雨的说法中正确的是
A.雨水溶解二氧化碳的结果
B.pH<7的雨水
C.引起呼吸系统的疾病
D.空气中硫、氮的氧化物随雨水下降的结果
√
1
2
3
5
随堂演练 知识落实
4
解析 正常雨水显酸性,酸雨的pH小于5.6。
2.入冬以来,雾霾天气已经严重影响了我国多数人的正常出行和生活节奏。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是
A.加高工厂的烟囱,使烟尘和废气运离地表
B.推广使用燃煤脱硫技术,防止SO2污染
C.研制新型高效可充电电池,发展纯电动汽车
D.开发利用绿色能源(例如太阳能)替代化石燃料
1
2
3
5
4
√
解析 加高工厂的烟囱,使烟尘和废气远离地表,不能改变空气中污染物的含量,A错误。
3.煤炭燃烧时会排放二氧化硫等污染物,为了减少污染物的排放,许多地方都使用了洁净煤(如脱硫)技术。读煤炭脱硫效率图,完成下题。
1
2
3
5
4
关于洁净煤技术的影响,叙述正确的是
A.该技术脱硫效率达到100%
B.该技术可以减小pH和酸雨危害
C.该技术使煤炭资源得到了循环利用
D.该技术提高了煤炭资源利用的经济价值
√
1
2
3
5
4
解析 洁净煤技术脱硫效率没达到100%,A错误;
洁净煤技术可使煤炭燃烧时排放的酸性气体减少,酸雨危害减小,pH增大,B错误;
该技术没有体现煤炭资源的循环利用,但提高了煤炭资源利用的经济价值。
4.下列物质中,属于“城市空气质量日报”报道的污染物是
A.N2
B.SO2
C.CO2
D.SO3
√
1
2
3
5
4
5.2013年1月,我国中东部的大部分地区出现雾霾天气,许多城市的空气质量已经达到了严重污染。下列有关说法中,正确的是
A.雾霾天气仅影响出行能见度,对人体健康没有影响
B.减少化石燃料燃烧和汽车尾气排放,是减少雾霾发生的有效措施
C.当光束分别通过雾霾和豆浆时,仅豆浆可看到一条光亮的通路
D.气候环境报告中新增的“PM2.5”就是雾霾
1
2
3
5
4
√
解析 雾霾有毒,所以雾霾天气对人体健康有害,故A项错误;
化石燃料燃烧和汽车尾气中含有粉尘,能形成雾霾天气,故B项正确;
雾霾和豆浆都属于胶体,当光束通过时都会产生一条光亮的通路,故C项错误;
雾霾天气指原因不明的因大量烟、尘等微粒悬浮而形成的浑浊现象,PM2.5:指环境空气中空气动力学当量直径小于2.5
μm的颗粒物,也称细颗粒物,二者不完全相同。
1
2
3
5
4
返回
课时对点练
题组一 自然界中的硫循环
1.硫在自然界中的循环过程如下图所示,下列说法不正确的是
A组 基础对点练
A.石油和煤等化石燃料中含有硫元素
B.大气中的二氧化硫只来源于火山喷
发产生的气体
C.地壳中的硫元素常以硫化物和硫酸
盐的形式存在
1
2
3
4
5
6
7
8
9
D.动植物遗体被微生物分解后,可产生
和SO2
√
1
2
3
4
5
6
7
8
9
解析 大气中的二氧化硫主要来源于化石燃料的燃烧、火山喷发和微生物的分解。
2.下列关于硫的叙述中不正确的是
A.硫是一种难溶于水的黄色固体
B.硫的化合物常存在于火山喷出的气体中和矿泉水里
C.硫在自然界中只能以硫化物和硫酸盐的形态存在
D.硫的燃烧产物二氧化硫是大气污染物之一
√
1
2
3
4
5
6
7
8
9
解析 硫在自然界中既能以化合态(主要为硫化物和硫酸盐)又能以游离态(火山喷口附近或地壳岩层)的形式存在。硫俗称硫黄,是一种黄色固体,难溶于水,微溶于酒精,易溶于二硫化碳,常用二硫化碳除去试管内壁附着的硫单质。
题组二 酸雨及其治理、空气质量评价
3.酸雨形成的最主要原因是
A.森林遭乱砍滥伐,破坏了生态平衡
B.工业上大量燃烧含硫燃料
C.大气中二氧化碳的含量增多
D.汽车排出大量尾气
√
1
2
3
4
5
6
7
8
9
解析 空气中硫的氧化物和氮的氧化物随雨水降下就形成酸雨。酸雨的形成主要是由于空气中SO2和NOx的增多。在我国主要是SO2的增多。空气中SO2的主要来源是:①化石燃料(煤和石油产品)的燃烧;②含硫矿石的冶炼;③硫酸、磷肥、纸浆厂的工业废气。目前,由于汽车用的燃料汽油、柴油等都经过了脱硫处理,所以形成酸雨的最主要原因是工业上大量燃烧含硫燃料。
1
2
3
4
5
6
7
8
9
4.下列气体中,无色有毒、能污染大气,能用碱液吸收的是
A.一氧化碳
B.二氧化碳
C.二氧化硫
D.氯气
1
2
3
4
5
6
7
8
9
解析 一氧化碳、二氧化硫、氯气有毒,一氧化碳不能与碱液反应,氯气为黄绿色。
√
5.现有以下几种措施:①对燃烧煤时产生的尾气进行除硫处理;②少用原煤作燃料;③燃煤时鼓入足量空气;④开发清洁能源。其中能减少酸雨产生的措施是
A.①②③
B.②③④
C.①②④
D.①③④
√
1
2
3
4
5
6
7
8
9
解析 煤及其他化石燃料中含S元素,它们燃烧产生的SO2大量排放是形成酸雨的主要原因。对燃煤产生的尾气进行除硫,少用、不用原煤作燃料,开发清洁能源都可以减少SO2的排放,减少酸雨的产生。燃煤时鼓入足量空气只能提高煤的燃烧效率,不能减少SO2的排放。
1
2
3
4
5
6
7
8
9
6.2013年12月6日,上海遭遇重度雾霾,空气质量指数达六级重度污染。雾霾是雾和霾的混合物,其中雾是自然天气现象,霾的核心物质是悬浮在空气中的烟、灰尘等物质,其中霾属于悬浊液,雾所属的分散系是
A.溶液
B.悬浊液
C.乳浊液
D.胶体
√
解析 雾是小液滴,形成的分散系是胶体,答案选D。
7.空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防止扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的供应量
√
1
2
3
4
5
6
7
8
9
解析 A、B、C都是可采取的措施,
在D中,若加大不可再生资源石油、煤的开采速度,会造成资源缺乏,同时会使空气中的SO2、NOx含量增加。
8.形成酸雨的原理之一可简示为
1
2
3
4
5
6
7
8
9
回答下列问题:
(1)A物质的化学式为_____,B物质的化学式为____。
(2)洗涤含SO2的烟气,以下物质可作洗涤剂的是___
(填字母)
a.Ca(OH)2
b.Na2CO3
c.CaCl2
d.NaHSO3
SO2
SO3
ab
(3)利用钠碱循环法可脱除烟气中的SO2,在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是____
____________________。
(4)某有色金属冶炼厂排放的废气中含SO2,先用石灰浆吸收SO2,然后利用空气中的氧气将产物继续氧化成石膏(CaSO4·2H2O)。写出有关反应的两个化学方程式:______________________________________________
________________。
1
2
3
4
5
6
7
8
9
SO2
SO2+Ca(OH)2===CaSO3+H2O,2CaSO3+O2+2H2O
===2CaSO4·2H2O
9.SO2被称为“空中死神”,其对环境的危害常表现为________(填一种即可)。为了减少危害,人们进行了许多探索和研究,并且在实际应用中取得了一定的成果。
1
2
3
4
5
6
7
8
9
形成酸雨
解析 酸雨是人类大量使用煤、石油、天然气等化石燃料燃烧后产生的硫氧化物或氮氧化物在大气中经过复杂的化学反应后形成的,由于酸雨对生物有极大的危害,因此SO2被称为“空中死神”。
(1)工业上常用生石灰来处理煤炭中的SO2,这是利用了SO2属于_____氧化物的性质。
1
2
3
4
5
6
7
8
9
酸性
解析 二氧化硫是酸性氧化物,二氧化硫和CaO反应生成亚硫酸钙,亚硫酸钙不稳定,极易被空气中的氧气氧化生成硫酸钙,因此工业上常用生石灰来处理煤炭中的SO2。
1
2
3
4
5
6
7
8
9
①此种方法中,可以循环利用的物质是_________。
NaCl溶液
(2)近年来,有人提出了一种利用电解饱和氯化钠溶液(2NaCl+2H2O
2NaOH+Cl2↑+H2↑)循环治理含二氧化硫的废气并回收二氧化硫的方法。该方法的流程如下:
解析 根据流程图可知,电解氯化钠溶液得到NaOH溶液、氯气和氢气,亚硫酸氢钠和稀盐酸反应生成氯化钠溶液、SO2和水,所以能循环利用的物质是氯化钠溶液。
1
2
3
4
5
6
7
8
9
②写出反应Ⅰ的离子方程式:_______________________。
解析 亚硫酸氢钠和稀盐酸发生复分解反应的离子方程式为
+H+===H2O+SO2↑。
A.含硫杆菌及好氧/厌氧菌促进了硫
的循环
B.硫循环中硫的化合物均为无机物
C.上述硫循环中硫元素均被氧化
1.硫是生物必需的营养元素之一,下列关于如图所示的自然界中硫循环的说法正确的是
√
B组 综合强化练
1
2
3
4
5
D.烧煤时加石灰石,可减少酸雨及温室气体的排放
6
1
2
3
4
5
解析 硫酸盐、亚硫酸盐等在含硫杆菌及好氧/厌氧菌作用下缓慢转化成植物R1—S—R2,故含硫杆菌及好氧/厌氧菌促进了硫的循环,A项正确;
硫循环中硫的化合物有含硫的有机物,如煤、石油等,不全是无机物,B项错误;
含硫杆菌及好氧/厌氧菌将硫酸盐、亚硫酸盐中的硫还原成R1—S—R2,硫循环中硫元素有时被氧化,有时被还原,C项错误;
烧煤时加石灰石,可减少酸雨的排放,但生成二氧化碳,会增加温室气体的排放,D项错误。
6
2.(不定项)(2019·吉林榆树一中期末)某工厂的一个生产工艺流程如图所示,下列叙述正确的是
1
2
3
4
5
A.该工艺流程是用来制备H2SO4的
B.气体M是SO3
C.气体M参加的反应是化合反应
D.SO2参加反应时氧化剂和还原剂的物质的量之比是1∶1
√
6
√
1
2
3
4
5
解析 由工艺流程的箭头指向可知,该过程中硫酸亚铁和硫酸铁可循环使用,气体M和SO2为反应物,指向流程之外的箭头只有硫酸(部分硫酸又参与循环),即硫酸铁和二氧化硫作用生成硫酸和硫酸亚铁。气体M和硫酸、硫酸亚铁作用生成硫酸铁。根据上述分析知该工艺流程是用来制备硫酸的,A项正确;
根据反应关系知气体M、H2SO4和FeSO4作用生成Fe2(SO4)3,所以M是具有氧化性的气体,如O2等,B项错误;
6
1
2
3
4
5
气体M、FeSO4溶液和硫酸溶液作用生成Fe2(SO4)3,气体M参加的反应是氧化还原反应,C项错误;
SO2参加反应时的化学方程式为SO2+Fe2(SO4)3+2H2O===2FeSO4+2H2SO4,参加反应时氧化剂和还原剂的物质的量之比是1∶1,D项正确。
6
3.如图是某燃煤发电厂处理废气的装置示意图,装置内发生的主要反应中不含
A.化合反应
B.分解反应
C.置换反应
D.氧化还原反应
√
1
2
3
4
5
解析 根据图示可知,装置中发生的反应有:碳酸钙分解生成氧化钙和二氧化碳;二氧化硫与氧化钙化合生成亚硫酸钙;亚硫酸钙与氧气反应,既是化合反应,又是氧化还原反应。
6
解析 光化学烟雾主要是由汽车排出的氮氧化物、碳氢化合物等造成的;臭氧层空洞是由氟氯代烃等的排放引起的;温室效应主要是由大气中CO2含量的不断增加造成的。
4.下列污染现象主要与二氧化硫有关的是
A.酸雨
B.光化学烟雾
C.臭氧层空洞
D.温室效应
1
2
3
4
5
√
6
5.实验证明铜在低温下不能和氧气发生反应,也不能和稀硫酸共热发生反应。但工业上却是将废铜屑倒入热的稀硫酸中并不断地通入空气来制取硫酸铜溶液的。
(1)写出铜屑在上述状态下发生的一系列反应的化学方程式:___________
___________;___________________________。
(2)利用铜和浓硫酸在加热条件下也能制备硫酸铜溶液,其化学方程式为_______________________________________。
1
2
3
4
5
2Cu+O2
CuO+H2SO4===CuSO4+H2O
6
解析 第一种方法中,Cu与O2反应后的生成物迅速溶解在热的稀硫酸中生成CuSO4;第二种方法是在加热条件下使铜与浓硫酸反应,H2SO4会被还原为SO2,H2SO4的利用率低且生成的气体有毒。
(3)以上两种方法是前者好还是后者好:_______,原因是_____________
_________________________________________________________。
1
2
3
4
5
前者好
制得相同质量的产品,前者消耗的硫酸少,而且后者生成的SO2会造成大气污染
6
6.回答下列问题:
(1)下列气体容易形成酸雨的是____
(填字母)。
A.CO2
B.SO2
C.N2
D.NO2
1
2
3
4
5
BD
解析 SO2、NOx易形成酸雨。
6
(2)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
1
2
3
4
5
测试时间/h
0
1
2
3
4
雨水的pH
4.73
4.63
4.56
4.55
4.55
分析数据,回答下列问题:
①雨水样品的pH变化的原因是____________________________________
________(用化学方程式表示)。
SO2+H2O
H2SO3,2H2SO3+O2===
2H2SO4
解析 酸雨放置时pH变小,其原因是雨水中的H2SO3被空气中氧气氧化所致:SO2+H2O
H2SO3,2H2SO3+O2===2H2SO4。
6
1
2
3
4
5
测试时间/h
0
1
2
3
4
雨水的pH
4.73
4.63
4.56
4.55
4.55
②如果将刚取样的上述雨水和自来水相混合,pH将变___,原因是_____
______________________________________________________(用化学方程式表示)。
小
Cl2+
2H2O+SO2===H2SO4+2HCl或H2SO3+HClO===H2SO4+HCl
解析 雨水和自来水混合,应考虑SO2与Cl2(或H2SO3与HClO)的反应:SO2+2H2O+Cl2===H2SO4+2HCl(或H2SO3+HClO===H2SO4+HCl)。因此雨水与自来水混合后溶液pH将变小。
6
(3)下列措施中,可减少酸雨产生的途径的是___
(填字母)。
①少用煤做燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③
B.②③④⑤
C.①③⑤
D.①③④⑤
1
2
3
4
5
C
解析 减少酸雨的产生需减少SO2的排放,将煤转化为清洁能源(如煤的气化和液化),燃料脱硫、固硫,开发不含硫的新能源(如氢能、核能等),都是有力措施。因此①③⑤正确。
返回
6
本课结束
