高中化学苏教版(2019)必修第一册 专题4 微专题七 二氧化硫和二氧化碳性质的鉴别(21张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)必修第一册 专题4 微专题七 二氧化硫和二氧化碳性质的鉴别(21张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 715.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-21 10:35:00 | ||
图片预览








文档简介
(共21张PPT)
微专题七 二氧化硫和二氧化碳性质的鉴别
1.鉴别单一气体
(1)物理方法
①根据气味鉴别:有刺激性气味的气体是SO2,无气味的是CO2。
②根据溶解性鉴别:同温同压下,将两种气体充满相同的试管,分别倒置于水槽中,试管内进水多的是SO2。
(2)化学方法
①用品红溶液鉴别:将两种气体分别通入品红溶液中,能使品红溶液褪色的是SO2。
②用溴水或酸性高锰酸钾溶液鉴别:将两种气体分别通入溴水或酸性高锰酸钾溶液中,能使溴水或酸性高锰酸钾溶液褪色的是SO2。
③用氢硫酸溶液鉴别:将两种气体分别通入H2S溶液中,出现淡黄色浑浊的是SO2,无明显现象的是CO2。化学方程式为2H2S+SO2===3S↓+2H2O。
④用FeCl3溶液鉴别:颜色(棕黄色)变浅的是SO2,无明显现象的是CO2。离子方程式为2Fe3++SO2+2H2O===2Fe2++4H++
。
提示 CO2与SO2都可以使澄清石灰水变浑浊,气体过量时,又变澄清。
2.鉴别混合气体
因为CO2、SO2均可以与澄清石灰水反应生成白色沉淀,所以混合气体采用下面方法鉴别:
(1)流程设计
流程设计
检验SO2→除去SO2→检验SO2是否被除尽→检验CO2
选用试剂
品红溶液
酸性KMnO4溶液
品红溶液
澄清石灰水
实验现象
褪色
褪色(或变浅)
不褪色
变浑浊
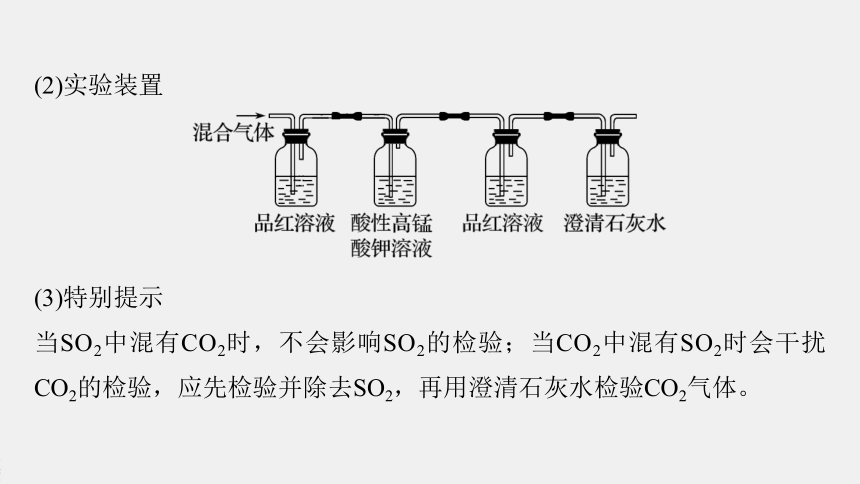
(2)实验装置
(3)特别提示
当SO2中混有CO2时,不会影响SO2的检验;当CO2中混有SO2时会干扰CO2的检验,应先检验并除去SO2,再用澄清石灰水检验CO2气体。
1.(2019·西安中学高一月考)下列溶液或用品中:①澄清石灰水;②H2S溶液;③酸性KMnO4溶液;④溴水;⑤Ba(NO3)2溶液;⑥品红溶液;⑦湿润的蓝色石蕊试纸。不能区别SO2和CO2气体的是
A.①⑦
B.①⑤⑦
C.②③④⑤⑥
D.①⑤
1
2
3
4
跟踪训练
√
5
6
7
解析 SO2和CO2都属于酸性氧化物,与澄清石灰水反应分别生成CaSO3和CaCO3白色沉淀,均能使湿润的蓝色石蕊试纸变红,所以①⑦不能用来区别SO2和CO2。SO2具有氧化性,能将H2S氧化生成单质硫(有淡黄色沉淀生成);SO2具有还原性,能被酸性KMnO4溶液和溴水氧化(溶液褪色),能和Ba(NO3)2溶液反应生成BaSO4沉淀;SO2具有漂白性,能使品红溶液褪色,而CO2没有这些性质。所以可以用②③④⑤⑥来区分SO2和CO2,A正确。
1
2
3
4
5
6
7
2.检验CO2中是否混有SO2气体,可采用的方法是
A.先通过NaOH溶液,再通过品红溶液,若品红溶液褪色,则说明混有
SO2气体
B.通过澄清石灰水,若变浑浊,则说明混有SO2气体
C.先通过NaOH溶液,再通过澄清石灰水,若变浑浊,则说明有SO2气体
D.通过酸性KMnO4溶液,若溶液褪色,则说明混有SO2气体
1
2
3
4
√
5
6
7
解析 SO2和CO2通过NaOH溶液均发生反应:2NaOH+SO2===Na2SO3+H2O,2NaOH+CO2===Na2CO3+H2O,再通过品红溶液不能检测到SO2,A错误;
SO2和CO2通过澄清石灰水都会产生白色沉淀,B错误;
SO2和CO2通过NaOH溶液都可能被吸收完全,也可能均过量,再通过澄清石灰水,均变浑浊,也不能确定混有SO2,C错误;
因为CO2不能使酸性KMnO4溶液褪色,SO2具有还原性,通过酸性KMnO4溶液,溶液褪色,则说明混有SO2气体,D正确。
1
2
3
4
5
6
7
3.除去二氧化碳中混有的少量二氧化硫气体,可选用的试剂是
A.饱和食盐水
B.氢氧化钠溶液
C.足量澄清石灰水
D.饱和碳酸氢钠溶液
√
1
2
3
4
解析 二氧化碳和二氧化硫都能与氢氧化钠溶液、澄清石灰水反应,都不能与饱和食盐水反应。因为亚硫酸的酸性强于碳酸,可用饱和碳酸氢钠溶液除去二氧化碳中的二氧化硫气体。
5
6
7
4.检验SO2中是否混有CO2,应采取的措施是
A.先通过Ba(OH)2溶液再通过澄清石灰水
B.先通过酸性KMnO4溶液再通过澄清石灰水
C.先通过小苏打悬浊液再通过澄清石灰水
D.先通过澄清石灰水再通过品红溶液
√
1
2
3
4
5
6
7
解析 二氧化硫和二氧化碳通过氢氧化钡溶液都会产生白色沉淀:CO2+Ba(OH)2===BaCO3↓+H2O、SO2+Ba(OH)2===BaSO3↓+H2O,再通过澄清石灰水无明显现象,无法验证有无CO2,A错误;
二氧化硫会和酸性高锰酸钾溶液反应而使之褪色,并且酸性KMnO4溶液将SO2完全吸收,再通过澄清石灰水,二氧化碳和氢氧化钙反应会产生白色沉淀:CO2+Ca(OH)2===CaCO3↓+H2O,能验证有无CO2,B正确;
二氧化硫通过碳酸氢钠溶液会有CO2生成,无法检验有无CO2,C错误;
二氧化硫和二氧化碳通过澄清石灰水都会产生白色沉淀:CO2+Ca(OH)2
===CaCO3↓+H2O、SO2+Ca(OH)2===CaSO3↓+H2O,澄清石灰水会将气体全部吸收,不能验证有无CO2,D错误。
1
2
3
4
5
6
7
5.能够用于鉴别二氧化硫和二氧化碳的溶液是
A.澄清石灰水
B.品红溶液
C.紫色石蕊溶液
D.氯化钡溶液
√
1
2
3
4
解析 二氧化硫、二氧化碳都能使澄清石灰水变浑浊;二氧化硫、二氧化碳与水反应的产物都能使紫色石蕊溶液变红;二氧化硫、二氧化碳都不与氯化钡溶液反应,选项A、C、D错误。
5
6
7
6.如图是检验某无色气体A是SO2和CO2的混合气体的装置图,按要求回答下列问题:
1
2
3
4
(1)装置B中加入的试剂是_________,作用是_________。
(2)装置C中加入的试剂是_______________,作用是__________________
_________。
(3)装置D中加入的试剂是___________,作用是_________。
(4)实验时,装置C中应观察到的现象是_____________________________
____________。
品红溶液
检验SO2
酸性KMnO4溶液
除去SO2并检验SO2
是否除尽
澄清石灰水
检验CO2
酸性KMnO4溶液的颜色变浅(写
褪色不正确)
5
6
7
解析 检验SO2用品红溶液,吸收SO2用酸性KMnO4溶液,检验CO2用澄清石灰水;在检验CO2之前,必须除尽SO2,因为SO2也能使澄清石灰水变浑浊。装置C的作用是除去SO2并检验SO2是否除尽,所以酸性KMnO4溶液颜色变浅,但不能褪成无色,若褪成无色则不能证明二氧化硫已除尽。
1
2
3
4
5
6
7
7.某化学兴趣小组为了探究常温下某未知气体的成分,将该气体通入澄清石灰水中,发现澄清石灰水变浑浊,持续通入,发现浑浊又变澄清。由此该小组同学对气体的成分提出猜想。
[提出猜想]
猜想1:_____________;
猜想2:_____________;
猜想3:__________________。
为了验证猜想,该小组同学设计如下实验进行探究。
1
2
3
4
气体含有CO2
气体含有SO2
气体含有CO2和SO2
5
6
7
[实验探究]
该小组同学按如图所示连接装置,将气体从a端通入。
(1)B中盛放的溶液应该是____(填字母)。
a.NaCl溶液
b.酸性KMnO4溶液
c.盐酸
d.澄清石灰水
(2)A中品红溶液的作用是_________________________。
1
2
3
4
b
检验该气体中是否含有SO2
5
6
7
(3)D中澄清石灰水的作用是__________________________。
通过以上实验,该小组同学观察到以下实验现象:
①A中品红溶液褪色;②C中品红溶液不褪色;③D中澄清石灰水变浑浊。
[得出结论]
(4)由上述现象,该小组同学认为该气体______________。
1
2
3
4
检验该气体中是否含有CO2
含有CO2和SO2
5
6
7
解析 首先根据题给信息,分析可能涉及的物质,进行假设,本题中猜想气体可能含有SO2或CO2,或二者都有;然后分析题目涉及物质的化学性质,如SO2和CO2性质的异同点;最后根据题意对假设进行一一验证,最终得出正确结论。SO2和CO2在某些性质方面较相似,如都能使澄清石灰水变浑浊,若通入的气体过量,则浑浊又变澄清。但SO2具有还原性,能被强氧化剂氧化,且SO2可使品红溶液褪色,而CO2不具备这些性质,可利用性质差异检验CO2是否存在。
1
2
3
4
5
6
7
归纳总结
(1)SO2与CO2的最大区别在于SO2具有漂白性、还原性和氧化性,而CO2只有氧化性。解决有关问题时,要注意相似性方面的干扰。
(2)CO2和SO2混合气体鉴别的实验题中,品红溶液常要使用两次,分别用于检验SO2的存在以及证明SO2是否被除尽。
(3)SO2虽有漂白性,但并不是所有与SO2有关的褪色都是因为SO2的漂白性。如:①SO2能使滴有酚酞的NaOH溶液褪色是因为SO2能与碱发生反应;②SO2能使溴水或酸性KMnO4溶液褪色是因为SO2的还原性。
本课结束
微专题七 二氧化硫和二氧化碳性质的鉴别
1.鉴别单一气体
(1)物理方法
①根据气味鉴别:有刺激性气味的气体是SO2,无气味的是CO2。
②根据溶解性鉴别:同温同压下,将两种气体充满相同的试管,分别倒置于水槽中,试管内进水多的是SO2。
(2)化学方法
①用品红溶液鉴别:将两种气体分别通入品红溶液中,能使品红溶液褪色的是SO2。
②用溴水或酸性高锰酸钾溶液鉴别:将两种气体分别通入溴水或酸性高锰酸钾溶液中,能使溴水或酸性高锰酸钾溶液褪色的是SO2。
③用氢硫酸溶液鉴别:将两种气体分别通入H2S溶液中,出现淡黄色浑浊的是SO2,无明显现象的是CO2。化学方程式为2H2S+SO2===3S↓+2H2O。
④用FeCl3溶液鉴别:颜色(棕黄色)变浅的是SO2,无明显现象的是CO2。离子方程式为2Fe3++SO2+2H2O===2Fe2++4H++
。
提示 CO2与SO2都可以使澄清石灰水变浑浊,气体过量时,又变澄清。
2.鉴别混合气体
因为CO2、SO2均可以与澄清石灰水反应生成白色沉淀,所以混合气体采用下面方法鉴别:
(1)流程设计
流程设计
检验SO2→除去SO2→检验SO2是否被除尽→检验CO2
选用试剂
品红溶液
酸性KMnO4溶液
品红溶液
澄清石灰水
实验现象
褪色
褪色(或变浅)
不褪色
变浑浊
(2)实验装置
(3)特别提示
当SO2中混有CO2时,不会影响SO2的检验;当CO2中混有SO2时会干扰CO2的检验,应先检验并除去SO2,再用澄清石灰水检验CO2气体。
1.(2019·西安中学高一月考)下列溶液或用品中:①澄清石灰水;②H2S溶液;③酸性KMnO4溶液;④溴水;⑤Ba(NO3)2溶液;⑥品红溶液;⑦湿润的蓝色石蕊试纸。不能区别SO2和CO2气体的是
A.①⑦
B.①⑤⑦
C.②③④⑤⑥
D.①⑤
1
2
3
4
跟踪训练
√
5
6
7
解析 SO2和CO2都属于酸性氧化物,与澄清石灰水反应分别生成CaSO3和CaCO3白色沉淀,均能使湿润的蓝色石蕊试纸变红,所以①⑦不能用来区别SO2和CO2。SO2具有氧化性,能将H2S氧化生成单质硫(有淡黄色沉淀生成);SO2具有还原性,能被酸性KMnO4溶液和溴水氧化(溶液褪色),能和Ba(NO3)2溶液反应生成BaSO4沉淀;SO2具有漂白性,能使品红溶液褪色,而CO2没有这些性质。所以可以用②③④⑤⑥来区分SO2和CO2,A正确。
1
2
3
4
5
6
7
2.检验CO2中是否混有SO2气体,可采用的方法是
A.先通过NaOH溶液,再通过品红溶液,若品红溶液褪色,则说明混有
SO2气体
B.通过澄清石灰水,若变浑浊,则说明混有SO2气体
C.先通过NaOH溶液,再通过澄清石灰水,若变浑浊,则说明有SO2气体
D.通过酸性KMnO4溶液,若溶液褪色,则说明混有SO2气体
1
2
3
4
√
5
6
7
解析 SO2和CO2通过NaOH溶液均发生反应:2NaOH+SO2===Na2SO3+H2O,2NaOH+CO2===Na2CO3+H2O,再通过品红溶液不能检测到SO2,A错误;
SO2和CO2通过澄清石灰水都会产生白色沉淀,B错误;
SO2和CO2通过NaOH溶液都可能被吸收完全,也可能均过量,再通过澄清石灰水,均变浑浊,也不能确定混有SO2,C错误;
因为CO2不能使酸性KMnO4溶液褪色,SO2具有还原性,通过酸性KMnO4溶液,溶液褪色,则说明混有SO2气体,D正确。
1
2
3
4
5
6
7
3.除去二氧化碳中混有的少量二氧化硫气体,可选用的试剂是
A.饱和食盐水
B.氢氧化钠溶液
C.足量澄清石灰水
D.饱和碳酸氢钠溶液
√
1
2
3
4
解析 二氧化碳和二氧化硫都能与氢氧化钠溶液、澄清石灰水反应,都不能与饱和食盐水反应。因为亚硫酸的酸性强于碳酸,可用饱和碳酸氢钠溶液除去二氧化碳中的二氧化硫气体。
5
6
7
4.检验SO2中是否混有CO2,应采取的措施是
A.先通过Ba(OH)2溶液再通过澄清石灰水
B.先通过酸性KMnO4溶液再通过澄清石灰水
C.先通过小苏打悬浊液再通过澄清石灰水
D.先通过澄清石灰水再通过品红溶液
√
1
2
3
4
5
6
7
解析 二氧化硫和二氧化碳通过氢氧化钡溶液都会产生白色沉淀:CO2+Ba(OH)2===BaCO3↓+H2O、SO2+Ba(OH)2===BaSO3↓+H2O,再通过澄清石灰水无明显现象,无法验证有无CO2,A错误;
二氧化硫会和酸性高锰酸钾溶液反应而使之褪色,并且酸性KMnO4溶液将SO2完全吸收,再通过澄清石灰水,二氧化碳和氢氧化钙反应会产生白色沉淀:CO2+Ca(OH)2===CaCO3↓+H2O,能验证有无CO2,B正确;
二氧化硫通过碳酸氢钠溶液会有CO2生成,无法检验有无CO2,C错误;
二氧化硫和二氧化碳通过澄清石灰水都会产生白色沉淀:CO2+Ca(OH)2
===CaCO3↓+H2O、SO2+Ca(OH)2===CaSO3↓+H2O,澄清石灰水会将气体全部吸收,不能验证有无CO2,D错误。
1
2
3
4
5
6
7
5.能够用于鉴别二氧化硫和二氧化碳的溶液是
A.澄清石灰水
B.品红溶液
C.紫色石蕊溶液
D.氯化钡溶液
√
1
2
3
4
解析 二氧化硫、二氧化碳都能使澄清石灰水变浑浊;二氧化硫、二氧化碳与水反应的产物都能使紫色石蕊溶液变红;二氧化硫、二氧化碳都不与氯化钡溶液反应,选项A、C、D错误。
5
6
7
6.如图是检验某无色气体A是SO2和CO2的混合气体的装置图,按要求回答下列问题:
1
2
3
4
(1)装置B中加入的试剂是_________,作用是_________。
(2)装置C中加入的试剂是_______________,作用是__________________
_________。
(3)装置D中加入的试剂是___________,作用是_________。
(4)实验时,装置C中应观察到的现象是_____________________________
____________。
品红溶液
检验SO2
酸性KMnO4溶液
除去SO2并检验SO2
是否除尽
澄清石灰水
检验CO2
酸性KMnO4溶液的颜色变浅(写
褪色不正确)
5
6
7
解析 检验SO2用品红溶液,吸收SO2用酸性KMnO4溶液,检验CO2用澄清石灰水;在检验CO2之前,必须除尽SO2,因为SO2也能使澄清石灰水变浑浊。装置C的作用是除去SO2并检验SO2是否除尽,所以酸性KMnO4溶液颜色变浅,但不能褪成无色,若褪成无色则不能证明二氧化硫已除尽。
1
2
3
4
5
6
7
7.某化学兴趣小组为了探究常温下某未知气体的成分,将该气体通入澄清石灰水中,发现澄清石灰水变浑浊,持续通入,发现浑浊又变澄清。由此该小组同学对气体的成分提出猜想。
[提出猜想]
猜想1:_____________;
猜想2:_____________;
猜想3:__________________。
为了验证猜想,该小组同学设计如下实验进行探究。
1
2
3
4
气体含有CO2
气体含有SO2
气体含有CO2和SO2
5
6
7
[实验探究]
该小组同学按如图所示连接装置,将气体从a端通入。
(1)B中盛放的溶液应该是____(填字母)。
a.NaCl溶液
b.酸性KMnO4溶液
c.盐酸
d.澄清石灰水
(2)A中品红溶液的作用是_________________________。
1
2
3
4
b
检验该气体中是否含有SO2
5
6
7
(3)D中澄清石灰水的作用是__________________________。
通过以上实验,该小组同学观察到以下实验现象:
①A中品红溶液褪色;②C中品红溶液不褪色;③D中澄清石灰水变浑浊。
[得出结论]
(4)由上述现象,该小组同学认为该气体______________。
1
2
3
4
检验该气体中是否含有CO2
含有CO2和SO2
5
6
7
解析 首先根据题给信息,分析可能涉及的物质,进行假设,本题中猜想气体可能含有SO2或CO2,或二者都有;然后分析题目涉及物质的化学性质,如SO2和CO2性质的异同点;最后根据题意对假设进行一一验证,最终得出正确结论。SO2和CO2在某些性质方面较相似,如都能使澄清石灰水变浑浊,若通入的气体过量,则浑浊又变澄清。但SO2具有还原性,能被强氧化剂氧化,且SO2可使品红溶液褪色,而CO2不具备这些性质,可利用性质差异检验CO2是否存在。
1
2
3
4
5
6
7
归纳总结
(1)SO2与CO2的最大区别在于SO2具有漂白性、还原性和氧化性,而CO2只有氧化性。解决有关问题时,要注意相似性方面的干扰。
(2)CO2和SO2混合气体鉴别的实验题中,品红溶液常要使用两次,分别用于检验SO2的存在以及证明SO2是否被除尽。
(3)SO2虽有漂白性,但并不是所有与SO2有关的褪色都是因为SO2的漂白性。如:①SO2能使滴有酚酞的NaOH溶液褪色是因为SO2能与碱发生反应;②SO2能使溴水或酸性KMnO4溶液褪色是因为SO2的还原性。
本课结束
