化学人教版(2019)必修第一册第一章第一节物质的分类及转化 说课(共41张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册第一章第一节物质的分类及转化 说课(共41张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 6.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-21 15:22:03 | ||
图片预览











文档简介
(共41张PPT)
第一节
物质的分类及转化
说
课
第一章
物质及其变化
课程安排:
本节安排了两部分内容:物质的分类、物质的转化
课时安排:
2课时
本节内容的特点:
源于初中,高于初中。在编排思路上,教材注意与初中化学相关知识的合理衔接,以物质的分类、物质的转化为线索,复习和巩固旧知识,适当引入新知识。
教材分析:
根据物质的组成和性质对纯净物进行分类,学生在初中化学已初步介绍。在初中的基础上,重点介绍“树状分类法”和“交叉分类法”,以及同素异形体、酸性氧化物和碱性氧化物的概念。
溶液、乳浊液和悬浊液都是混合物,学生在初中化学课上已经学过。以此为基础,介绍分散系、分散质和分散剂的概念,然后以分散质粒子的直径大小为依据,引入胶体的概念,通过实验1—1引出胶体的重要化学性质——丁达尔效应。
1、物质的分类
2、物质的转化
以“思考与讨论”的形式,引导学生复习酸、碱、盐的主要化学性质,如列举实例,说明反应类型等。
巩固初中基础,加深对反应规律的认识,为介绍物质转化做准备。
通过以Ca、C元素的物质为例,引导学生认识不同类别物质之间的转化关系及反应规律。
教学目标:
1、通过对生活实例的反思,提炼分类的意义和方法,并迁移至物质分类,能对酸、碱、盐、氧化物及它们之间的反应进行描述和符号表征。
2、通过归纳相关物质间的化学反应关系,建立物质转化模型,认识物质的变化规律。
3、通过对Fe(OH)3胶体性质的讨论,能从微观粒子尺度和宏观性质相结合的角度解释相关解释相关自然现象。
教学重点和难点:
重点:应用分类法建立各类物质的转化关系模型
难点:各类物质间的转化关系。
第一章
物质的分类及转化
第一节
物质的分类
(第一课时)
教学过程:建议从学生熟悉的事物理解分类
请学生按照自己的方式整理自己的课本、练习册、笔记本、字典、词典等等。
如:
学生的可能情况:
1.
按学科分类
例如:语文、语文练习册、语文笔记本、语文作业本
2.
按模块分类
例如:课本、笔记本、练习册、作业本,工具书
请尝试对这些化学物质进行分类(红色字体标出的请写化学式)
分类的方法多种多样,并不唯一
空气、乙醇、水、硫酸钠、铜、碘酒、碘、氧气、石墨、食盐水、碳酸钠、二氧化硫、氧化铜、氢氧化铁
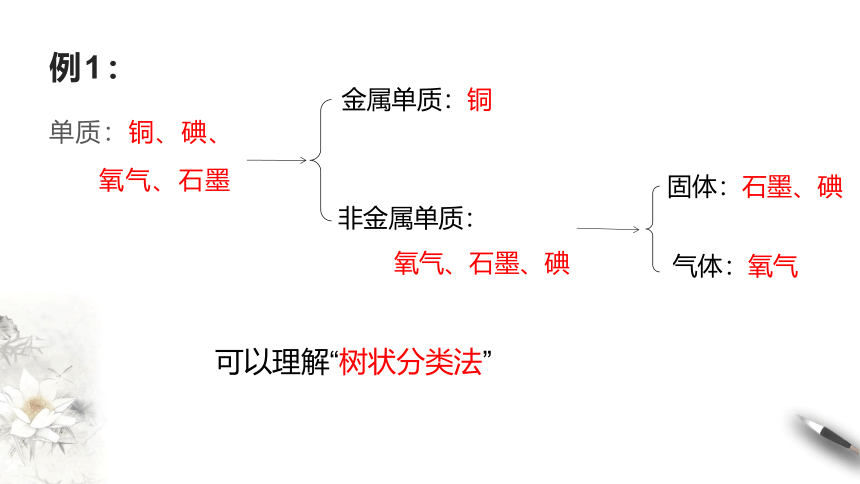
例1:
单质:铜、碘、
氧气、石墨
金属单质:铜
非金属单质:
氧气、石墨、碘
气体:氧气
固体:石墨、碘
可以理解“树状分类法”
1.物质的元素组成
(1)物质都是由_____组成,单质都是由_______元素组成,化合物是由_______元素组成。
(2)金刚石、石墨和C60都是由____元素组成的单质,它们的性质______。
(3)同素异形体是由________元素形成的几种_____不同的单质。
(4)CO和CO2是由____元素和____元素以不同的方式组成的化合物,它们都属于________氧化物。
一、根据物质的组成和性质分类
同一种
不同种
碳
不同
同一种
性质
碳
氧
非金属
元素
(1).树状分类法
指出右图中序号所示物质的分类依据:
①_____________________;
②_____________________;
③___________;
④_________________;
⑤_____________。
按是否由同种物质组成
按是否由同种元素组成
按元素性质
按是否含有碳元素
按化合物性质
根据研究对象的共同点和差异点,对同类事物按不同的属性进行再分类,形成有一定从属关系的不同等级系统的一种分类方法。
特点:同一层次的物质类别间一般是相互独立、没有交叉的。
使我们对事物的认识更加深刻
分类标准唯一
物质
纯净物
混合物
单质
化合物
酸
碱
盐
氧化物
金属单质
非金属单质
有机化合物
无机化合物
例2:将下列物质以不同标准分类
Na2CO3
K2SO4
钾
盐
硫酸盐
钠
盐
碳酸盐
Na2SO4
以所含阴离
子不同进行
分类
K2CO3
以所含阳离
子不同进行
分类
可以理解“交叉分类法”
2
交叉分类法
交叉分类法
钠
盐
碳酸盐
Na2CO3
Na2CO3
物质类别之间有部分交叉。
特点:
交叉分类法:依据物质的不同属性从不同的角度对物质进行分类的方法。
交叉分类法
树状分类法
特点:物质类别间有相交叉的部分
特点:同层次中各类别间相互独立
分类角度多样
分类标准唯一
1.常用分类方法
2.分类一般步骤:
选择分类方法
得出正确的分类
分类的一般原则:行之有效,简单易行。
确定分类标准
课
堂
小
结
一、物质的分类
2、分散系及分类
自学要求
:仔细阅读课本8、9页识记以下问题
1、识记分散系、分散质、分散剂概念
2、识记胶体的概念;胶体的分类
3、如何区分溶液与胶体
4、氢氧化铁胶体的制备
1、分散系
把一种或多种物质分散在另一种或多种物质中得到的体系
组成:分散系中被分散成粒子的物质叫做分散质,
另一种物质叫做分散剂。
分散质粒子大小
分散系
主要特征
实例
>100nm
浊液
不稳定、不均一
泥浆水
<1nm
溶液
稳定、均一
NaCl水溶液
1~100nm
(10-9~10-7m)
胶体
较稳定、均一
豆浆
按照分散质粒子直径大小,将分散剂为液体的分散系分为三种
①分散质粒子直径小于1
nm的分散系是溶液;
②分散质粒子直径大于100
nm的分散系是浊液;
③分散质粒子直径在1~100
nm之间的分散系是胶体。
胶体的特征:较均一,稳定,介稳体系
本质特征:分散质粒子直径在1-100nm之间。
(1)概念:分散质微粒的直径大小在10-9—10-7m(1-100nm)之间的分散系。
(溶液:
<1nm
;
悬浊液、乳浊液:
>100nm)
2、胶体
胶体属于纯净物还是混合物?
(2)、胶体的分类
根据分散质微粒的构成分
粒子胶体:Fe(OH)3胶体、AgI胶体
分子胶体:淀粉溶液、蛋白质溶液
根据分散剂状态分
固溶胶:有色玻璃、烟水晶
液溶胶:AgI胶体、Fe(OH)3胶体
气溶胶:烟、云、雾
常见的胶体
液溶胶
固溶胶
烟水晶
有色玻璃
雾
气溶胶
烟
白云
常见的胶体:烟、云、雾,河、湖、池塘中的水、血液、牛奶、豆浆、果冻、米粥汤、蛋白质溶液、胶水、墨水、液状涂料、肥皂水、有色玻璃、变色玻璃、土壤胶体、淀粉溶液。
(3)、Fe(OH)3胶体的制备
FeCl3
+
3H2O
Fe(OH)3(胶体)
+
3HCl
△
当溶液呈红褐色时马上停止加热。
(3)、Fe(OH)3胶体的制备
必须选用FeCl3饱和溶液,不能用稀溶液。
向沸水中滴加FeCl3饱和溶液,而不直接加热FeCl3饱和溶液。
必须使用蒸馏水,不然会导致生成Fe(OH)3沉淀
往沸水中滴加FeCl3饱和溶液后,可稍微加热煮沸,但不宜时间过长,长时间加热将导致氢氧化铁胶体聚沉
边加热边摇动烧杯,但不能用玻璃棒搅拌,否则会使Fe(OH)3胶粒碰撞成大颗粒形成沉淀
利用丁达尔效应来区分胶体和溶液是一种的常用物理方法。
3、胶体的性质:
当一束光线照射胶体时,从侧面观察,可看见在胶体里形成一条光亮的通路的现象。它是物质的聚集状态所表现出来的一种性质。
丁达尔效应:
胶体的光学性质-Tyndall现象
CuSO4溶液
Fe(OH)3溶胶
丁
达
尔
效
应
都市的美丽夜空
小结
1)概念:
2、分散系及其分类
分散质粒子直径大小在1~100nm之间的分散系
一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物。
分散质:
被分散成粒子的物质
分散剂:
容纳分散质的物质
2)组成
3)分类及其分类依据:
溶液
浊液
胶体
(1)胶体的定义:
本质特征
小结
(2)胶体的种类:
气溶胶
液溶胶
固溶胶
(3)Fe(OH)3胶体的制备
方法:
原理:
将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6
滴
FeCl3饱和溶液。
继续煮沸至溶液呈红褐色,停止加热。
丁达尔效应--区分胶体与溶液的一种物理方法。
(4)胶体的性质
成因:
胶体粒子对光线散射形成
FeCl3
+
3H2O
==
Fe(OH)3(胶体)
+
3HCl
△
第一章
物质的分类及转化
第一节
物质的分类
(第二课时)
二、物质的转化
建议:提供三个表格分别归纳酸、碱、盐的化学性质。让学生独立完成。可以在学案里完成!
(1)酸的主要化学性质归纳如下,请列举反应实例,完成下表
酸的主要化学性质
反应实例(写出化学方程式)
酸与活泼金属反应
酸与碱性氧化物反应
酸与碱反应
酸与某些盐反应
1.
酸、碱、盐的性质
(2)碱的主要化学性质归纳如下,请列举反应实例,完成下表
碱的主要化学性质
反应实例(写出化学方程式)
碱与活泼金属反应
碱与酸性氧化物反应
碱与酸反应
碱与某些盐反应
(3)盐的主要化学性质归纳如下,请列举反应实例,完成下表
盐的主要化学性质
反应实例(写出化学方程式)
盐与金属反应
盐与碱反应
盐与酸反应
盐与盐反应
根据物质的组成和性质,通过化学变化可以实现物质之间的转化。请同学们完成P11思考与讨论
2、物质的转化
金属
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
非金属单质
酸性氧化物
酸
盐
O2
H2O
碱或碱性氧化物
酸或酸性氧化物
碱或碱性氧化物
从物质的分类角度构建物质转化规律的模型认知
物质组成与性质
物质的分类
物质的转化
工业生产中物质的制备
谢
观
看
THANK
YOU
FOR
WATCHING
谢
第一节
物质的分类及转化
说
课
第一章
物质及其变化
课程安排:
本节安排了两部分内容:物质的分类、物质的转化
课时安排:
2课时
本节内容的特点:
源于初中,高于初中。在编排思路上,教材注意与初中化学相关知识的合理衔接,以物质的分类、物质的转化为线索,复习和巩固旧知识,适当引入新知识。
教材分析:
根据物质的组成和性质对纯净物进行分类,学生在初中化学已初步介绍。在初中的基础上,重点介绍“树状分类法”和“交叉分类法”,以及同素异形体、酸性氧化物和碱性氧化物的概念。
溶液、乳浊液和悬浊液都是混合物,学生在初中化学课上已经学过。以此为基础,介绍分散系、分散质和分散剂的概念,然后以分散质粒子的直径大小为依据,引入胶体的概念,通过实验1—1引出胶体的重要化学性质——丁达尔效应。
1、物质的分类
2、物质的转化
以“思考与讨论”的形式,引导学生复习酸、碱、盐的主要化学性质,如列举实例,说明反应类型等。
巩固初中基础,加深对反应规律的认识,为介绍物质转化做准备。
通过以Ca、C元素的物质为例,引导学生认识不同类别物质之间的转化关系及反应规律。
教学目标:
1、通过对生活实例的反思,提炼分类的意义和方法,并迁移至物质分类,能对酸、碱、盐、氧化物及它们之间的反应进行描述和符号表征。
2、通过归纳相关物质间的化学反应关系,建立物质转化模型,认识物质的变化规律。
3、通过对Fe(OH)3胶体性质的讨论,能从微观粒子尺度和宏观性质相结合的角度解释相关解释相关自然现象。
教学重点和难点:
重点:应用分类法建立各类物质的转化关系模型
难点:各类物质间的转化关系。
第一章
物质的分类及转化
第一节
物质的分类
(第一课时)
教学过程:建议从学生熟悉的事物理解分类
请学生按照自己的方式整理自己的课本、练习册、笔记本、字典、词典等等。
如:
学生的可能情况:
1.
按学科分类
例如:语文、语文练习册、语文笔记本、语文作业本
2.
按模块分类
例如:课本、笔记本、练习册、作业本,工具书
请尝试对这些化学物质进行分类(红色字体标出的请写化学式)
分类的方法多种多样,并不唯一
空气、乙醇、水、硫酸钠、铜、碘酒、碘、氧气、石墨、食盐水、碳酸钠、二氧化硫、氧化铜、氢氧化铁
例1:
单质:铜、碘、
氧气、石墨
金属单质:铜
非金属单质:
氧气、石墨、碘
气体:氧气
固体:石墨、碘
可以理解“树状分类法”
1.物质的元素组成
(1)物质都是由_____组成,单质都是由_______元素组成,化合物是由_______元素组成。
(2)金刚石、石墨和C60都是由____元素组成的单质,它们的性质______。
(3)同素异形体是由________元素形成的几种_____不同的单质。
(4)CO和CO2是由____元素和____元素以不同的方式组成的化合物,它们都属于________氧化物。
一、根据物质的组成和性质分类
同一种
不同种
碳
不同
同一种
性质
碳
氧
非金属
元素
(1).树状分类法
指出右图中序号所示物质的分类依据:
①_____________________;
②_____________________;
③___________;
④_________________;
⑤_____________。
按是否由同种物质组成
按是否由同种元素组成
按元素性质
按是否含有碳元素
按化合物性质
根据研究对象的共同点和差异点,对同类事物按不同的属性进行再分类,形成有一定从属关系的不同等级系统的一种分类方法。
特点:同一层次的物质类别间一般是相互独立、没有交叉的。
使我们对事物的认识更加深刻
分类标准唯一
物质
纯净物
混合物
单质
化合物
酸
碱
盐
氧化物
金属单质
非金属单质
有机化合物
无机化合物
例2:将下列物质以不同标准分类
Na2CO3
K2SO4
钾
盐
硫酸盐
钠
盐
碳酸盐
Na2SO4
以所含阴离
子不同进行
分类
K2CO3
以所含阳离
子不同进行
分类
可以理解“交叉分类法”
2
交叉分类法
交叉分类法
钠
盐
碳酸盐
Na2CO3
Na2CO3
物质类别之间有部分交叉。
特点:
交叉分类法:依据物质的不同属性从不同的角度对物质进行分类的方法。
交叉分类法
树状分类法
特点:物质类别间有相交叉的部分
特点:同层次中各类别间相互独立
分类角度多样
分类标准唯一
1.常用分类方法
2.分类一般步骤:
选择分类方法
得出正确的分类
分类的一般原则:行之有效,简单易行。
确定分类标准
课
堂
小
结
一、物质的分类
2、分散系及分类
自学要求
:仔细阅读课本8、9页识记以下问题
1、识记分散系、分散质、分散剂概念
2、识记胶体的概念;胶体的分类
3、如何区分溶液与胶体
4、氢氧化铁胶体的制备
1、分散系
把一种或多种物质分散在另一种或多种物质中得到的体系
组成:分散系中被分散成粒子的物质叫做分散质,
另一种物质叫做分散剂。
分散质粒子大小
分散系
主要特征
实例
>100nm
浊液
不稳定、不均一
泥浆水
<1nm
溶液
稳定、均一
NaCl水溶液
1~100nm
(10-9~10-7m)
胶体
较稳定、均一
豆浆
按照分散质粒子直径大小,将分散剂为液体的分散系分为三种
①分散质粒子直径小于1
nm的分散系是溶液;
②分散质粒子直径大于100
nm的分散系是浊液;
③分散质粒子直径在1~100
nm之间的分散系是胶体。
胶体的特征:较均一,稳定,介稳体系
本质特征:分散质粒子直径在1-100nm之间。
(1)概念:分散质微粒的直径大小在10-9—10-7m(1-100nm)之间的分散系。
(溶液:
<1nm
;
悬浊液、乳浊液:
>100nm)
2、胶体
胶体属于纯净物还是混合物?
(2)、胶体的分类
根据分散质微粒的构成分
粒子胶体:Fe(OH)3胶体、AgI胶体
分子胶体:淀粉溶液、蛋白质溶液
根据分散剂状态分
固溶胶:有色玻璃、烟水晶
液溶胶:AgI胶体、Fe(OH)3胶体
气溶胶:烟、云、雾
常见的胶体
液溶胶
固溶胶
烟水晶
有色玻璃
雾
气溶胶
烟
白云
常见的胶体:烟、云、雾,河、湖、池塘中的水、血液、牛奶、豆浆、果冻、米粥汤、蛋白质溶液、胶水、墨水、液状涂料、肥皂水、有色玻璃、变色玻璃、土壤胶体、淀粉溶液。
(3)、Fe(OH)3胶体的制备
FeCl3
+
3H2O
Fe(OH)3(胶体)
+
3HCl
△
当溶液呈红褐色时马上停止加热。
(3)、Fe(OH)3胶体的制备
必须选用FeCl3饱和溶液,不能用稀溶液。
向沸水中滴加FeCl3饱和溶液,而不直接加热FeCl3饱和溶液。
必须使用蒸馏水,不然会导致生成Fe(OH)3沉淀
往沸水中滴加FeCl3饱和溶液后,可稍微加热煮沸,但不宜时间过长,长时间加热将导致氢氧化铁胶体聚沉
边加热边摇动烧杯,但不能用玻璃棒搅拌,否则会使Fe(OH)3胶粒碰撞成大颗粒形成沉淀
利用丁达尔效应来区分胶体和溶液是一种的常用物理方法。
3、胶体的性质:
当一束光线照射胶体时,从侧面观察,可看见在胶体里形成一条光亮的通路的现象。它是物质的聚集状态所表现出来的一种性质。
丁达尔效应:
胶体的光学性质-Tyndall现象
CuSO4溶液
Fe(OH)3溶胶
丁
达
尔
效
应
都市的美丽夜空
小结
1)概念:
2、分散系及其分类
分散质粒子直径大小在1~100nm之间的分散系
一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物。
分散质:
被分散成粒子的物质
分散剂:
容纳分散质的物质
2)组成
3)分类及其分类依据:
溶液
浊液
胶体
(1)胶体的定义:
本质特征
小结
(2)胶体的种类:
气溶胶
液溶胶
固溶胶
(3)Fe(OH)3胶体的制备
方法:
原理:
将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6
滴
FeCl3饱和溶液。
继续煮沸至溶液呈红褐色,停止加热。
丁达尔效应--区分胶体与溶液的一种物理方法。
(4)胶体的性质
成因:
胶体粒子对光线散射形成
FeCl3
+
3H2O
==
Fe(OH)3(胶体)
+
3HCl
△
第一章
物质的分类及转化
第一节
物质的分类
(第二课时)
二、物质的转化
建议:提供三个表格分别归纳酸、碱、盐的化学性质。让学生独立完成。可以在学案里完成!
(1)酸的主要化学性质归纳如下,请列举反应实例,完成下表
酸的主要化学性质
反应实例(写出化学方程式)
酸与活泼金属反应
酸与碱性氧化物反应
酸与碱反应
酸与某些盐反应
1.
酸、碱、盐的性质
(2)碱的主要化学性质归纳如下,请列举反应实例,完成下表
碱的主要化学性质
反应实例(写出化学方程式)
碱与活泼金属反应
碱与酸性氧化物反应
碱与酸反应
碱与某些盐反应
(3)盐的主要化学性质归纳如下,请列举反应实例,完成下表
盐的主要化学性质
反应实例(写出化学方程式)
盐与金属反应
盐与碱反应
盐与酸反应
盐与盐反应
根据物质的组成和性质,通过化学变化可以实现物质之间的转化。请同学们完成P11思考与讨论
2、物质的转化
金属
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
非金属单质
酸性氧化物
酸
盐
O2
H2O
碱或碱性氧化物
酸或酸性氧化物
碱或碱性氧化物
从物质的分类角度构建物质转化规律的模型认知
物质组成与性质
物质的分类
物质的转化
工业生产中物质的制备
谢
观
看
THANK
YOU
FOR
WATCHING
谢
