1.1 反应热 课件 【新教材】人教版(2019)高中化学选择性必修一(38张PPT)
文档属性
| 名称 | 1.1 反应热 课件 【新教材】人教版(2019)高中化学选择性必修一(38张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 8.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-21 17:41:59 | ||
图片预览






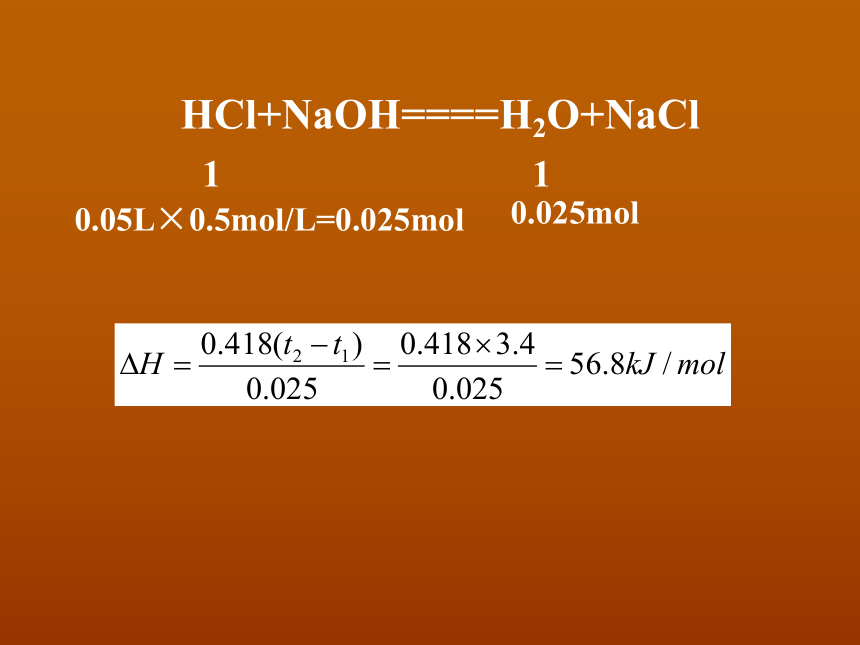


文档简介
(共38张PPT)
选择性必修1——化学反应原理
一、反应热、焓变
(一)反应热及其测定
1、定义:
等温条件之下,化学反应体系向环境释放或者从环境吸收的热量,称之为化学反应的热效应,简称为反应热。
说明:热量指的是因为温度不同从而在体系何环境之间交换或者传递的能量
例:某试管中盛有Al粉和稀盐酸,下列有关说法不正确的是(
)
A.试管、Al粉、稀盐酸及发生的反应可看作一个体系
B.除反应物、生成物及相关反应外,其他均看作环境
C.Al与稀盐酸反应导致体系温度升高,且向环境中释放热量
D.Al与稀盐酸反应的反应热可以通过量热计测量
答案:A
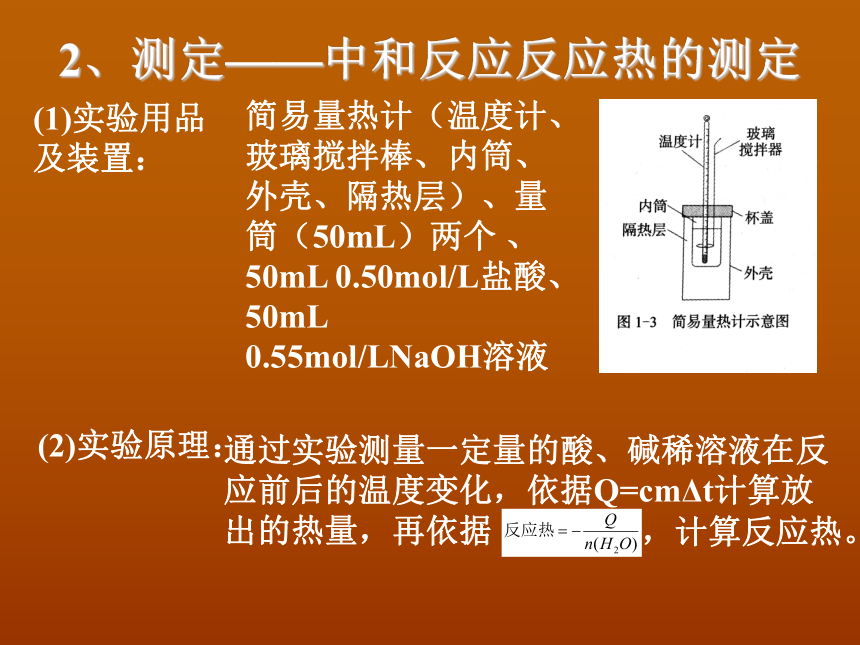
2、测定——中和反应反应热的测定
(1)实验用品
及装置:
简易量热计(温度计、玻璃搅拌棒、内筒、外壳、隔热层)、量筒(50mL)两个
、50mL
0.50mol/L盐酸、50mL
0.55mol/LNaOH溶液
(2)实验原理:
通过实验测量一定量的酸、碱稀溶液在反应前后的温度变化,依据Q=cmΔt计算放出的热量,再依据
,计算反应热。
(3)实验步骤:
请按照下列步骤,用简易量热计测量盐酸与NaOH溶液反应前后的温度
①反应物温度的测量。
I、用量筒量取50mL0.50mol/L
盐酸,打开杯盖,倒入量热计的内筒中,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)用水把温度计上的酸冲洗干净,擦干备用。
II、用另一个量筒量取50mL0.55
mol/L
NaOH溶液,用温度计测量并记录NaOH溶液的温度(数据填入下表)。
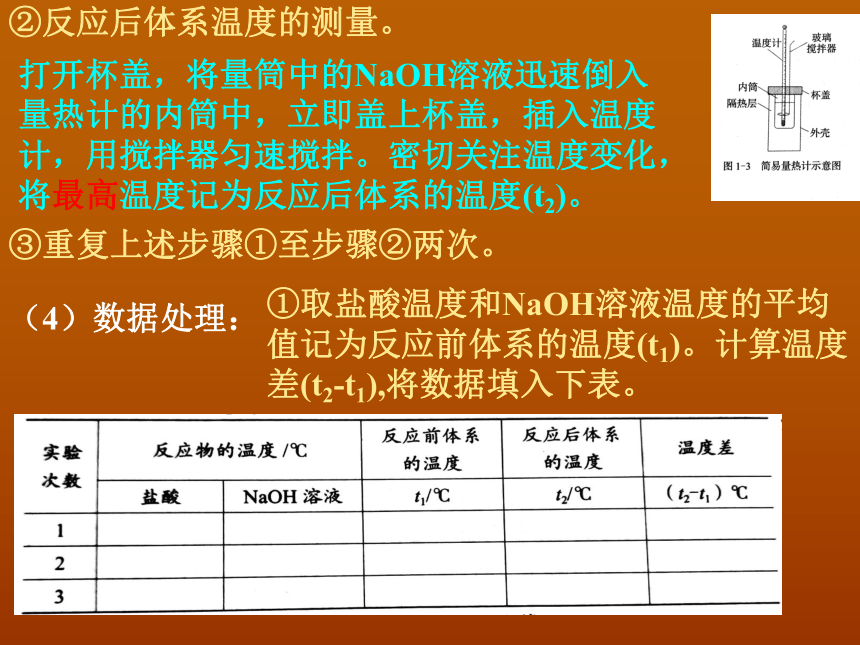
②反应后体系温度的测量。
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒中,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温度(t2)。
③重复上述步骤①至步骤②两次。
(4)数据处理:
①取盐酸温度和NaOH溶液温度的平均值记为反应前体系的温度(t1)。计算温度差(t2-t1),将数据填入下表。
II、反应后生成的溶液的比热容c=4.18J/(g·℃),
50mL0.50mol/L盐酸与50mL0.55
mol/L
NaOH溶液发生
中和反应时放出的热量为:
(m1+m2)·c·(t2-t1)=
②取三次测量所得温度差的平均值作为计算依据。
③根据温度差和比热容等计算反应热。
为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容,则:
I、50mL0.50moL盐酸的质量m1=50g,
50mL0.55mo/
L
NaOH溶液的质量m2=50g。
4.18J/(g·℃)×(50mL×1g/mL+50mL×1g/mL)×(t2-t1)=0.418(t2-t1)
kJ
III、生成1moH2O时放出的热量为
?????????
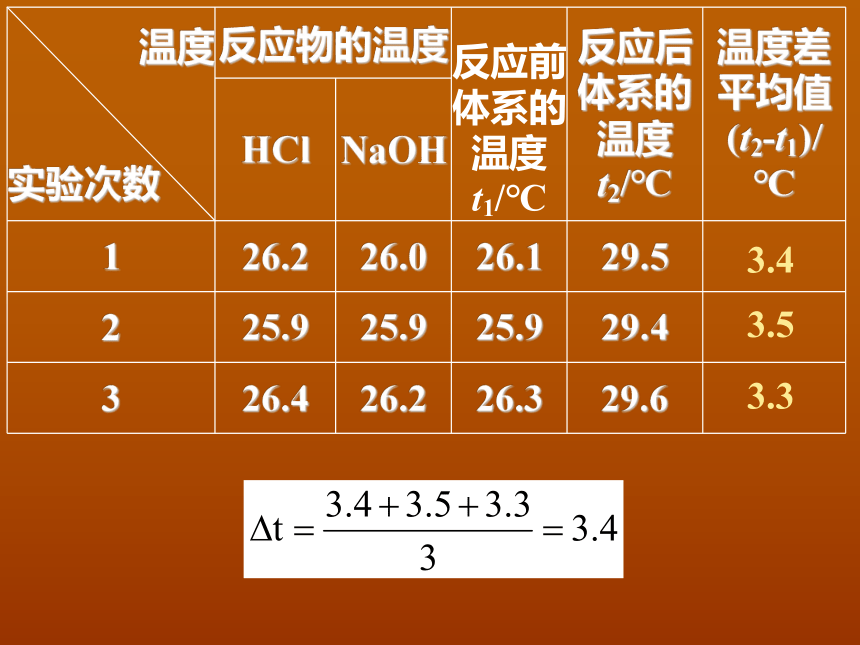
温度
实验次数
反应物的温度
反应前体系的温度t1/℃
反应后体系的温度
t2/℃
温度差平均值
(t2-t1)/
℃
HCl
NaOH
1
26.2
26.0
26.1
29.5
?
2
25.9
25.9
25.9
29.4
3
26.4
26.2
26.3
29.6
3.4
3.5
3.3
HCl+NaOH====H2O+NaCl
1
1
0.05L×0.5mol/L=0.025mol
0.025mol
(5)注意事项:
①要使用同一支温度计:测量酸碱及混合液的温度时,测定一种溶液温度后温度计必须用水冲洗干净并用滤纸擦干
②减少热量损失:在量热的过程中,操作时动作要快,尽量减少热量的散失。盖板上的两个孔不要开得过大,只要能正好使温度计和玻璃搅拌棒通过即可。要一次性、迅速地将NaOH溶液倒进装有盐酸的容器里(注意不要洒到外面),并立即用杯盖盖好,及时观察温度上升情况
③操作规范、读数准确
a、所配溶液的浓度要准确,所用NaOH溶液最好是新配制的,久置的NaOH溶液往往由于吸收空气中的CO2导致浓度不准,影响实验结果。
b、要比较准确地测量出反应中溶液温度的变化,所用的盐酸和氢氧化钠溶液配好后要充分冷却至室温后,才能使用,且中和后的温度一定要记混合溶液的最高温
c、温度计的水银球要完全浸没在溶液中,且不能靠在容器的底部或壁上。测混合液最高温度时,要随时读取温度值,以提高所测温度的精确度
d、量取液体体积时读数要准确
e、要用玻璃搅拌棒轻轻搅动溶液,使酸碱充分反应
(6)导致测定误差的因素
①量取溶液的体积不准确
②温度计读数有误(如未读取混合溶液的最高温度,就记为终止温度)
③实验过程中有液体溅出
④混合酸、碱溶液时,动作缓慢,从而引起实验误差
⑤隔热层隔热效果不好,实验过程中热量损失太大,从而引起误差
⑥测过盐酸的温度计未用水清洗,便立即去测碱的温度,因热量损失而引起误差
⑦溶液浓度不准确
⑧没有进行重复实验
3、中和热:
(1)定义:
在稀溶液中,酸与碱发生中和反应生成1molH2O(l)
时放出的热量,叫做中和热
(2)表示方法:
H+(aq)+OH-(aq)=H2O(l)
ΔH=-57.3kJ/mol
(3)说明:
①条件:
稀溶液,因浓酸或浓碱在稀释时会放出热量,使最终的中和热数值变大
②反应物:
必须是强酸与强碱,因弱酸、弱碱电离吸热,使最终的中和热数值变小
③生成物及其物质的量:
必须是1molH2O(l);
不能有沉淀生成,因生成沉淀放热,使最终的中和热数值变大
④表述:
用文字表述中和热时,不带“-”号;用ΔH表示时,带上“-”。
例如:强酸与强碱反应的中和热为57.3kJ/mol或ΔH=-57.3kJ/mol
⑤对于任意一个中和热的热化学方程式,它的ΔH准确值一定等于-57.3kJ/mol
(二)反应热与焓变
1、化学反应前后反应热产生的原因:化学反应前后体系的内能发生了变化
2、内能:是体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响
3、焓变:
(1)焓的由来:
为了描述等压条件下的反应热,科学上引入了一个与内能有关的物理量——焓(符号为H)
(2)焓变与反应热的关系:
在等压条件下进行的化学反应(严格地说,对反应体系作功还有限定,中学阶段一般不考虑),其反应热就等于反应的焓变
(3)焓变的符号和单位:
ΔH,kJ/mol或kJ·mol-1
4、焓变产生的原因:
(1)微观:化学键的断裂与形成
反应物→断键→吸收能量
>
生成物→成键→释放能量
吸收能量→吸热反应→焓变为正值
反应物→断键→吸收能量
<
生成物→成键→释放能量
释放能量→放热反应→焓变为负值
(2)宏观:反应物与生成物的总能量
反应物的总能量>生成物的总能量→放热反应→焓变为负值
反应物的总能量<生成物的总能量→吸热反应→焓变为正值
(4)焓变与焓的关系:
ΔH=H生成物-H反应物
5、焓变(或反应热)与吸、放热反应的关系
(1)关系:
放热反应:ΔH为“-”,即ΔH<0(放热→体系能量降低)
吸热反应:ΔH为“+”,即ΔH>0(吸热→体系能量升高)
在25℃和101kPa下,1molC(如无特别说明,C均指石墨)与1molH2O(g)
反应,生成1
mol
CO和1molH2,需要吸收131.5kJ的热量,则该反应的反应热为△H=+131.5kJ/mol
例如,在25℃和101kPa下,1molH2与1
mol
Cl2反应生成2
mol
HCl时放出184.6kJ的热量,则该反应的反应热为:△H=-184.6kJ/mol
(2)比较大小:
比较ΔH大小时,要带上“+”、“-”号,
即所有放热反应的焓变小于所有吸热反应的焓变
复习:常见的放热反应与吸热反应
放热反应:所有的燃烧反应、所有的酸碱中和反应、大多数化合反应、铝热反应、活泼金属与水或酸的反应
、少数分解反应(如过氧化氢分解制备氧气)
吸热反应:
大多数的分解反应、C+CO2
2CO
Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3·H2O+8H2O
C+H2O(g)
CO+H2
NaHCO3+HCl=H2O+CO2↑+NaCl
(3)计算方法:
宏观:ΔH=生成物的总能量-反应物的总能量
微观:ΔH=断键吸收的能量-成键释放的能量
ΔH=反应物的键能之和-生成物的键能之和
注:①在描述ΔH时,符号、数值、单位三者缺一不可,是个整体
②键能:拆开化学键所需要的能量
③键能与能量的关系:物质的键能越大,物质本身所具有的能量越低,物质越稳定
④常见物质化学键的键数
1mol物质
CO2(C=O)
CH4(C-H)
P4(P-P)
SiO2(Si-O)
石墨(C-C)
金刚石(C-C)
Si(Si-Si)
键数
2
4
6
4
1.5
2
2
1、根据键能数据计算CH4(g)+
4F2(g)=CF4(g)+4HF(g)的反应热△H为(
)
A.-485
kJ/mol
B.+485
kJ/mol
C.+1940
kJ/mol
D.-1940
kJ
/mol
D
解析:?H=(4×414+4×155)-(4×489+4×565)
=-1940
(ΔH=反应物的键能之和-生成物的键能之和)
2.化学键的键能是形成(或拆开)lmol化学键时释放(或吸收)的能量。已知白磷和P4O6
的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷,s)+3O2(g)=P4O6(s)
(
)
A.放出1638kJ热量
B.吸收1638kJ热量
C.放出126kJ热量
D.吸收126kJ热量
A
(ΔH=反应物的键能之和-生成物的键能之和)
解析:?H=(6×198+3×498)-(12×360)
=-1638
二、热化学方程式
(一)定义:表明反应所释放或吸收的热量的化学
方程式
(二)意义:表明了化学反应中的物质变化和能量变化
(三)书写:
1、步骤:
写——写出配平的化学方程式
标——标出各物质的聚集状态:气体(g)、固体(s)、
液体(l)、溶液(aq);化学式相同的同素异
形体还应注明名称,例如:金刚石表示为
“C(金刚石,s)”。
注——注明ΔH的正负号,数值和单位(ΔH与最后一种生成物之间留一空格)
举例:
H2
(g)+I2
(g)=====2HI
(g)
△H=-
14.9kJ/mol
200℃
101kPa
2、注意事项
⑴需注明物质的聚集状态,
聚集状态不同,它们所具
有的内能、焓也均不同。
1、2H2
(g)+O2
(g)=2H2O
(l)
△H=-
571.6kJ/mol
2、2H+(aq)+2OH-
(aq)+Ba2+(aq)+SO42-(aq)=BaSO4(s)+2H2O(l)
ΔH=-QkJ/mol
⑵各物质前的计量数只表示物质的物质的量,所
以可以写整数也可以写分数
1、KOH(aq)+1/2H2SO4(aq)=1/2K2SO4(aq)+H2O(l)?
ΔH=-57.3kJ/mol
2、C(s)+1/2O2(g)=CO(g)
ΔH
=-111kJ/mol
⑶ΔH的数值随整个方程式发生变化:方程式加倍或减少,ΔH也随之加倍或减少;方程式反应物和生成物调换,ΔH的正负号也随之调换
1、2H2
(g)+O2
(g)=2H2O
(l)
△H=-
571.6kJ/mol
2、H2
(g)+1/2O2
(g)=H2O
(l)
△H=-
285.8kJ/mol
3、
2H2O
(l)
=2H2
(g)+O2
(g)
△H=+571.6kJ/mol
⑷不写反应条件;由于已经注明了物质的聚集状态,所以热化学方程式不写↓、↑
1、2H+(aq)+2OH-
(aq)+Ba2+(aq)+SO42-(aq)=BaSO4(s)+2H2O(l)
ΔH=-QkJ/mol
2、
2H2O
(l)
=2H2
(g)+O2
(g)
△H=+571.6kJ/mol
⑸不论化学反应是否可逆,热化学方程式中的
ΔH都表示反应进行到底(即完全转化)时的
能量变化
例如:2SO2(g)+O2(g)
2SO3(g)
?H=-197kJ/mol,是指2molSO2(g)和1molO2(g)完全转化为2SO3(g)时放出的热量为197kJ。若在相同的温度和压强下,向某容器中加入2molSO2(g)和1molO2(g),反应达到平衡时放出的热量为Q,因反应不能进行彻底,故Q<197kJ
⑹需注明反应的温度和压强,但因中学化学所用
的ΔH的数值一般都是在101kpa和25℃时测定
的,因此可以不注明
1、H2
(g)+I2
(g)=====2HI
(g)
△H=-
14.9kJ/mol
200℃
101kPa
2、2H2
(g)+O2
(g)=2H2O
(l)
△H=-
571.6kJ/mol
(四)判断热化学方程式的正误要注意“四看”
1、看各物质的聚集状态是否正确
2、看ΔH的正负号是否正确
3、看反应热的单位是否为kJ/mol
4、看反应热数值与化学计量数是否相对应
下列有关热化学方程式的书写和叙述正确的是(
)
A.1mol液态肼在足量氧气中完全燃烧生成氮气和水蒸气,放出642kJ的热量:
N2H4(1)+O2(g)=N2(g)+2H2O(g)
△H=+642kJ·mol-1
B.12g石墨转化为CO(g)时,放出110.5kJ的热量:
2C(石墨,s)+O2(g)=2CO(g)
△H=-110.5kJ·mol-1
C.已知H2(g)+2O2(g)=H2O(1)
△H=-285.8kJ·mol-1,则2H2O(1)=2H2(g)+O2(g)
△H=+571.6kJ·mol-1
D.已知N2(g)+3H2(g)
2NH3(g)△H=-92.2kJ·mol-1,则在一定条件下向密闭容器中充入0.5molN2(g)和1.5molH2(g)充分反应放出46.1kJ的热量
C
三、燃烧热
(一)定义:
101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量,叫做该物质的燃烧热
(二)单位:
kJ/mol或kJ·mol-1
(三)测定:
燃烧热通常利用量热计由实验测得
(四)意义:
C的燃烧热为393.5kJ/mol,表示在101kPa时,1molC完全燃烧生成CO2(g)时所放出393.5kJ的热量
(五)说明:
1、反应条件:101kPa
2、可燃物的用量:1mol纯物质,即在写燃烧热的热化学方程式时,可燃物前面的系数必须为1
3、反应程度:完全燃烧,形成指定产物:C→CO2(g)、H→H2O(l)、S→SO2(g)、N→N2(g)
4、燃烧环境:没有特殊说明。燃烧一般是指在氧气中的燃烧
5、文字叙述燃烧热时,用“正值”或“ΔH”表示。例如:CH4的燃烧热为890.31kJ/mol或ΔH=
—890.31kJ/mol
6、比较燃烧热大小时,只比较绝对值
7、注意区分燃烧的热化学方程式与燃烧热的热化学方程式
例题:甲醇属于可再生能源,可代替汽油作为汽车燃料。下列表示甲醇燃烧热的热化学方程式书写正确的是(
)
A.CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(1)△H=+726.5kJ/mol
B.CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(1)
△H=-726.5kJ/mol
C
.CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(g)△H=-675.3kJ/mol
D.2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1)△H=-1453kJ/mol
B
选择性必修1——化学反应原理
一、反应热、焓变
(一)反应热及其测定
1、定义:
等温条件之下,化学反应体系向环境释放或者从环境吸收的热量,称之为化学反应的热效应,简称为反应热。
说明:热量指的是因为温度不同从而在体系何环境之间交换或者传递的能量
例:某试管中盛有Al粉和稀盐酸,下列有关说法不正确的是(
)
A.试管、Al粉、稀盐酸及发生的反应可看作一个体系
B.除反应物、生成物及相关反应外,其他均看作环境
C.Al与稀盐酸反应导致体系温度升高,且向环境中释放热量
D.Al与稀盐酸反应的反应热可以通过量热计测量
答案:A
2、测定——中和反应反应热的测定
(1)实验用品
及装置:
简易量热计(温度计、玻璃搅拌棒、内筒、外壳、隔热层)、量筒(50mL)两个
、50mL
0.50mol/L盐酸、50mL
0.55mol/LNaOH溶液
(2)实验原理:
通过实验测量一定量的酸、碱稀溶液在反应前后的温度变化,依据Q=cmΔt计算放出的热量,再依据
,计算反应热。
(3)实验步骤:
请按照下列步骤,用简易量热计测量盐酸与NaOH溶液反应前后的温度
①反应物温度的测量。
I、用量筒量取50mL0.50mol/L
盐酸,打开杯盖,倒入量热计的内筒中,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)用水把温度计上的酸冲洗干净,擦干备用。
II、用另一个量筒量取50mL0.55
mol/L
NaOH溶液,用温度计测量并记录NaOH溶液的温度(数据填入下表)。
②反应后体系温度的测量。
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒中,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温度(t2)。
③重复上述步骤①至步骤②两次。
(4)数据处理:
①取盐酸温度和NaOH溶液温度的平均值记为反应前体系的温度(t1)。计算温度差(t2-t1),将数据填入下表。
II、反应后生成的溶液的比热容c=4.18J/(g·℃),
50mL0.50mol/L盐酸与50mL0.55
mol/L
NaOH溶液发生
中和反应时放出的热量为:
(m1+m2)·c·(t2-t1)=
②取三次测量所得温度差的平均值作为计算依据。
③根据温度差和比热容等计算反应热。
为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容,则:
I、50mL0.50moL盐酸的质量m1=50g,
50mL0.55mo/
L
NaOH溶液的质量m2=50g。
4.18J/(g·℃)×(50mL×1g/mL+50mL×1g/mL)×(t2-t1)=0.418(t2-t1)
kJ
III、生成1moH2O时放出的热量为
?????????
温度
实验次数
反应物的温度
反应前体系的温度t1/℃
反应后体系的温度
t2/℃
温度差平均值
(t2-t1)/
℃
HCl
NaOH
1
26.2
26.0
26.1
29.5
?
2
25.9
25.9
25.9
29.4
3
26.4
26.2
26.3
29.6
3.4
3.5
3.3
HCl+NaOH====H2O+NaCl
1
1
0.05L×0.5mol/L=0.025mol
0.025mol
(5)注意事项:
①要使用同一支温度计:测量酸碱及混合液的温度时,测定一种溶液温度后温度计必须用水冲洗干净并用滤纸擦干
②减少热量损失:在量热的过程中,操作时动作要快,尽量减少热量的散失。盖板上的两个孔不要开得过大,只要能正好使温度计和玻璃搅拌棒通过即可。要一次性、迅速地将NaOH溶液倒进装有盐酸的容器里(注意不要洒到外面),并立即用杯盖盖好,及时观察温度上升情况
③操作规范、读数准确
a、所配溶液的浓度要准确,所用NaOH溶液最好是新配制的,久置的NaOH溶液往往由于吸收空气中的CO2导致浓度不准,影响实验结果。
b、要比较准确地测量出反应中溶液温度的变化,所用的盐酸和氢氧化钠溶液配好后要充分冷却至室温后,才能使用,且中和后的温度一定要记混合溶液的最高温
c、温度计的水银球要完全浸没在溶液中,且不能靠在容器的底部或壁上。测混合液最高温度时,要随时读取温度值,以提高所测温度的精确度
d、量取液体体积时读数要准确
e、要用玻璃搅拌棒轻轻搅动溶液,使酸碱充分反应
(6)导致测定误差的因素
①量取溶液的体积不准确
②温度计读数有误(如未读取混合溶液的最高温度,就记为终止温度)
③实验过程中有液体溅出
④混合酸、碱溶液时,动作缓慢,从而引起实验误差
⑤隔热层隔热效果不好,实验过程中热量损失太大,从而引起误差
⑥测过盐酸的温度计未用水清洗,便立即去测碱的温度,因热量损失而引起误差
⑦溶液浓度不准确
⑧没有进行重复实验
3、中和热:
(1)定义:
在稀溶液中,酸与碱发生中和反应生成1molH2O(l)
时放出的热量,叫做中和热
(2)表示方法:
H+(aq)+OH-(aq)=H2O(l)
ΔH=-57.3kJ/mol
(3)说明:
①条件:
稀溶液,因浓酸或浓碱在稀释时会放出热量,使最终的中和热数值变大
②反应物:
必须是强酸与强碱,因弱酸、弱碱电离吸热,使最终的中和热数值变小
③生成物及其物质的量:
必须是1molH2O(l);
不能有沉淀生成,因生成沉淀放热,使最终的中和热数值变大
④表述:
用文字表述中和热时,不带“-”号;用ΔH表示时,带上“-”。
例如:强酸与强碱反应的中和热为57.3kJ/mol或ΔH=-57.3kJ/mol
⑤对于任意一个中和热的热化学方程式,它的ΔH准确值一定等于-57.3kJ/mol
(二)反应热与焓变
1、化学反应前后反应热产生的原因:化学反应前后体系的内能发生了变化
2、内能:是体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响
3、焓变:
(1)焓的由来:
为了描述等压条件下的反应热,科学上引入了一个与内能有关的物理量——焓(符号为H)
(2)焓变与反应热的关系:
在等压条件下进行的化学反应(严格地说,对反应体系作功还有限定,中学阶段一般不考虑),其反应热就等于反应的焓变
(3)焓变的符号和单位:
ΔH,kJ/mol或kJ·mol-1
4、焓变产生的原因:
(1)微观:化学键的断裂与形成
反应物→断键→吸收能量
>
生成物→成键→释放能量
吸收能量→吸热反应→焓变为正值
反应物→断键→吸收能量
<
生成物→成键→释放能量
释放能量→放热反应→焓变为负值
(2)宏观:反应物与生成物的总能量
反应物的总能量>生成物的总能量→放热反应→焓变为负值
反应物的总能量<生成物的总能量→吸热反应→焓变为正值
(4)焓变与焓的关系:
ΔH=H生成物-H反应物
5、焓变(或反应热)与吸、放热反应的关系
(1)关系:
放热反应:ΔH为“-”,即ΔH<0(放热→体系能量降低)
吸热反应:ΔH为“+”,即ΔH>0(吸热→体系能量升高)
在25℃和101kPa下,1molC(如无特别说明,C均指石墨)与1molH2O(g)
反应,生成1
mol
CO和1molH2,需要吸收131.5kJ的热量,则该反应的反应热为△H=+131.5kJ/mol
例如,在25℃和101kPa下,1molH2与1
mol
Cl2反应生成2
mol
HCl时放出184.6kJ的热量,则该反应的反应热为:△H=-184.6kJ/mol
(2)比较大小:
比较ΔH大小时,要带上“+”、“-”号,
即所有放热反应的焓变小于所有吸热反应的焓变
复习:常见的放热反应与吸热反应
放热反应:所有的燃烧反应、所有的酸碱中和反应、大多数化合反应、铝热反应、活泼金属与水或酸的反应
、少数分解反应(如过氧化氢分解制备氧气)
吸热反应:
大多数的分解反应、C+CO2
2CO
Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3·H2O+8H2O
C+H2O(g)
CO+H2
NaHCO3+HCl=H2O+CO2↑+NaCl
(3)计算方法:
宏观:ΔH=生成物的总能量-反应物的总能量
微观:ΔH=断键吸收的能量-成键释放的能量
ΔH=反应物的键能之和-生成物的键能之和
注:①在描述ΔH时,符号、数值、单位三者缺一不可,是个整体
②键能:拆开化学键所需要的能量
③键能与能量的关系:物质的键能越大,物质本身所具有的能量越低,物质越稳定
④常见物质化学键的键数
1mol物质
CO2(C=O)
CH4(C-H)
P4(P-P)
SiO2(Si-O)
石墨(C-C)
金刚石(C-C)
Si(Si-Si)
键数
2
4
6
4
1.5
2
2
1、根据键能数据计算CH4(g)+
4F2(g)=CF4(g)+4HF(g)的反应热△H为(
)
A.-485
kJ/mol
B.+485
kJ/mol
C.+1940
kJ/mol
D.-1940
kJ
/mol
D
解析:?H=(4×414+4×155)-(4×489+4×565)
=-1940
(ΔH=反应物的键能之和-生成物的键能之和)
2.化学键的键能是形成(或拆开)lmol化学键时释放(或吸收)的能量。已知白磷和P4O6
的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷,s)+3O2(g)=P4O6(s)
(
)
A.放出1638kJ热量
B.吸收1638kJ热量
C.放出126kJ热量
D.吸收126kJ热量
A
(ΔH=反应物的键能之和-生成物的键能之和)
解析:?H=(6×198+3×498)-(12×360)
=-1638
二、热化学方程式
(一)定义:表明反应所释放或吸收的热量的化学
方程式
(二)意义:表明了化学反应中的物质变化和能量变化
(三)书写:
1、步骤:
写——写出配平的化学方程式
标——标出各物质的聚集状态:气体(g)、固体(s)、
液体(l)、溶液(aq);化学式相同的同素异
形体还应注明名称,例如:金刚石表示为
“C(金刚石,s)”。
注——注明ΔH的正负号,数值和单位(ΔH与最后一种生成物之间留一空格)
举例:
H2
(g)+I2
(g)=====2HI
(g)
△H=-
14.9kJ/mol
200℃
101kPa
2、注意事项
⑴需注明物质的聚集状态,
聚集状态不同,它们所具
有的内能、焓也均不同。
1、2H2
(g)+O2
(g)=2H2O
(l)
△H=-
571.6kJ/mol
2、2H+(aq)+2OH-
(aq)+Ba2+(aq)+SO42-(aq)=BaSO4(s)+2H2O(l)
ΔH=-QkJ/mol
⑵各物质前的计量数只表示物质的物质的量,所
以可以写整数也可以写分数
1、KOH(aq)+1/2H2SO4(aq)=1/2K2SO4(aq)+H2O(l)?
ΔH=-57.3kJ/mol
2、C(s)+1/2O2(g)=CO(g)
ΔH
=-111kJ/mol
⑶ΔH的数值随整个方程式发生变化:方程式加倍或减少,ΔH也随之加倍或减少;方程式反应物和生成物调换,ΔH的正负号也随之调换
1、2H2
(g)+O2
(g)=2H2O
(l)
△H=-
571.6kJ/mol
2、H2
(g)+1/2O2
(g)=H2O
(l)
△H=-
285.8kJ/mol
3、
2H2O
(l)
=2H2
(g)+O2
(g)
△H=+571.6kJ/mol
⑷不写反应条件;由于已经注明了物质的聚集状态,所以热化学方程式不写↓、↑
1、2H+(aq)+2OH-
(aq)+Ba2+(aq)+SO42-(aq)=BaSO4(s)+2H2O(l)
ΔH=-QkJ/mol
2、
2H2O
(l)
=2H2
(g)+O2
(g)
△H=+571.6kJ/mol
⑸不论化学反应是否可逆,热化学方程式中的
ΔH都表示反应进行到底(即完全转化)时的
能量变化
例如:2SO2(g)+O2(g)
2SO3(g)
?H=-197kJ/mol,是指2molSO2(g)和1molO2(g)完全转化为2SO3(g)时放出的热量为197kJ。若在相同的温度和压强下,向某容器中加入2molSO2(g)和1molO2(g),反应达到平衡时放出的热量为Q,因反应不能进行彻底,故Q<197kJ
⑹需注明反应的温度和压强,但因中学化学所用
的ΔH的数值一般都是在101kpa和25℃时测定
的,因此可以不注明
1、H2
(g)+I2
(g)=====2HI
(g)
△H=-
14.9kJ/mol
200℃
101kPa
2、2H2
(g)+O2
(g)=2H2O
(l)
△H=-
571.6kJ/mol
(四)判断热化学方程式的正误要注意“四看”
1、看各物质的聚集状态是否正确
2、看ΔH的正负号是否正确
3、看反应热的单位是否为kJ/mol
4、看反应热数值与化学计量数是否相对应
下列有关热化学方程式的书写和叙述正确的是(
)
A.1mol液态肼在足量氧气中完全燃烧生成氮气和水蒸气,放出642kJ的热量:
N2H4(1)+O2(g)=N2(g)+2H2O(g)
△H=+642kJ·mol-1
B.12g石墨转化为CO(g)时,放出110.5kJ的热量:
2C(石墨,s)+O2(g)=2CO(g)
△H=-110.5kJ·mol-1
C.已知H2(g)+2O2(g)=H2O(1)
△H=-285.8kJ·mol-1,则2H2O(1)=2H2(g)+O2(g)
△H=+571.6kJ·mol-1
D.已知N2(g)+3H2(g)
2NH3(g)△H=-92.2kJ·mol-1,则在一定条件下向密闭容器中充入0.5molN2(g)和1.5molH2(g)充分反应放出46.1kJ的热量
C
三、燃烧热
(一)定义:
101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量,叫做该物质的燃烧热
(二)单位:
kJ/mol或kJ·mol-1
(三)测定:
燃烧热通常利用量热计由实验测得
(四)意义:
C的燃烧热为393.5kJ/mol,表示在101kPa时,1molC完全燃烧生成CO2(g)时所放出393.5kJ的热量
(五)说明:
1、反应条件:101kPa
2、可燃物的用量:1mol纯物质,即在写燃烧热的热化学方程式时,可燃物前面的系数必须为1
3、反应程度:完全燃烧,形成指定产物:C→CO2(g)、H→H2O(l)、S→SO2(g)、N→N2(g)
4、燃烧环境:没有特殊说明。燃烧一般是指在氧气中的燃烧
5、文字叙述燃烧热时,用“正值”或“ΔH”表示。例如:CH4的燃烧热为890.31kJ/mol或ΔH=
—890.31kJ/mol
6、比较燃烧热大小时,只比较绝对值
7、注意区分燃烧的热化学方程式与燃烧热的热化学方程式
例题:甲醇属于可再生能源,可代替汽油作为汽车燃料。下列表示甲醇燃烧热的热化学方程式书写正确的是(
)
A.CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(1)△H=+726.5kJ/mol
B.CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(1)
△H=-726.5kJ/mol
C
.CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(g)△H=-675.3kJ/mol
D.2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1)△H=-1453kJ/mol
B
