电解质
图片预览






文档简介
(共16张PPT)
第二节 电解质
第二课时 电解质在水溶液中的反应
一位护士遇到了一个难题,她在给病人输液时发现一瓶氯化钠注射液和一瓶葡萄糖注射液的标签脱落了,能否用一种简便的化学方法帮她将这两瓶溶液分开呢?
【学习目标】
【知识技能】:
1.了解离子反应实质 2.掌握离子方程式的书写
【过程方法】:
通过硫酸与氢氧化钡溶液反应实质的探究,使学生进
一步学会运用实验方法进行化学研究和学习
【情感态度价值观】:
能通过“交流·研讨”活动,培养学生合作学习的意识。
能以“联想·质疑”激发学生的学习兴趣
【重点、难点】:离子反应及离子方程式书写
【观察·思考】
先向Ba(OH)2溶液中加几滴酚酞溶
液,连接装置.然后滴加H2SO4溶液,观察现象。
【探究一】:电解质在水溶液反应的实质
将稀H2SO4滴入含酚酞Ba(OH)2溶液的中 现象1 现象2 现象3
电流计指针读数由
大到小
溶液颜色由
红色变无色
白色沉淀
【探究一】:电解质在水溶液反应的实质
【问题组一】
1、稀硫酸与Ba(OH)2溶液中存在哪些离子?
2、灯泡亮度的变化说明了什么问题?
3、溶液颜色的变化是什么原因引起的?
4、白色沉淀的成分是什么?如何形成的?
5、稀硫酸与Ba(OH)2反应的实质是什么?
温馨提示:溶液的导电能力与离子浓度有关
2H+
SO42-
2OH-
Ba2+
2H2O
BaSO4
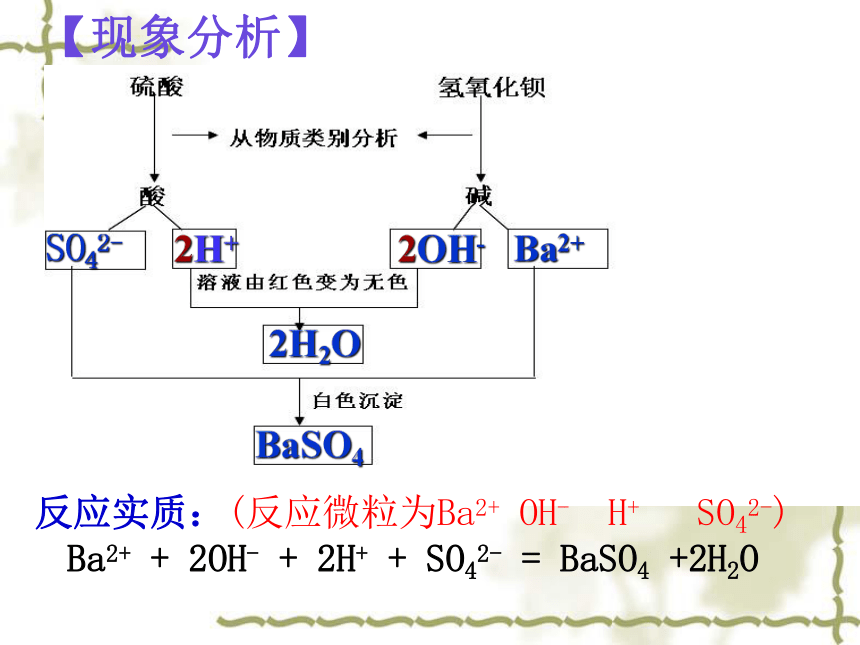
【现象分析】
反应实质:(反应微粒为Ba2+ OH- H+ SO42-)
Ba2+ + 2OH- + 2H+ + SO42- = BaSO4 +2H2O
请结合H2SO4与Ba(OH)2反应,从电解质电离
的角度分析下列反应过程中离子浓度的变化
Na+
OH-
Cu2+
SO42-
Na+
SO42-
Cu(OH)2
Na+
CO32-
H+
Cl-
Na+
Cl-
H2O、CO2
Na+
OH-
Na+
Cl-
H2O
H+
Cl-
探究二:离子反应的条件
沉淀、难电离的物质、易挥发的物质
问题组二
1、发生离子反应的条件是什么?
2、在离子反应过程中所有的离子都参与了反应?
不是
离子方程式:用实际参加反应的离子符号表示离子反应的式子
【探究三】:离子方程式的书写规则
1.分析反应物在水溶液中的存在形式。
2.判断上述微粒反应生成的沉淀、难电
离或挥发性物质,用化学式表示。
3.综合前两步,写出离子方程式。
【迁移·应用】
(1)KOH溶液与CuCl2溶液的反应
(2)NaOH溶液与CuSO4溶液的反应
(3)Ba(OH)2溶液与盐酸的反应
(4)NaOH溶液与H2SO4溶液的反应
(1)(2)题:2OH-+Cu2+===Cu(OH)2
(3)(4) 题:OH-+H+====H2O
结论
离子方程式描述反应的本质,而且表示的是一类化学反应
环保部门准备检测某化工厂所排放的污水中是否含大量SO42-。如果你是一名环保工作人员,你应该怎样进行检测呢?
取少量污水于试管中,滴加BaCl2溶液,有
白色沉淀产生,再滴加硝酸,沉淀不溶解。
我的收获
离子方程式的书写
离子反应
【作业】
1.有三种白色固体分别为氯化钠、硫酸钠碳酸钠。请用实验方法进行鉴别,写出相应的离子方程式。
2.完成课本P47页第五题。
第二节 电解质
第二课时 电解质在水溶液中的反应
一位护士遇到了一个难题,她在给病人输液时发现一瓶氯化钠注射液和一瓶葡萄糖注射液的标签脱落了,能否用一种简便的化学方法帮她将这两瓶溶液分开呢?
【学习目标】
【知识技能】:
1.了解离子反应实质 2.掌握离子方程式的书写
【过程方法】:
通过硫酸与氢氧化钡溶液反应实质的探究,使学生进
一步学会运用实验方法进行化学研究和学习
【情感态度价值观】:
能通过“交流·研讨”活动,培养学生合作学习的意识。
能以“联想·质疑”激发学生的学习兴趣
【重点、难点】:离子反应及离子方程式书写
【观察·思考】
先向Ba(OH)2溶液中加几滴酚酞溶
液,连接装置.然后滴加H2SO4溶液,观察现象。
【探究一】:电解质在水溶液反应的实质
将稀H2SO4滴入含酚酞Ba(OH)2溶液的中 现象1 现象2 现象3
电流计指针读数由
大到小
溶液颜色由
红色变无色
白色沉淀
【探究一】:电解质在水溶液反应的实质
【问题组一】
1、稀硫酸与Ba(OH)2溶液中存在哪些离子?
2、灯泡亮度的变化说明了什么问题?
3、溶液颜色的变化是什么原因引起的?
4、白色沉淀的成分是什么?如何形成的?
5、稀硫酸与Ba(OH)2反应的实质是什么?
温馨提示:溶液的导电能力与离子浓度有关
2H+
SO42-
2OH-
Ba2+
2H2O
BaSO4
【现象分析】
反应实质:(反应微粒为Ba2+ OH- H+ SO42-)
Ba2+ + 2OH- + 2H+ + SO42- = BaSO4 +2H2O
请结合H2SO4与Ba(OH)2反应,从电解质电离
的角度分析下列反应过程中离子浓度的变化
Na+
OH-
Cu2+
SO42-
Na+
SO42-
Cu(OH)2
Na+
CO32-
H+
Cl-
Na+
Cl-
H2O、CO2
Na+
OH-
Na+
Cl-
H2O
H+
Cl-
探究二:离子反应的条件
沉淀、难电离的物质、易挥发的物质
问题组二
1、发生离子反应的条件是什么?
2、在离子反应过程中所有的离子都参与了反应?
不是
离子方程式:用实际参加反应的离子符号表示离子反应的式子
【探究三】:离子方程式的书写规则
1.分析反应物在水溶液中的存在形式。
2.判断上述微粒反应生成的沉淀、难电
离或挥发性物质,用化学式表示。
3.综合前两步,写出离子方程式。
【迁移·应用】
(1)KOH溶液与CuCl2溶液的反应
(2)NaOH溶液与CuSO4溶液的反应
(3)Ba(OH)2溶液与盐酸的反应
(4)NaOH溶液与H2SO4溶液的反应
(1)(2)题:2OH-+Cu2+===Cu(OH)2
(3)(4) 题:OH-+H+====H2O
结论
离子方程式描述反应的本质,而且表示的是一类化学反应
环保部门准备检测某化工厂所排放的污水中是否含大量SO42-。如果你是一名环保工作人员,你应该怎样进行检测呢?
取少量污水于试管中,滴加BaCl2溶液,有
白色沉淀产生,再滴加硝酸,沉淀不溶解。
我的收获
离子方程式的书写
离子反应
【作业】
1.有三种白色固体分别为氯化钠、硫酸钠碳酸钠。请用实验方法进行鉴别,写出相应的离子方程式。
2.完成课本P47页第五题。
