3.1.1《甲烷的性质》PPT课件(新人教版-必修2)
文档属性
| 名称 | 3.1.1《甲烷的性质》PPT课件(新人教版-必修2) |

|
|
| 格式 | zip | ||
| 文件大小 | 345.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-08 00:00:00 | ||
图片预览






文档简介
(共34张PPT)
新课标人教版课件系列
《高中化学》
必修2
3.1.1《甲烷的性质》
第三章 有机化合物 第一节《最简单的有机化合物-甲烷》 第1课时
教学目标
知识与技能:
1.使学生掌握甲烷的结构式、甲烷的电子式和甲烷分子的正四面体结构;
2.掌握甲烷的化学性质,了解有关实验的结论,了解取代反应;
3.了解甲烷的存在和甲烷的用途等。
过程与方法:
1.通过实践活动(模型制作)、探究实验、模型、图表、图片、甲烷、烷烃的多多媒体动画等,培养学生关心科学、研究科学和探索科学的精神。
2培养学生用新概念理解知识的能力;培养学生设计实验、动手实验、观察现象,并根据实验现象得出可能的规律的能力。
情感态度与价值观:
1.通过甲烷的分子结构的探究,解析其可能有的性质,并设计实验来证明,激发学生学习化学的兴趣,探索新知识的欲望,且在实验研究中培养求实、进取的优良品质。
2.使学生初步掌握研究物质的方法——结构解析、推测可能的性质、设计实验、观察现象、解析现象、得出结论,再辩证地解析结论的适用范围。
教学重点: 甲烷的结构和甲烷的化学性质
教学难点:甲烷的结构、研究某物质的程序和方法。
教具准备: 多多媒体、两试管SO2气体、试管、水槽、烧杯、石棉网、酒精灯、铁架台、品红试液、KMnO4溶液、溴水。
[交流与思考] 有机物种类繁多。在初中,我们已经学习过一些简单的有机物,那么,哪些物质属于有机物呢?其组成元素有哪些?有机物和无机物又有何区别呢?
☆★含碳的化合物叫有机物。
(某些含碳化合物,如:CO2、CO、H2CO3、碳酸盐等,由于其结构和性质与无机物相似,归为无机物)
组成元素: C 、H 、O 、N 、 S 、P 、卤素等。
其中,仅含碳和氢两种元素的有机物叫碳氢化合物,也称为烃。甲烷是最简单的烃。
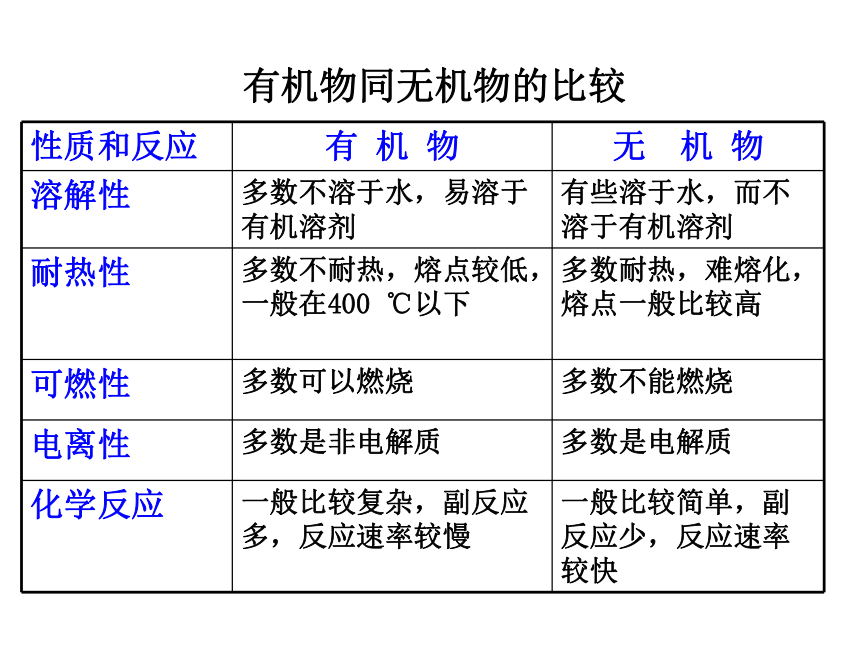
性质和反应 有 机 物 无 机 物
溶解性 多数不溶于水,易溶于有机溶剂 有些溶于水,而不溶于有机溶剂
耐热性 多数不耐热,熔点较低,一般在400 ℃以下 多数耐热,难熔化,熔点一般比较高
可燃性 多数可以燃烧 多数不能燃烧
电离性 多数是非电解质 多数是电解质
化学反应 一般比较复杂,副反应多,反应速率较慢 一般比较简单,副反应少,反应速率较快
有机物同无机物的比较
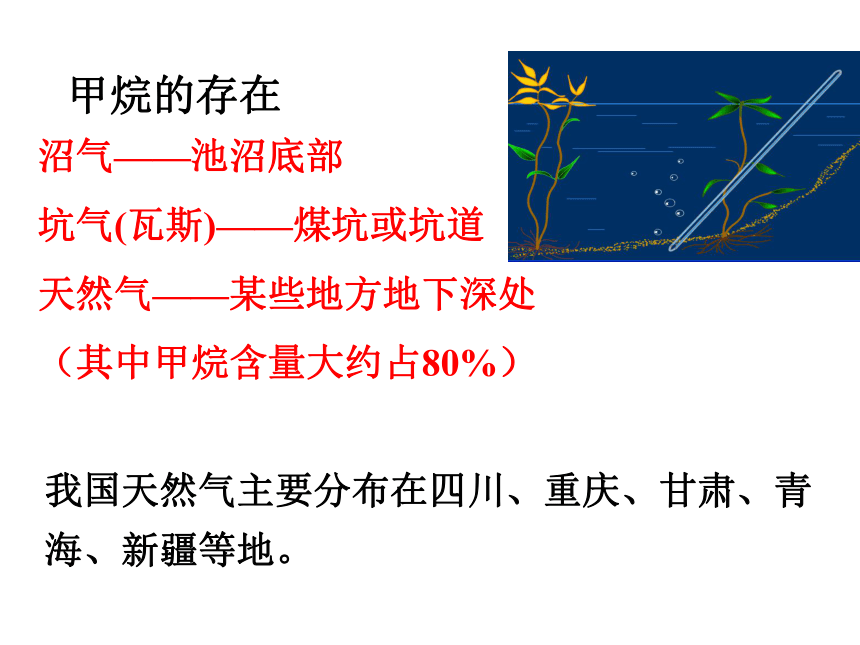
甲烷的存在
沼气——池沼底部
坑气(瓦斯)——煤坑或坑道
天然气——某些地方地下深处
(其中甲烷含量大约占80%)
我国天然气主要分布在四川、重庆、甘肃、青海、新疆等地。
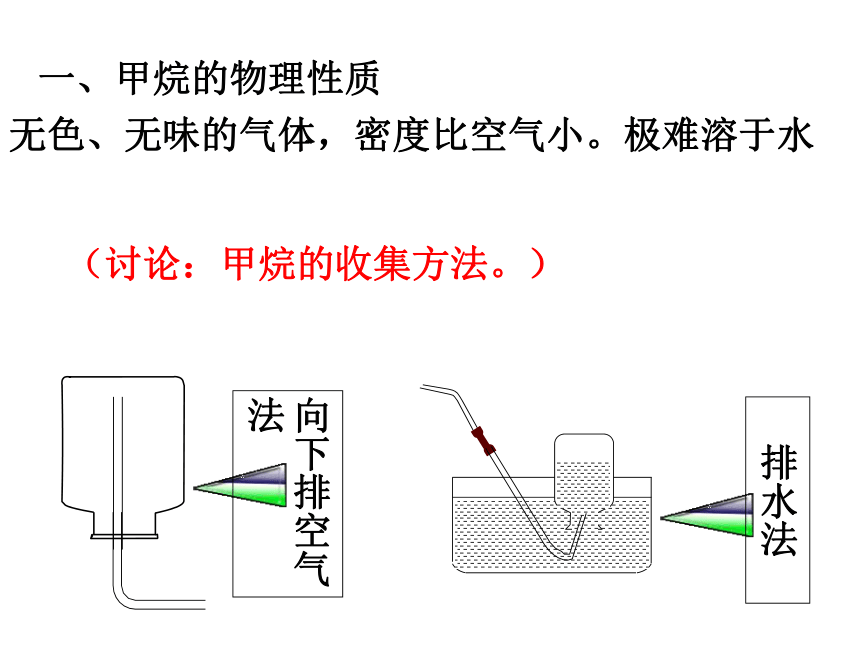
向下排空气法
排水法
一、甲烷的物理性质
(讨论:甲烷的收集方法。)
无色、无味的气体,密度比空气小。极难溶于水
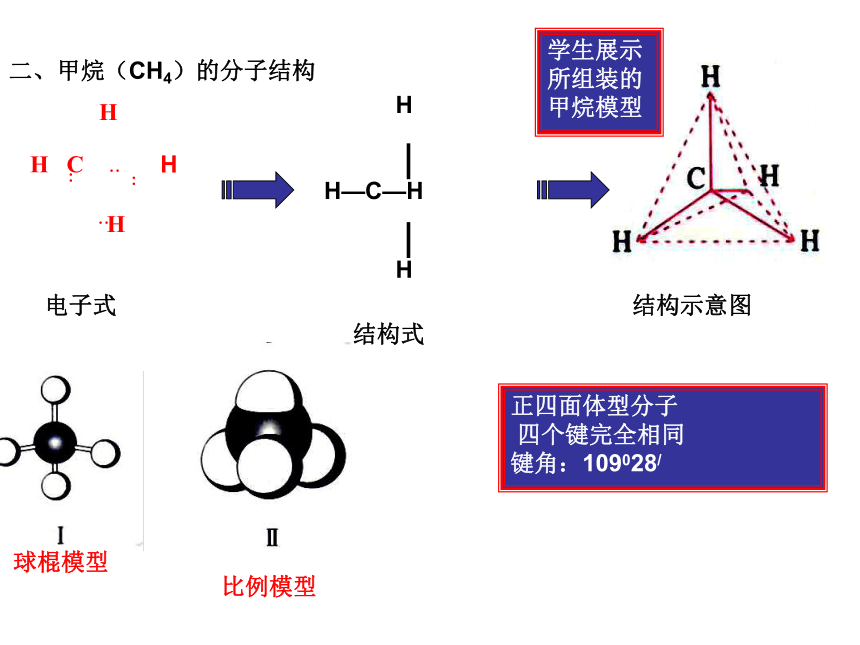
二、甲烷(CH4)的分子结构
电子式
﹕
H C
﹕
﹕
﹕
H
H
H
结构式
H—C—H
H
H
结构示意图
比例模型
球棍模型
正四面体型分子
四个键完全相同
键角:109028/
学生展示所组装的甲烷模型
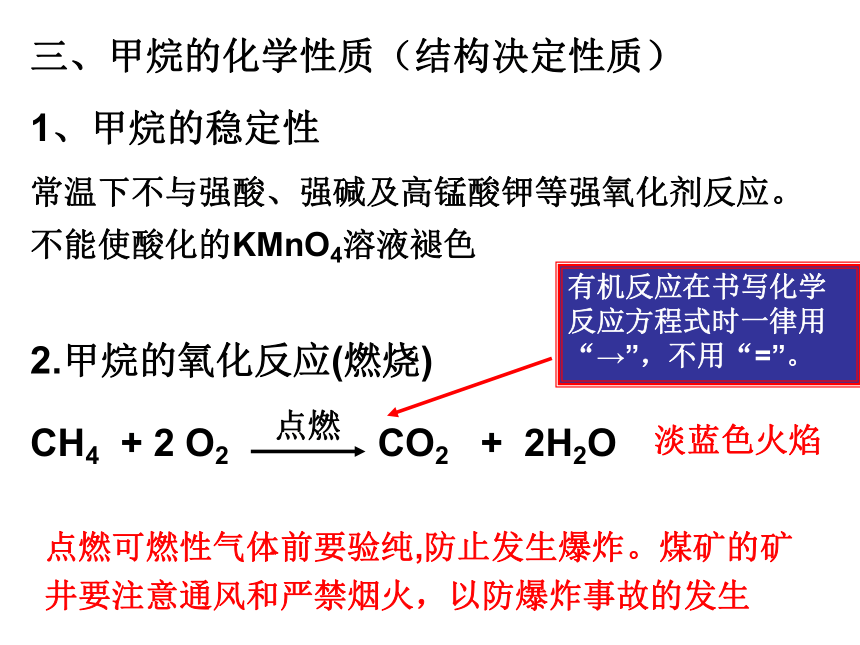
三、甲烷的化学性质(结构决定性质)
1、甲烷的稳定性
2.甲烷的氧化反应(燃烧)
CH4 + 2 O2 CO2 + 2H2O
点燃
点燃可燃性气体前要验纯,防止发生爆炸。煤矿的矿井要注意通风和严禁烟火,以防爆炸事故的发生
淡蓝色火焰
常温下不与强酸、强碱及高锰酸钾等强氧化剂反应。不能使酸化的KMnO4溶液褪色
有机反应在书写化学反应方程式时一律用“→”,不用“=”。
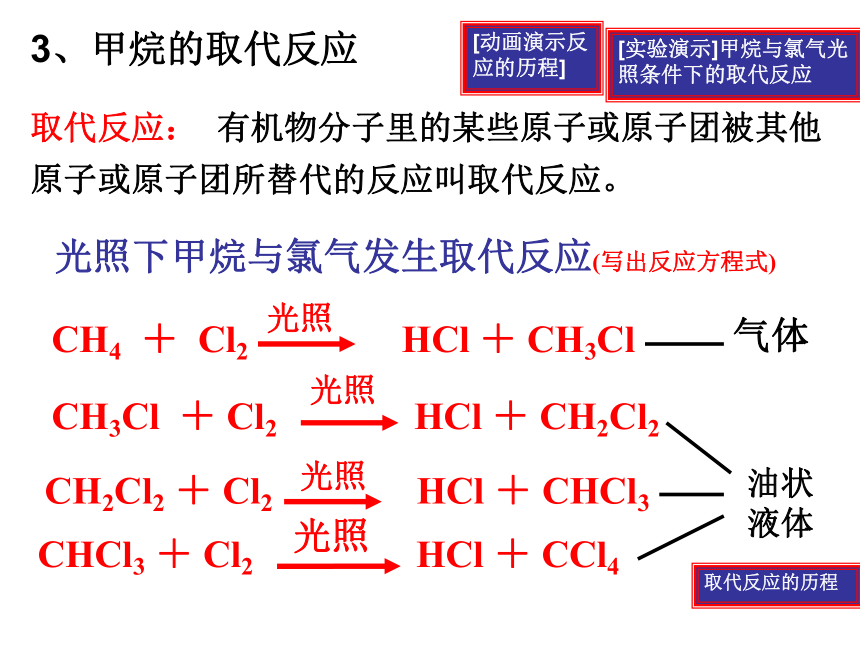
3、甲烷的取代反应
[实验演示]甲烷与氯气光照条件下的取代反应
光照下甲烷与氯气发生取代反应(写出反应方程式)
CH4 + Cl2 HCl + CH3Cl
光照
CH3Cl + Cl2 HCl + CH2Cl2
光照
CH2Cl2 + Cl2 HCl + CHCl3
光照
CHCl3 + Cl2 HCl + CCl4
光照
气体
油状液体
[动画演示反应的历程]
取代反应: 有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应叫取代反应。
取代反应的历程
取代反应与置换反应的区别
取代反应 置换反应
生成物中不一定有单质
反应物中和生成物中一定有单质
反应能否进行,受温度、光照、催化剂等外界条件的影响较大
遵循金属或非金属活动性顺序
反应逐步进行,很多反应是可逆的
反应一般为单方向进行
4、分解反应
CH4 C + 2 H2 (工业上制炭黑)
高温
[例1] 如图所示,某气体X可能由H2、CO、CH4中的一种或几种组成,将X气体燃烧把燃烧后生成的气体通过A、B两个洗气瓶。试回答下列问题。
气体
A
B
浓H2SO4
澄清石灰水
(1)若A洗气瓶的质量增加,
B洗气瓶的质量不变,则气体X
是 。
(2)若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是 。
(3)若A、B两个洗气瓶的质量都增加,则气体X是 。
H2
CO
CH4或H2、CO或H2、CH4或CO、CH4或H2、CO、CH4
[例2] 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略。将封闭有甲烷和氯气的混和气体的装置放置在有光亮的地方,让混和气体缓慢的反应一段时间。
(1)假设甲烷与氯气反应充分,且
只产生一种有机物,请写出化学方程
式。 ,
指出该有机物的分子的空间结构: 。
正四面体型
CH4 + 4Cl2 4HCl + CCl4
光照
[例2] 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略。将封闭有甲烷和氯气的混和气体的装置放置在有光亮的地方,让混和气体缓慢的反应一段时间。
(2)经过几个小时的反应后,U型管右端的玻璃管中水柱变化是 。
A.升高 B.降低
C.不变 D.无法确定
(3)U型管左端的气柱变化是 。
A.体积增大 B.体积减小
C.消失 D.不变
B
BC
注意:体积消失是体积减小的极限
[例2] 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略。将封闭有甲烷和氯气的混和气体的装置放置在有光亮的地方,让混和气体缓慢的反应一段时间。
(4)试解释U型管右端的玻璃管中水柱变化的原因。
由上述化学方程式可知,此反应中气体的物质的量减少,且生成的HCl能够溶解于水,所以左侧压强减小至零,故右侧玻璃管中的水柱降低,左侧气柱消失 。
结束
[练习1] 下列物质中不是有机物的是 ( )
A.CO(NH2)2 B.K2CO3
C.CHCl3 D.CH3COOH
B
结束
[练习2] 下列关于甲烷性质叙述中不正确的是A.甲烷是一种无色无味的气体
B.甲烷的密度比空气的密度小
C.甲烷极难溶解于水
D.甲烷性质稳定,不和其它物质反应
D
结束
[练习3] 在标准状况下将11.2L甲烷和22.4L的氧气混和后点燃,恢复到原来的状态,气体的体积是 ( )
A.11.2L B.22.4L
C.33.6L D.44.8L
A
结束
[练习4 ] 将1molCH4与氯气发生取代反应,待反应完全后,测定四种有机物的物质的量相等,则产生HCl的物质的量是 ( )
A.0.5mol B.2 mol
C.2.5 mol D.4mol
C
结束
[练习5] 下列反应不属于取代反应的是( )
B、 2 HI + Cl2 = I2 + 2HCl
A、 CH4 C + 2 H2
高温
C、 C6H5-H + Br2 C6H5-Br + HBr
Fe
D、 C6H5-H + C2H5Cl C6H5-C2H5+HCl
一定条件
AB
结束
[延伸拓展] 将一定量的甲烷燃烧后得到CO、CO2和水蒸气,混和气体的质量是49.6g,通过无水氯化钙时,无水氯化钙增重25.2g,则CO2的质量是 ( )
A.12. 5g B.13.2g
C.19.7g D. 24.4g
B
结束
[小结]这节课我们学习了甲烷的结构和性质。由甲烷分子的结构可知甲烷是较稳定的物质,在通常不与强酸、强碱及酸性高锰酸钾反应。甲烷在一定条件下可以发生氧化反应、取代反应和分解反应。
甲烷与氯气光照条件下的取代反应
甲烷与氯气
光照条件下的取代反应
甲烷与氯气
光照条件下的取代反应
甲烷与氯气
光照条件下的取代反应
甲烷与氯气
光照条件下的取代反应
甲烷与氯气
光照条件下的取代反应
甲烷与氯气
光照条件下的取代反应
甲烷与氯气
光照条件下的取代反应
甲烷与氯气
光照条件下的取代反应
甲烷与氯气
光照条件下的取代反应
返回
新课标人教版课件系列
《高中化学》
必修2
3.1.1《甲烷的性质》
第三章 有机化合物 第一节《最简单的有机化合物-甲烷》 第1课时
教学目标
知识与技能:
1.使学生掌握甲烷的结构式、甲烷的电子式和甲烷分子的正四面体结构;
2.掌握甲烷的化学性质,了解有关实验的结论,了解取代反应;
3.了解甲烷的存在和甲烷的用途等。
过程与方法:
1.通过实践活动(模型制作)、探究实验、模型、图表、图片、甲烷、烷烃的多多媒体动画等,培养学生关心科学、研究科学和探索科学的精神。
2培养学生用新概念理解知识的能力;培养学生设计实验、动手实验、观察现象,并根据实验现象得出可能的规律的能力。
情感态度与价值观:
1.通过甲烷的分子结构的探究,解析其可能有的性质,并设计实验来证明,激发学生学习化学的兴趣,探索新知识的欲望,且在实验研究中培养求实、进取的优良品质。
2.使学生初步掌握研究物质的方法——结构解析、推测可能的性质、设计实验、观察现象、解析现象、得出结论,再辩证地解析结论的适用范围。
教学重点: 甲烷的结构和甲烷的化学性质
教学难点:甲烷的结构、研究某物质的程序和方法。
教具准备: 多多媒体、两试管SO2气体、试管、水槽、烧杯、石棉网、酒精灯、铁架台、品红试液、KMnO4溶液、溴水。
[交流与思考] 有机物种类繁多。在初中,我们已经学习过一些简单的有机物,那么,哪些物质属于有机物呢?其组成元素有哪些?有机物和无机物又有何区别呢?
☆★含碳的化合物叫有机物。
(某些含碳化合物,如:CO2、CO、H2CO3、碳酸盐等,由于其结构和性质与无机物相似,归为无机物)
组成元素: C 、H 、O 、N 、 S 、P 、卤素等。
其中,仅含碳和氢两种元素的有机物叫碳氢化合物,也称为烃。甲烷是最简单的烃。
性质和反应 有 机 物 无 机 物
溶解性 多数不溶于水,易溶于有机溶剂 有些溶于水,而不溶于有机溶剂
耐热性 多数不耐热,熔点较低,一般在400 ℃以下 多数耐热,难熔化,熔点一般比较高
可燃性 多数可以燃烧 多数不能燃烧
电离性 多数是非电解质 多数是电解质
化学反应 一般比较复杂,副反应多,反应速率较慢 一般比较简单,副反应少,反应速率较快
有机物同无机物的比较
甲烷的存在
沼气——池沼底部
坑气(瓦斯)——煤坑或坑道
天然气——某些地方地下深处
(其中甲烷含量大约占80%)
我国天然气主要分布在四川、重庆、甘肃、青海、新疆等地。
向下排空气法
排水法
一、甲烷的物理性质
(讨论:甲烷的收集方法。)
无色、无味的气体,密度比空气小。极难溶于水
二、甲烷(CH4)的分子结构
电子式
﹕
H C
﹕
﹕
﹕
H
H
H
结构式
H—C—H
H
H
结构示意图
比例模型
球棍模型
正四面体型分子
四个键完全相同
键角:109028/
学生展示所组装的甲烷模型
三、甲烷的化学性质(结构决定性质)
1、甲烷的稳定性
2.甲烷的氧化反应(燃烧)
CH4 + 2 O2 CO2 + 2H2O
点燃
点燃可燃性气体前要验纯,防止发生爆炸。煤矿的矿井要注意通风和严禁烟火,以防爆炸事故的发生
淡蓝色火焰
常温下不与强酸、强碱及高锰酸钾等强氧化剂反应。不能使酸化的KMnO4溶液褪色
有机反应在书写化学反应方程式时一律用“→”,不用“=”。
3、甲烷的取代反应
[实验演示]甲烷与氯气光照条件下的取代反应
光照下甲烷与氯气发生取代反应(写出反应方程式)
CH4 + Cl2 HCl + CH3Cl
光照
CH3Cl + Cl2 HCl + CH2Cl2
光照
CH2Cl2 + Cl2 HCl + CHCl3
光照
CHCl3 + Cl2 HCl + CCl4
光照
气体
油状液体
[动画演示反应的历程]
取代反应: 有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应叫取代反应。
取代反应的历程
取代反应与置换反应的区别
取代反应 置换反应
生成物中不一定有单质
反应物中和生成物中一定有单质
反应能否进行,受温度、光照、催化剂等外界条件的影响较大
遵循金属或非金属活动性顺序
反应逐步进行,很多反应是可逆的
反应一般为单方向进行
4、分解反应
CH4 C + 2 H2 (工业上制炭黑)
高温
[例1] 如图所示,某气体X可能由H2、CO、CH4中的一种或几种组成,将X气体燃烧把燃烧后生成的气体通过A、B两个洗气瓶。试回答下列问题。
气体
A
B
浓H2SO4
澄清石灰水
(1)若A洗气瓶的质量增加,
B洗气瓶的质量不变,则气体X
是 。
(2)若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是 。
(3)若A、B两个洗气瓶的质量都增加,则气体X是 。
H2
CO
CH4或H2、CO或H2、CH4或CO、CH4或H2、CO、CH4
[例2] 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略。将封闭有甲烷和氯气的混和气体的装置放置在有光亮的地方,让混和气体缓慢的反应一段时间。
(1)假设甲烷与氯气反应充分,且
只产生一种有机物,请写出化学方程
式。 ,
指出该有机物的分子的空间结构: 。
正四面体型
CH4 + 4Cl2 4HCl + CCl4
光照
[例2] 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略。将封闭有甲烷和氯气的混和气体的装置放置在有光亮的地方,让混和气体缓慢的反应一段时间。
(2)经过几个小时的反应后,U型管右端的玻璃管中水柱变化是 。
A.升高 B.降低
C.不变 D.无法确定
(3)U型管左端的气柱变化是 。
A.体积增大 B.体积减小
C.消失 D.不变
B
BC
注意:体积消失是体积减小的极限
[例2] 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略。将封闭有甲烷和氯气的混和气体的装置放置在有光亮的地方,让混和气体缓慢的反应一段时间。
(4)试解释U型管右端的玻璃管中水柱变化的原因。
由上述化学方程式可知,此反应中气体的物质的量减少,且生成的HCl能够溶解于水,所以左侧压强减小至零,故右侧玻璃管中的水柱降低,左侧气柱消失 。
结束
[练习1] 下列物质中不是有机物的是 ( )
A.CO(NH2)2 B.K2CO3
C.CHCl3 D.CH3COOH
B
结束
[练习2] 下列关于甲烷性质叙述中不正确的是A.甲烷是一种无色无味的气体
B.甲烷的密度比空气的密度小
C.甲烷极难溶解于水
D.甲烷性质稳定,不和其它物质反应
D
结束
[练习3] 在标准状况下将11.2L甲烷和22.4L的氧气混和后点燃,恢复到原来的状态,气体的体积是 ( )
A.11.2L B.22.4L
C.33.6L D.44.8L
A
结束
[练习4 ] 将1molCH4与氯气发生取代反应,待反应完全后,测定四种有机物的物质的量相等,则产生HCl的物质的量是 ( )
A.0.5mol B.2 mol
C.2.5 mol D.4mol
C
结束
[练习5] 下列反应不属于取代反应的是( )
B、 2 HI + Cl2 = I2 + 2HCl
A、 CH4 C + 2 H2
高温
C、 C6H5-H + Br2 C6H5-Br + HBr
Fe
D、 C6H5-H + C2H5Cl C6H5-C2H5+HCl
一定条件
AB
结束
[延伸拓展] 将一定量的甲烷燃烧后得到CO、CO2和水蒸气,混和气体的质量是49.6g,通过无水氯化钙时,无水氯化钙增重25.2g,则CO2的质量是 ( )
A.12. 5g B.13.2g
C.19.7g D. 24.4g
B
结束
[小结]这节课我们学习了甲烷的结构和性质。由甲烷分子的结构可知甲烷是较稳定的物质,在通常不与强酸、强碱及酸性高锰酸钾反应。甲烷在一定条件下可以发生氧化反应、取代反应和分解反应。
甲烷与氯气光照条件下的取代反应
甲烷与氯气
光照条件下的取代反应
甲烷与氯气
光照条件下的取代反应
甲烷与氯气
光照条件下的取代反应
甲烷与氯气
光照条件下的取代反应
甲烷与氯气
光照条件下的取代反应
甲烷与氯气
光照条件下的取代反应
甲烷与氯气
光照条件下的取代反应
甲烷与氯气
光照条件下的取代反应
甲烷与氯气
光照条件下的取代反应
返回
